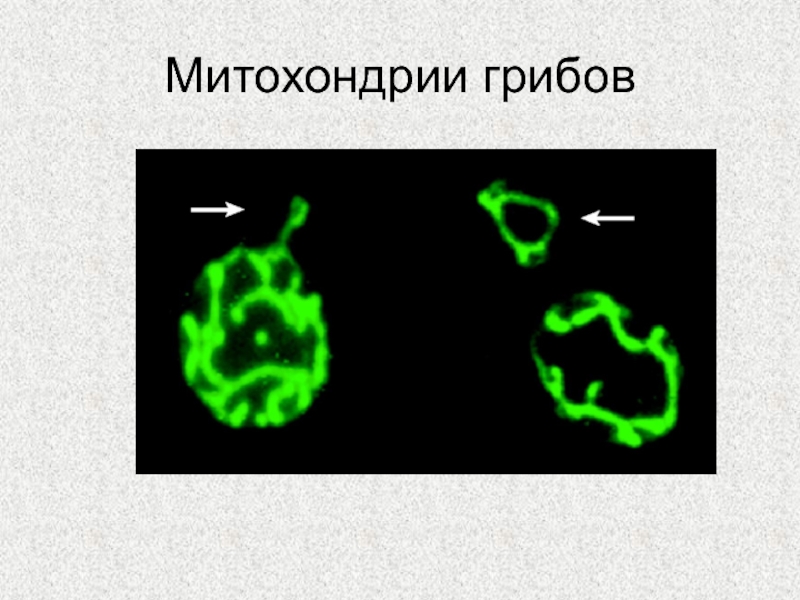
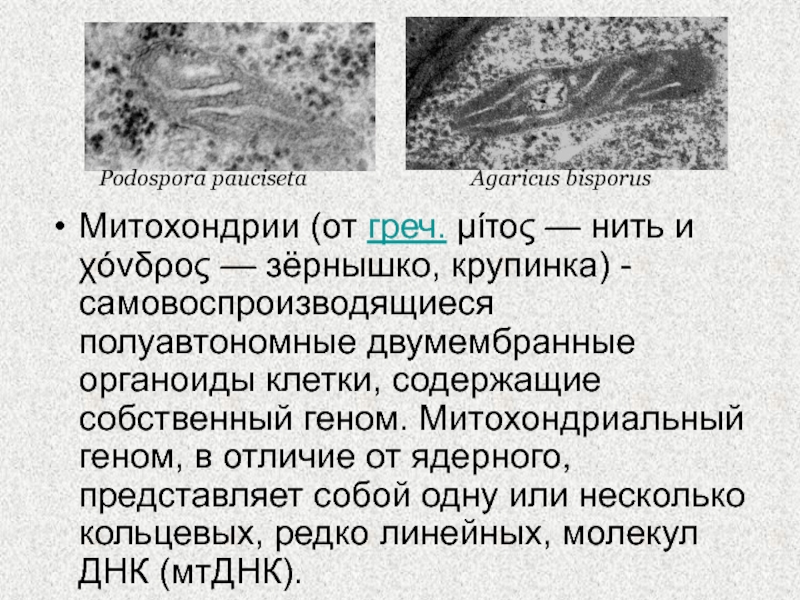
Слайд 2Митохондрии (от греч. μίτος — нить и χόνδρος — зёрнышко, крупинка) -
самовоспроизводящиеся полуавтономные двумембранные органоиды клетки, содержащие собственный геном. Митохондриальный геном,
в отличие от ядерного, представляет собой одну или несколько кольцевых, редко линейных, молекул ДНК (мтДНК).
Podospora pauciseta
Agaricus bisporus
Слайд 3Митохондрии характерны за малым исключением для всех эукариотических клеток, как
аутотрофных (фотосинтезирующие растения), так и гетеротрофных (животные, грибы) организмов. Митохондрий
нет у некоторых облигатных анаэробных грибов, обитающих в желудке коров и других травоядных животных.
Слайд 4Митохондрии это мультифункциональные полиморфные органеллы, выполняющие функции обеспечения жизнедеятельности клетки.
Динамика изменения морфологии митохондрий позволяет адаптировать их активность к потребностям
клеток во времени и пространстве.
Митохондрии генерируют энергию окислительным фосфорилированием, играют ключевую роль в сборке железо-серного кластера [2Fe 2S], участвуют в промежуточном метаболизме, передаче кальциевых сигналов и апоптозе.
Слайд 5Функции митохондрий
Основная функция митохондрий связана с окислением органических соединений и
использованием освобождающейся при распаде этих соединений энергии в синтезе молекул
АТФ в процессе дыхания - основной энергетической единицы всего царства живого, поэтому митохондрии называют энергетическими станциями клетки.
Митохондрии дрожжей выполняют кроме основной, следующие функции (Feldmann, 2005):
синтез и десатурацию жирных кислот и липидов,
биосинтез эргостеролов,
ответ на стресс и адаптация к нему,
локализация ферментов синтеза отдельных амино- и дикарбоновых кислот, пиримидиновых и пуриновых оснований, порфирина и птеридинов,
мобилизация гликогена,
продукция ароматических компонентов
участие в апоптозе клетки.
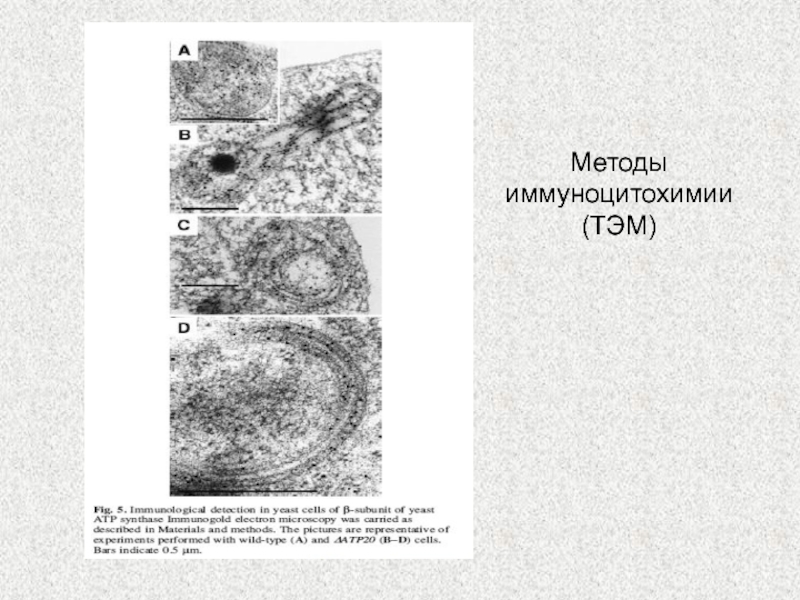
Слайд 6Субкомпартменты внутренней мембраны митохондрий
Митохондрии содержат около 800 белков/1500 у человека
Субкомпартментализация
внутренней мембраны митохондрий. Распространение митохондриальных белков участвующих в нескольких главных
процессах митохондрий определенных методами количественной иммуноцитохимии с использованием электронного микроскопа у S. cerevisiae. Белки внутренней мембраны вовлечены в слияние митохондрий (Mgm1p) или белок привязки (Mia40p, TIM23 комплекс) предпочтительно локализованных во внутренней мембране. Кроме белков, вовлеченных в окислительное фосфорилирование (ANC adenine nucleotide carrier protein, Complex III, Complex IV, F1FO-ATP синтаза) мембрана крист богата кластерами Fe/S. Это распределение неравномерное и изменяющееся. Динамика перераспределения белков зависит о физиологического статуса клетки. CS- цитозоль; OM, наружная мембрана; IMS, межмембранное пространство; IM, внутренняя мембрана; M, пространство матрикса.Zicketal.,2009
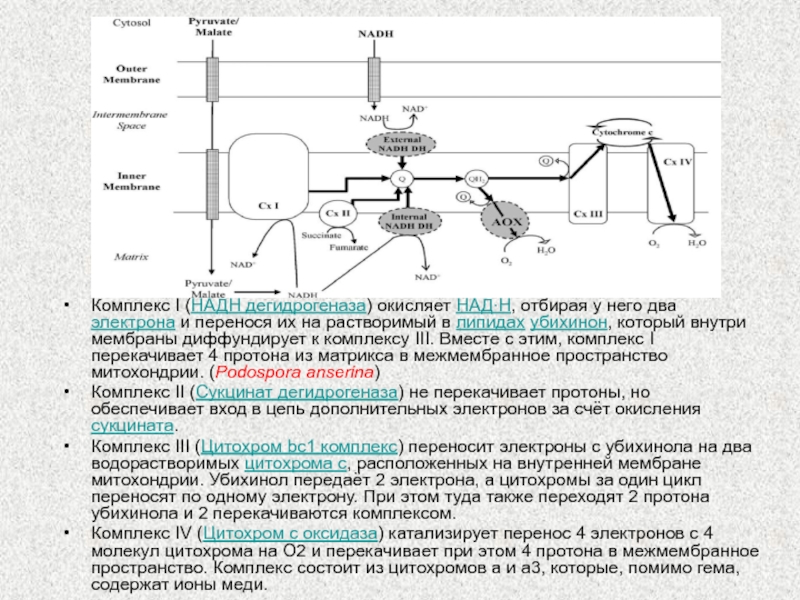
Слайд 7Комплекс I (НАДН дегидрогеназа) окисляет НАД∙Н, отбирая у него два
электрона и перенося их на растворимый в липидах убихинон, который
внутри мембраны диффундирует к комплексу III. Вместе с этим, комплекс I перекачивает 4 протона из матрикса в межмембранное пространство митохондрии. (Podospora anserina)
Комплекс II (Сукцинат дегидрогеназа) не перекачивает протоны, но обеспечивает вход в цепь дополнительных электронов за счёт окисления сукцината.
Комплекс III (Цитохром bc1 комплекс) переносит электроны с убихинола на два водорастворимых цитохрома с, расположенных на внутренней мембране митохондрии. Убихинол передаёт 2 электрона, а цитохромы за один цикл переносят по одному электрону. При этом туда также переходят 2 протона убихинола и 2 перекачиваются комплексом.
Комплекс IV (Цитохром c оксидаза) катализирует перенос 4 электронов с 4 молекул цитохрома на O2 и перекачивает при этом 4 протона в межмембранное пространство. Комплекс состоит из цитохромов a и a3, которые, помимо гема, содержат ионы меди.
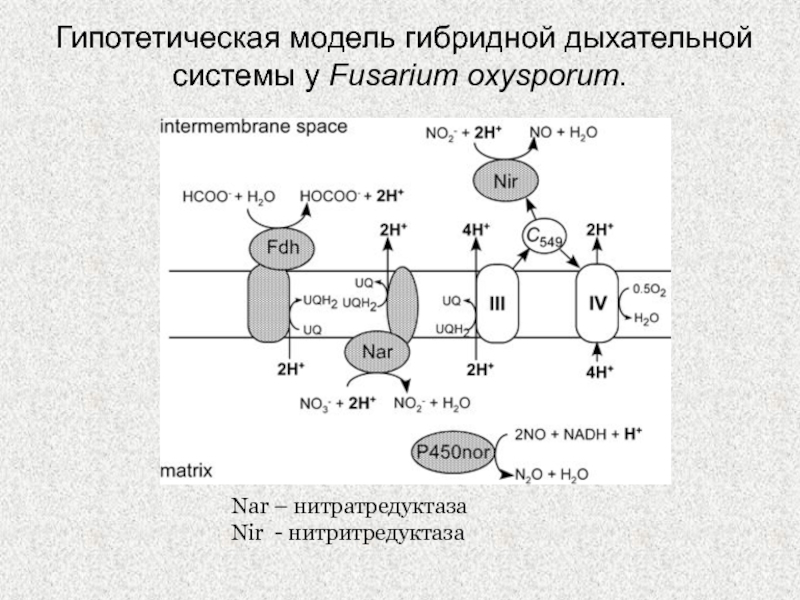
Слайд 8Гипотетическая модель гибридной дыхательной системы у Fusarium oxysporum.
Nar – нитратредуктаза
Nir
- нитритредуктаза
Слайд 9Первые наблюдения митохондрий у гриба Pustularia versispora (Tarzetta catinus) относятся
к 1911 году, несколько позже описаны митохондрии у дрожжей. С
1938 года по 1950 год в печати вышла серия работ русского ученого М.Н. Мейселя по изучению функциональной морфологии дрожжевых организмов, в которых большое внимание было уделено структуре и функциям митохондрий.
Слайд 10Методы наблюдения митохондрий у грибов
Флуоресцентные (потенциалзависимые красители или встраивание GFP
плазмиды в геном митохондрий)
Методы иммуноцитохимии с последующим наблюдением в световом
или электронном микроскопе
Слайд 12Морфология и распределение хондриома в клетке
определяется следующими факторами:
- положением
клеток в колонии
- условиями культивирования
- стадией жизненного цикла
и т.д.
Совокупность
митохондрий в клетке – хондриом.
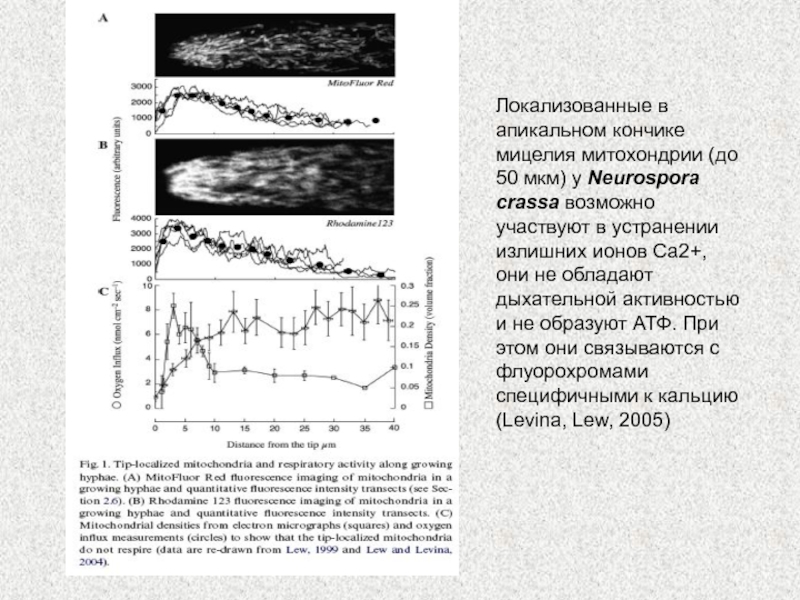
Слайд 13Локализованные в апикальном кончике мицелия митохондрии (до 50 мкм) у
Neurospora crassa возможно участвуют в устранении излишних ионов Са2+,
они
не обладают дыхательной активностью и не образуют АТФ. При этом они связываются с флуорохромами специфичными к кальцию (Levina, Lew, 2005)
Слайд 14Распределение и морфология митохондрий у мицелиальных грибов
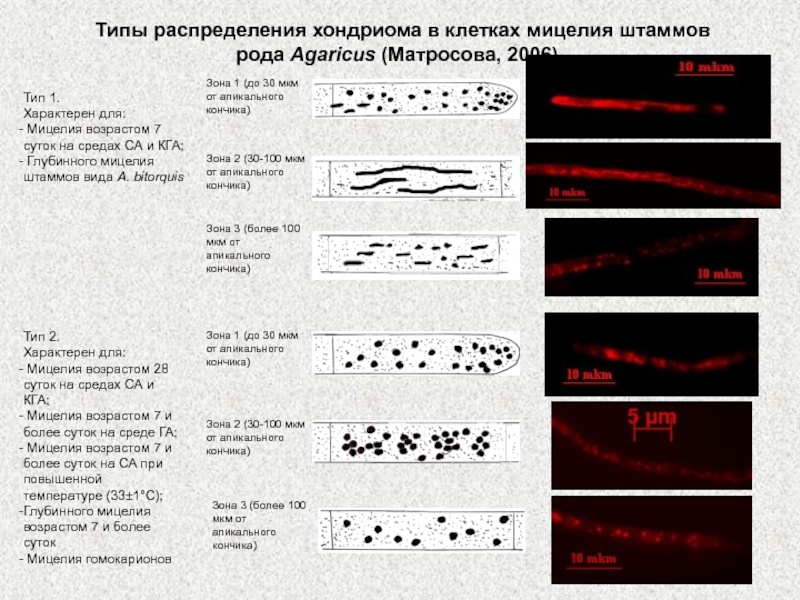
Слайд 15Типы распределения хондриома в клетках мицелия штаммов рода Agaricus (Матросова,
2006) .
Тип 1.
Характерен для:
Мицелия возрастом 7 суток на средах
СА и КГА;
Глубинного мицелия штаммов вида A. bitorquis
Тип 2.
Характерен для:
Мицелия возрастом 28 суток на средах СА и КГА;
Мицелия возрастом 7 и более суток на среде ГА;
Мицелия возрастом 7 и более суток на СА при повышенной температуре (33±1°С);
Глубинного мицелия возрастом 7 и более суток
Мицелия гомокарионов
Зона 1 (до 30 мкм от апикального кончика)
Зона 2 (30-100 мкм от апикального кончика)
Зона 3 (более 100 мкм от апикального кончика)
Зона 1 (до 30 мкм от апикального кончика)
Зона 2 (30-100 мкм от апикального кончика)
Зона 3 (более 100 мкм от апикального кончика)
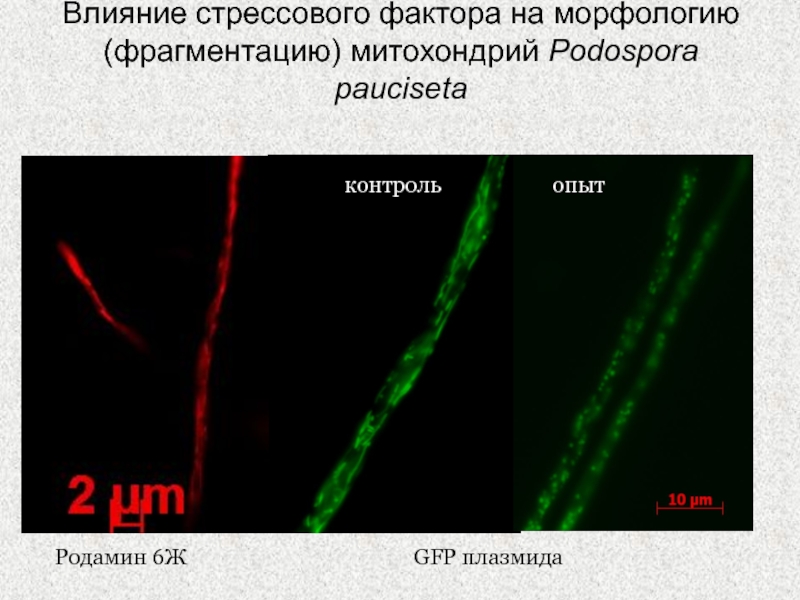
Слайд 18Влияние стрессового фактора на морфологию (фрагментацию) митохондрий Podospora pauciseta
Родамин 6Ж
GFP
плазмида
контроль
опыт
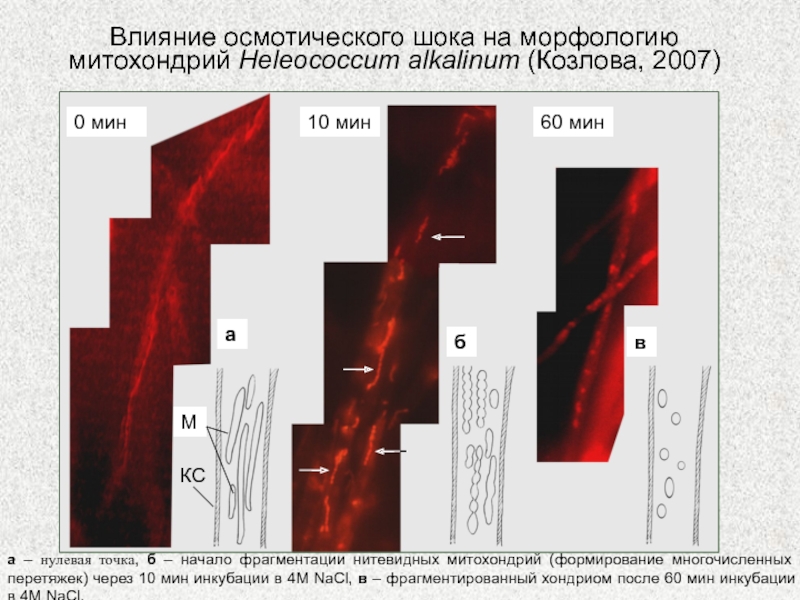
Слайд 19а – нулевая точка, б – начало фрагментации нитевидных митохондрий
(формирование многочисленных перетяжек) через 10 мин инкубации в 4М NaCl,
в – фрагментированный хондриом после 60 мин инкубации в 4М NaCl.
Влияние осмотического шока на морфологию митохондрий Heleococcum alkalinum (Козлова, 2007)
а
б
в
М
КС
0 мин
10 мин
60 мин
Слайд 20Распределение и морфология митохондрий у одноклеточных грибов
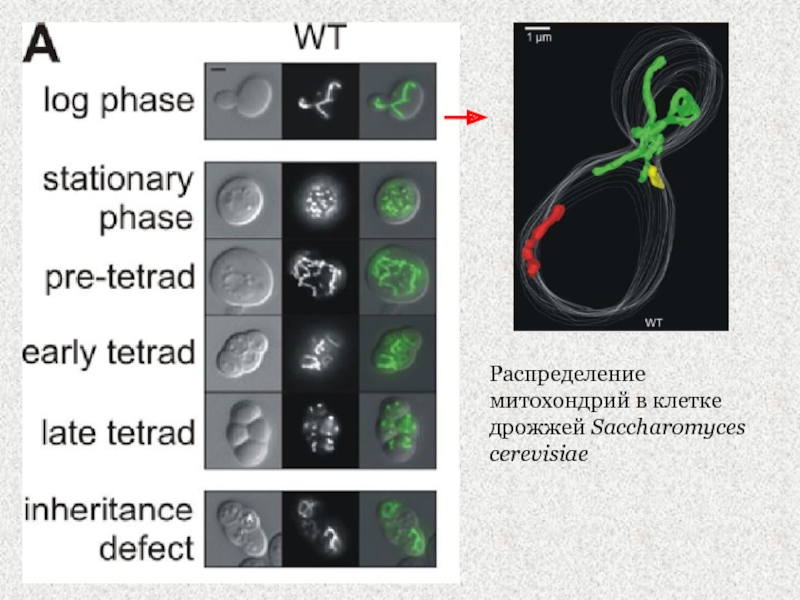
Слайд 21Распределение митохондрий в клетке дрожжей Saccharomyces cerevisiae
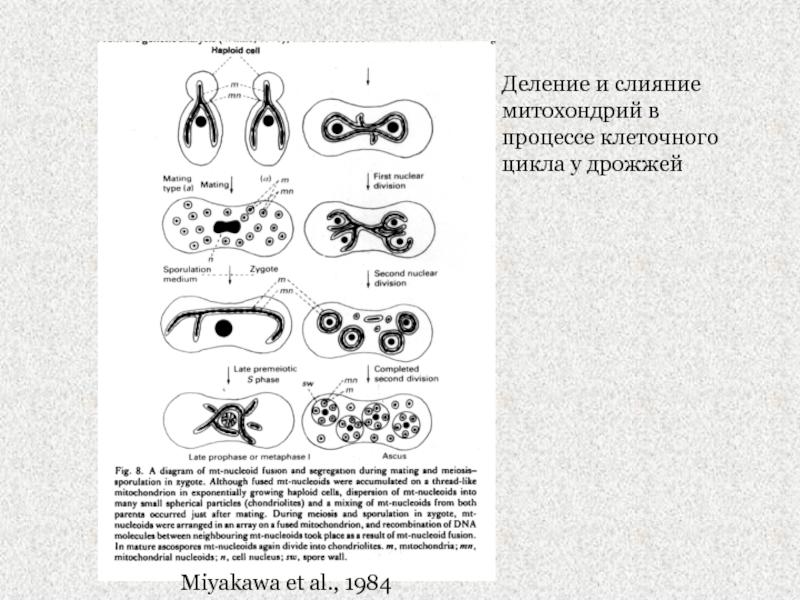
Слайд 22Miyakawa et al., 1984
Деление и слияние митохондрий в процессе клеточного
цикла у дрожжей
Слайд 24Размеры митохондрий
Размеры митохондрий непостоянны у разных видов. Обычно митохондрии
представляют собой мелкие (длина 0.5-3 мкм, редко до 25 мкм
и толщина до 0.5 мкм) внутриклеточные гранулярные или нитевидные, иногда ветвящиеся образования, располагающиеся в тех местах клетки, где необходимо использовать энергию для любых жизненных процессов (Weber et al., 1998).
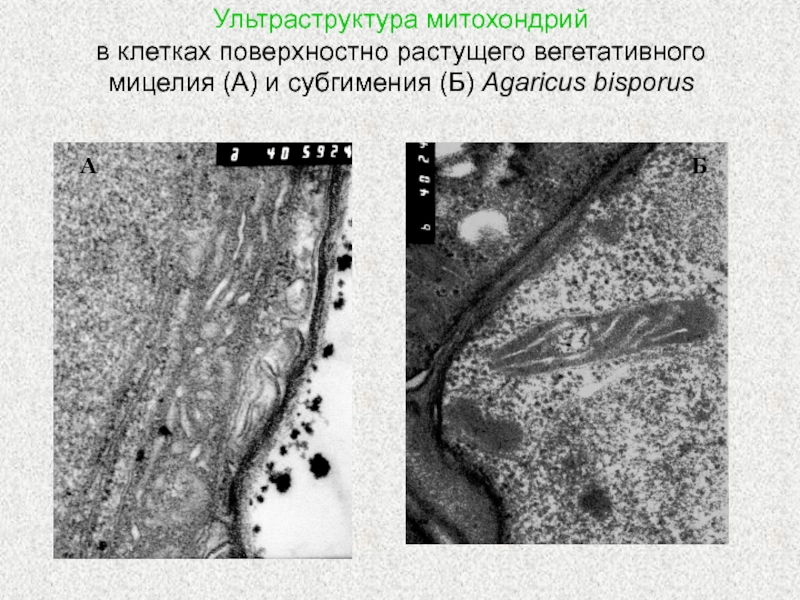
Слайд 25Ультраструктура митохондрий
в клетках поверхностно растущего вегетативного мицелия (А) и
субгимения (Б) Agaricus bisporus
А
Б
Слайд 27Морфология крист у дрожжей
Внутренняя митохондриальная мембрана способна в зависимости
от напряженности энергетического обмена образовывать большее или меньшее число складок
- крист, которые увеличивают ее активную поверхность. Кристы – наиболее лабильная структура дрожжевых митохондрий, точно реагирующая на условия аэрации культуры грибов. Они редуцируются при анаэробном развитии дрожжей (Мейсель, 1950).
Слайд 29Геном митохондрий грибов
ДНК в митохондриях представлена циклическими молекулами, не образующими
связь с гистонными белками. Митохондриальная ДНК очень однородна, отличие заключается
в величине интронов/нетранскрибируемых участков.
Митохондриальная ДНК представлены множественными копиями, собранными в кластеры. В митохондриях имеется стандартный набор генов: гены ферментов дыхательной цепи, участвующие в процессах окислительного фосфорилирования, гены рРНК, тРНК и гены АТФаз.
Митохондриальная ДНК собрана в отдельную зону – нуклеоид. В митохондриях грибов может быть от 1 до 10 нуклеоидов.
Синтез митохондриальной ДНК не связан с синтезом ДНК в ядре. В клетках дрожжей S. cerevisiae в стационарной фазе содержится 22 и более митохондрий, имеющих по четыре генома.
В отличие от позвоночных животных, у растений, грибов и простейших мтДНК содержат до 80% некодирующих последовательностей. Несмотря на то, что в геномах митохондрий млекопитающих и дрожжей содержится приблизительно одинаковое количество генов, размеры дрожжевого генома в 4-5 раз больше — около 80 тыс. пар нуклеотидов, у P. anserina – 100 тыс. пар нуклеотидов. Хотя кодирующие последовательности мтДНК дрожжей высоко гомологичны соответствующим последовательностям у человека, дрожжевые мРНК имеют дополнительно 5'-лидерную и 3'-некодирующую области, как и большинство ядерных мРНК.

Слайд 30Наследование митохондрий
Сохранение целостности митохондриального генома в процессе наследования очень важно
для дыхательной функции. Факторы, контролирующие сегрегацию митохондриального генома у грибов
мало изучены. У большинства высших эукариотических организмов однородительское наследование mtDNA (McAlpine et al., 2001). У мицелиальных грибов из класса Ascomycota Neurospora tetrasperma и N. crassa показано однородительское наследование митохондрий (Lee and Taylor, 1993, Mannella et al., 1979). Как в случае слияния специализированных половых клеток (трихогина и конидии), так и при слиянии гомокариотических клеток вегетативного мицелия, отличающихся по ядрам с разными mat-локусами сохраняются митохондрии клеток акцепторов ядер.
В то время как для почкующихся дрожжей характерно двуродительское наследование (Berger and Yaffe, 2000; Okamoto et al.,1998).
Слайд 31Движение митохондрий
В клетках Saccharomyces cerevisiae, как и в клетках Aspergillus
nidulans в транспорте митохондрий большую роль играют актиновые микрофиламенты (Hermann
and Shaw, 1998).
У дрожжей, Schizosaccharomyces pombe (Yaffe et al., 1996), и в клетках Neurospora crassa (Steinberg, Schlia, 1993), наоборот, в распределении митохондрий задействованы, в основном, микротрубочки. Исследователи наблюдали движение органелл со скоростью 1.4 мкм/с в гифах, протопласте, клеточных фрагментах и мутантах, лишенных клеточной стенки. Разрушение микротрубочек с помощью нокодазола уменьшало подвижность митохондрий, в то время как разрушение микрофиламентов цитохалазином D не оказывало такого влияния.
Было выяснено, что связывание митохондрий с микротрубочками осуществляют периферические белки этих органелл. К таким белкам относятся белки из семейства кинезинов или родственного динеину белка.
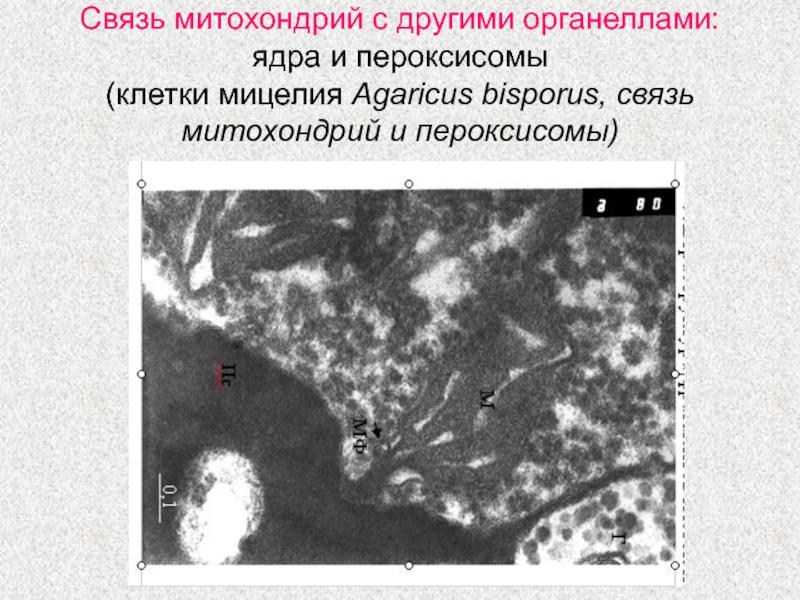
Слайд 32Связь митохондрий с другими органеллами: ядра и пероксисомы
(клетки мицелия
Agaricus bisporus, связь митохондрий и пероксисомы)
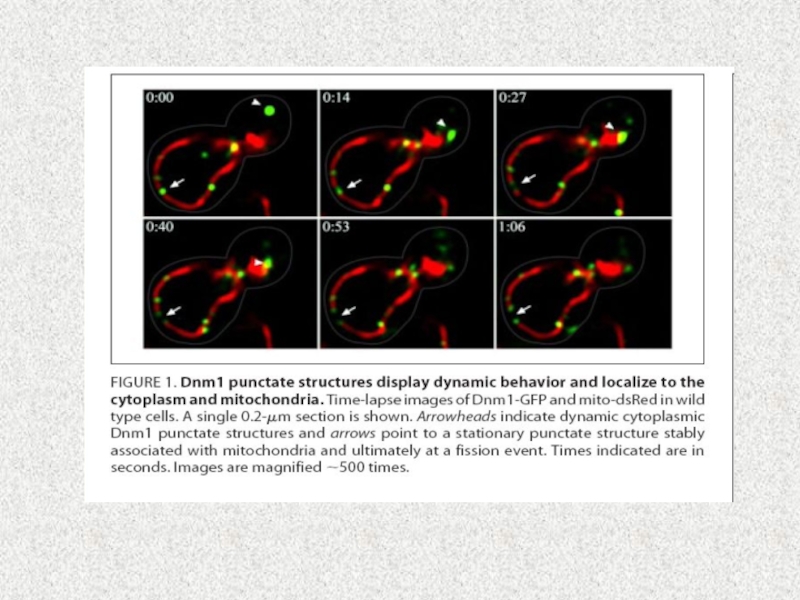
Слайд 33Слияние (англ. fusion) и деление (англ.fission или division) митохондрий
Морфология митохондрий
и количество копий зависит от баланса активности слияния и деления.
Изменение в сторону слияния дает возможности клетке строить вытянутые взаимосвязанные митохондриальные сети, в тоже время сдвиг в сторону деления генерирует множество морфологически и функционально разных маленьких сферических органелл. Эта адаптация митохондиального компартмента к клеточным потребностям является ключевой для множества важных процессов
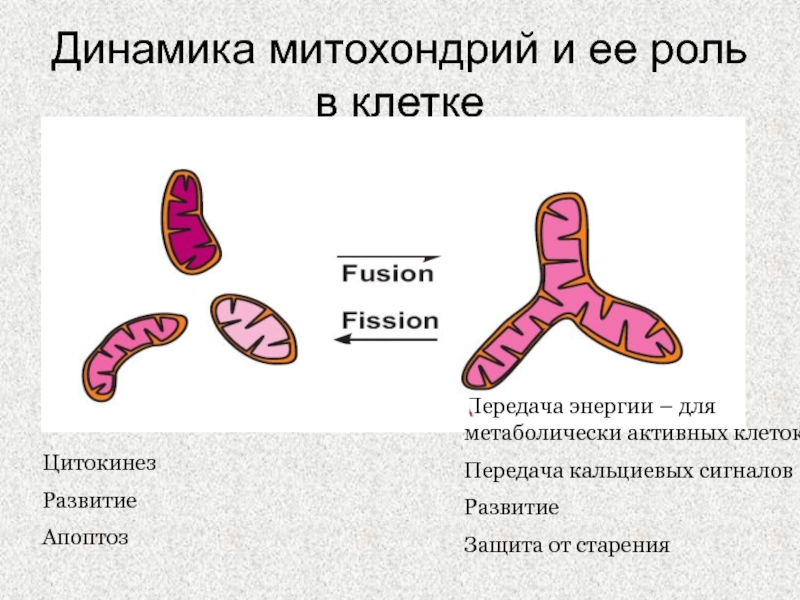
Слайд 34Динамика митохондрий и ее роль в клетке
Цитокинез
Развитие
Апоптоз
Передача энергии – для
метаболически активных клеток
Передача кальциевых сигналов
Развитие
Защита от старения
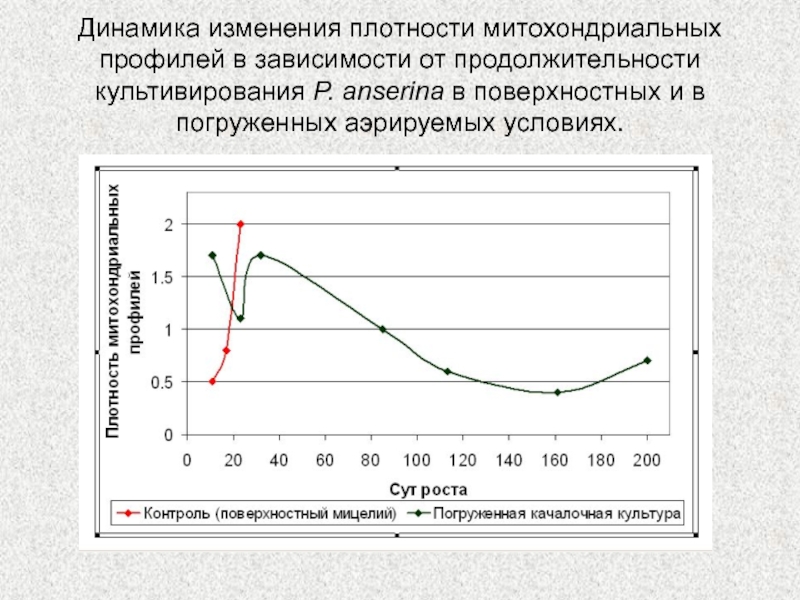
Слайд 35Динамика изменения плотности митохондриальных профилей в зависимости от продолжительности культивирования
P. anserina в поверхностных и в погруженных аэрируемых условиях.
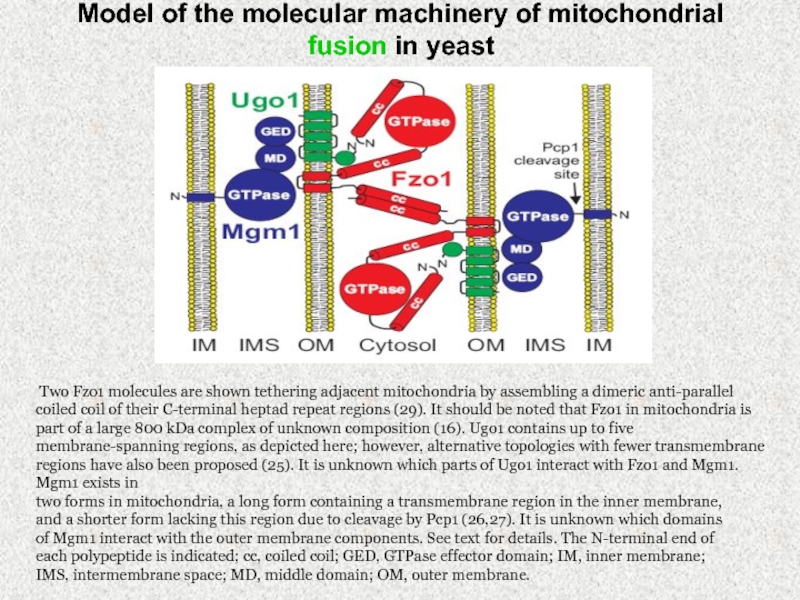
Слайд 37Model of the molecular machinery of mitochondrial fusion in yeast
Two Fzo1 molecules are shown tethering adjacent mitochondria by assembling
a dimeric anti-parallel coiled coil of their C-terminal heptad repeat regions (29). It should be noted that Fzo1 in mitochondria is part of a large 800 kDa complex of unknown composition (16). Ugo1 contains up to five membrane-spanning regions, as depicted here; however, alternative topologies with fewer transmembrane regions have also been proposed (25). It is unknown which parts of Ugo1 interact with Fzo1 and Mgm1. Mgm1 exists in
two forms in mitochondria, a long form containing a transmembrane region in the inner membrane,
and a shorter form lacking this region due to cleavage by Pcp1 (26,27). It is unknown which domains
of Mgm1 interact with the outer membrane components. See text for details. The N-terminal end of
each polypeptide is indicated; cc, coiled coil; GED, GTPase effector domain; IM, inner membrane;
IMS, intermembrane space; MD, middle domain; OM, outer membrane.
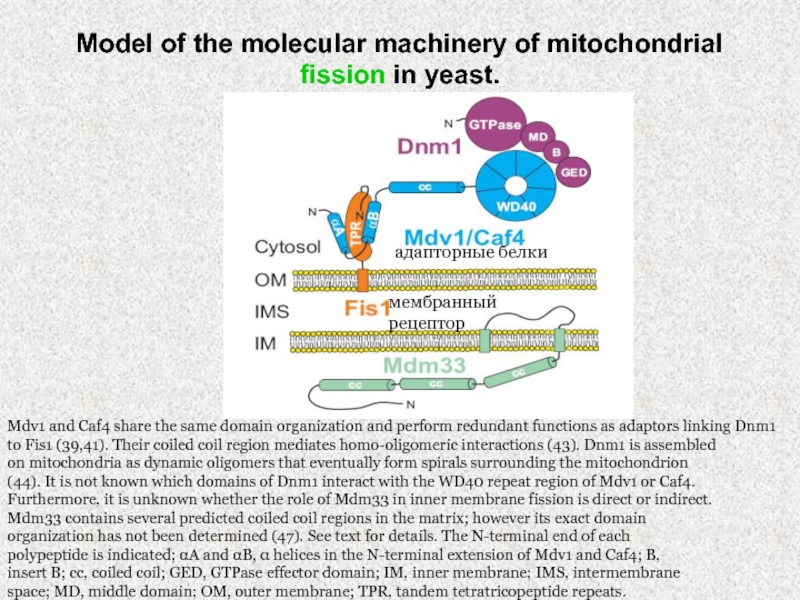
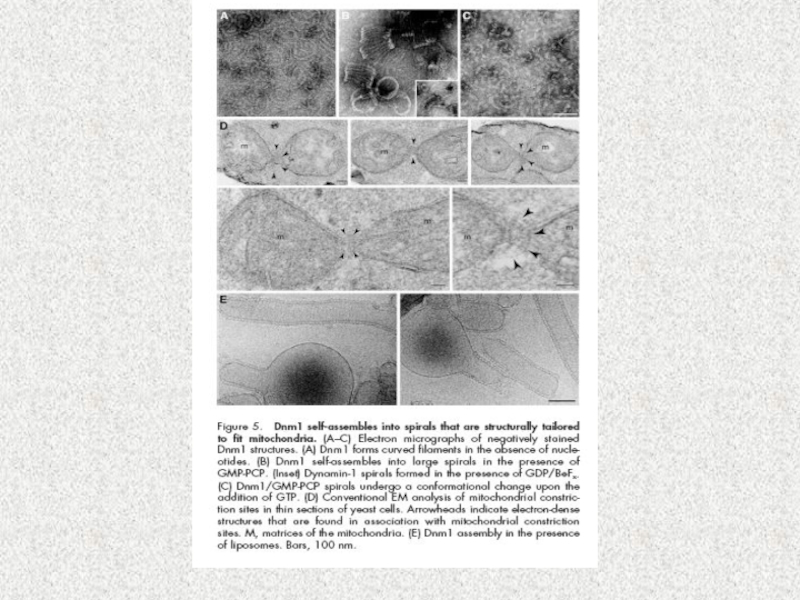
Слайд 38Model of the molecular machinery of mitochondrial fission in yeast.
Mdv1
and Caf4 share the same domain organization and perform redundant
functions as adaptors linking Dnm1 to Fis1 (39,41). Their coiled coil region mediates homo-oligomeric interactions (43). Dnm1 is assembled
on mitochondria as dynamic oligomers that eventually form spirals surrounding the mitochondrion
(44). It is not known which domains of Dnm1 interact with the WD40 repeat region of Mdv1 or Caf4.
Furthermore, it is unknown whether the role of Mdm33 in inner membrane fission is direct or indirect.
Mdm33 contains several predicted coiled coil regions in the matrix; however its exact domain
organization has not been determined (47). See text for details. The N-terminal end of each
polypeptide is indicated; αA and αB, α helices in the N-terminal extension of Mdv1 and Caf4; B,
insert B; cc, coiled coil; GED, GTPase effector domain; IM, inner membrane; IMS, intermembrane
space; MD, middle domain; OM, outer membrane; TPR, tandem tetratricopeptide repeats.
мембранный рецептор
адапторные белки
Слайд 41Продолжительность жизни, старение и смерть грибов
Слайд 42Долгоживущий мицелий базидиомицетов
Слайд 43Armillaria bulbosa (Smith , M., J. Bruhn and J. Anderson,
1992. The fungus Armillaria bulbosa is among the largest and
oldest living organisms. Nature 356 : 428 - 431). Анализ mDNA, RAPD и RFLP маркеры.
Индивидуумы Armillaria bulbosa могут оккупировать территорию 10000 м2, весить 10 000 кг и оставаться генетически стабильными более чем 1500 лет. Штат Мичиган (США), красный дуб/белая береза/сахарный клен сменились посадками красной сосны. Скорость роста ризоморф примерно 0.3 - 0.6 м в год.
Хвойный
лес
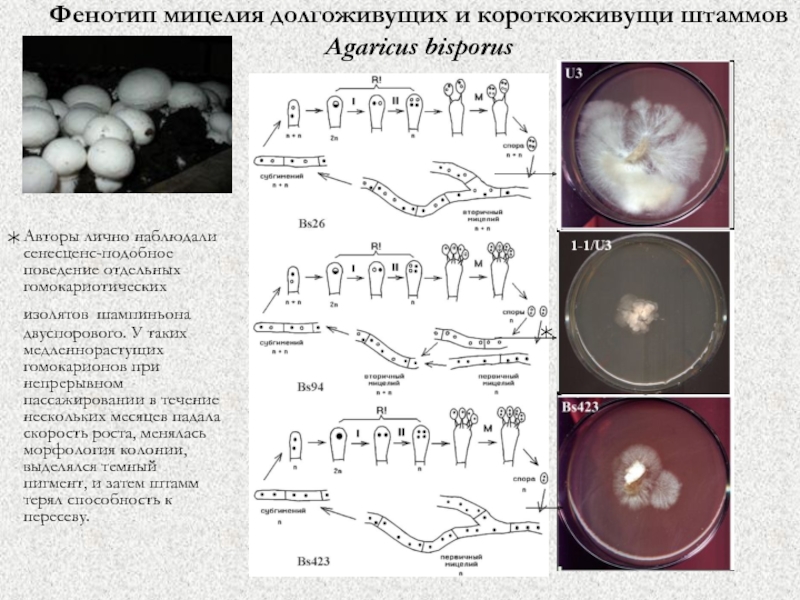
Слайд 44Фенотип мицелия долгоживущих и короткоживущи штаммов Agaricus bisporus
Авторы лично наблюдали
сенесценс-подобное поведение отдельных гомокариотических изолятов шампиньона двуспорового. У таких медленнорастущих
гомокарионов при непрерывном пассажировании в течение нескольких месяцев падала скорость роста, менялась морфология колонии, выделялся темный пигмент, и затем штамм терял способность к пересеву.
*
*
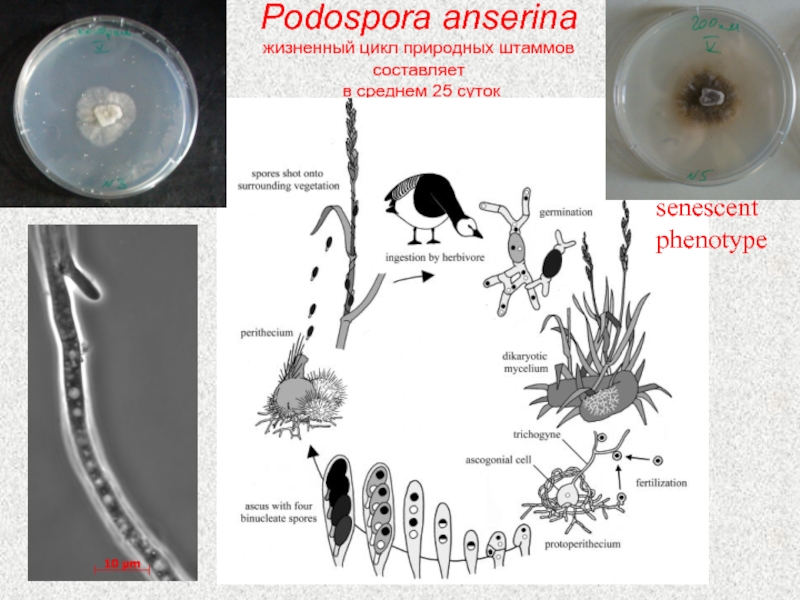
Слайд 45Podospora anserina
жизненный цикл природных штаммов составляет
в среднем 25 суток
senescent
phenotype
Слайд 46Продолжительность жизни Saccharomyces cerevisiae
Средняя продолжительность жизни клетки лабораторных штаммов
дрожжей Saccharomyces cerevisiae составляет в среднем 25 делений (время митоза
10-15 минут).
Время клеточного цикла одной клетки 135 минут (около 2-ух часов). Время жизни одной клетки составляет примерно двое суток.
Слайд 47Какие факторы влияют на продолжительность жизни модельных объектов Podospora anserina
и Saccharomyces cerevisiae ?
Источник и концентрация углерода:
Глюкоза (2%) – укорачивает
жизнь, а ацетат или глицерин (2%) - продлевают
Снижение концентрации глюкозы в среде культивирования P. anserina в 100 раз (0,02%) увеличивает продолжительность жизни в 50 раз
Снижение концентрации глюкозы в среде культивирования S.cerevisiae в 4 раза (с 2% до 0,02 %) приводит к увеличению продолжительности жизни дрожжей в 10 раз.
Ингибиторы синтеза белка и цитохромоксидазы в митохондриях увеличивают продолжительность жизни
Повышенная температура и ультрафиолетовый свет (90–120 Дж/м2), дозы, вызывающие повреждение ДНК укорачивают жизнь гриба
Окислительный стресс (обработка перекисью водорода в концентрации 3–5 мМ 180–200 мин) укорачивает жизнь клеток, а антиоксиданты (глютатион, витамин Е) ее удлиняют. И т.д.
Слайд 48На продолжительность жизни оказывают влияние не только факторы окружающей среды
и доступность питательных веществ, но и онтогенетическая программа, которая обеспечивает
адаптивную продолжительность жизни.
Слайд 49 Старение (англ. аging) это фундаментальный процесс обнаруженный почти
у всех биологических систем и может быть определен как зависимая
от времени утрата функции/й и экспоненциальное увеличение скорости наступления смерти (Osiewacz, Kimpel, 1999).
Старение, прогрессирующий процесс дегенерации, приводящий к возрастозависимому повышению смертности, обнаружено у большинства эукариот (Dufour et al., 2000). Молекулярные механизмы, отвечающие за этот процесс, остаются в большинстве своем неизвестными.
Слайд 50Признаки старения Podospora anserina and Neurospora crassa (senescent strains) (Griffiths,
1992, Osiewacz and Hamman, 2006), которые проявляются накануне смерти клеток
мицелия:
Замедление скорости роста мицелия и остановка роста
Редукция надсубстратного мицелия
Усиление пигментации
Формирование нежизнеспособных конидий
Нарушение апикального роста гиф
Подавление цитоплазматического наследования
Слайд 51У грибов процесс старения включает несколько возможных базисных механизмов (Мажейка
и сотр., 2011):
хронологическое старение
репликативное старение
апоптоз
Слайд 52Хронологическое и репликативное (митотическое) старение
Хронологическое старение - потеря жизнеспособности индивидуальных
клеток дрожжей при культивировании в стационарной фазе. Культивируемые на искусственной
среде дрожжи, после достижения стационарной фазы, живут от недели до месяца. Описано для почкующихся дрожжей и обнаружена практически у всех клеточных организмов и характеризуется накоплением внутри клетки нарушенных биомолекул и структур, внутриклеточным дефицитом макроэргов и других жизненно важных биомолекул (Bitterman et al., 2003; Osiewacz, Scheckhuber, 2006) .
Репликативное или митотическое старение – ограниченное количество клеточных делений при экспоненциальном росте колонии, сопровождающееся снижением скорости роста и смертью либо старых клеток у дрожжей, либо апикальных у мицелиальных грибов. В основе механизма репликативного старения/антистарения лежит ассиметричный цитокинез, обеспечивающий неравномерное распределение факторов старения между клетками, получившимися в результате деления. Описано для дрожжей и подоспоры (Pereira et al., 2001; Smeets, Segal, 2002; Leonhard, Nurse, 2005; Meadows, Millar, 2008) .
Особенность репликативного старения - перераспределение фактора/ов старения между клетками колонии и более быстрое накопление фактора/ов в определенных клетках (материнских у дрожжей, апикальных у P. anserina). Неравномерное распределение детерминанта старения обусловлено либо фильтрацией при цитокинезе, либо фактом, что в области деления/нарастания активный метаболизм, большие энергетические и биосинтетические потребности, либо тем и другим.

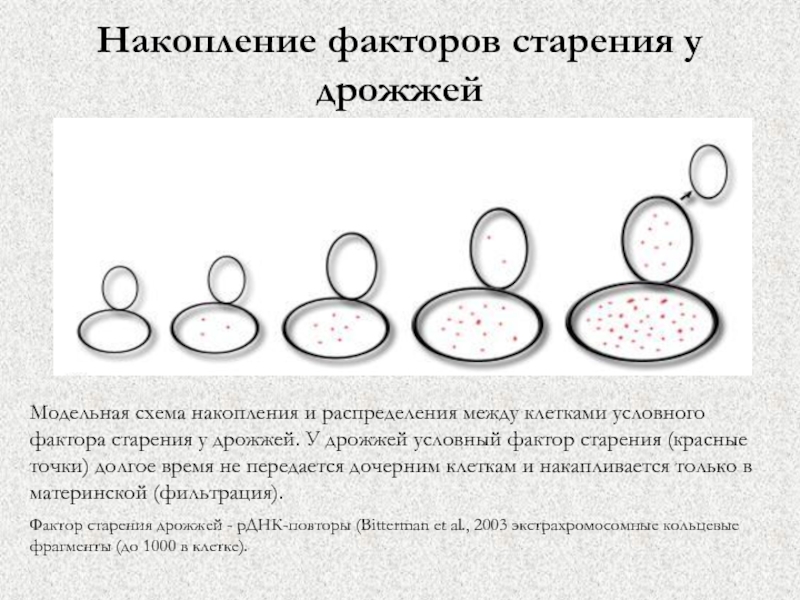
Слайд 53Накопление факторов старения у дрожжей
Модельная схема накопления и распределения между
клетками условного фактора старения у дрожжей. У дрожжей условный фактор
старения (красные точки) долгое время не передается дочерним клеткам и накапливается только в материнской (фильтрация).
Фактор старения дрожжей - рДНК-повторы (Bitterman et al., 2003 экстрахромосомные кольцевые фрагменты (до 1000 в клетке).
Слайд 54Накопление факторов старения у Рodospora anserina
Модельная схема накопления и распределения
между клеток условного фактора старения. у P. anserina. У P.
anserina фактор накапливается в гифальном апексе. Изображено два варианта такого накопления. Гифа сверху – без фильтрации, фактор накапливается в апексе – в месте наибольшей клеточной активности, и с равномерным возрастанием распределен от старых клеток к молодым. Гифа снизу – механизм, похожий на дрожжевой, с фильтрацией – фактор остается в более старых клетках лишь тогда, когда его концентрация в апексе сильно возрастает и происходит «пробой» фильтров
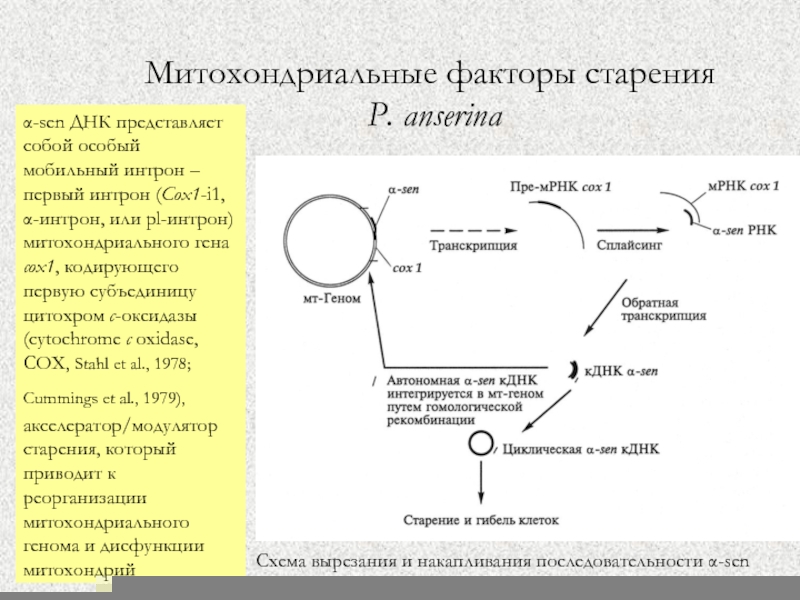
Слайд 55Митохондриальные факторы старения
P. anserina
Схема вырезания и накапливания последовательности α-sen
в стареющих культурах P.
anserina (Дьяков и др., 2005)
α-sen ДНК представляет собой особый мобильный интрон – первый интрон (Cox1-i1, α-интрон, или pl-интрон) митохондриального гена cox1, кодирующего первую субъединицу цитохром c-оксидазы (cytochrome c oxidase, COX, Stahl et al., 1978; Cummings et al., 1979), акселератор/модулятор старения, который приводит к реорганизации митохондриального генома и дисфункции митохондрий
Слайд 56Какие факторы влияют на продление или сокращение продолжительности жизни у
грибов?
Рассмотрим один фактор - условия культивирования мицелия
Слайд 57Культивирование мицелия Podospora anserina в глубинных условиях (Turker, Cummings, 1987;
Кудрявцева с сотр., 2011)
Культивирование в жидкой среде в стационарных условиях
позволяет увеличить продолжительность жизни в 2 раза по сравнению с культивированием на агаризованной среде.
Культивирование в жидкой среде на ротационной качалке позволяет получить бессмертные мутанты. Они теряют способность к формированию при скрещивании плодовых тел (женская стерильность).
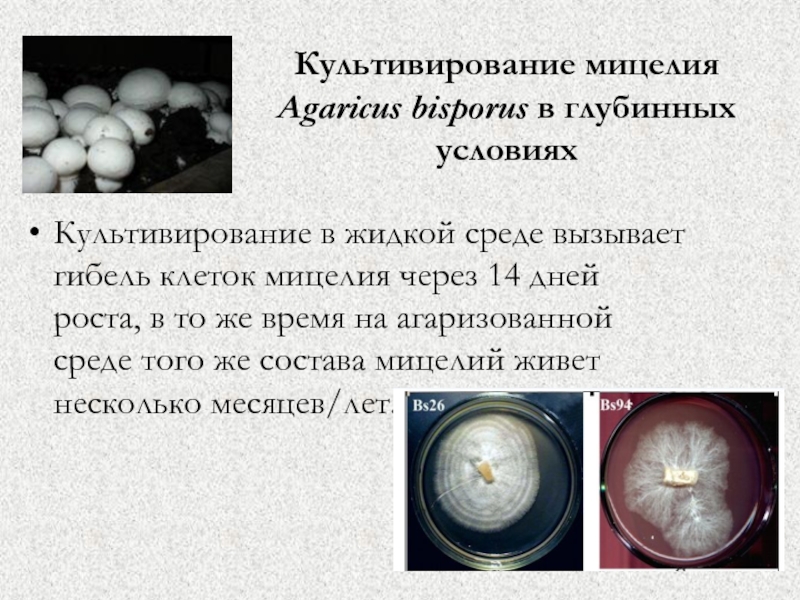
Слайд 58Культивирование мицелия Agaricus bisporus в глубинных условиях
Культивирование в жидкой среде
вызывает гибель клеток мицелия через 14 дней роста, в то
же время на агаризованной среде того же состава мицелий живет несколько месяцев/лет.
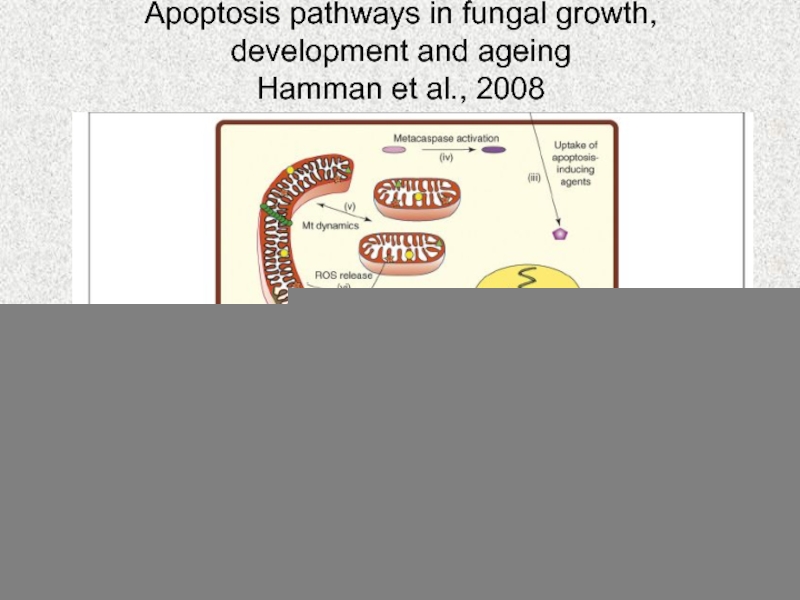
Слайд 59Роль митохондрий в апоптозе клетки
Слайд 60Apoptosis pathways in fungal growth,
development and ageing
Hamman et al., 2008
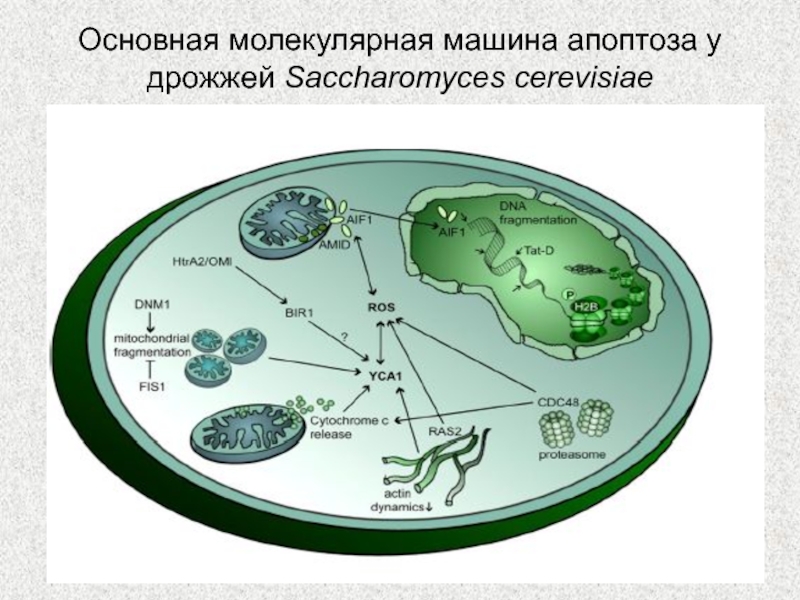
Слайд 61Основная молекулярная машина апоптоза у дрожжей Saccharomyces cerevisiae
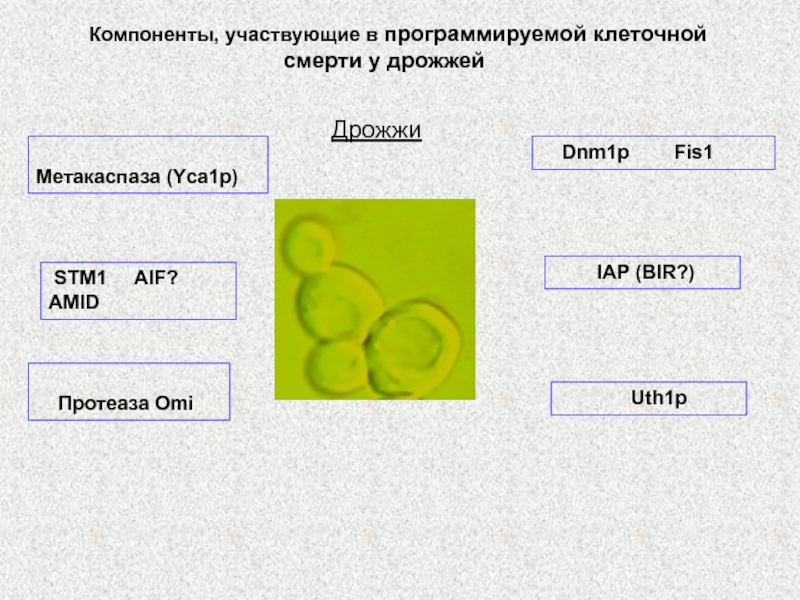
Слайд 62Дрожжи
Метакаспаза (Yca1p)
Uth1p
Dnm1p Fis1
Компоненты, участвующие в
программируемой клеточной смерти у дрожжей
STM1 AIF? AMID
IAP (BIR?)
Протеаза Omi
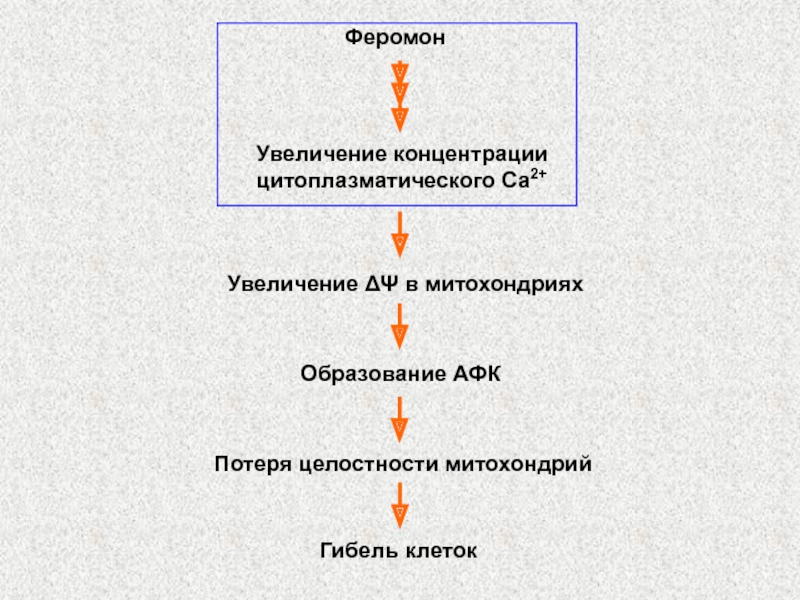
Слайд 63Феромон
Увеличение концентрации
цитоплазматического Ca2+
Увеличение ΔΨ в митохондриях
Образование АФК
Потеря целостности митохондрий
Гибель
клеток
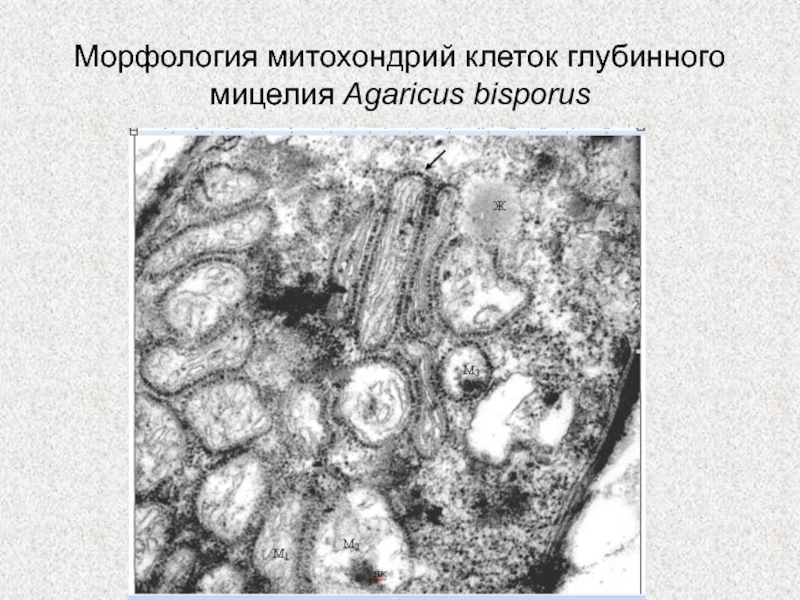
Слайд 64Морфология митохондрий клеток глубинного мицелия Agaricus bisporus
Слайд 65Ультраструктура клетки глубинного мицелия Agaricus bisporus после длительного культивирования
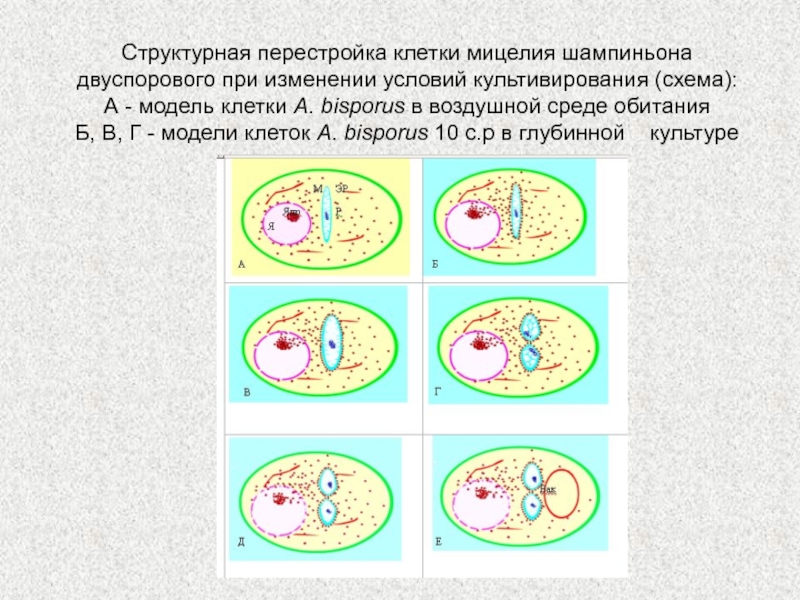
Слайд 66Структурная перестройка клетки мицелия шампиньона двуспорового при изменении условий культивирования
(схема):
А - модель клетки A. bisporus в воздушной среде
обитания
Б, В, Г - модели клеток A. bisporus 10 с.р в глубинной культуре