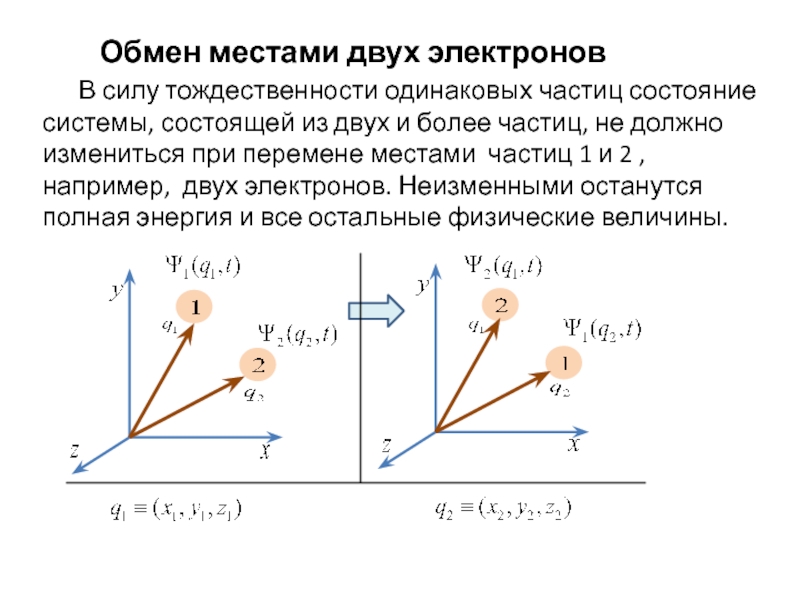
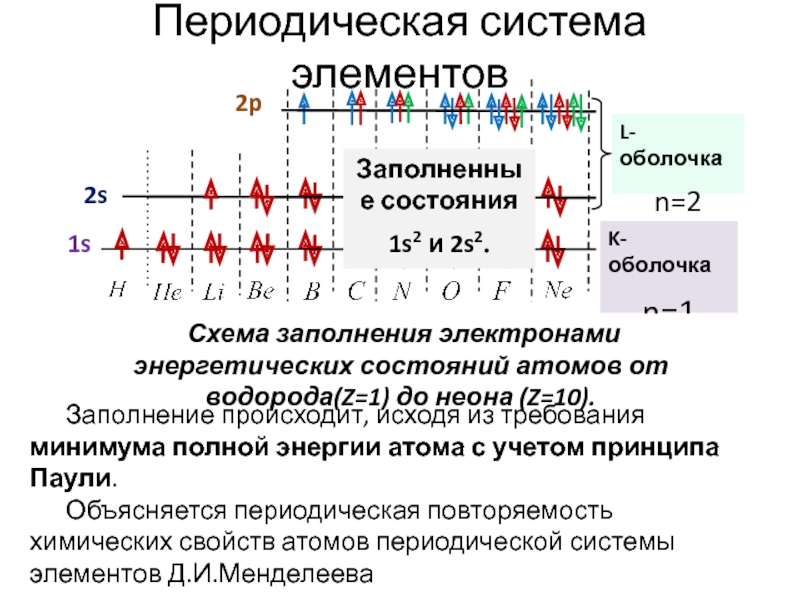
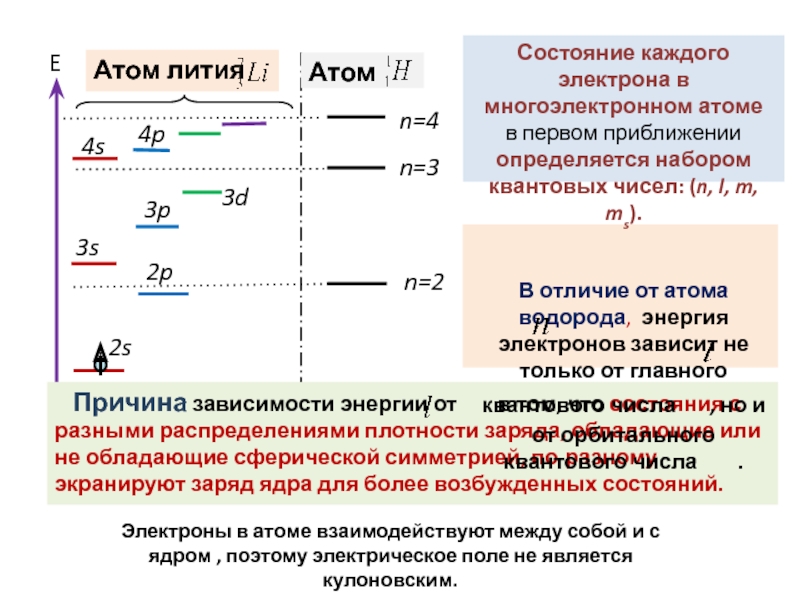
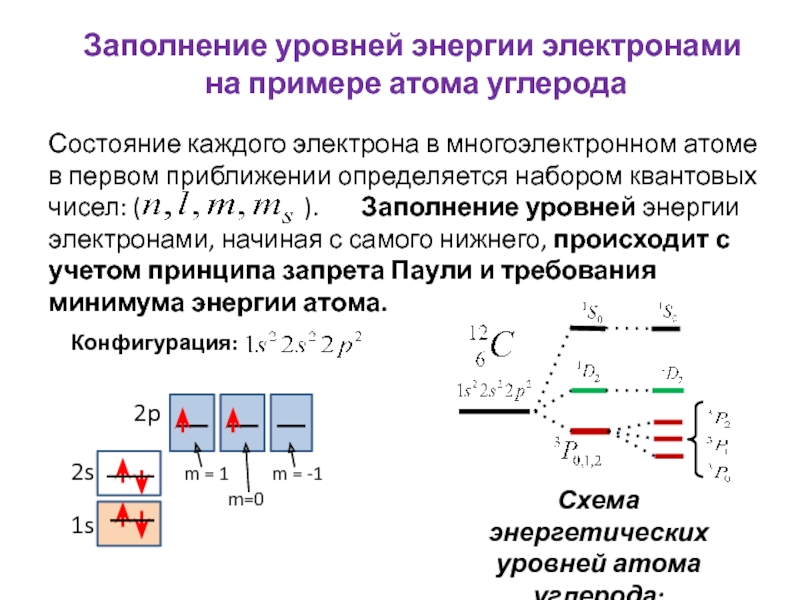
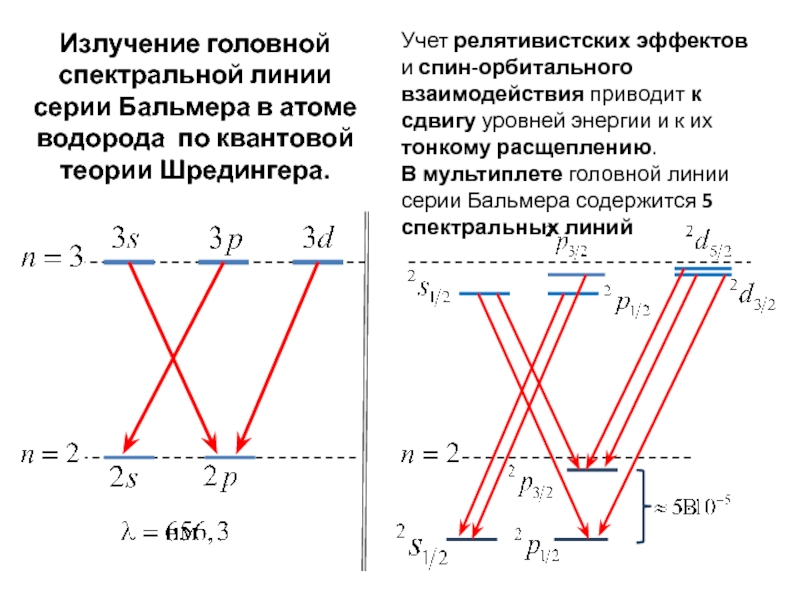
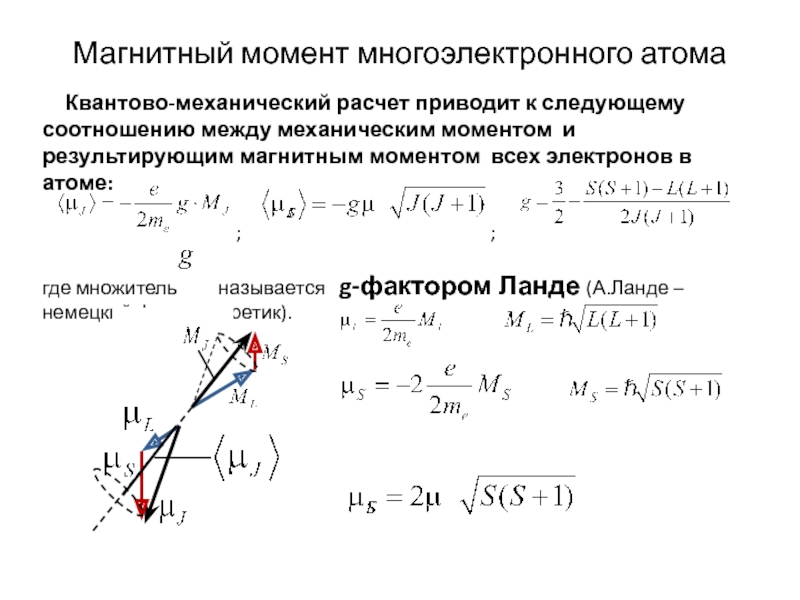
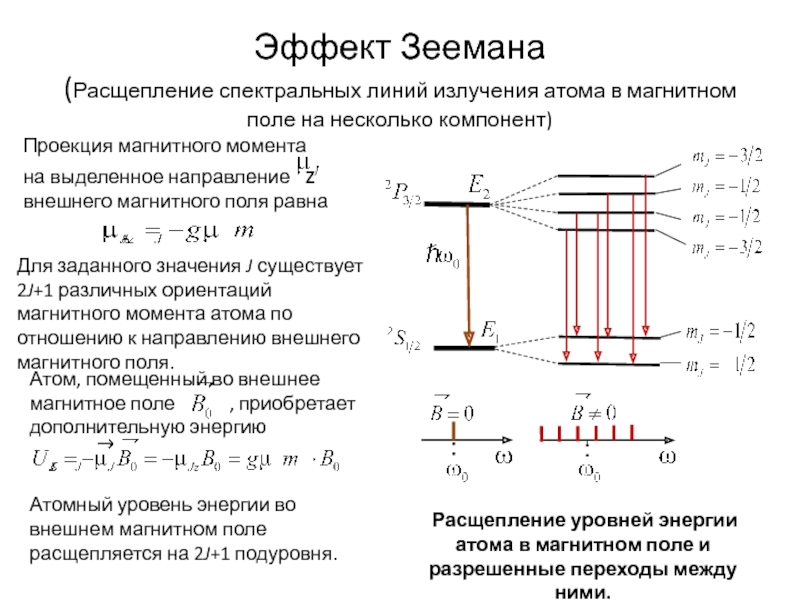
всегда можно, хотя бы в принципе, определить
индивидуальную траекторию каждой из многиходинаковых частиц.
В квантовой механике
траектория «потеряна» с самого начала согласно соотношениям неопределенностей.
Поэтому одинаковые частицы, которые имеют одинаковые значения массы, электрического заряда, спина и т.д. и находятся в общей области существования, оказываются тождественными и принципиально неразличимыми.