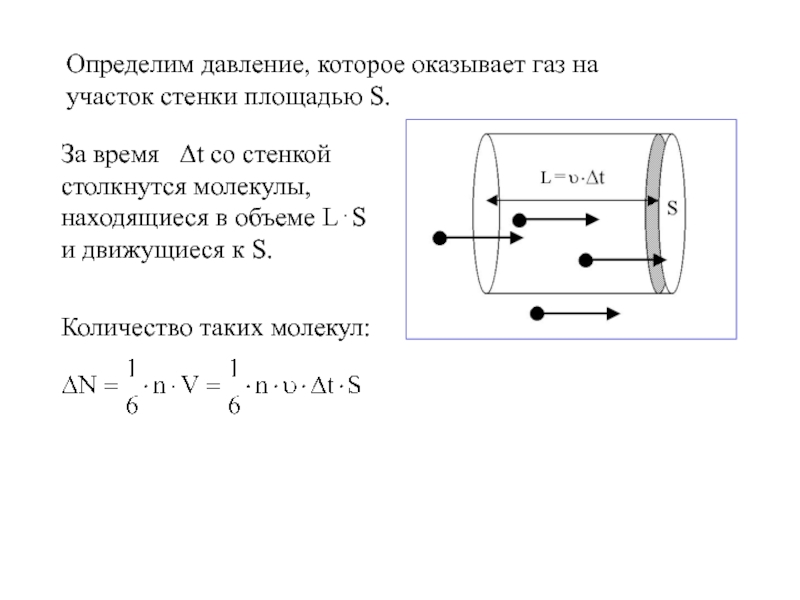
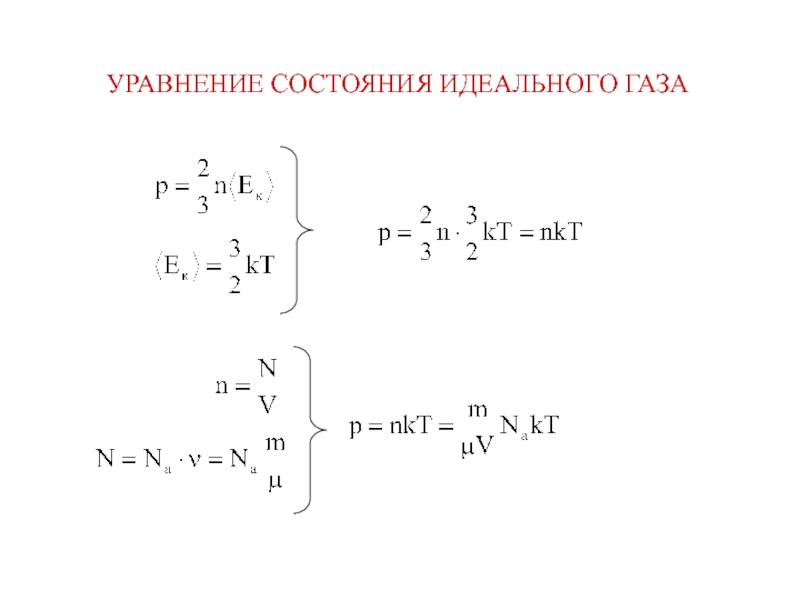
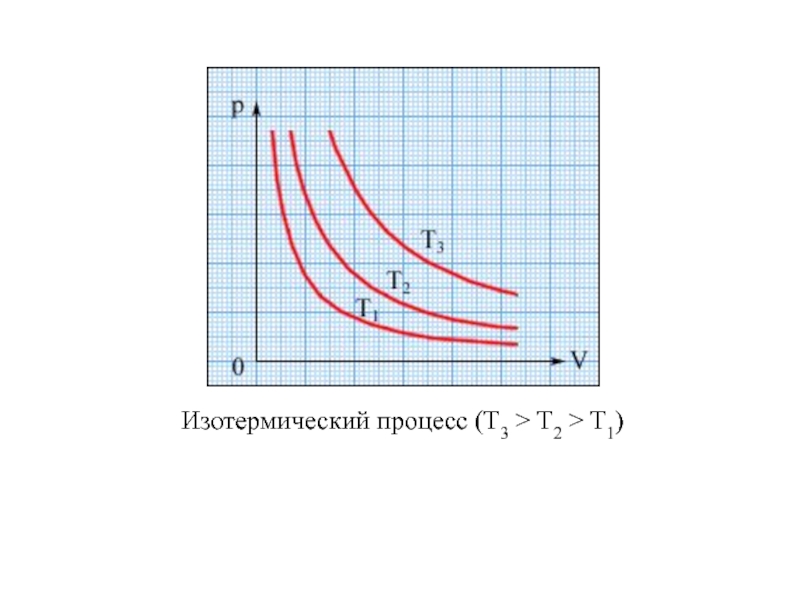
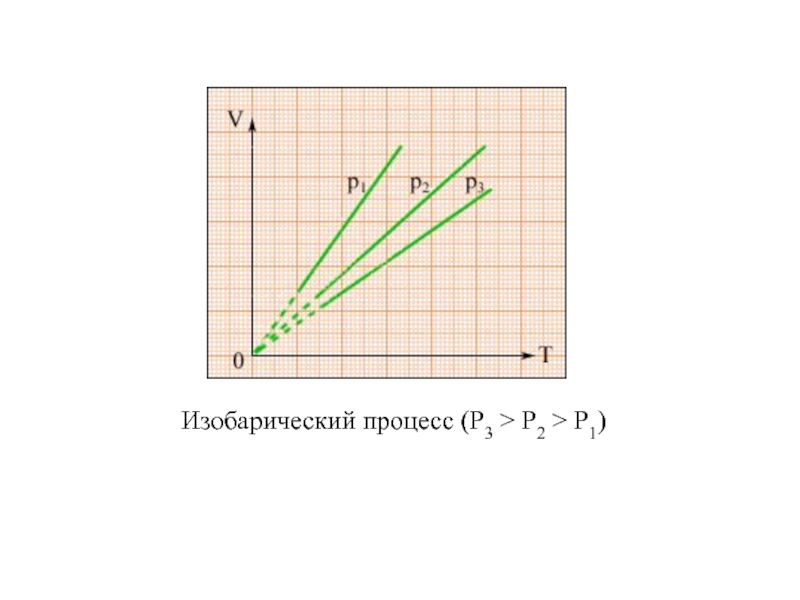
физики, в которых изучаются макроскопические процессы в телах, связанные с
огромным числом содержащихся в телах атомов и молекул. Для исследования этих процессов применяются два качественно различных метода: молекулярно-статистический (статистический) и термодинамический. Первый лежит в основе молекулярной физики, второй – термодинамики.Молекулярная физика – раздел физики, изучающий строение и свойства вещества, исходя из молекулярно–кинетических представлений, основывающихся на том, что все тела состоят из молекул, находящихся в непрерывном движении.
Термодинамика – раздел физики, изучающий общие свойства макроскопических систем и процессы перехода между различными состояниями.
Статистический и термодинамический методы