Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Молекулярная физика. Основные положения молекулярно- кинетической теории ( МКТ
Содержание
- 1. Молекулярная физика. Основные положения молекулярно- кинетической теории ( МКТ
- 2. Слайд 2
- 3. учение, которое объясняет строение
- 4. Фундаментом МКТ является атомистическая гипотеза: все тела
- 5. Слайд 5
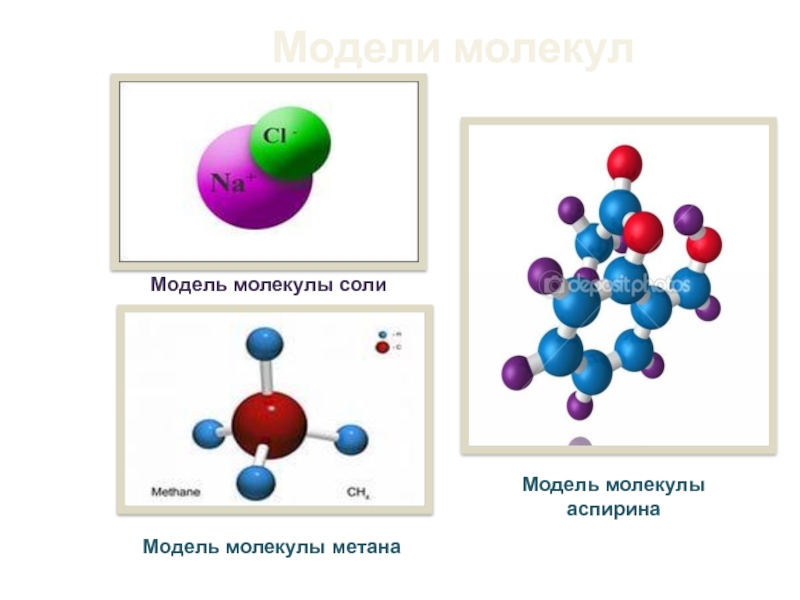
- 6. Модели молекулМодель молекулы аспирина Модель молекулы солиМодель молекулы метана
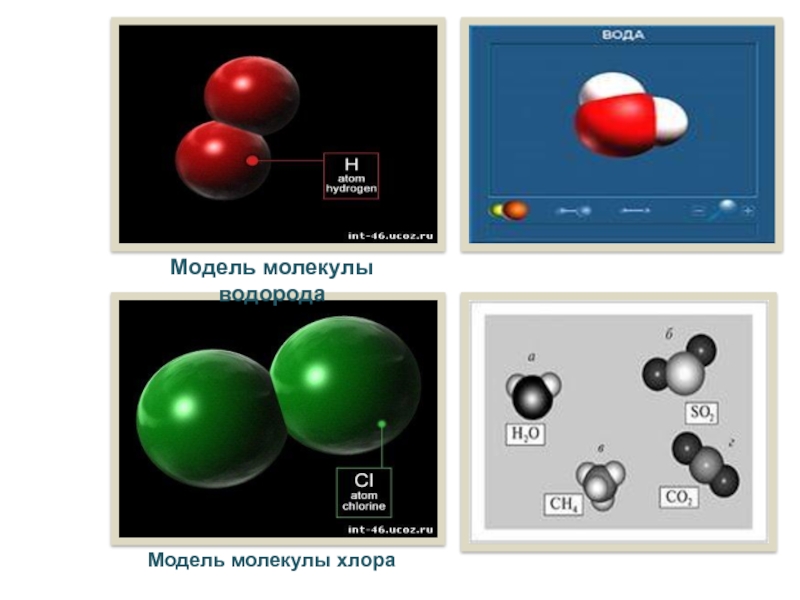
- 7. Модель молекулы водородаМодель молекулы хлораМодель молекулы воды
- 8. Основные положения МКТ:1. все тела состоят из
- 9. Косвенные доказательства:дробление веществаИспарение расширение и сжатие при
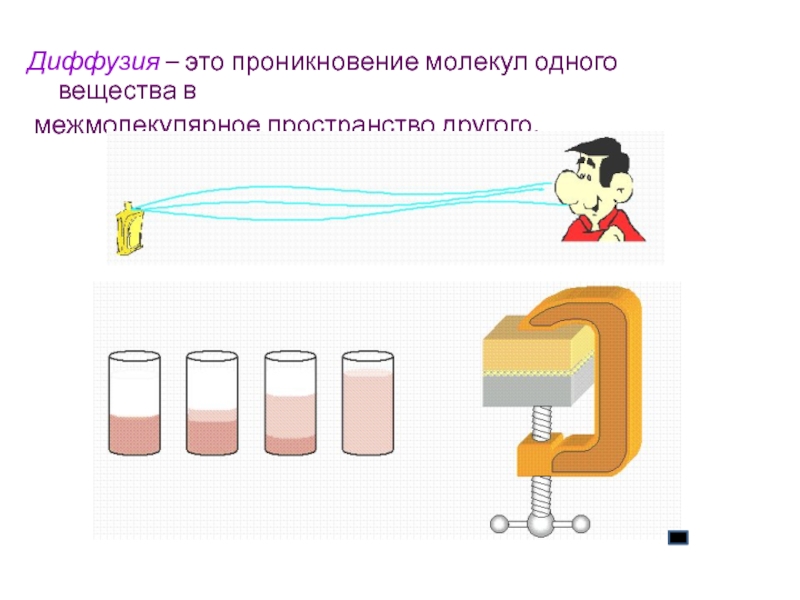
- 10. Диффузия – это проникновение молекул одного вещества в межмолекулярное пространство другого.
- 11. Причина: удары молекул жидкости о частицу
- 12. Слайд 12
- 13. Оценка размеров молекул
- 14. Число молекулПодсчитаем приблизительное число молекул в капле воды массой 1 г и, следовательно объемом 1 см3.
- 15. Масса молекулыВычислим массу одной молекулы воды.В 1 г воды содержится 3,7·1022 молекул.
- 16. Относительная молекулярная массаОтносительной молекулярной (или атомной) массой
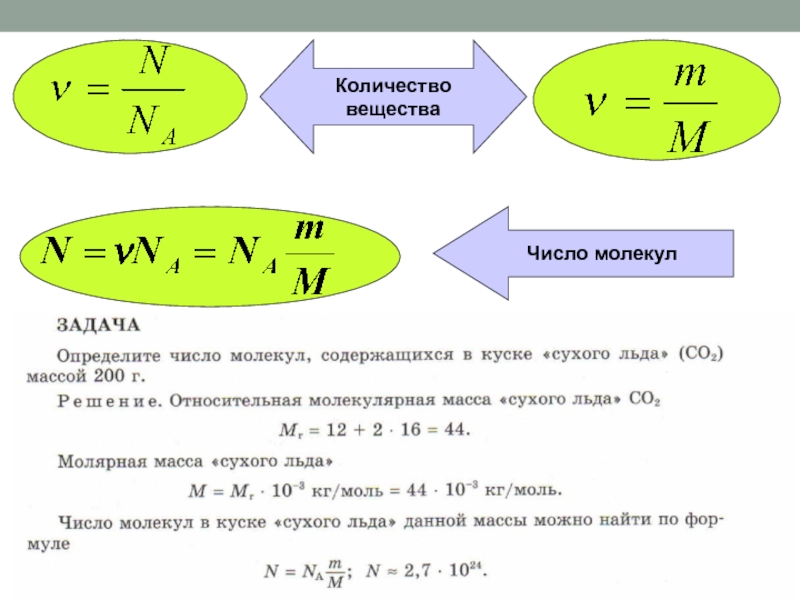
- 17. Постоянная АвогадроОдин моль – это количество вещества,
- 18. Количество вещества ν равно отношению числа молекул
- 19. Молярная массаМолярной массой М вещества называют массу
- 20. Слайд 20
- 21. Слайд 21
- 22. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Молекулярная физика.
Основные положения молекулярно-
кинетической теории (МКТ)
Размеры молекул.
Масса молекул. Количество вещества
Диффузия.
Броуновское движение
Слайд 3
учение, которое объясняет строение и свойства тел
движением и взаимодействием частиц, из которых состоят тела.
Молекулярно-кинетическая теория (МКТ)
- Слайд 4Фундаментом МКТ является атомистическая гипотеза:
все тела в природе состоят
из мельчайших структурных единиц – атомов и молекул
Слайд 8Основные положения МКТ:
1. все тела состоят из молекул, между которыми
есть промежутки;
2. частицы вещества находятся в непрерывном хаотическом движении;
3. частицы
вещества взаимодействуют друг с другомСлайд 9Косвенные доказательства:
дробление вещества
Испарение
расширение и сжатие при изменении температуры или
деформации
диффузия
Прямые доказательства:
фотографии отдельных больших молекул
определение параметров молекул
(d, m, v …)Слайд 10Диффузия – это проникновение молекул одного вещества в
межмолекулярное пространство
другого.
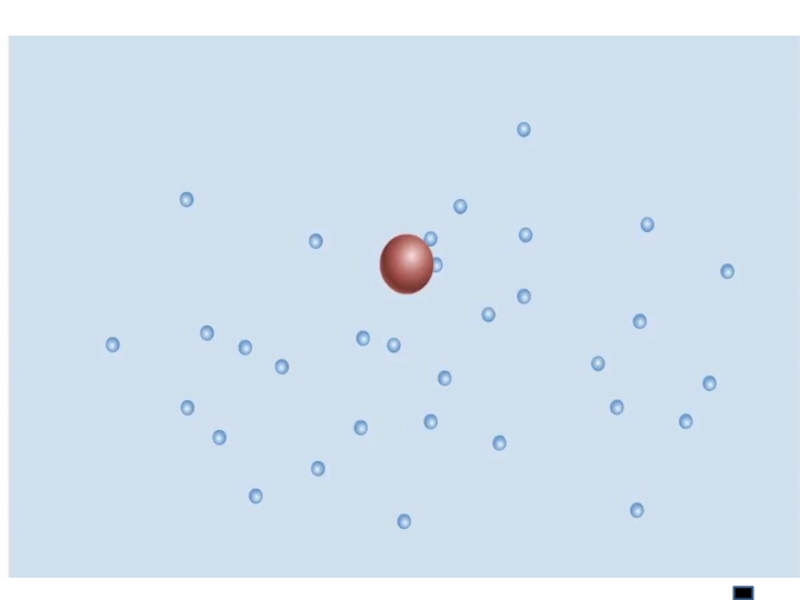
Слайд 11Причина: удары молекул жидкости
о частицу не компенсируют друг друга
Характер
движения зависит от вида жидкости, размера и формы частиц,
температуры.Броуновское движение- это беспорядочное непрерывное движение мельчайших, взвешенных в жидкости или газе частиц твердого тела под ударами молекул жидкости или газа
Характер движения зависит от вида жидкости,
размера и формы частиц, температуры.
Характер движения зависит от вида жидкости, размера и формы частиц, температуры.
Р. Броун 1827 г.
Слайд 14Число молекул
Подсчитаем приблизительное число молекул в капле воды массой 1
г и, следовательно объемом 1 см3.
Слайд 16Относительная молекулярная масса
Относительной молекулярной (или атомной) массой вещества Мr называют
отношение массы молекулы (или атома) m0 данного вещества к 1/12
массы атома углерода m0CMr (Н2О)= 2·1+16=18 а.е.м.
Вычислим Mr воды Н2О (для этого воспользуемся таблицей Менделеева)
Атомная единица массы (а.е.м.) ≈ 1,66·10-27 кг
Слайд 17Постоянная Авогадро
Один моль – это количество вещества, в котором содержится
столько же молекул или атомов, сколько атомов содержится в углероде
массой 12 г.1 моль любого вещества содержится одно и то же число атомов или молекул. Это число атомов обозначают NA и называют постоянной Авогадро в честь итальянского ученого (XIX в.).
NA = 6·1023 моль-1
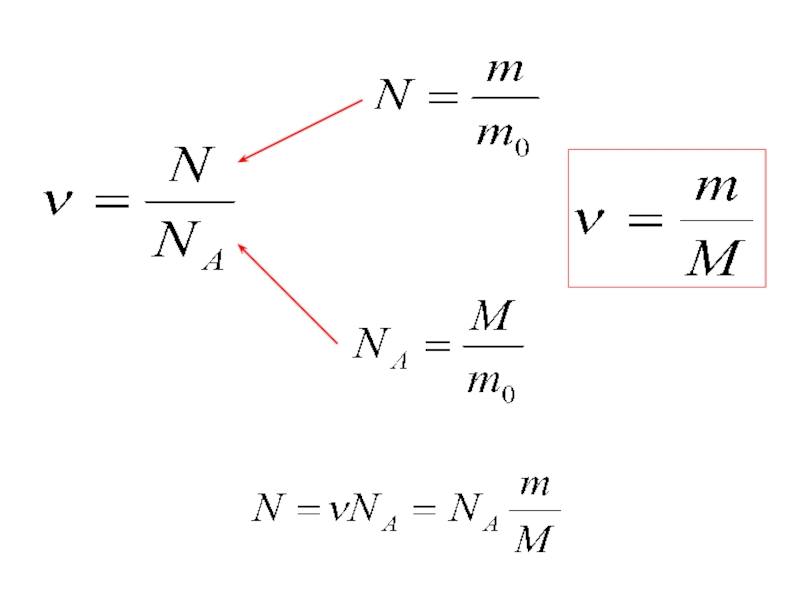
Слайд 18Количество вещества ν равно отношению числа молекул N в данном
теле к постоянной Авогадро NA, т. е. к числу молекул
в 1 моль вещества:Количество вещества
Слайд 19Молярная масса
Молярной массой М вещества называют массу вещества, взятого в
количестве 1 моль.
M = m0NA
Масса т любого количества вещества
равна произведению массы одной молекулы на число молекул в теле: m = m0N





















![АВТОМАТИЗАЦИЯ ЗВУКА [ Л ]
В СЛОВАХ](/img/tmb/6/598195/9904114927fd66f267234b3a5c44ea6c-800x.jpg)