Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Мукополисахаридозы (болезни накопления в соединительной ткани
Содержание
- 1. Мукополисахаридозы (болезни накопления в соединительной ткани
- 2. Эластин: первичная структураФибриллярный белок соединительной тканиВ нем
- 3. Эластин: пространственная организацияПолипептидные цепи укладываются в пространстве
- 4. Эластин: роль десмозинового мостикаДесмозин – это структура
- 5. Слайд 5
- 6. Аморфное вещество соединительной ткани (межуточное вещество)Клетки соединительной
- 7. Слайд 7
- 8. Слайд 8
- 9. Аморфное вещество соединительной ткани (межуточное вещество)Эластиновые волокна
- 10. Эти особые свойства соединительной ткани обеспечивают компоненты
- 11. Неколлагеновые белки соединительной ткани1. Фибронектины2. Ламинин3. Протеогликаны
- 12. ФибронектиныШироко распространены в организмеНекоторые клетки выделяют водорастворимую
- 13. Строение фибронектинаФибронектин – типичный пример «модулярных» гликопротеиновГомодимер,
- 14. Строение фибронектинаКаждая субъединица, образованная полипептидной цепью, представляет
- 15. Строение фибронектинаСтруктурные домены относительно устойчивы к протеиназам,
- 16. Строение фибронектина
- 17. Генетика фибронектинаКаждый из этих функциональных блоков –
- 18. Роль фибронектинаНерастворимая форма фибронектина в виде фибриллярной
- 19. Роль фибронектинаФибронектин связывается с агрегирующимися проколлагеновыми фибриллами
- 20. Гликозаминогликаны (гетерополисахариды) соединительной тканиДелятся на 2 группы:Сульфатированные
- 21. Сульфатированные гликозаминогликаны (СГАГ)Сульфатированные гликозаминогликаны подразделяются на 6
- 22. Сульфатированные гликозаминогликаны (ГАГ)хондроитин-4-сульфатхондороитин-6-сульфатдерматансульфатгепарингепарансульфат
- 23. Число чередующихся дисахаридных звеньев в гликозаминогликанах может
- 24. Кератансульфат – особый тип СГАГВ СГАГ шестого
- 25. Пространственная организация СГАГДлинные полисахаридные цепи складываются в
- 26. Роль СГАГУЧАСТВУЮТ В ФОРМИРОВАНИИ ПРОТЕОГЛИКАНОВ СОЕДИНИТЕЛЬНОЙ ТКАНИГлюкозаминогликаны
- 27. Несульфатированные ГАГ – гиалуроновая кислотаЯвляется одним из
- 28. Несульфатированные ГАГ – гиалуроновая кислотаГиалуроновая кислота является главным компонентом синовиальной жидкости, отвечающим за её вязкость
- 29. Формирование протеогликанов соединительной ткани Остальные 5 %
- 30. Дальнейшая судьба протеогликановВ клетке протеогликаны образуют сложный
- 31. Формирование комплекса протеогликанов с гиалуроновой кислотой
- 32. Дальнейшая судьба протеогликановТакое химическое строение обеспечивает выполнение
- 33. Дальнейшая судьба протеогликанов Например, капсула почечного клубочка
- 34. Строение гиалуроновой кислотыГиалуроновая кислота представляет собой полимер,
- 35. Строение гиалуроновой кислотыПриродная гиалуроновая кислота имеет молекулярную
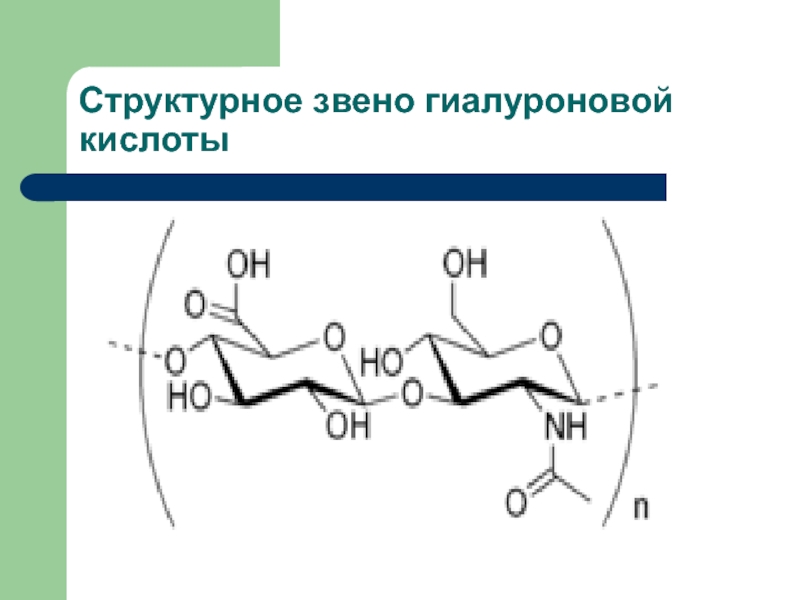
- 36. Структурное звено гиалуроновой кислоты
- 37. Содержание гиалуроновой кислотыВ теле человека весом 70
- 38. Синтез гиалуроновой кислотыГиалуроновая кислота синтезируется классом встроенных
- 39. Синтез гиалуроновой кислотыЭти ферменты удлиняют молекулу гиалуроновой
- 40. Катаболизм гиалуроновой кислотыГиалуроновая кислота расщепляется семейством ферментов,
- 41. Особенности гиалуроновой кислоты в разных тканях: хрящевая
- 42. Кожа и гиалуроновая кислотаГиалуроновая кислота входит в
- 43. Кожа и гиалуроновая кислотаПри чрезмерном воздействии на
- 44. Новые направления в исследовании роли гиалуроновой кислотыГиалуроновая
- 45. Использование препаратов гиалуроновой кислоты (гиалуронаны, гели гиалуроновой
- 46. Использование гиалуронидаз для коррекции рубцовРасщепляют гиалуроновую кислоты
- 47. Формирование протеогликанов соединительной тканиСГАГ входят в состав
- 48. Скачать презентанцию
Эластин: первичная структураФибриллярный белок соединительной тканиВ нем до 90 % гидрофобных аминокислот – еще более гидрофобен, чем зрелый коллаген. Много лизина, есть участки со строго определенной последовательностью расположения аминокислот (триады), но
Слайды и текст этой презентации
Слайд 1Биохимия соединительной ткани: эластин; фибронектин и другие неколлагеновые белки. Биохимия аморфного
вещества соединительной ткани
Слайд 2Эластин: первичная структура
Фибриллярный белок соединительной ткани
В нем до 90 %
гидрофобных аминокислот – еще более гидрофобен, чем зрелый коллаген.
Много
лизина, есть участки со строго определенной последовательностью расположения аминокислот (триады), но их меньше, чем в коллагенеСлайд 3Эластин: пространственная организация
Полипептидные цепи укладываются в пространстве в виде рыхлых
глобул из одной полипептидной цепи
За счет остатков лизина происходит
взаимодействие между молекулами эластинаПри взаимодействии лизина 4-х молекул эластина образуется ДЕСМОЗИН
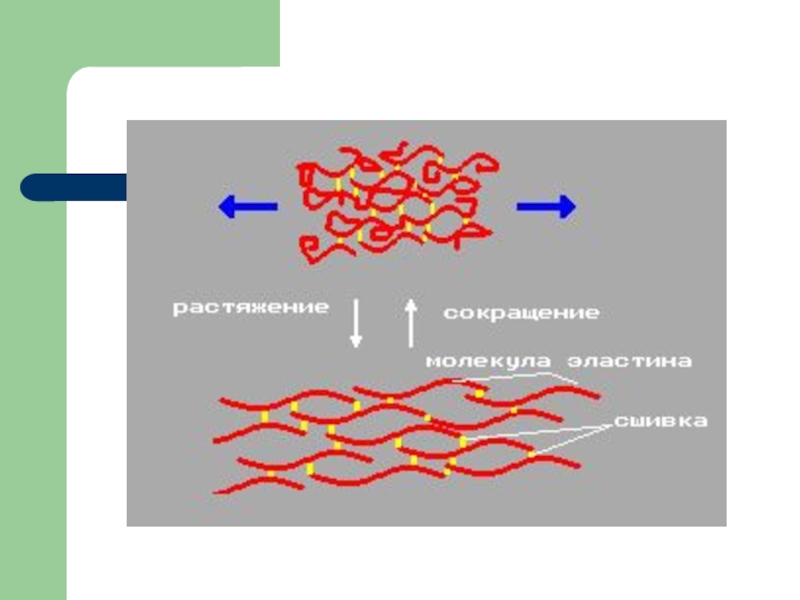
Слайд 4Эластин: роль десмозинового мостика
Десмозин – это структура пиридина, которая образована
4-мя остатками лизина четырех эластиновых цепей.
Десмозин – аналог сшивки в
коллагене. Образование десмозина между отдельными молекулами эластина делает возможным смещение молекул без разрыва (растяжение тканей, богатых эластином)
Слайд 6Аморфное вещество соединительной ткани (межуточное вещество)
Клетки соединительной ткани не могут
свободно перемещаться в ней
Коллагеновые фибриллы формируют мощные волокна коллагена, которые
практически не распадаются на отдельные нитиСлайд 9Аморфное вещество соединительной ткани (межуточное вещество)
Эластиновые волокна формируют протяженные сети,
которые после растяжения возвращаются в исходное состояние
Соединительной ткани в целом
присущи высокая упругость, малая проницаемость и постоянная степень гидрофильности (определенное количество воды в структуре соединительной ткани)Слайд 10Эти особые свойства соединительной ткани обеспечивают компоненты внеклеточного аморфного вещества:
Неколлагеновые
белки аморфного вещества
Углеводные структуры (гетерополисахариды соединительной ткани)
Слайд 11Неколлагеновые белки соединительной ткани
1. Фибронектины
2. Ламинин
3. Протеогликаны соединительной ткани
4. Белки-регуляторы
остеогенеза
Все эти белки синтезируются клетками соединительной ткани, однако зрелая форма
образуется в межклеточном пространстве путем многоступенчатой посттрансляционнной модификацииСлайд 12Фибронектины
Широко распространены в организме
Некоторые клетки выделяют водорастворимую разновидность фибронектина
Клетки соединительной
ткани продуцируют в основном нерастворимую форму фибронектина
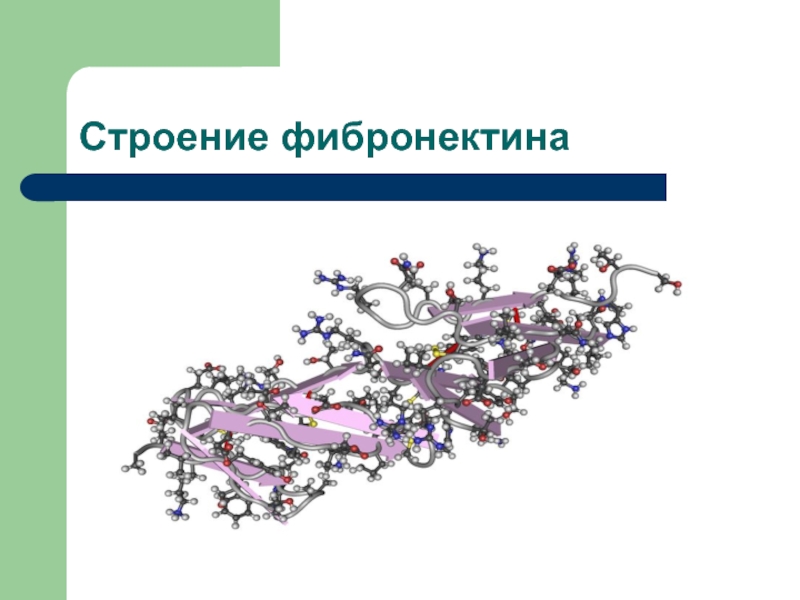
Слайд 13Строение фибронектина
Фибронектин – типичный пример «модулярных» гликопротеинов
Гомодимер, состоящий из 2
идентичных полипетидов, каждый из которых имеет молекулярную массу порядка 235
КДа (2 субъединицы фибронектина)Полипетиды гомодимера связаны друг с другом дисульфидными связями на С-концевой части молекулы
Слайд 14Строение фибронектина
Каждая субъединица, образованная полипептидной цепью, представляет собой вытянутую структуру,
длиной 60-70 нм и диаметром 2-3 нм, содержит ряд небольших
функциональных ДОМЕНОВ (блоков)В фибронектине идентифицированы домены, отвечающие за способность белка связываться с коллагеном, фибрином, фактором XIII свертывания крови, гепарином, компонентом С1 комплемента, клетками разных видов
Слайд 15Строение фибронектина
Структурные домены относительно устойчивы к протеиназам, но соединены участками,
чувствительными к протеолизу
Все домены фибронектина сильно гликозилированы: присоединеннные олигосахаридные цепи
делают белок «клейким», поэтому его называют иногда «билогический клей»Слайд 17Генетика фибронектина
Каждый из этих функциональных блоков – доменов - кодируется
в гене белка одним или парой экзонов
Гены фибронектина во
всех типах клеток идентичны, но в разных клетках синтезируются разные варианты фибронектина (разные способы экспрессии генов) Не все экзоны экспрессируются в каждой молекуле фибронектина
Слайд 18Роль фибронектина
Нерастворимая форма фибронектина в виде фибриллярной сети располагается на
клеточной поверхности и во внеклеточном матриксе, препятствуя свободному перемещению клеток
Молекулы фибронектина обеспечивают прикрепление клеток к фибриллам внеклеточного матрикса
Слайд 19Роль фибронектина
Фибронектин связывается с агрегирующимися проколлагеновыми фибриллами и ускоряет образование
зрелых фибрилл
Благодаря фибронектину коллагеновые и эластиновые волокна образуют протяженные упругие
структурыФибронектины связывают бактерии, попадающие в ткани, и препятствуют их дальнейшему продвижению и размножению
При опухолевых заболеваниях количество фибронектина снижается, что способствует метастазированию опухоли
Слайд 20Гликозаминогликаны (гетерополисахариды) соединительной ткани
Делятся на 2 группы:
Сульфатированные (содержат остатки серной
кислоты)
Несульфатированные – к ним относится только ГИАЛУРОНОВАЯ КИСЛОТА
Слайд 21Сульфатированные гликозаминогликаны (СГАГ)
Сульфатированные гликозаминогликаны подразделяются на 6 основных типов
5 типов
структурно сходны — в их полисахаридных цепях чередуются дисахаридные звенья,
состоящие из остатков сульфатированных аминосахаров (N-ацетилглюкозамина и N-ацетилгалактозамина) и уроновых кислот (D-глюкуроновой или L-идуроновой)Слайд 22Сульфатированные гликозаминогликаны (ГАГ)
хондроитин-4-сульфат
хондороитин-6-сульфат
дерматансульфат
гепарин
гепарансульфат
Слайд 23
Число чередующихся дисахаридных звеньев в гликозаминогликанах может быть очень большим
Сульфатные
группы могут присоединяться к гликозаминогликанам через атом кислорода (O-сульфатирование) или
через атом азота (N-сульфатирование)Слайд 24Кератансульфат – особый тип СГАГ
В СГАГ шестого типа — кератансульфате
в дисахаридных звеньях вместо уроновых кислот находится D-галактоза.
Слайд 25Пространственная организация СГАГ
Длинные полисахаридные цепи складываются в глобулы
Эти глобулы рыхлые
(не имеют компактной укладки) и занимают сравнительно большой объем
Обычно
далее связываются со специальными белкамиСлайд 26Роль СГАГ
УЧАСТВУЮТ В ФОРМИРОВАНИИ ПРОТЕОГЛИКАНОВ СОЕДИНИТЕЛЬНОЙ ТКАНИ
Глюкозаминогликаны являются гидрофильными соединениями,
содержат много гидроксильных групп, имеют значительный отрицательный заряд (много карбоксильных
и сульфогрупп)Значительный отрицательный заряд способствует присоединению к ним положительно заряженных катионов калия, натрия, кальция, магния
Присутствие ионов увеличивает способность удерживать воду, обеспечивая высокие упругие свойства соединительной ткани
Слайд 27Несульфатированные ГАГ – гиалуроновая кислота
Является одним из основных компонентов внеклеточного
матрикса, формирующим надмолекулярные комплексы протеогликанов
Содержится во многих биологических жидкостях (слюне,
синовиальной жидкости и др.) Слайд 28Несульфатированные ГАГ – гиалуроновая кислота
Гиалуроновая кислота является главным компонентом синовиальной
жидкости, отвечающим за её вязкость
Слайд 29Формирование протеогликанов соединительной ткани
Остальные 5 % веса - это
специальный белок COR («сердцевина»)
1 молекула COR-белка может присоединить до 100
молекул СГАГ.Белковый и небелковый компоненты в протеогликанах связаны прочными ковалентными связями
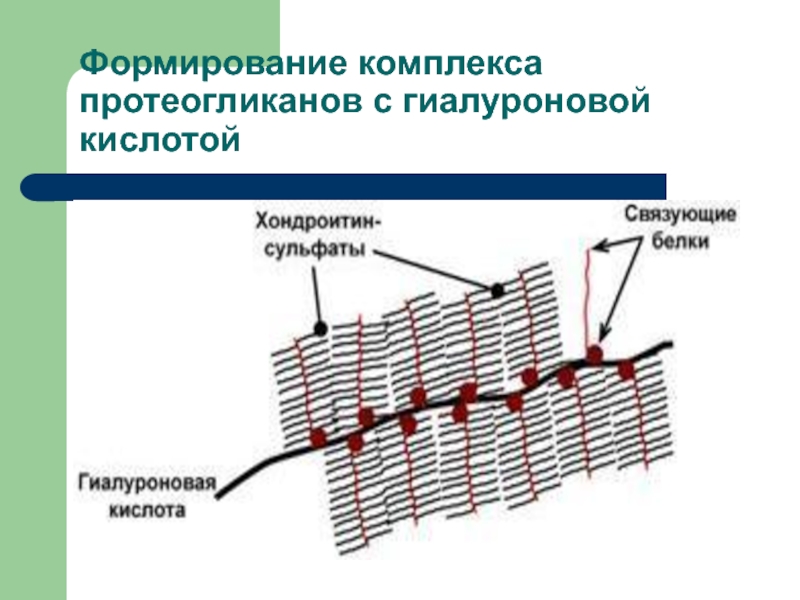
Слайд 30Дальнейшая судьба протеогликанов
В клетке протеогликаны образуют сложный надмолекулярный комплекс с
гиалуроновой кислотой
В его составе: гиалуроновая кислота, особые связующие белки, а
также протеогликаныУпругие цепи СГАГ в составе протеогликанов образуют образуют макромолекулярные сетчатые структуры
Слайд 32Дальнейшая судьба протеогликанов
Такое химическое строение обеспечивает выполнение функции молекулярного сита
с определенными размерами пор при транспорте различных веществ и метаболитов
Размер
пор определяется типом СГАГ, преобладающим в данной конкретной тканиСлайд 33Дальнейшая судьба протеогликанов
Например, капсула почечного клубочка обеспечивает селективный транспорт
веществ в процессе ультрафильтрации, работая как молекулярное сито
За счет множества
сульфо- и карбоксильных групп сетчатые структуры являются полианионами, способными депонировать воду, некоторые катионы (К+, Na+, Ca+2, Mg+2).Слайд 34Строение гиалуроновой кислоты
Гиалуроновая кислота представляет собой полимер, состоящий из остатков
D-глюкуроновой кислоты и D-N-ацетилглюкозамина, соединённых поочерёдно β-1,4- и β-1,3-гликозидными связями
Молекула гиалуроновой кислоты может содержать до 25 000 таких дисахаридных звеньев
Слайд 35Строение гиалуроновой кислоты
Природная гиалуроновая кислота имеет молекулярную массу от 5
000 до 20 000 000 Да.
Средняя молекулярная масса полимера,
содержащегося в синовиальной жидкости у человека составляет 3 140 000 Да Слайд 37Содержание гиалуроновой кислоты
В теле человека весом 70 кг в среднем
содержится около 15 граммов гиалуроновой кислоты, треть из которой преобразуется
(расщепляется или синтезируется) каждый день.Слайд 38Синтез гиалуроновой кислоты
Гиалуроновая кислота синтезируется классом встроенных мембранных белков, называющихся
гиалуронат-синтетазами (HAS)
В организмах позвоночных содержатся три типа гиалуронат-синтетаз: HAS1,
HAS2 и HAS3 Слайд 39Синтез гиалуроновой кислоты
Эти ферменты удлиняют молекулу гиалуроновой кислоты, поочерёдно присоединяя
к исходному полисахариду глюкуроновую кислоту и N-ацетилглюкозамин
В процессе синтеза полимер
экструдируется («выдавливается») через клеточную мембрану в межклеточное пространство Слайд 40Катаболизм гиалуроновой кислоты
Гиалуроновая кислота расщепляется семейством ферментов, называемых гиалуронидазами
В
организме человека существуют по меньшей мере семь типов гиалуронидазоподобных ферментов,
некоторые из них подавляют опухолеобразование.Слайд 41Особенности гиалуроновой кислоты в разных тканях: хрящевая ткань
Гиалуроновая кислота —
важный компонент суставного хряща, в котором присутствует в виде оболочки
каждой клетки (хондроцита)В хряще формируются крупные отрицательно заряженные агрегаты, поглощающие воду
С возрастом длина полимера гиалуроновой кислоты в хряще сильно уменьшается, хотя общее количество ее увеличивается.
Снижение длины цепей гиалуроновой кислоты ухудшает упругие свойства хряща (развитие артрозов, остеохондроза и т.д.)
Слайд 42Кожа и гиалуроновая кислота
Гиалуроновая кислота входит в состав кожи, где
участвует в регенерации ткани
Принимает значительное участие в пролиферации и
миграции клеток, Слайд 43Кожа и гиалуроновая кислота
При чрезмерном воздействии на кожу ультрафиолета, происходит
её воспаление («солнечный ожог»), при этом в клетках дермы прекращается
синтез гиалуроновой кислоты и увеличивается скорость её распадаБыстрое снижение содержания гиалуроновой кислоты в коже может стимулировать процесс развития злокачественных опухолей кожи
Слайд 44Новые направления в исследовании роли гиалуроновой кислоты
Гиалуроновая кислота участвует в
системе врождённого иммунитета
Продукты разложения гиалуроновой кислоты (олигосахариды и крайне низкомолекулярные
гиалуронаты) проявляют проангиогенные свойства – способствуют росту и восстановлению сосудов в области поврежденийНедавние исследования показали, что фрагменты гиалуроновой кислоты способны индуцировать воспалительный ответ в макрофагах и дендритных клетках при повреждениях тканей и отторжении трансплантированной кожи.
Слайд 45Использование препаратов гиалуроновой кислоты (гиалуронаны, гели гиалуроновой килсоты)
Катаракта (помутнение хрусталика)
Остеоартрит и другие болезни суставов: эндопротезы синовиальной жидкости;
Хирургическая среда
для офтальмологических операций; Препараты для мягкого увеличения тканей и заполнения морщин (в том числе в виде внутрикожных инъекций) в косметической хирургии
Слайд 46Использование гиалуронидаз для коррекции рубцов
Расщепляют гиалуроновую кислоты в тканях на
короткие фрагменты
При этом снижается плотность рубцовой ткани
Стимулируется образование новых сосудов
и улучшается кровоснабжениеАктивируется деление клеток эпителия в зоне введения гиалуроноидазы