них), как она изложена в некоторых книгах, подобна странице музыки
без инструмента, на котором ее можно исполнить». Ф.А. Коттон, Дж. Уилкинсон«… науки, которые не родились из эксперимента, этой основы всех познаний, бесполезны и полны заблуждений…»
Леонардо да Винчи
«Наука – это кладбище гипотез».
Анри Пуанкаре







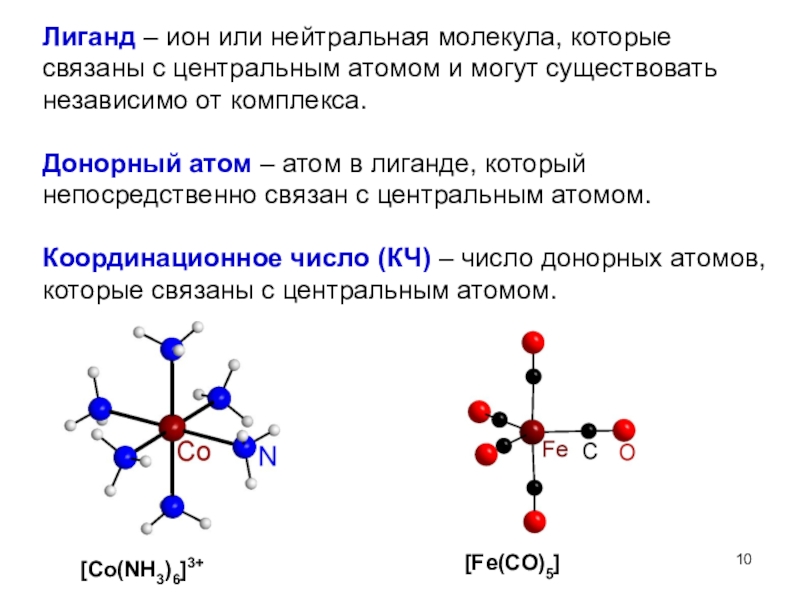
![Мы убеждены, что неорганическая химия без фактов (или почти без них), как она [Co(NH3)6]3+ - комплекс [Co(NH3)6]Cl3 – комплексное соединение (соль).[Fe(CO)5] – комплекс и [Co(NH3)6]3+ - комплекс [Co(NH3)6]Cl3 – комплексное соединение (соль).[Fe(CO)5] – комплекс и комплексное соединениеКомплекс означает центральный атом или](/img/thumbs/e79a62b1925ba29483e26240b750d7a6-800x.jpg)
![Мы убеждены, что неорганическая химия без фактов (или почти без них), как она Строение комплексного соединенияK3 [Fe(CN)6]Ион-комплексообразователь(центральный атом)ЛигандыКоординационное числоВнутренняя сфераВнешняя сфера Строение комплексного соединенияK3 [Fe(CN)6]Ион-комплексообразователь(центральный атом)ЛигандыКоординационное числоВнутренняя сфераВнешняя сфера](/img/thumbs/09ab6f5f168d0bb274c7238f828949d7-800x.jpg)

![Мы убеждены, что неорганическая химия без фактов (или почти без них), как она Примеры лигандовАнионы бескислородных кислотF-, Cl-, Br-, I- (фторо-лиганд и т.д.)Пример: K2[HgI4] Примеры лигандовАнионы бескислородных кислотF-, Cl-, Br-, I- (фторо-лиганд и т.д.)Пример: K2[HgI4] – тетраиодомеркурат(II) калияДонорный атом OОстатки кислородсодержащих](/img/thumbs/dbb783ad87035e48b8565e381a040228-800x.jpg)
![Мы убеждены, что неорганическая химия без фактов (или почти без них), как она Донорный атом OOH- - гидроксо-лигандO2- - оксо-лигандO22- - пероксо-лигандK2[Zn(OH)4] – тетрагидроксоцинкат(II) Донорный атом OOH- - гидроксо-лигандO2- - оксо-лигандO22- - пероксо-лигандK2[Zn(OH)4] – тетрагидроксоцинкат(II) калияЭлекторонейтральные молекулы с донорными атомами O:](/img/thumbs/150c678aa22e232d36f241a627721d66-800x.jpg)
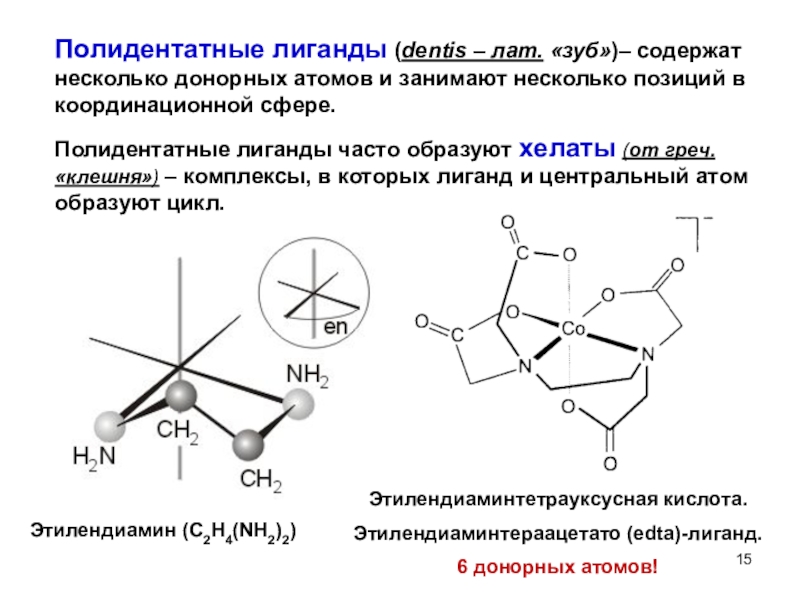
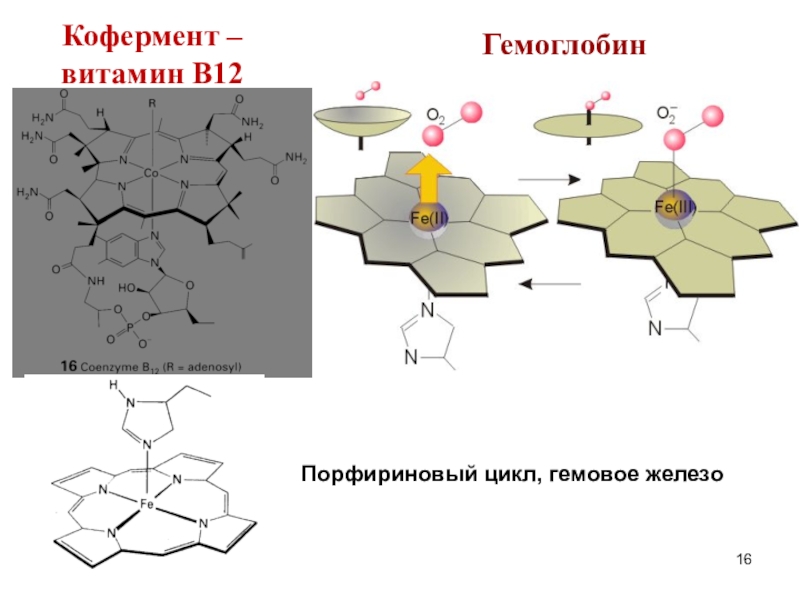
![Мы убеждены, что неорганическая химия без фактов (или почти без них), как она Электоронейтральные молекулы с донорными атомами NNH3 – аммин (лиганд)R-NH2 – амин Электоронейтральные молекулы с донорными атомами NNH3 – аммин (лиганд)R-NH2 – амин (лиганд)Пиридин (Py)Этилендиамин (En)[Pt(en)2]Cl2 – бис(этилендиамин)платина(II) хлорид](/img/thumbs/7f579f3ed668ae3e3994aca88e9ef5c3-800x.jpg)
![Мы убеждены, что неорганическая химия без фактов (или почти без них), как она Изомерия КС Геометрическая изомерияЦис-и транс- изомеры, дляквадратных частиц.[Pt(Gly)2] – диглицинатоплатина (II)Транс Изомерия КС Геометрическая изомерияЦис-и транс- изомеры, дляквадратных частиц.[Pt(Gly)2] – диглицинатоплатина (II)Транс – менее растворим в воде, чем](/img/tmb/6/506119/1ba3a35b43e0c7d4c4611b1276504d9b-800x.jpg)
![Мы убеждены, что неорганическая химия без фактов (или почти без них), как она Геометрическая изомерияос- (mer-) реберный гран- (fac-) граневойДля октаэдрических частиц[Pt(NH3)2Cl4][Co(NH3)3Cl3]транс- (trans-) цис- (cis-) Геометрическая изомерияос- (mer-) реберный гран- (fac-) граневойДля октаэдрических частиц[Pt(NH3)2Cl4][Co(NH3)3Cl3]транс- (trans-) цис- (cis-)](/img/tmb/6/506119/d2503d450959cce1ec4e1225d90ae061-800x.jpg)
![Мы убеждены, что неорганическая химия без фактов (или почти без них), как она Ионизационная изомерияЛиганды во внутренней и внешней координационной сфере меняются местами.[Co(NH3)5Cl]CN – Ионизационная изомерияЛиганды во внутренней и внешней координационной сфере меняются местами.[Co(NH3)5Cl]CN – пентаамминхлорокобальт (II) цианид[Co(NH3)5СN]Cl – пентаамминцианокобальт (II)](/img/thumbs/1882426bff75171ea260a2b15e56b308-800x.jpg)

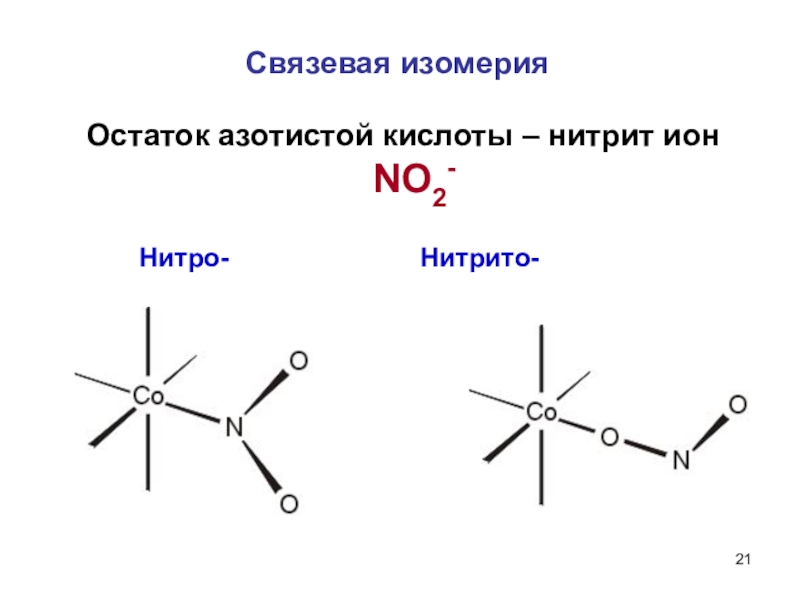

![Мы убеждены, что неорганическая химия без фактов (или почти без них), как она Координационная полимерия связана с изменение молекулярной массы комплексного соединения(PtCl2(NH3)2)n[Pt(NH3)2Cl2] – один Координационная полимерия связана с изменение молекулярной массы комплексного соединения(PtCl2(NH3)2)n[Pt(NH3)2Cl2] – один атом платины, оба изомера (цис- и](/img/thumbs/3b9d1255e09c00833a3cc21ef016c35a-800x.jpg)
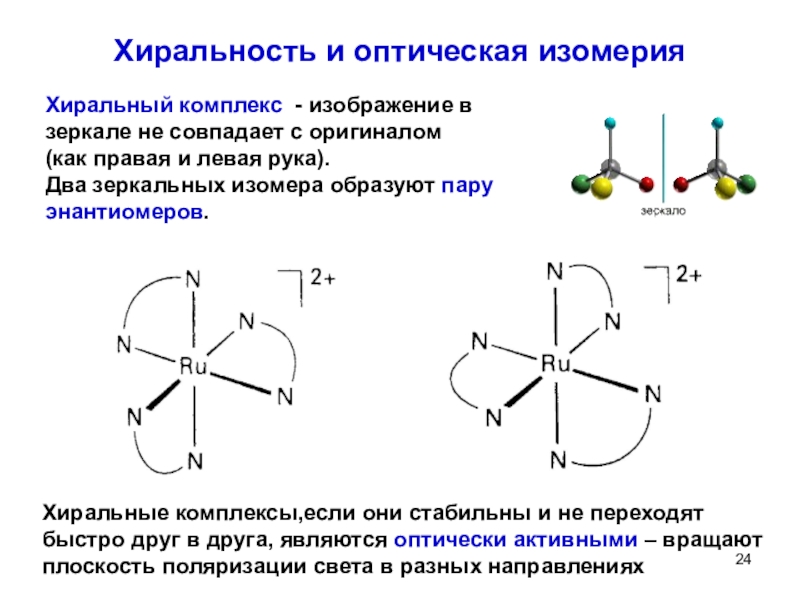
![Мы убеждены, что неорганическая химия без фактов (или почти без них), как она ТЕРМОДИНАМИЧЕСКИЕ СВОЙСТВА КОМПЛЕКСОВCd2+ + CN- = [Cd(CN)+] ТЕРМОДИНАМИЧЕСКИЕ СВОЙСТВА КОМПЛЕКСОВCd2+ + CN- = [Cd(CN)+] K1 = [Cd(CN)+]/[Cd2+][CN-][Cd(CN)+]](/img/thumbs/a10e250a942b419ea01d75d6bc387175-800x.jpg)

![Мы убеждены, что неорганическая химия без фактов (или почти без них), как она ХЕЛАТНЫЙ ЭФФЕКТ Большая устойчивость хелатных комплексов по сравнению с их нехелатными ХЕЛАТНЫЙ ЭФФЕКТ Большая устойчивость хелатных комплексов по сравнению с их нехелатными аналогами.[Ni(H2O)6]2+ + 6 NH3 = [Ni(NH3)6]2+](/img/thumbs/2de46e5235b709c4e4b472ec44f6c2ea-800x.jpg)