элементов Ia и IIa подгрупп ПС;
простые вещества, металлохимические свойства;
ослабление активности
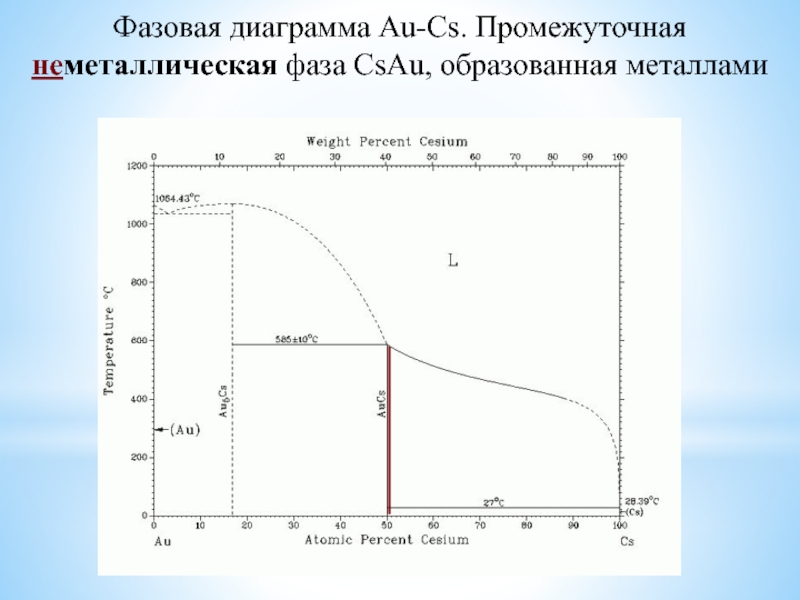
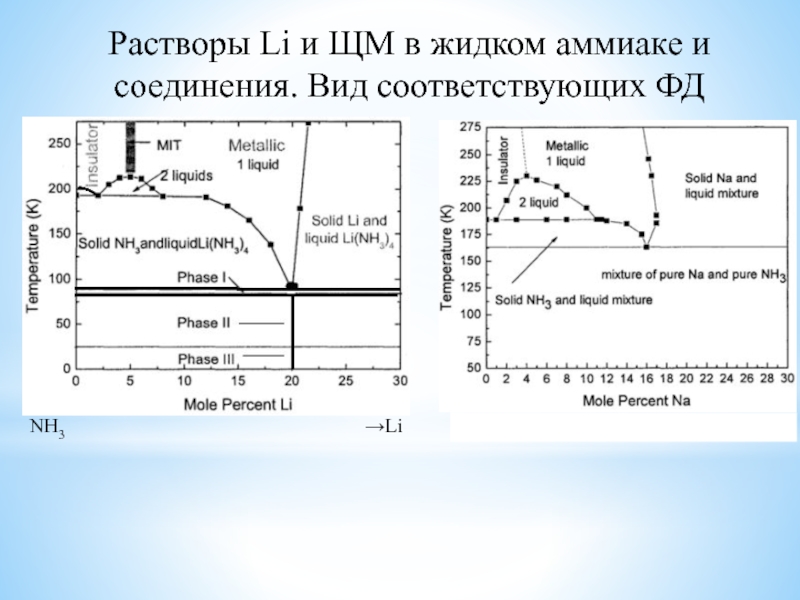
в растворенном состоянии (возможность растворения в ртути и в жидком аммиаке);солеобразование даже с благородными металлами (ЩМ);
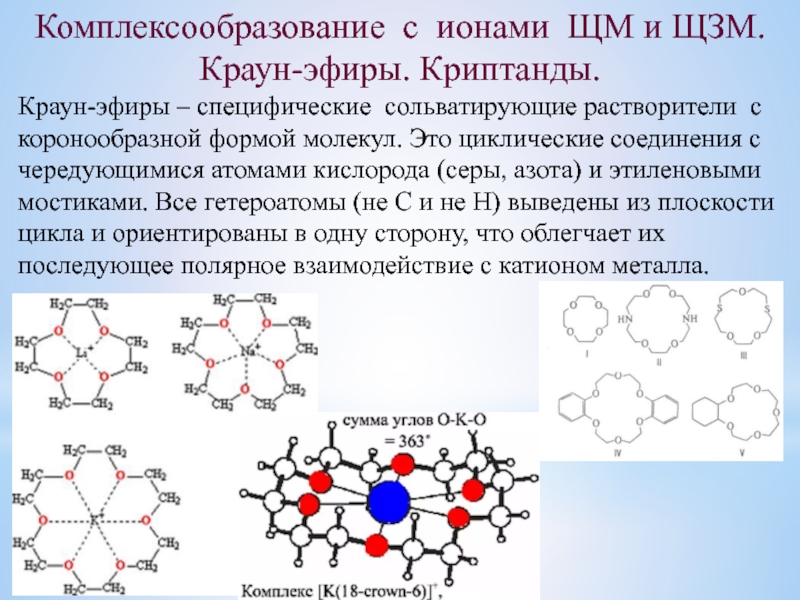
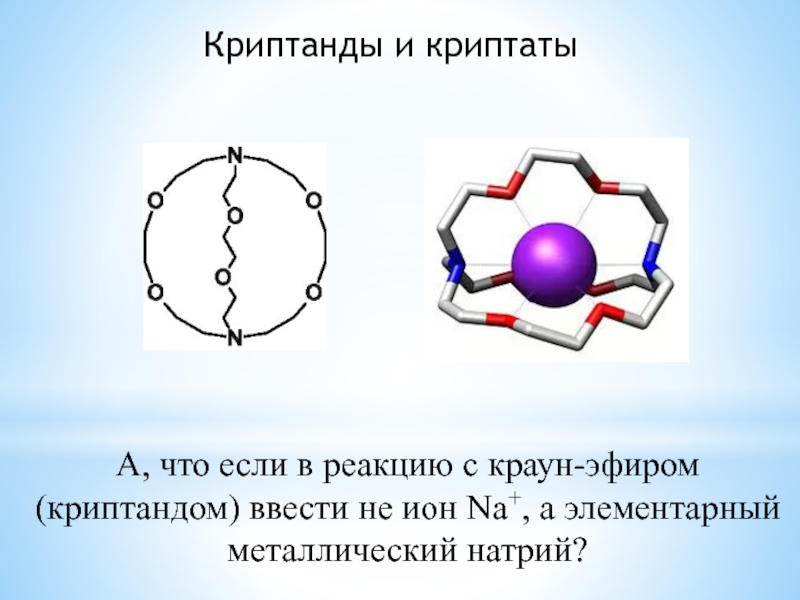
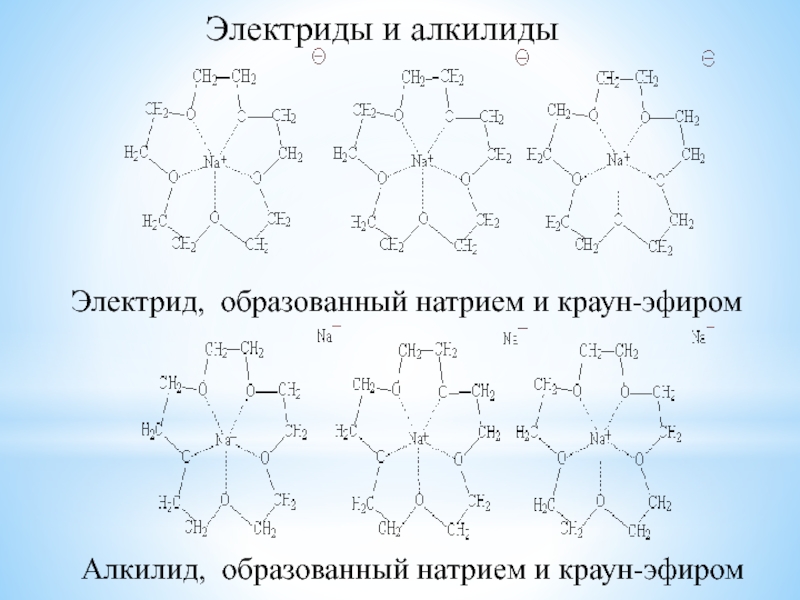
комплексообразование;
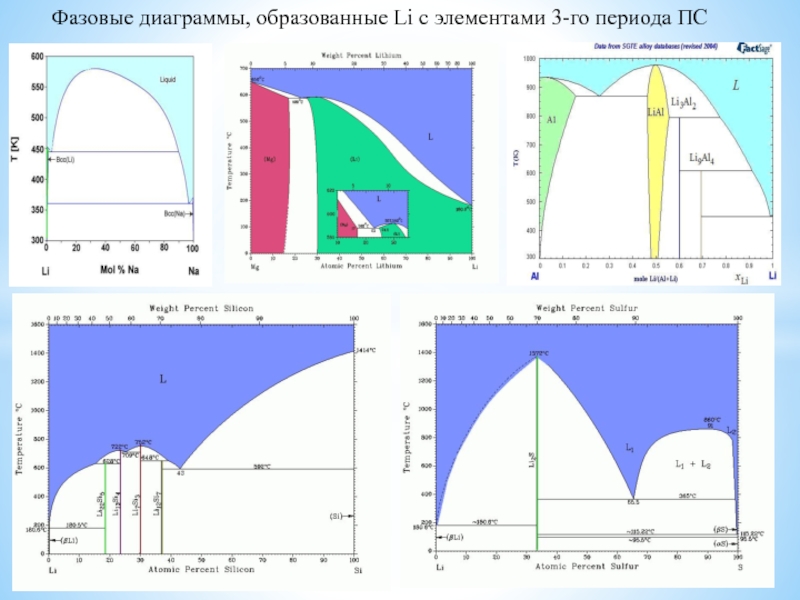
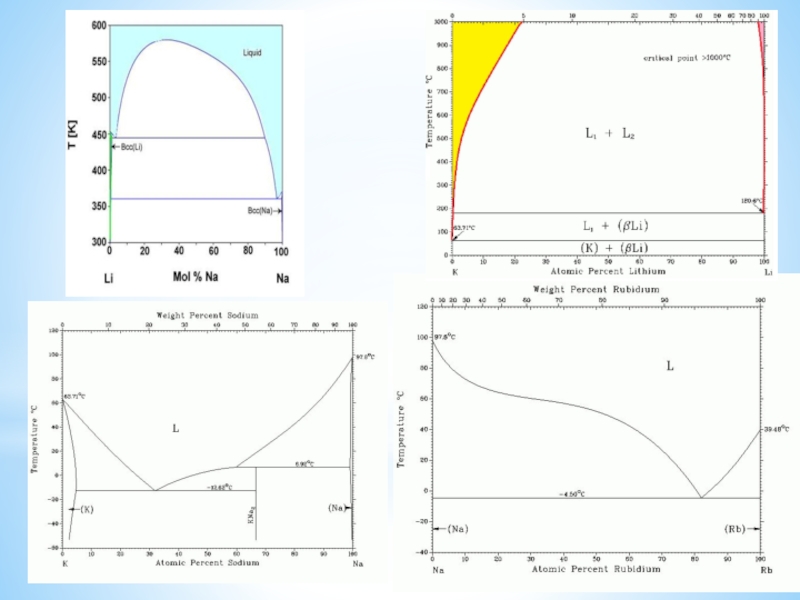
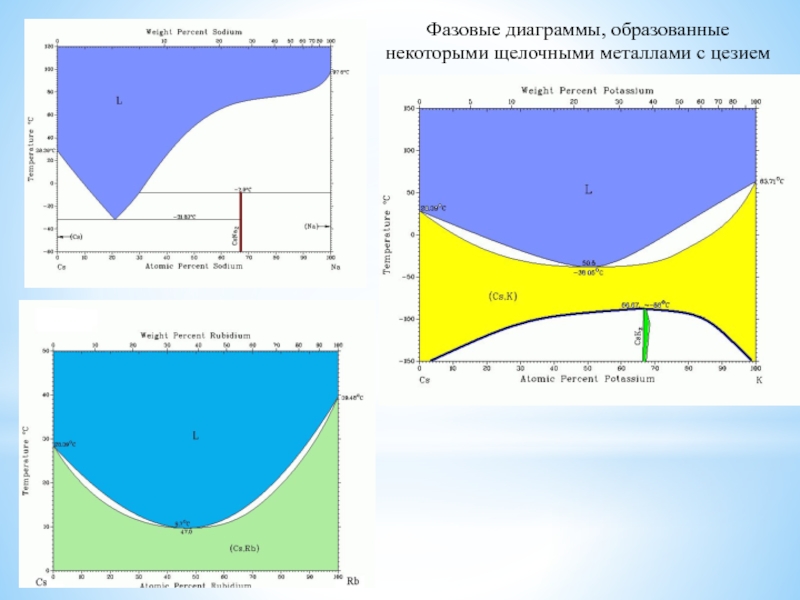
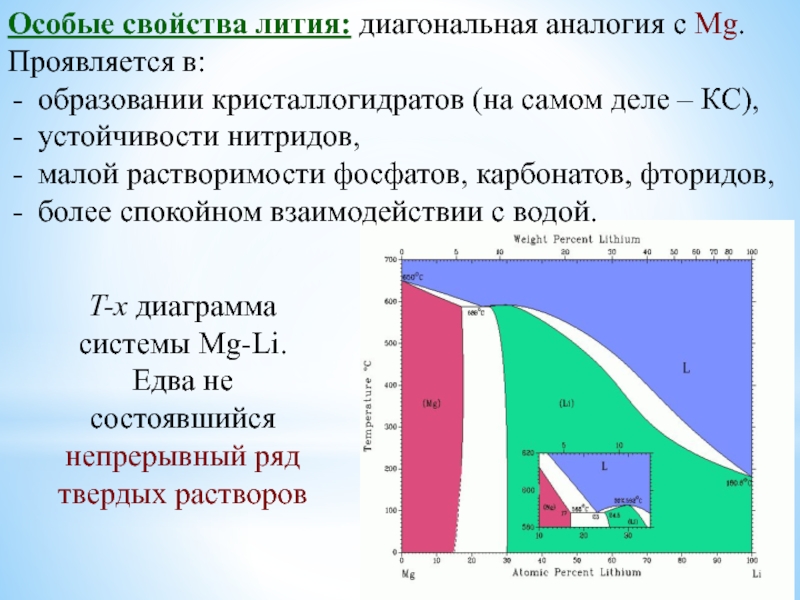
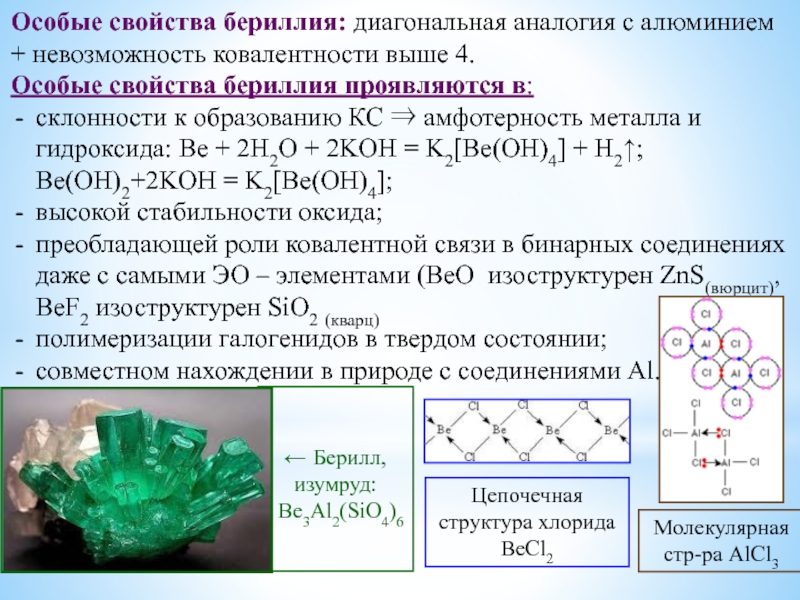
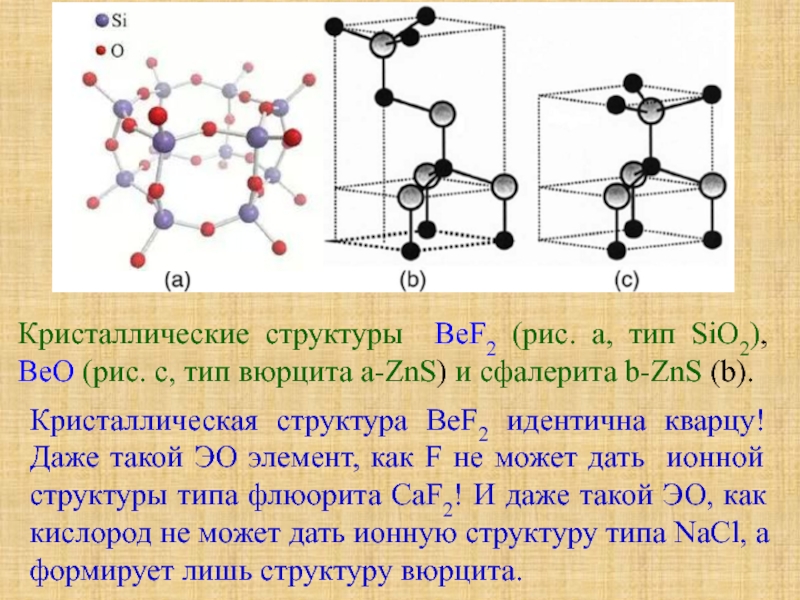
Особое положение легких металлов: диагональная периодичность: Li и Mg, Be и Al.



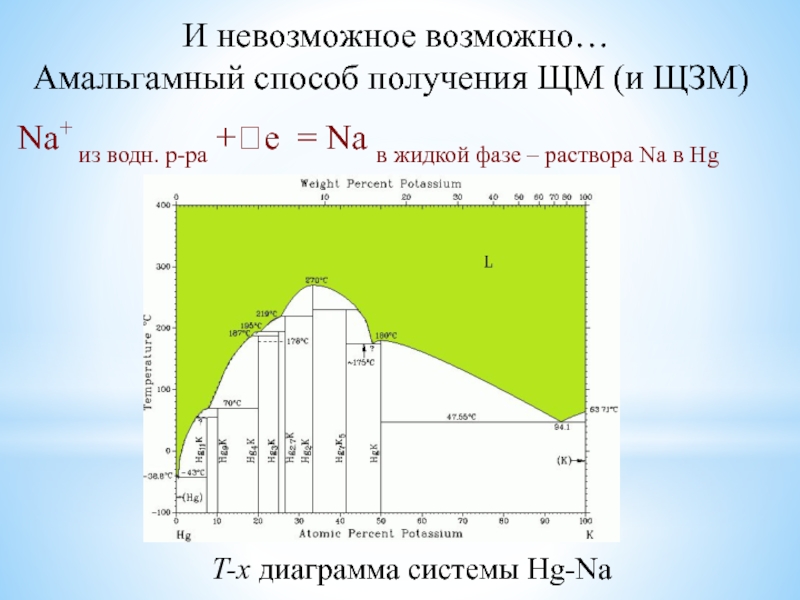



![Наиболее активные металлы: элементы I и II групп ПС Характерные свойства ЩЗМ (Ca, Sr, Ba, Ra):Растворимость в безводном жидком аммиаке Характерные свойства ЩЗМ (Ca, Sr, Ba, Ra):Растворимость в безводном жидком аммиаке Me + 14NH3 (ж) = [Me(NH3)6]2+(р-р)](/img/thumbs/e3ab4e1efbecfad7b43b905753743af2-800x.jpg)
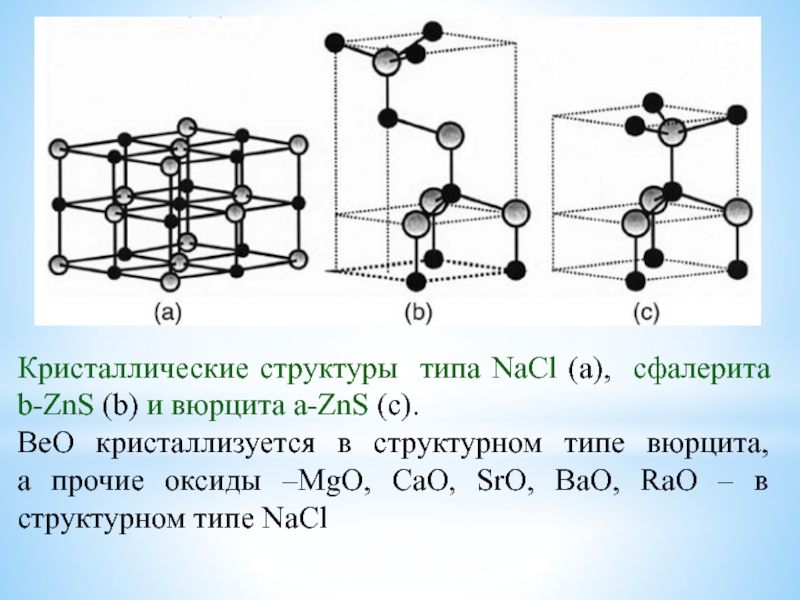
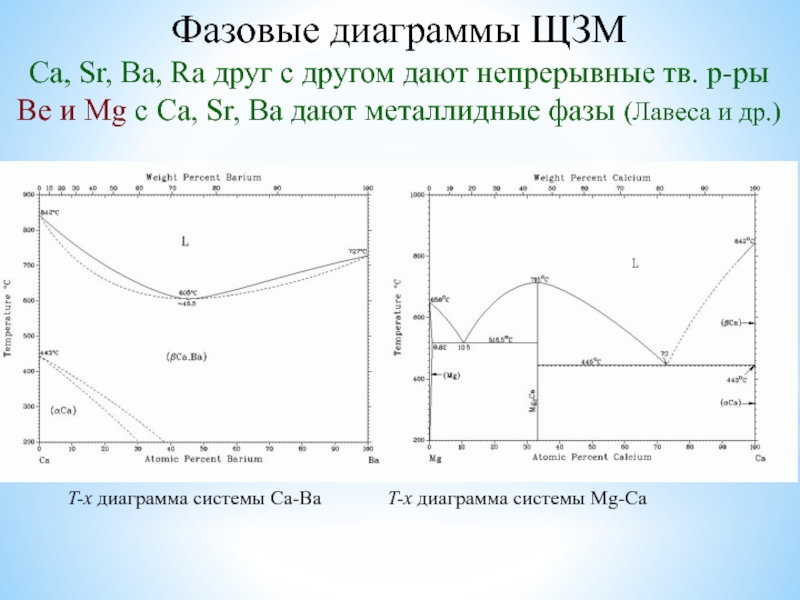
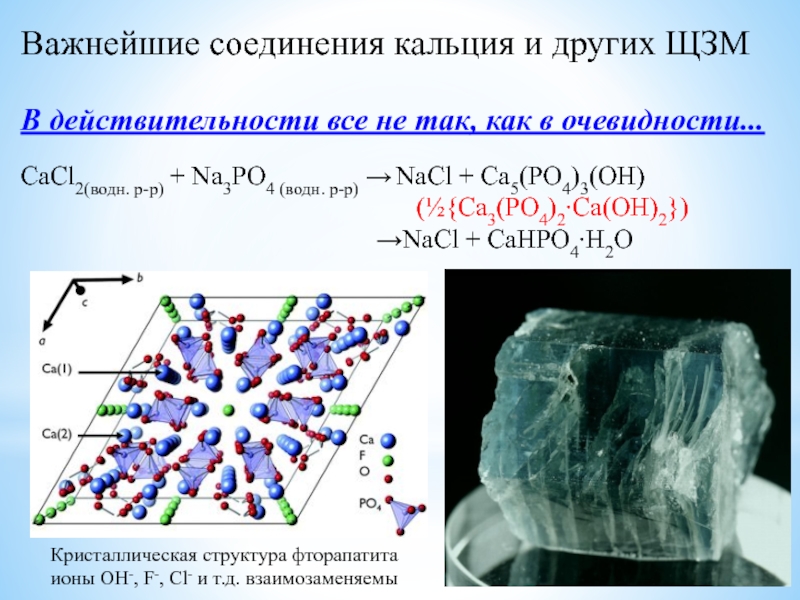

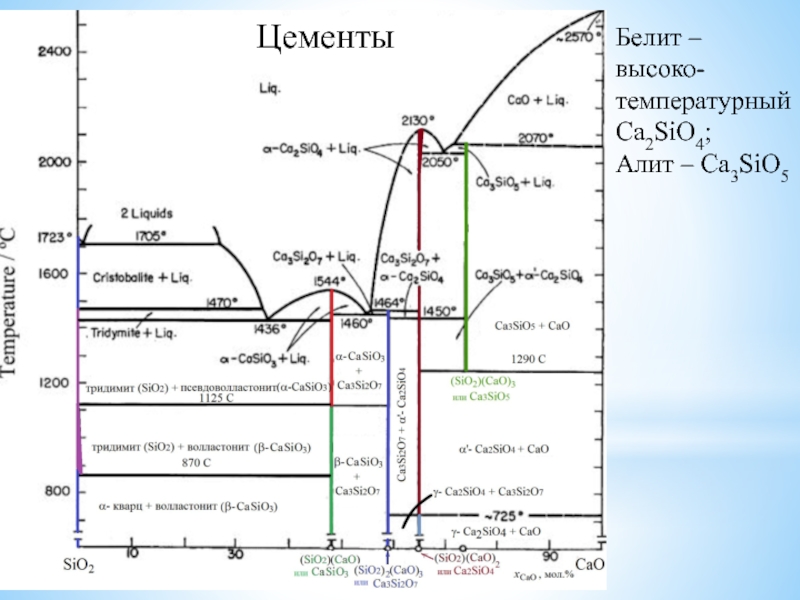
![Наиболее активные металлы: элементы I и II групп ПС [Be4O]Ac6; СH3COO Ac;BeAc2 + HOH Be(OH)Ac + HAc;2Be(OH)Ac [Be4O]Ac6; СH3COO Ac;BeAc2 + HOH Be(OH)Ac + HAc;2Be(OH)Ac Be2OAc2 + H2O(отщепление воды ](/img/thumbs/5d9b5ac5c7c55e67907cad4fac0b7736-800x.jpg)



















