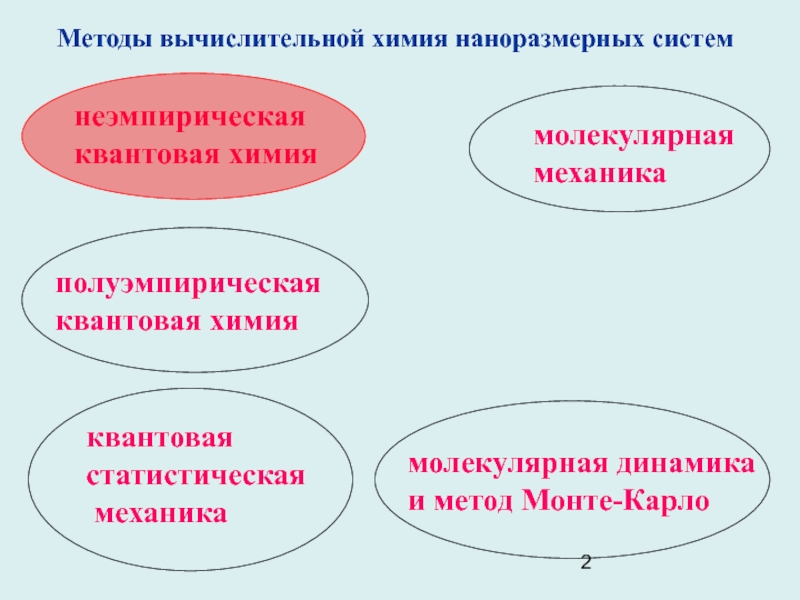
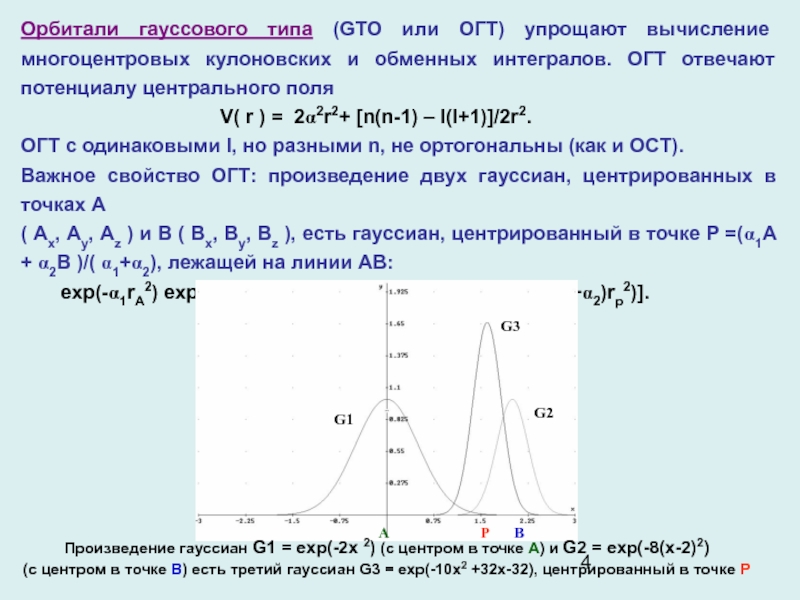
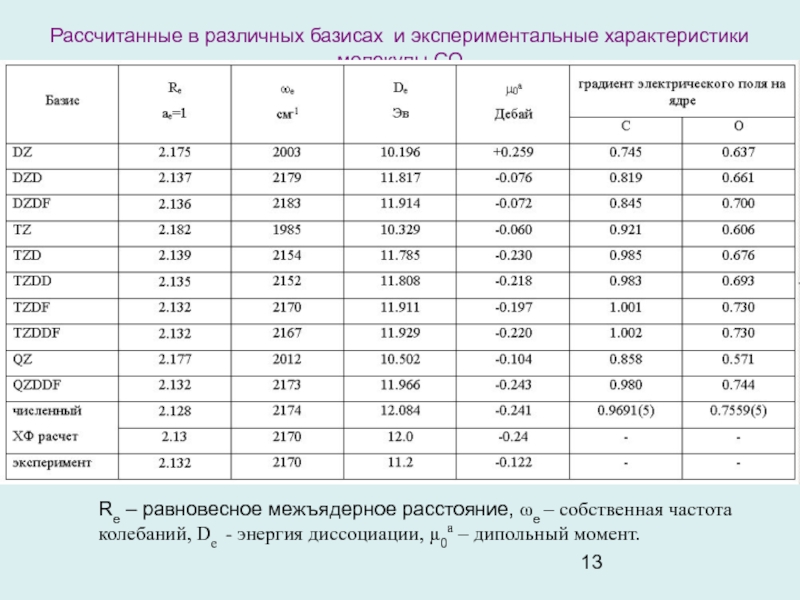
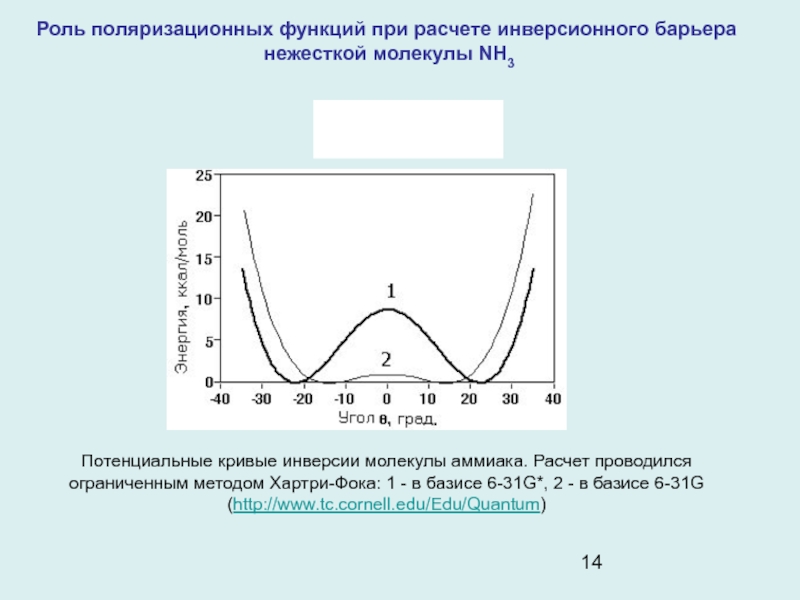
и обменных интегралов. ОГТ отвечают потенциалу центрального поля
V( r )
= 2α2r2+ [n(n-1) – l(l+1)]/2r2.
ОГТ с одинаковыми l, но разными n, не ортогональны (как и ОСТ).
Важное свойство ОГТ: произведение двух гауссиан, центрированных в точках А
( Аx, Аy, Аz ) и В ( Вx, Вy, Вz ), есть гауссиан, центрированный в точке P =(α1A + α2B )/( α1+α2), лежащей на линии АВ:
exp(-α1rA2) exp(-α2rB2)= exp[-(α1α2rAB2)/( α1+α2)] exp[(-α1+α2)rp2)].
Произведение гауссиан G1 = exp(-2x 2) (с центром в точке А) и G2 = exp(-8(x-2)2)
(с центром в точке В) есть третий гауссиан G3 = exp(-10x2 +32x-32), центрированный в точке Р
G3
G1
G2
А
B
P