Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Неорганическая химия, ч. I (общая химия) Основные разделы: учение о химических
Содержание
- 1. Неорганическая химия, ч. I (общая химия) Основные разделы: учение о химических
- 2. Основной вопрос: «Что такое химия?»Тезис: химия –
- 3. Основная задача химии – изучить возможности и
- 4. Изотопы — разновидности атомов одного химического элемента,
- 5. Стехиоме́трия – система законов, правил и терминов,
- 6. Закон эквивалентов. Но прежде – о понятии
- 7. Иллюстрация к «полезности» понятия эквивалентаm
- 8. Еще раз о термине «количество вещества»... Количество
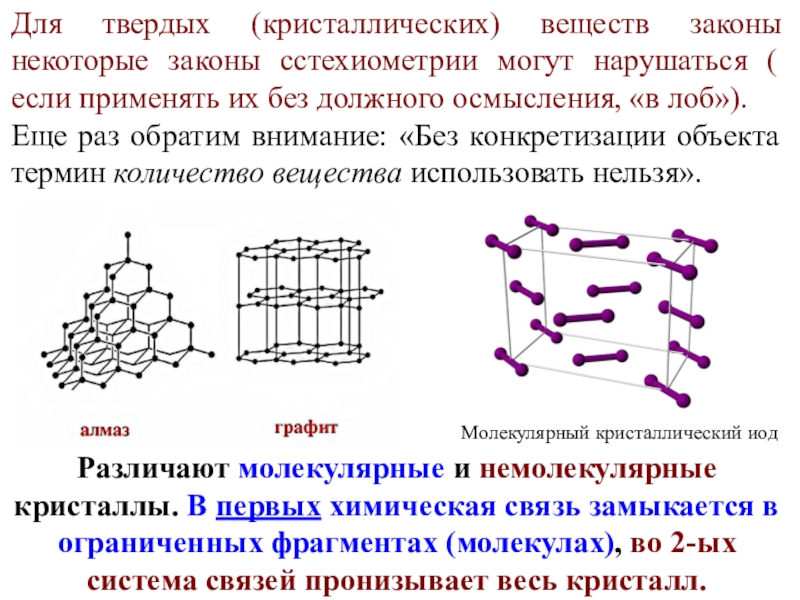
- 9. Для твердых (кристаллических) веществ законы некоторые законы
- 10. Различают молекулярные и немолекулярные кристаллы. В первых
- 11. Пример окрашенного сильвина (KCl). Содержит избыток калия
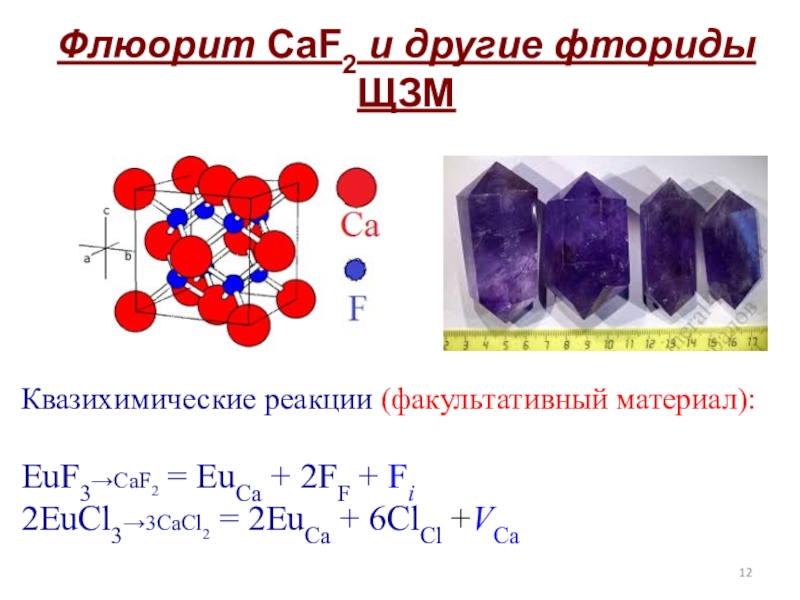
- 12. Флюорит CaF2 и другие фториды ЩЗМКвазихимические реакции
- 13. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Неорганическая химия, ч. I (общая химия)
Основные разделы:
учение о химических процессах
(термодинамика и кинетика);
химииСлайд 2Основной вопрос: «Что такое химия?»
Тезис: химия – наука о превращениях
вообще.
Это так? Давайте превратим во что-нибудь некое свинцовое тело. Например,
расплющим его. Это химия? Конечно, нет. (Наш тезис “не катит”.)
Подметим, что химические превращения всегда протекают по основному стехиометрическому закону.
“Количества вступивших в реакцию веществ относятся друг к другу, а также к образовавшимся количествам продуктов как стехиометрические коэффициенты реакции.”
Эти отношения сводятся к отношениям целых чисел. Например,
2Cl2 + 2H2O = 4HCl + O2
n(Cl2):n(H2O):n(Cl2):n(Cl2) = 2:2:4:1
Слайд 3Основная задача химии – изучить возможности и закономерности таких превращений
веществ, которые сопровождаются перераспределением электронной плотности в веществе, т.е –
образованием или изменением химических связей.Эти новые химические связи, которые являются однотипными для большого (макроскопического) числа частиц, приводят к определенной пространственной организации вещества. Такая пространственная организация называется строением вещества.
Вопросы:
III. Есть реакция: Bi209 + p → Po209 + n Это химическая реакция?
ядерная реакция поглощения протона ядром висмута с образованием изотопа полония и выделением нейтрона
В примерах I – III представлены «пограничные» с химией ситуации
II. H2O(лёд) → H2O(вода) Это химическая реакция?
I. P4 (белый) → Pn (красный) или С60 → Сграфит Это химические реакции?
Слайд 4Изотопы — разновидности атомов одного химического элемента, имеющие одинаковые структуры
электронных оболочек, но отличающиеся массой ядер за счет разного количества
нейтронов в атомах.Атом – это мельчайшая электронейтральная частица вещества, неделимая в любых химических превращениях. Атомы состоят из некоторого количества (Z) электронов c зарядом каждого электронаe и ядра зарядом (Ze) ядра. Ядро построено из протонов (хотя бы одного) и некоторого количества нейтронов.
Молекула— электрически нейтральная частица, образованная из двух или более связанных преимущественно ковалентными связями атомов.
Продолжим о понятиях...
Химический элемент – это определенный вид атомов, характеризующийся определенным (и одинаковым для всех атомов данного вида) зарядом атомных ядер.
Слайд 5Стехиоме́трия – система законов, правил и терминов, обосновывающих расчёты состава
веществ и количественных отношений масс (и объёмов для газов) веществ
в химических реакциях.Законы стехиометрии включают в себя основной стехиометрический закон (см. стр.2), закон Авогадро, закон постоянства состава вещества, закон простых объемных отношений, закон кратных массовых отношений, закон эквивалентов и др.
--------------------------------------------------------------------------------------------------
Чуть в сторону. Пример реакции с, возможно, наибольшими коэффициентами:
10[Cr(N2H4CO)6]4[Cr(CN)6]3 + 1176KMnO4 + 2798HNO3
35K2Cr2O7 + 420CO2 + 1106KNO3 + 1176Mn(NO3)2 + 1879H2O
------------------------------------------------------------------------------------------
В основу составления химических уравнений положен метод материального баланса, основанный на законах сохранения массы и числа атомов.
Слайд 6Закон эквивалентов. Но прежде – о понятии эквивалента.
Эквивалент — реальная
или мнимая частица, которая может присоединять, высвобождать или другим способом
быть эквивалентна катиону водорода (H+) в кислотно-основных реакциях или электрону (e ) в окислительно-восстановительных реакциях или атому водорода (H˙)в тех же реакциях.Закон эквивалентов: Количество (число моль) эквивалентов для всех веществ, участвующих в реакции, одинаково.
Иллюстрация реакции синтеза CH4 с исп. символов типа Дальтона.
4H˙ + С = CH4; H˙ + ¼C = ¼CH4;
H
4H˙ + = H--H; ◄ + H˙ = H-◄
H
Слайд 7Иллюстрация к «полезности» понятия эквивалента
m
изб.
VQ + xHCl = QClx + x/2H2; M/x = mVA/(2V)
M VA
2KMnO4 + 5H2O2 + 3 H2SO4 = K2SO4 + MnSO4 + 5O2 + 8H2O
MnO4- + 5e + 8H+ = Mn2+ + 8H2O (I); 2H2O2 = 2H+ + O2 + 2e (II)
2MnO4- + 5H2O2 + 6H+ = Mn2+ + 8H2O + O2 (III): (III) = (I)2 + (II)5
Э(MnO4-) = M(MnO4-)/5 (см. комментарий по лекции!)
Закон кратных массовых отношений: если два элемента образуют друг с другом более 1-го соединения, то массы одного из элементов, приходящиеся на одну и ту же массу другого элемента, относятся как целые числа.
Cl2O ClO2 Cl2O6 Cl2O7
m(Cl)/m(O) 4,438 1,109 0,740 0,634
( /0,634) 7 1,75 1,167 1
(*4) 28 7 4,448 4
(*3) 84 21 14 12
Слайд 8Еще раз о термине «количество вещества»...
Количество вещества — физическая
величина, характеризующая количество однотипных структурных единиц, содержащихся в веществе. Под
структурными единицами понимаются любые частицы, из которых состоит вещество (атомы, молекулы, ионы, электроны или любые другие частицы). Единица измерения количества вещества – моль. Без конкретизации объекта термин «количество вещества» использовать нельзя.Всегда ли применим основной стехиометрический закон?
Ответ – в общем – отрицательный.
Этот закон напрямую не может быть применен для сложных твердых (кристаллических) веществ.
Слайд 9Для твердых (кристаллических) веществ законы некоторые законы сстехиометрии могут нарушаться
( если применять их без должного осмысления, «в лоб»).
Еще раз
обратим внимание: «Без конкретизации объекта термин количество вещества использовать нельзя».Молекулярный кристаллический иод
Различают молекулярные и немолекулярные кристаллы. В первых химическая связь замыкается в ограниченных фрагментах (молекулах), во 2-ых система связей пронизывает весь кристалл.
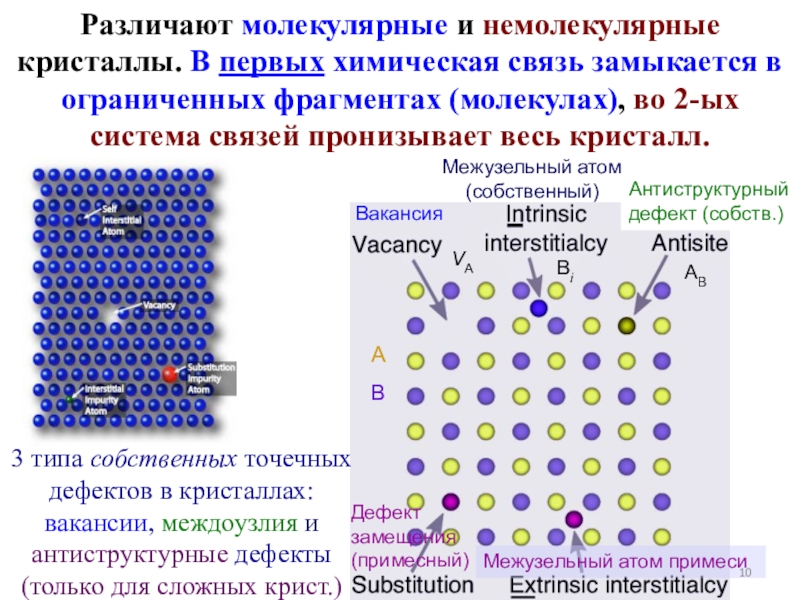
Слайд 10Различают молекулярные и немолекулярные кристаллы. В первых химическая связь замыкается
в ограниченных фрагментах (молекулах), во 2-ых система связей пронизывает весь
кристалл.Вакансия
Межузельный атом
(собственный)
Антиструктурный
дефект (собств.)
A
B
VA
Bi
AB
3 типа собственных точечных дефектов в кристаллах: вакансии, междоузлия и антиструктурные дефекты (только для сложных крист.)
Дефект замещения
(примесный)
Межузельный атом примеси
Слайд 11Пример окрашенного сильвина (KCl). Содержит избыток калия за счет образования
вакансий в подрешетке хлора
Можно получить, выдерживая горячий KCl в
парах чистого калия:K(пар) = VCl + KK(в KCl) (содержание K варьируемо!)
Имеются и кристаллы с недостижимым идеальным (стехиометрическим) составом. Например, моносульфид железа всегда содержит избыток вакансий в подрешетке железа по сравнению с подрешеткой серы. Формула Fe1-xS.