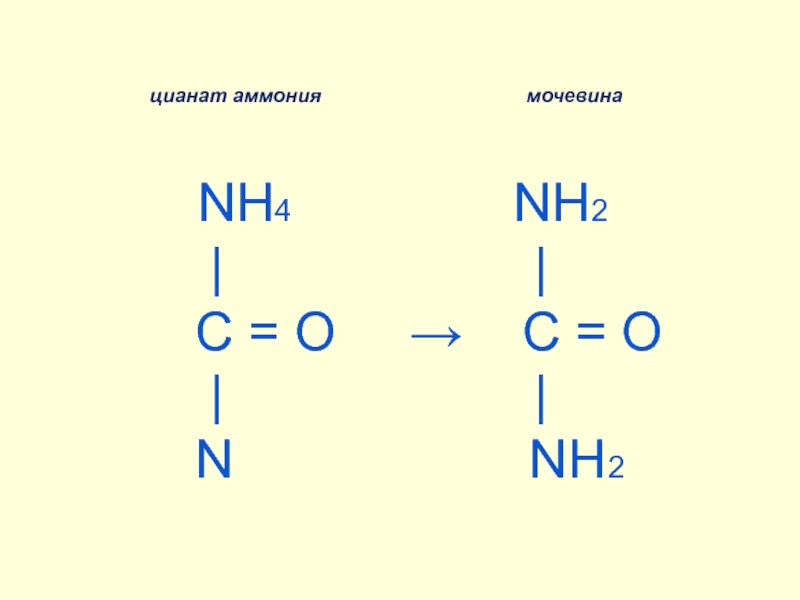
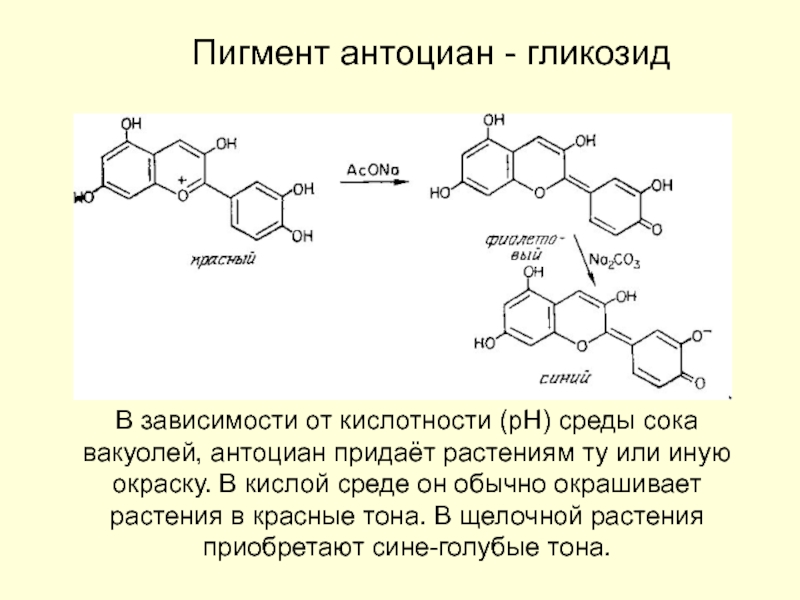
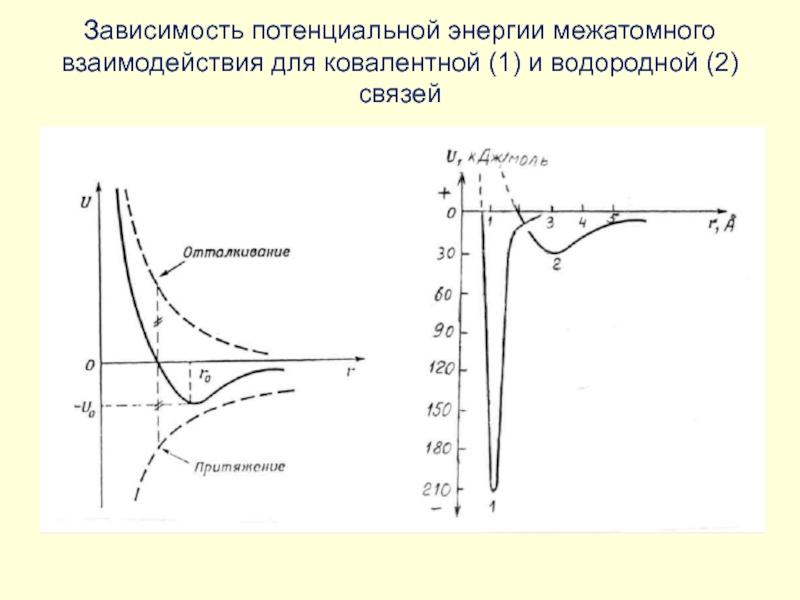
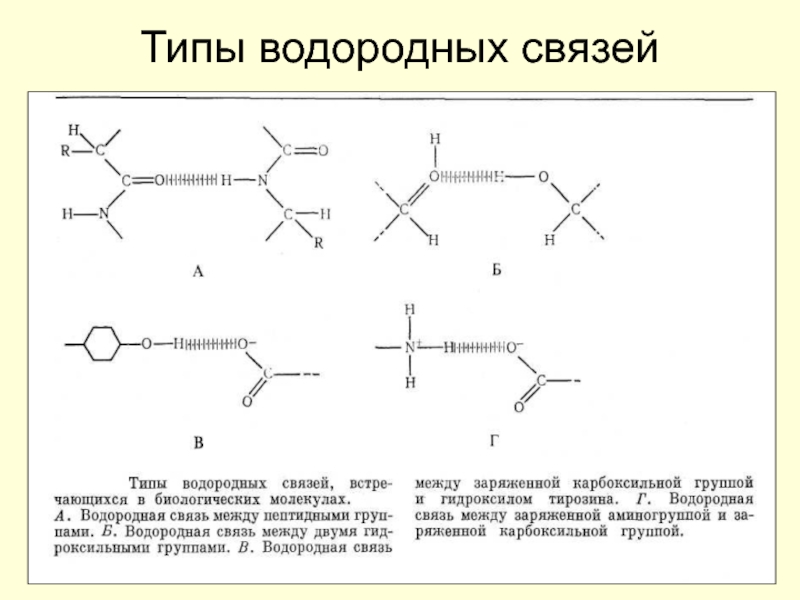
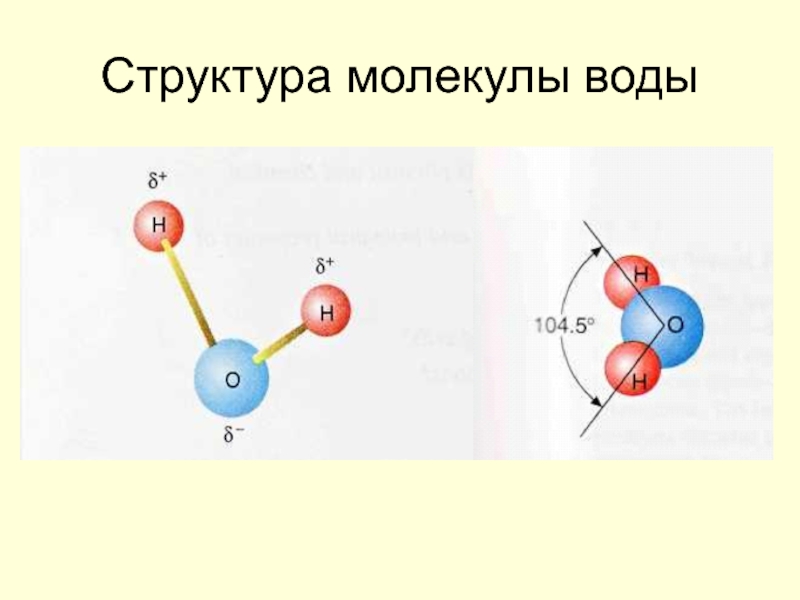
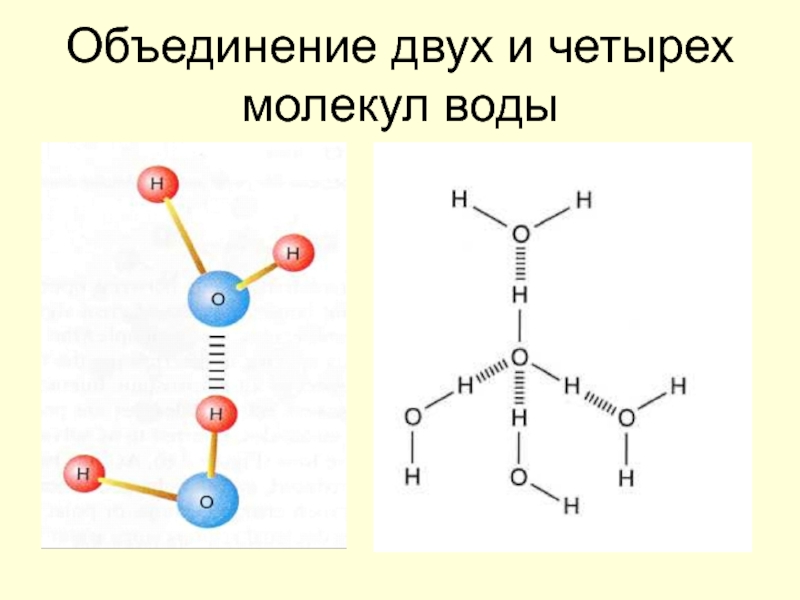
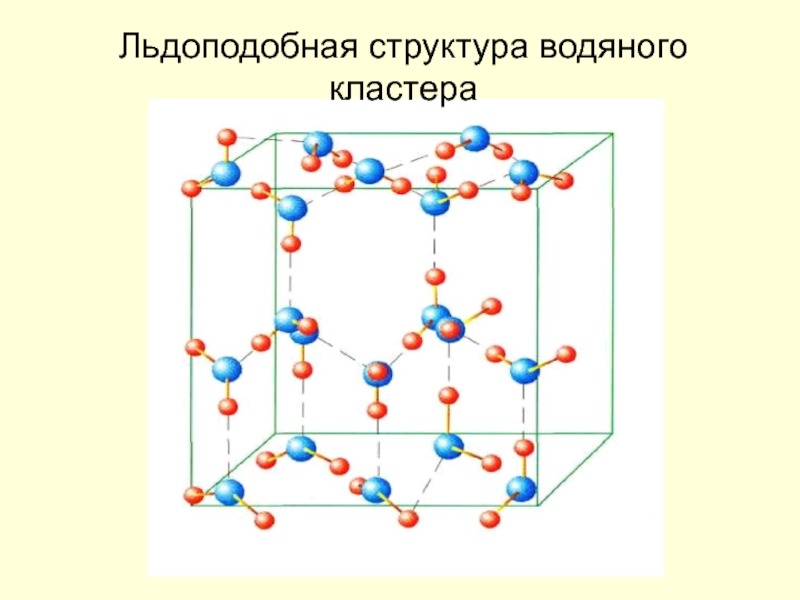
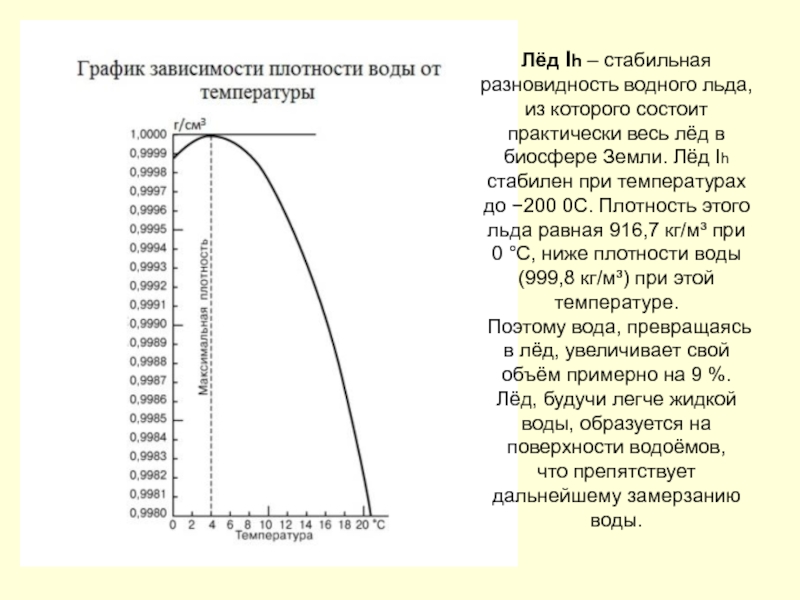
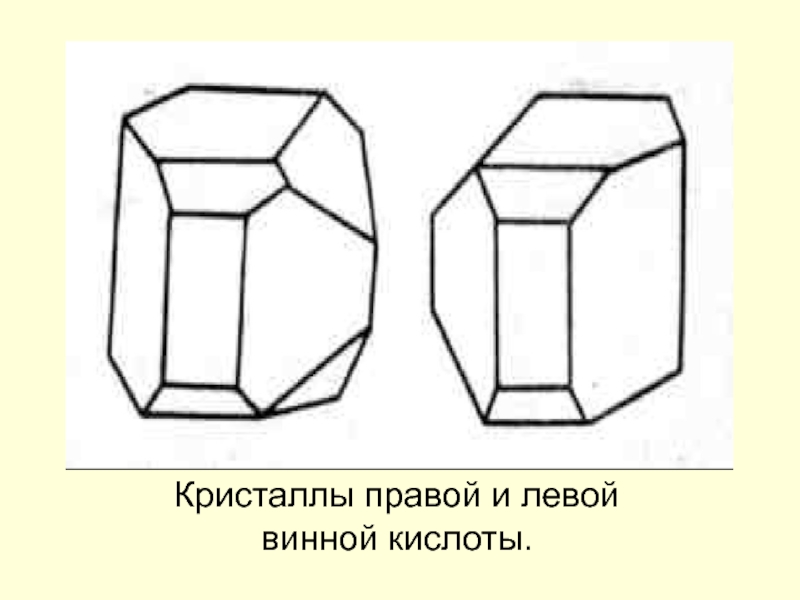
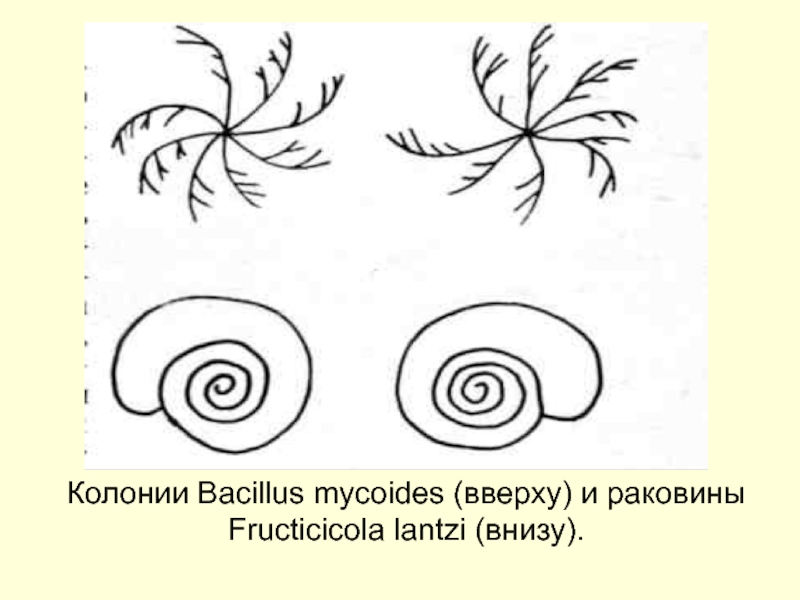
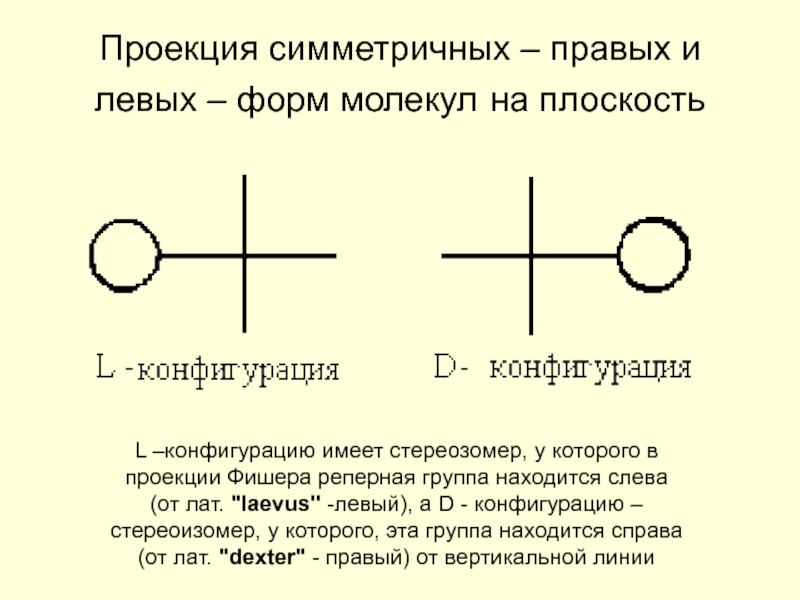
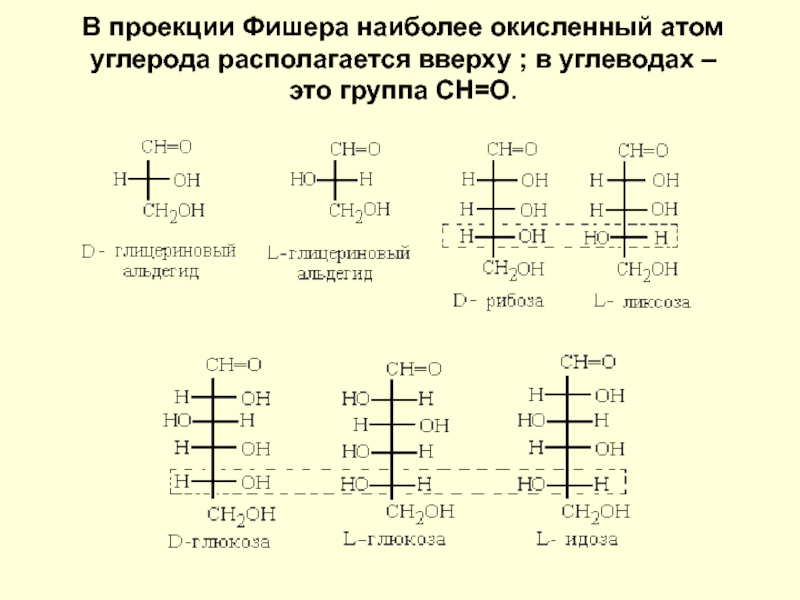
Барри Шарплесс
Риоджи Нойори.
У. Ноулз в 1968 году создал хиральные катализаторы, позволяющие в реакции гидрогенирования (присоединения водорода к атомам углерода) получать молекулы в основном той же хиральности, что и катализатор. На основе этих катализаторов удалось разработать промышленный процесс производства L-DOPA –лекарства от болезни Паркинсона.
Р. Нойори в 1980 году смог усовершенствовать катализаторы Ноулза, так что реакции с их участием стали давать почти исключительно один энантиомер. Это позволило наладить производство некоторых антибиотиков и ароматизаторов, молекулы которых действенны только в одной хиральной форме.
В том же году Б. Шарплесс получил катализаторы для другого важного класса химических реакций - окисления, также позволяющие синтезировать продукты заданной хиральности. На основе процессов направленного окисления сейчас производят бета-блокаторы - медикаменты, защищающие сердце от излишнего возбуждения. Хиральные катализаторы применяются также для синтеза вкусовых добавок и инсектицидов
Нобелевская премия по химии 2001 года