Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Нуклеїнові кислоти
Содержание
- 1. Нуклеїнові кислоти
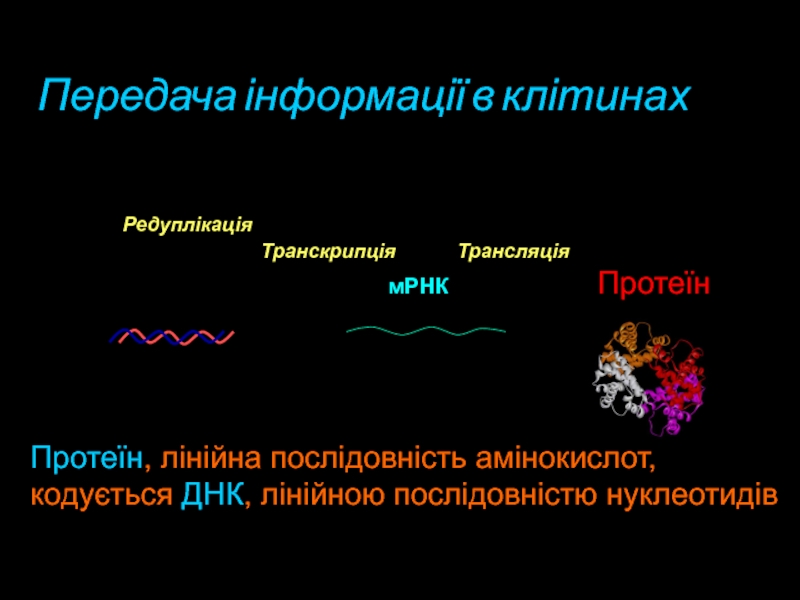
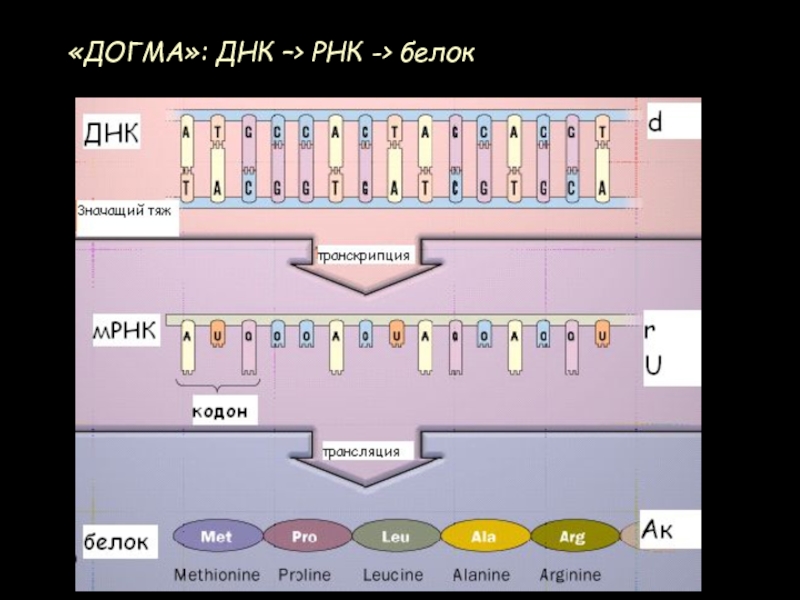
- 2. мРНКПротеїнДНКТранскрипціяТрансляція“Центральна догма” молекулярної біологіїРедуплікаціяПередача інформації в клітинах Протеїн, лінійна послідовність амінокислот,кодується ДНК, лінійною послідовністю нуклеотидів
- 3. ДНК
- 4. Слайд 4
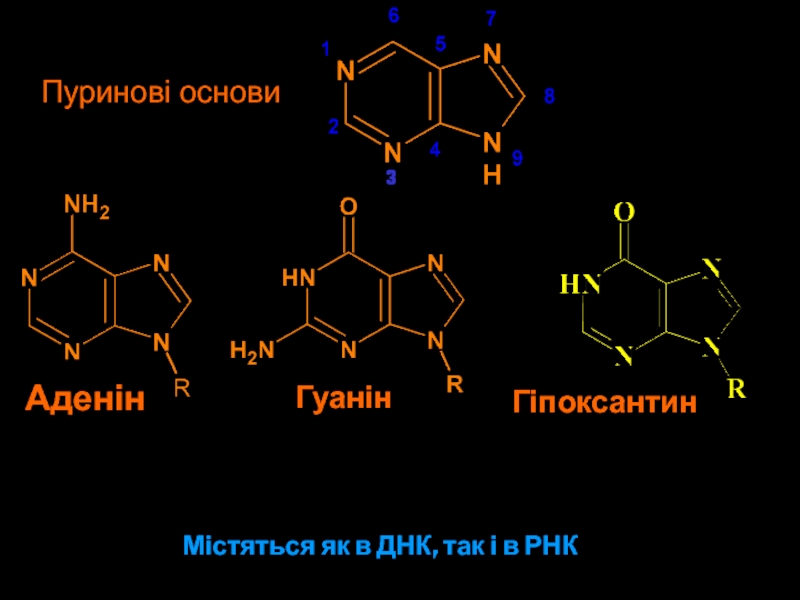
- 5. Пуринові основиМістяться як в ДНК, так і в РНКАденінГуанін3Гіпоксантин
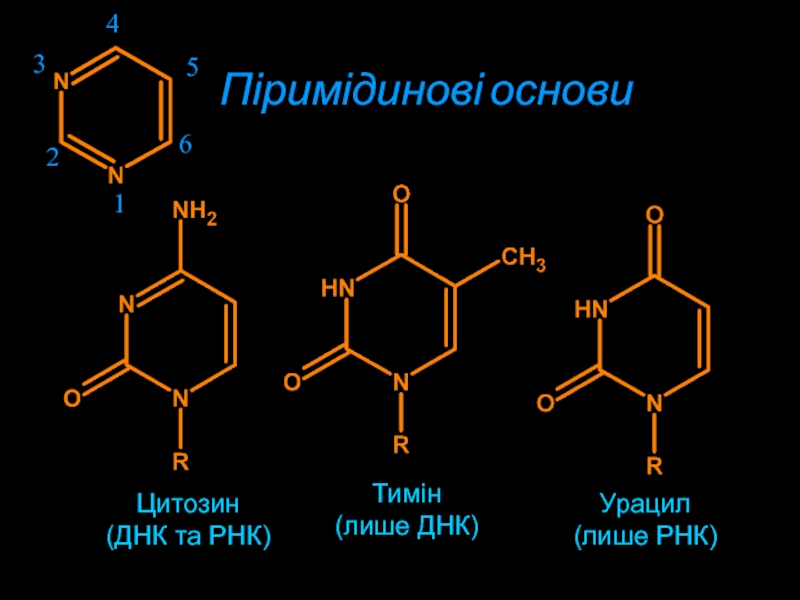
- 6. Цитозин(ДНК та РНК)Тимін(лише ДНК)Урацил(лише РНК)Піримідинові основи123456
- 7. Мінорні основи1-метиладенін1-метилгуаніндигідроурацил3-метилурацил5-гідроксиметилцитозинДо 20% у т-РНК!
- 8. Нуклеотидні пентозиВідмінність: 2'-OH замість 2'-H Ця відмінність
- 9. Нуклеозиди = основа+ пентозаОснови приєднуються глікозидним
- 10. Преференційні конформації нуклеозидівПуринові нуклеозиди син- і анти Піримідинові нуклеозидианти є преференційним
- 11. Нуклеотид = нуклеозид + фосфатНуклеотиди – багатоосновні кислоти напр., Aденозин 5’-мoнoфoсфат (AMФ)(аденілова кислота)
- 12. Функції нуклеотидівПопередники полінуклеотидів ДНК і РНКПереносники енергії
- 13. Циклічний нуклеотид: Aденозин 3’,5’ монофосфатФосфодіестер6-членний циклATФ + цAMФ + PPн(циклічний AMФ або цAMФ)
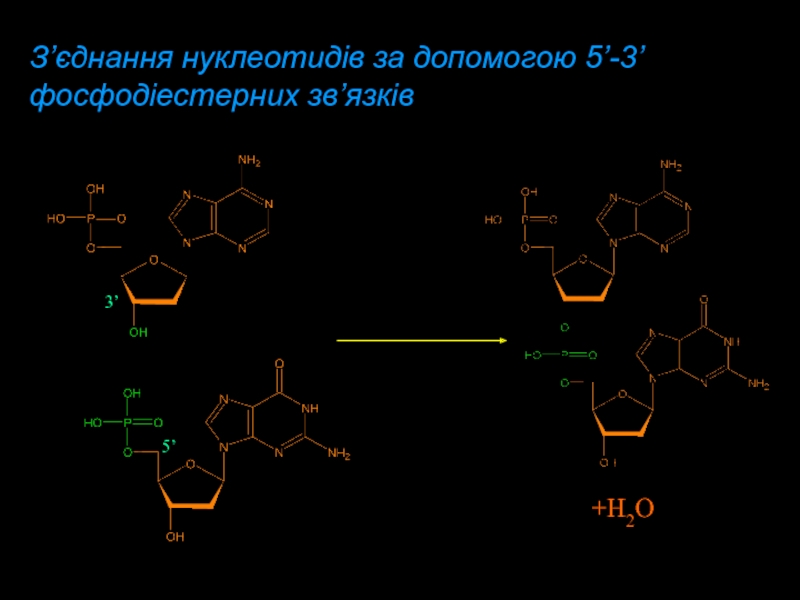
- 14. З’єднання нуклеотидів за допомогою 5’-3’ фосфодіестерних зв’язків
- 15. 5’-GACA-3’ 5’3’Ланцюг утворений фосфодіестерними зв’язками між 5’
- 16. Класи нуклеїнових кислотДНК – один тип, одна
- 17. Подвійна спіраль ДНК: коротка історіяСтабілізована водневими зв’язками“Пари
- 18. Д. УотсонФ. КрикКембридж, Англия, 1952М. УилкинсР. ФранклинДНК как апериодический кристалл
- 19. Подвійна спіраль ДНКДві низки, спрямовані антипаралельно“Пари основ“,
- 20. Канонічні пари комплементарних основЦитозинТимінабо урацилГуанінАденінДовжина Н-зв’язку ~ 3 Å
- 21. Вторинна структура нуклеїнових кислот: подвійна спіраль ДНКДіаметр
- 22. Схема одного з ланцюгів подвійної спіралі ДНК.Основи
- 23. Вторинна структура нуклеїнових кислот: подвійна спіраль ДНКМодель двохспіральної молекули ДНК.Два ланцюги орієнтовані в протилежних напрямках!
- 24. Суперспирализация
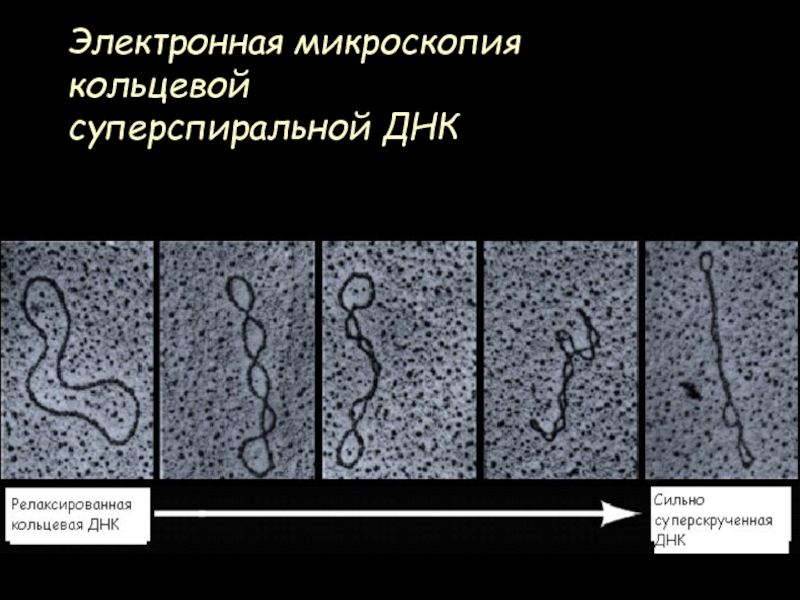
- 25. Электронная микроскопия кольцевой суперспиральной ДНК
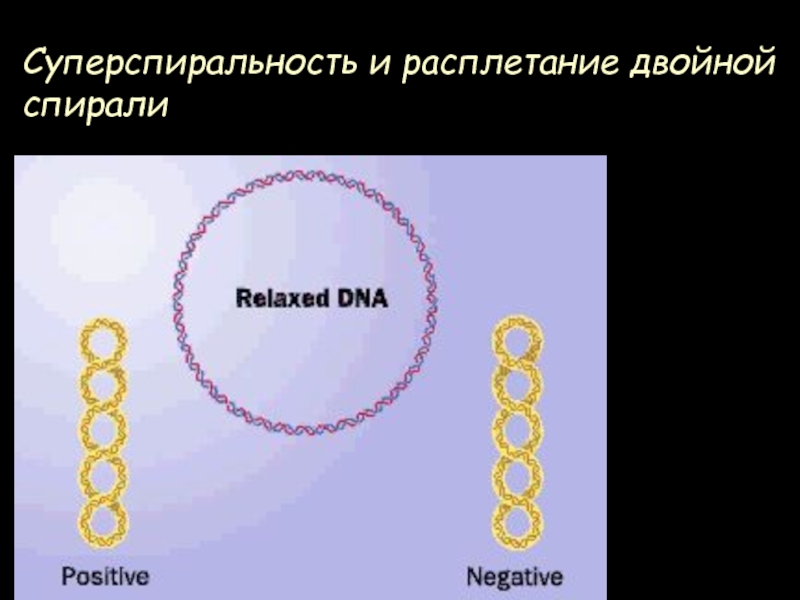
- 26. Суперспиральность и расплетание двойной спиралиLk = Tw + Wr
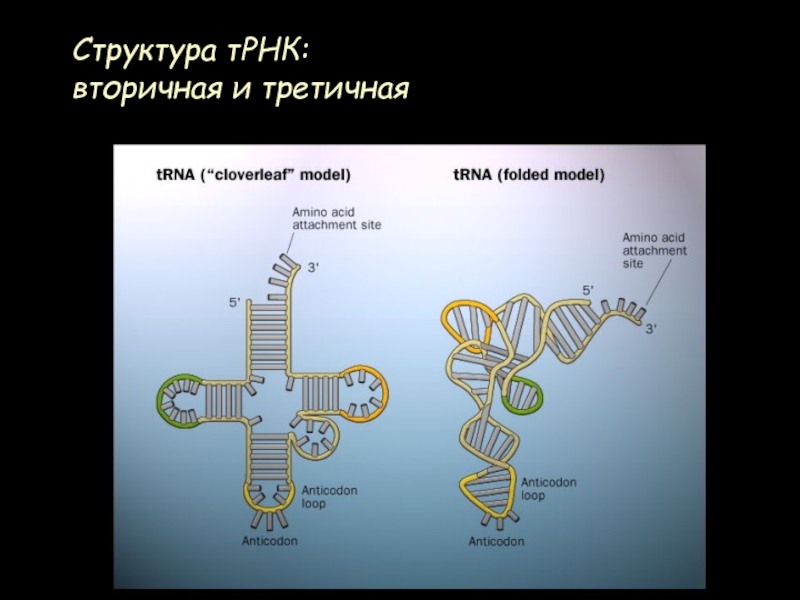
- 27. Структура тРНК: вторичная и третичная
- 28. Мимикрия третичной структурытРНК белок тРНК белок
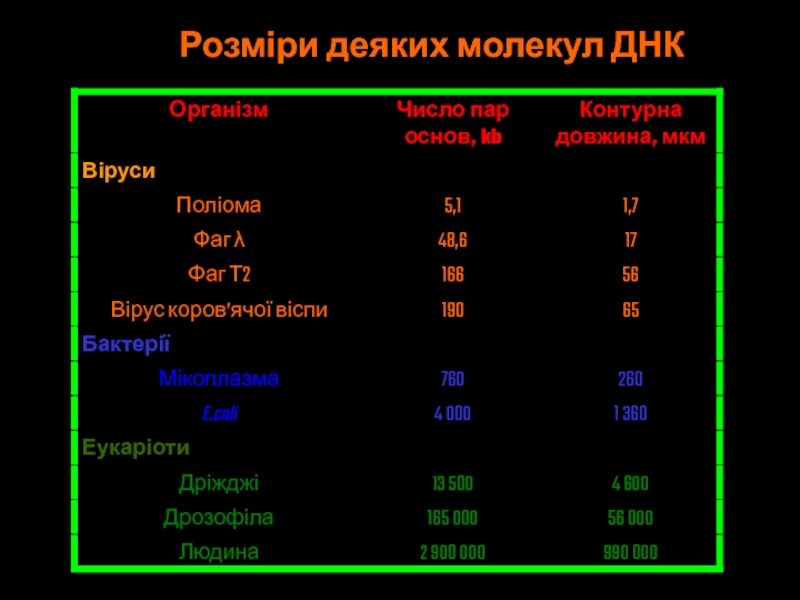
- 29. Розміри деяких молекул ДНК
- 30. Длина ДНК человекаhttp://nature.web.ru/В ядре каждой клетки человека
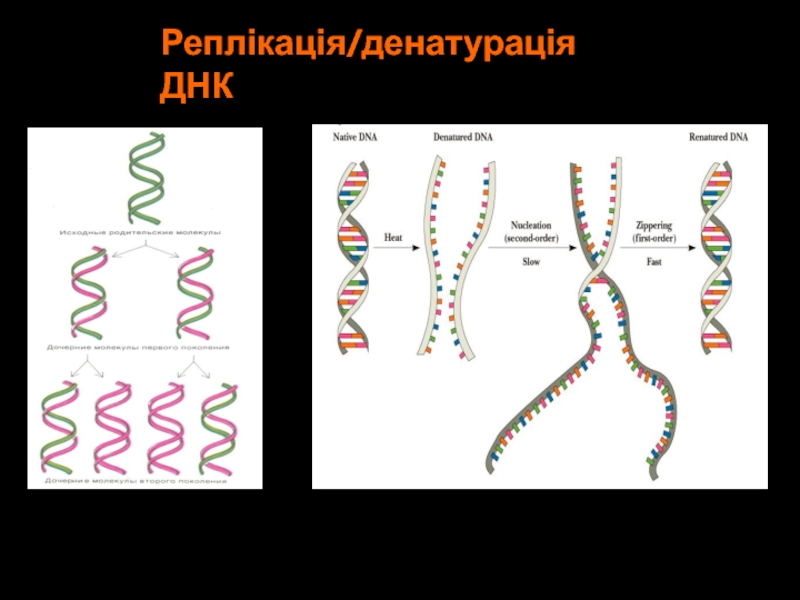
- 31. Реплікація/денатурація ДНК
- 32. При денатурації подвійної спіраліпоглинання розчину ДНК при
- 33. Електронна фотографія молекули ДНК,що частково розплетена під дією лугу.Ці ділянки багаті на пари АТ
- 34. Відмінності між ДНК і РНКЧому ДНК містить
- 35. H2ONH3ЦитозинУрацил
- 36. ДНК & РНК відмінності IIЧому ДНК 2'-дезокси,
- 37. ДНК & РНК відмінності IIIЧому РНК можуть
- 38. Комплекси металів з основами, нуклеозидами та нуклеотидамиГОЛОВНІ
- 39. Комплекси металів з основами, нуклеозидами та нуклеотидами фосфатні групи
- 40. СТРУКТУРА КОМПЛЕКСІВ МЕТАЛІВ З ПУРИНОВИМИТА ПІРИМІДИНОВИМИ ОСНОВАМИЧому не так?РСтАРСтАСтр-ра к-су гуаніну з CuCl2Стр-ра к-су Cu(II)-аденін
- 41. Зв’язування іонів металів з основами, що неприєднані
- 42. Комплекси металів з основами, нуклеозидами та
- 43. Комплекси металів з основами, нуклеозидами та
- 44. pH ≠ 7pH=7Можлива місткова функція у N-1
- 45. ВСТАНОВЛЕННЯ СПОСОБІВ КООРДИНАЦІЇНУКЛЕОЗИДІВ ТА НУКЛЕОТИДІВСпостереження за зсувами
- 46. ВСТАНОВЛЕННЯ СПОСОБІВ КООРДИНАЦІЇНУКЛЕОЗИДІВ ТА НУКЛЕОТИДІВЗсуви сигналів ПМР
- 47. ВСТАНОВЛЕННЯ СПОСОБІВ КООРДИНАЦІЇНУКЛЕОЗИДІВ ТА НУКЛЕОТИДІВCu(II) уширює сигнали
- 48. ВСТАНОВЛЕННЯ СПОСОБІВ КООРДИНАЦІЇНУКЛЕОЗИДІВ ТА НУКЛЕОТИДІВЧи здійснюється координаціячерез
- 49. Способи координації нуклеотидівМожливий також варіант місткового зв’язування черезN-7 однієї молекули та фосфатну групу іншої молекули
- 50. Встановлення способів координації нуклеозидів та нуклеотидів з
- 51. Способи координації основ у нуклеозидах та нуклеотидах
- 52. 2-дезокси-D-рибоза (в ДНК)D-рибоза (в РНК)1’1’2’2’3’3’4’4’5’5’Встановлення способів координації нуклеозидів та нуклеотидівРИБОЗА і ДЕЗОКСИРИБОЗА
- 53. MMMЗвязування металів з полінуклеотидамиMОСНОВИ можуть координуватисятак же
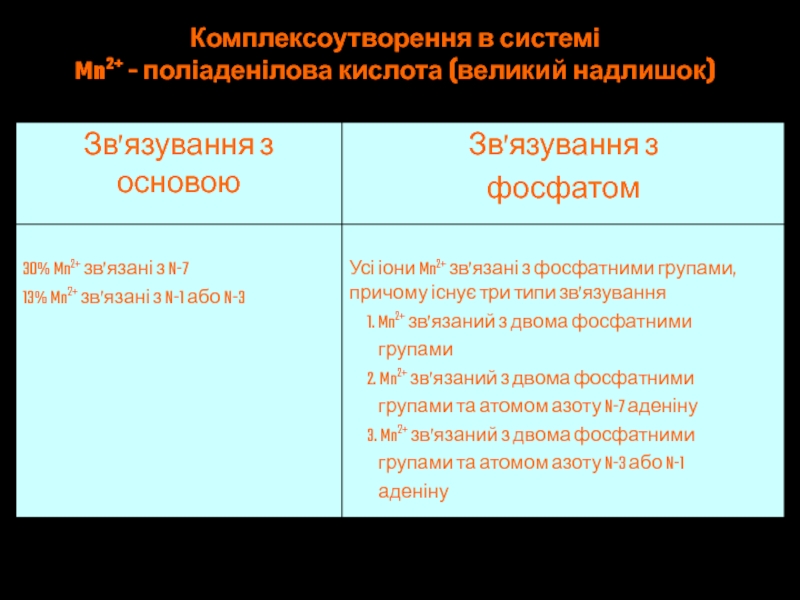
- 54. Комплексоутворення в системі Mn2+ - поліаденілова кислота (великий надлишок)
- 55. Комплексоутворення в системах M2+ - полінуклеотидВизначення місць
- 56. ВПЛИВ ІОНІВ МЕТАЛІВ НА СТРУКТУРУ ДНК1. Стабілізація
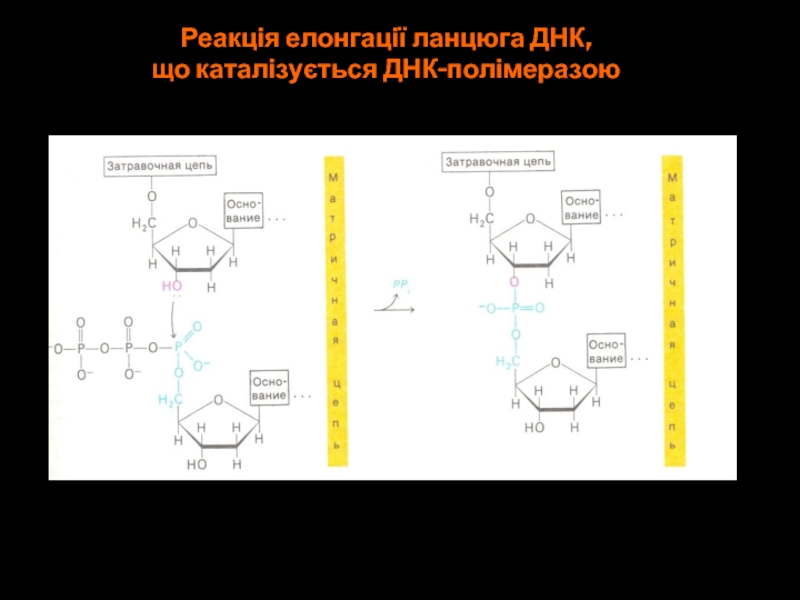
- 57. Реакція елонгації ланцюга ДНК, що каталізується ДНК-полімеразою
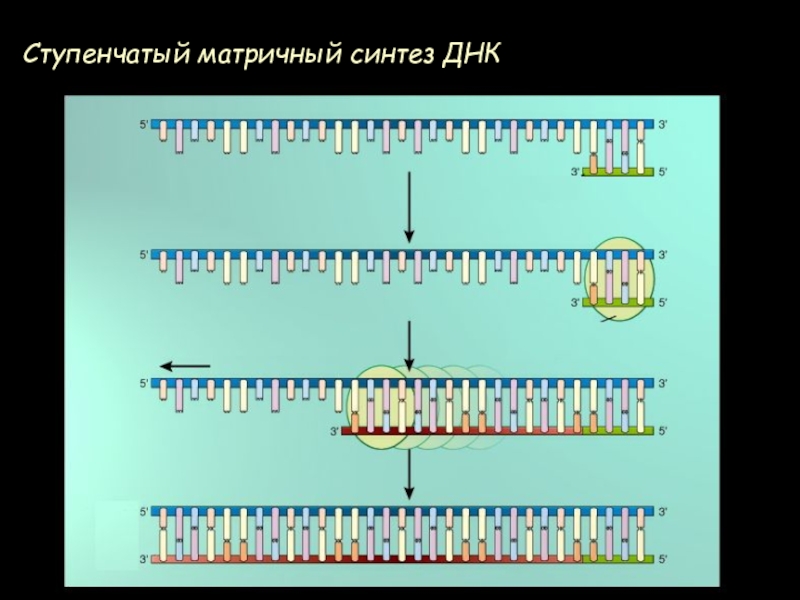
- 58. Ступенчатый матричный синтез ДНК
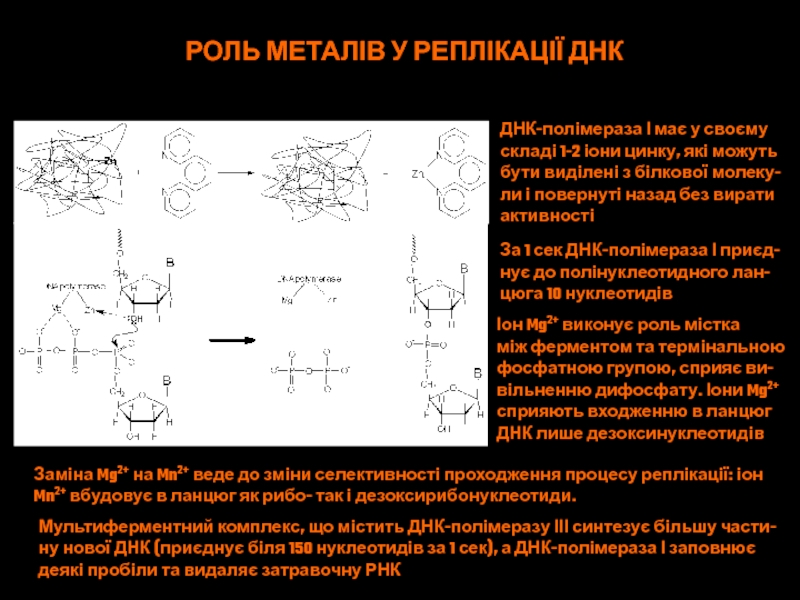
- 59. РОЛЬ МЕТАЛІВ У РЕПЛІКАЦІЇ ДНКДНК-полімераза І має
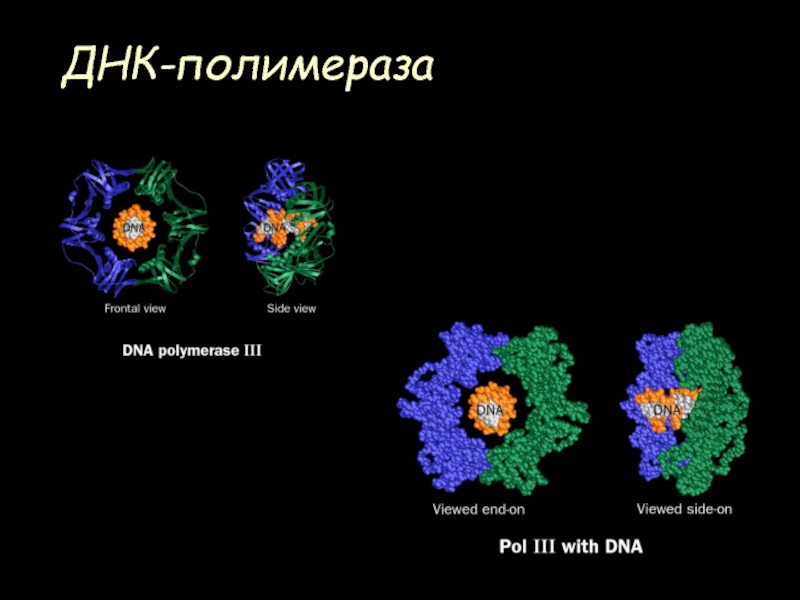
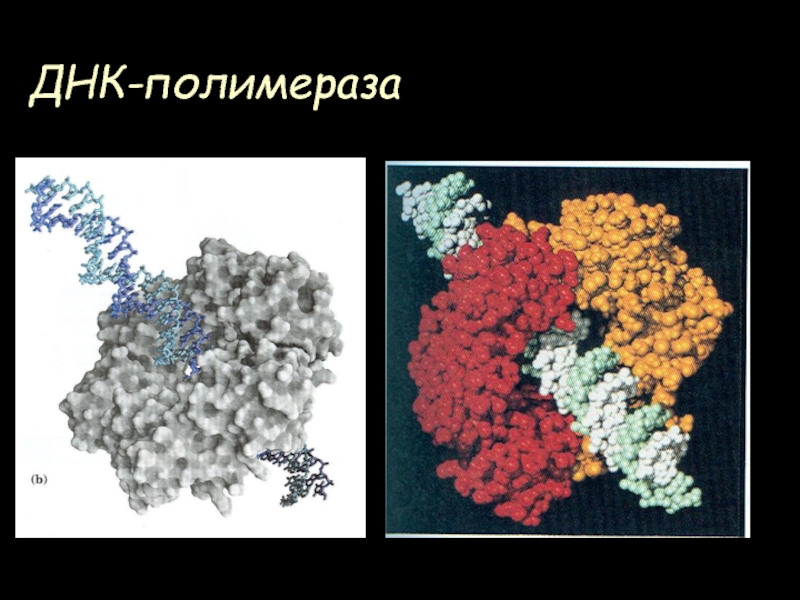
- 60. ДНК-полимераза
- 61. ДНК-полимераза
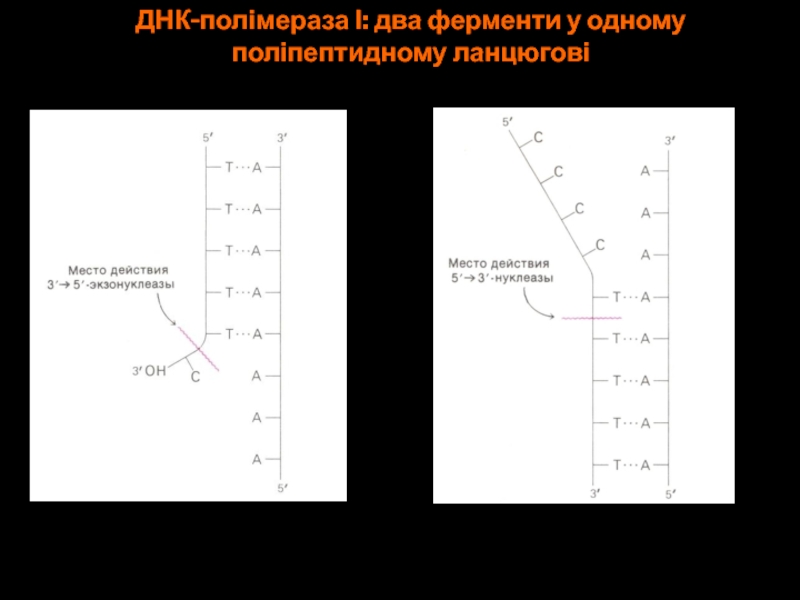
- 62. ДНК-полімераза І: два ферменти у одному поліпептидному ланцюгові
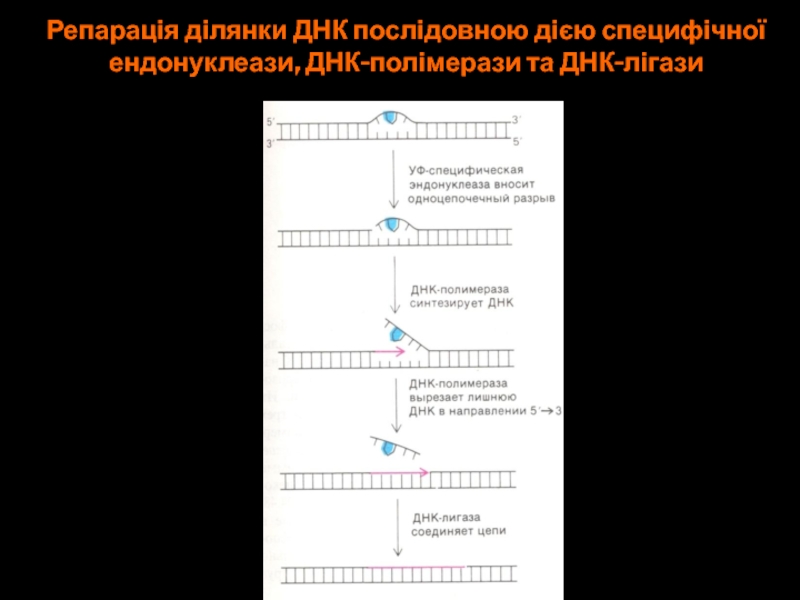
- 63. Репарація ділянки ДНК послідовною дією специфічноїендонуклеази, ДНК-полімерази та ДНК-лігази
- 64. мРНКПротеїнДНКТранскрипціяТрансляція“Центральна догма” молекулярної біологіїРедуплікаціяПередача інформації в клітинах Протеїн, лінійна послідовність амінокислот,кодується ДНК, лінійною послідовністю нуклеотидів
- 65. ТРАНСКРИПЦІЯ1.Копіювання коду ДНК (синтез мРНК) здійснюється за
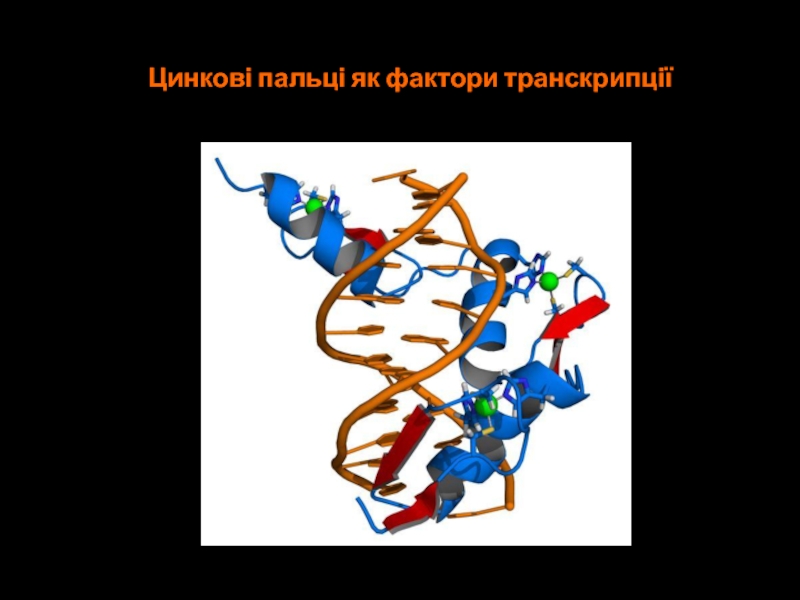
- 66. Цинкові пальці як фактори транскрипції
- 67. Петля антикодонуІОНИ МЕТАЛІВ ТА тРНКІони Mg2+ мають
- 68. ДЕПОЛІМЕРИЗАЦІЯ РНКІони металів, особливо Zn2+, сприяють розщепленню
- 69. «ДОГМА»: ДНК –> РНК -> белок
- 70. ТРАНСЛЯЦИЯ – перевод генетической информации
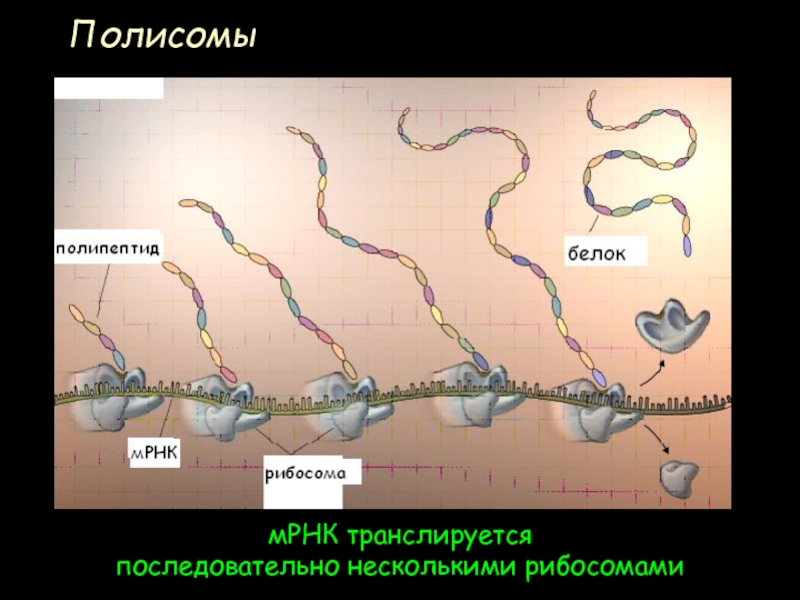
- 71. Полисомы мРНК транслируется последовательно несколькими рибосомами
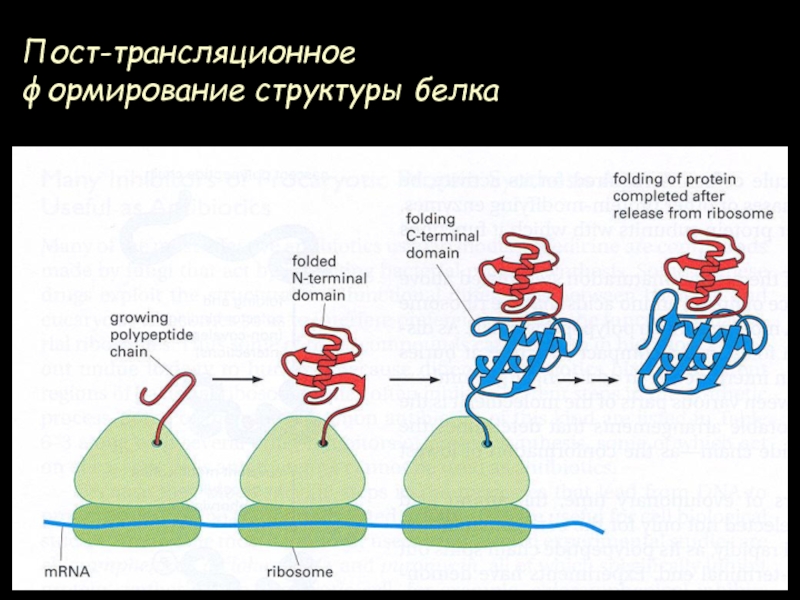
- 72. Пост-трансляционное формирование структуры белка
- 73. ТРАНСЛЯЦІЯСинтез поліпептидних ланцюгів на рибосомах вимагає оптимальної
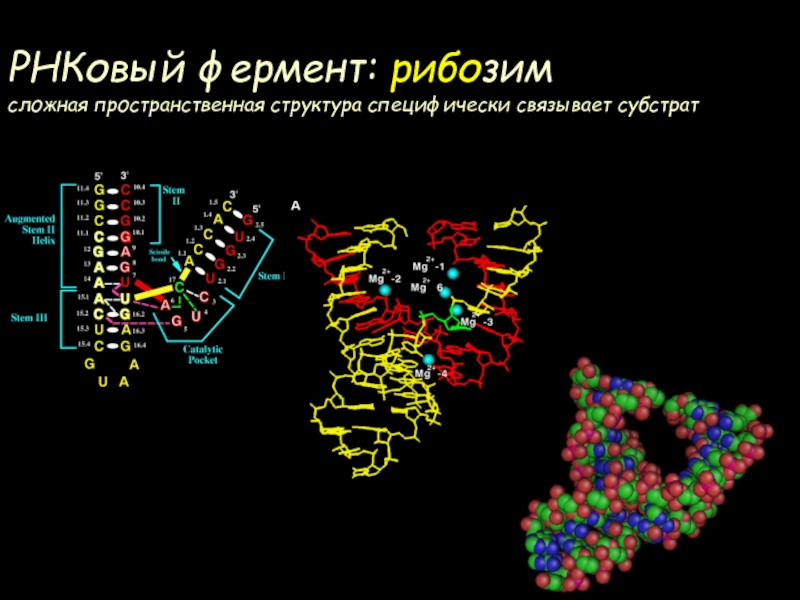
- 74. РНКовый фермент: рибозим сложная пространственная структура специфически связывает субстрат
- 75. РНК – фермент: рибозимСкорости превращенияСпонтанно – 1 молекула/годРибозим – 107 молекул/годЭнзим - 1010 молекул/год
- 76. Функции нуклеиновых кислотДНК 1.Активное хранение генетической информации. Организация вместе
- 77. James Watson, reflecting on creativity“It’s necessary to
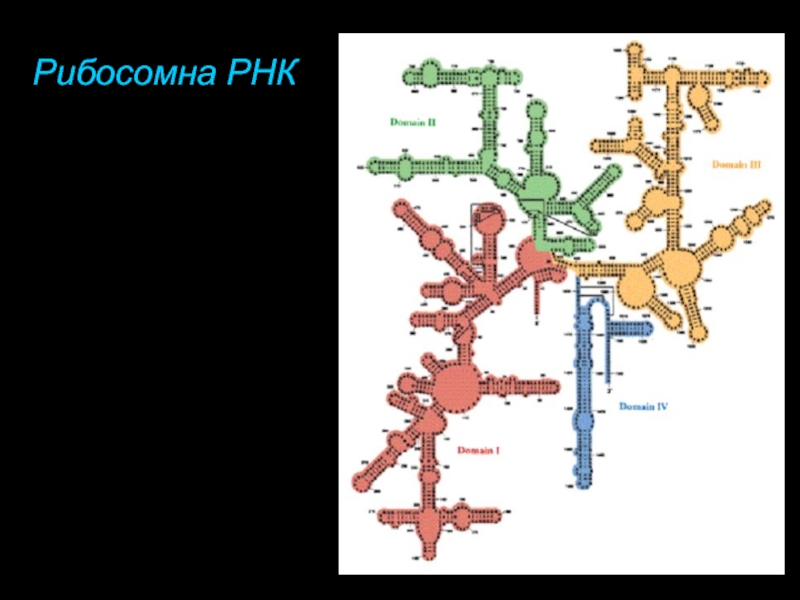
- 78. Рибосомна РНК
- 79. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1
Нуклеотиди: фундаментальні субодиниці
Нуклеїнові кислоти: структура і функція
Нуклеїнові кислоти
Слайд 2мРНК
Протеїн
ДНК
Транскрипція
Трансляція
“Центральна догма” молекулярної біології
Редуплікація
Передача інформації в клітинах
Протеїн, лінійна послідовність
амінокислот,
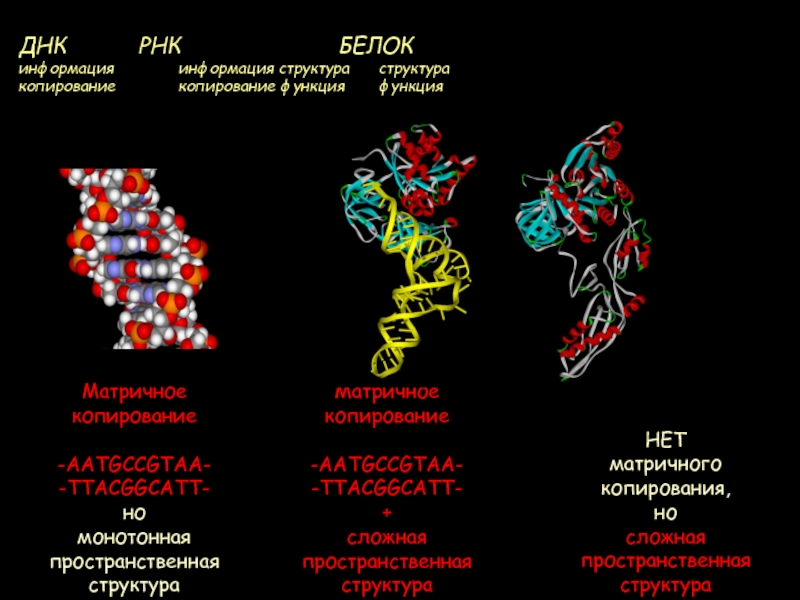
Слайд 3ДНК РНК
БЕЛОК информация информация структура структура
копирование копирование функция функцияМатричное
копирование
-AATGCCGTAA-
-TTACGGCATT-
но
монотонная
пространственная структура
НЕТ
матричного
копирования,
но
сложная
пространственная
структура
Матричное
копирование
-AATGCCGTAA-
-TTACGGCATT-
+
сложная
пространственная
структура
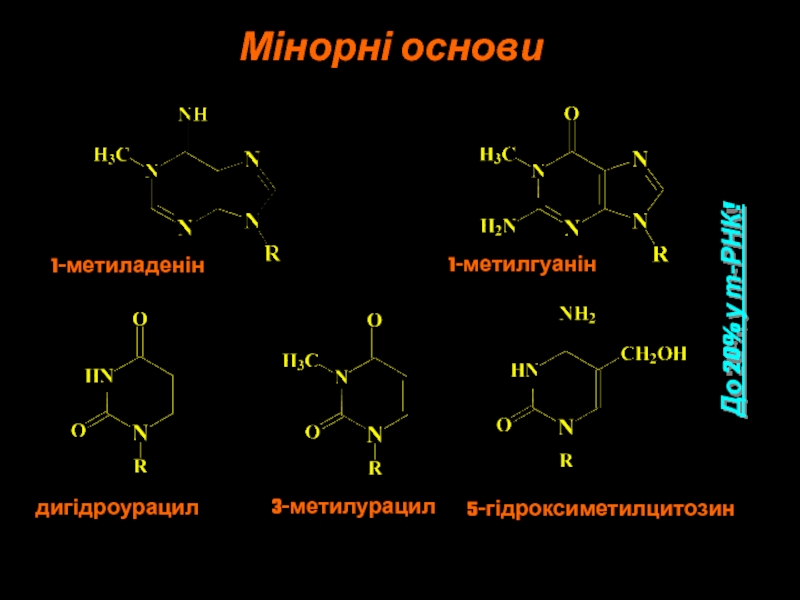
Слайд 7Мінорні основи
1-метиладенін
1-метилгуанін
дигідроурацил
3-метилурацил
5-гідроксиметилцитозин
До 20% у т-РНК!
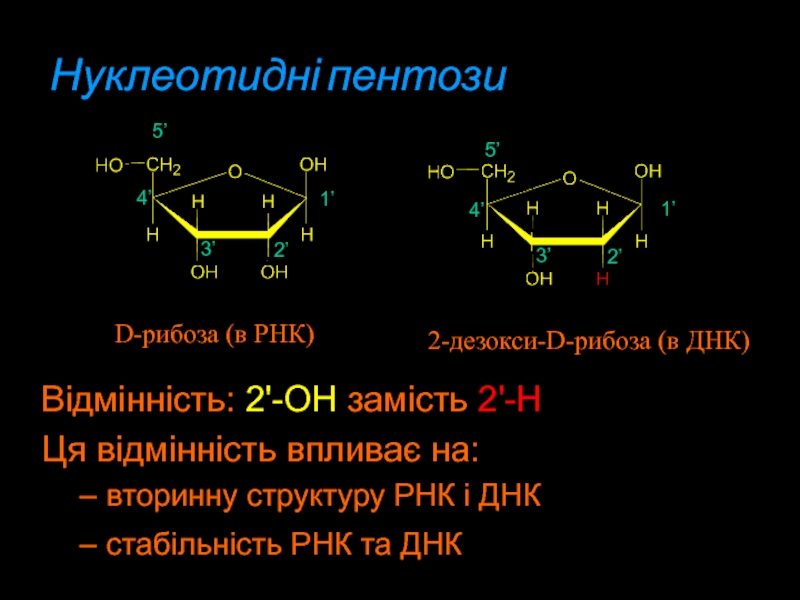
Слайд 8Нуклеотидні пентози
Відмінність: 2'-OH замість 2'-H
Ця відмінність впливає на:
вторинну структуру
РНК і ДНК
стабільність РНК та ДНК
2-дезокси-D-рибоза (в ДНК)
D-рибоза (в
РНК)1’
1’
2’
2’
3’
3’
4’
4’
5’
5’
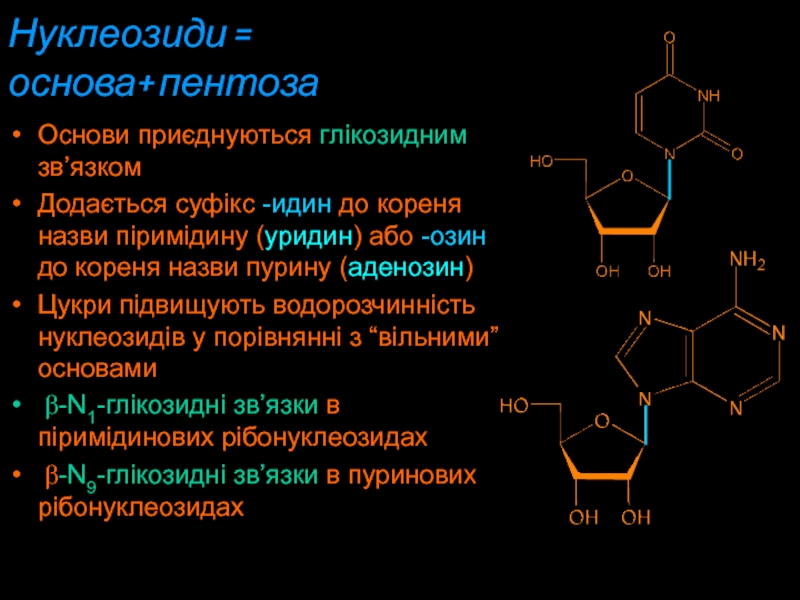
Слайд 9Нуклеозиди =
основа+ пентоза
Основи приєднуються глікозидним зв’язком
Додається суфікс -идин
дo кореня назви піримідину (уридин) або -озин до кореня назви
пурину (аденозин)Цукри підвищують водорозчинність нуклеозидів у порівнянні з “вільними” основами
b-N1-глікозидні зв’язки в піримідинових рібонуклеозидах
b-N9-глікозидні зв’язки в пуринових рібонуклеозидах
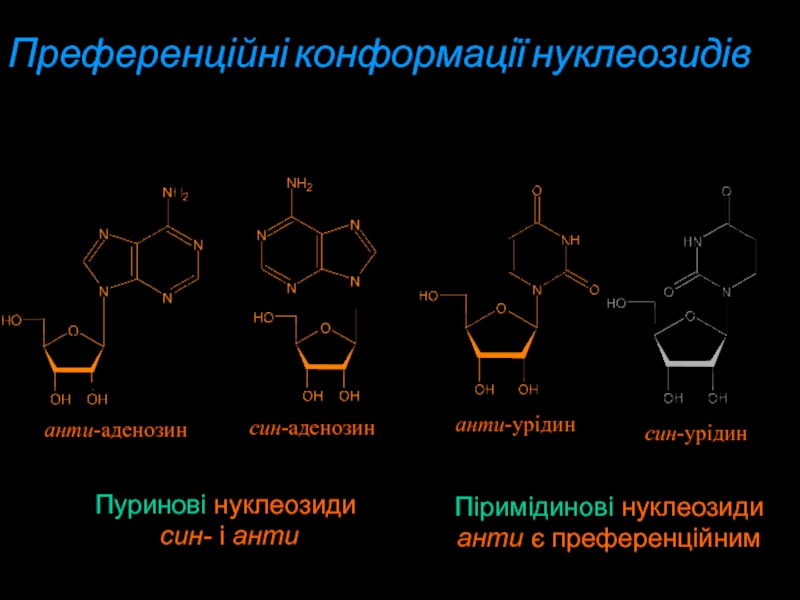
Слайд 10Преференційні конформації нуклеозидів
Пуринові нуклеозиди
син- і анти
Піримідинові нуклеозиди
анти є
преференційним
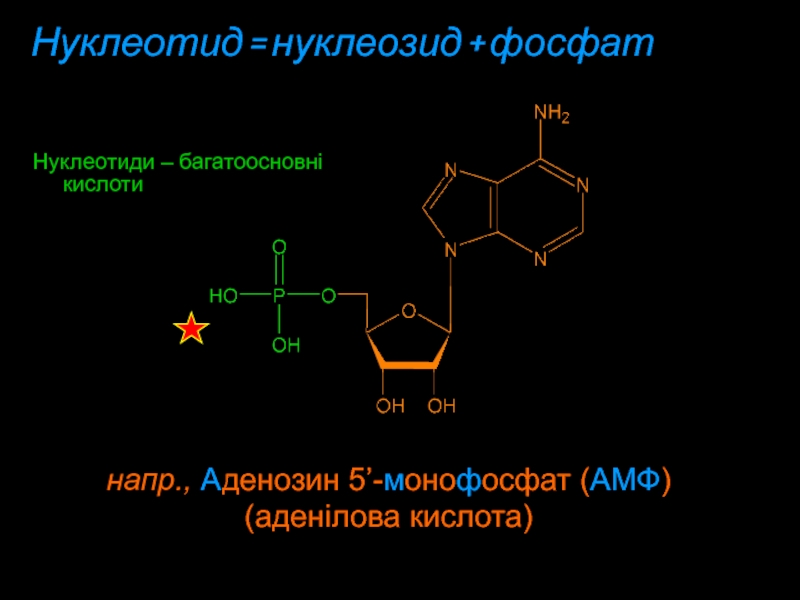
Слайд 11Нуклеотид = нуклеозид + фосфат
Нуклеотиди – багатоосновні кислоти
напр., Aденозин
5’-мoнoфoсфат (AMФ)
(аденілова кислота)
Слайд 12Функції нуклеотидів
Попередники полінуклеотидів ДНК і РНК
Переносники енергії через перенесення фосфорильних
груп
напр., ATФ + H2O AДФ + Фн + eнергія
Основи
служать як одиниці розпізнавання ATФ – енергетичний метаболізм
ГTФ – синтез протеїнів
ЦTФ – синтез ліпідів
УTФ – синтез вуглеводів
Циклічні нуклеотиди – сигнальні молекули і регулятори клітинного метаболізму і репродукції
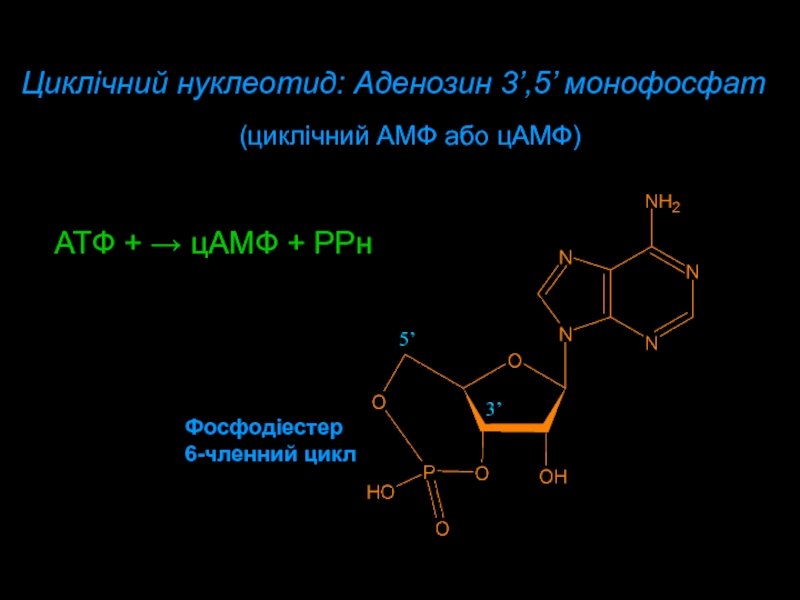
Слайд 13Циклічний нуклеотид: Aденозин 3’,5’ монофосфат
Фосфодіестер
6-членний цикл
ATФ + цAMФ +
PPн
(циклічний AMФ або цAMФ)
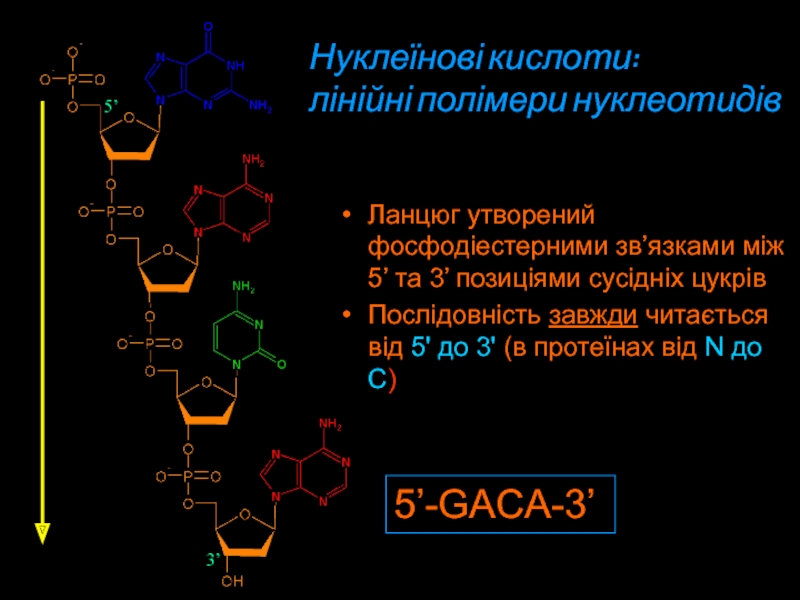
Слайд 155’-GACA-3’
5’
3’
Ланцюг утворений фосфодіестерними зв’язками між 5’ та 3’ позиціями
сусідніх цукрів
Послідовність завжди читається від 5' дo 3' (в
протеїнах від N дo C)Нуклеїнові кислоти:
лінійні полімери нуклеотидів
Слайд 16Класи нуклеїнових кислот
ДНК – один тип, одна ціль: генетичний матеріал
характеризується
первинною і вторинною структурою (спіраль), але не третинною структурою
РНК –
3 типи, 3 цілі:первинна, вторинна і третинна структури
рибосомні РНК – основа структури та функції рибосом
матричні РНК – переносники “месседжів”
транспортні РНК – переносники амінокислот
Слайд 17Подвійна спіраль ДНК: коротка історія
Стабілізована водневими зв’язками
“Пари основ" є наслідком
Н-зв’язків:
A однієї низки утворює пару з T іншої низки
G утворює
пару з CЕрвін Шаргафф знайшов явище спарювання, але не зрозумів його сенс
Розалінда Франклін РСтА мав вирішальне значення
Френсіс Крік
Джеймс Уотсон
коректна інтерпретація
Слайд 19Подвійна спіраль ДНК
Дві низки, спрямовані антипаралельно
“Пари основ“, що утворюють H-зв’язки:
A
+ T
G + C
Низки є комплементарними
Ван-дер-Ваальсівські взаємодії між
основами, що стикуються, також стабілізують спіральEлектростатичне відштовхування між фосфатними групами дестабілізує спіраль...
Але зв’язування протийонів (напр., Mg2+) мінімізує його вплив
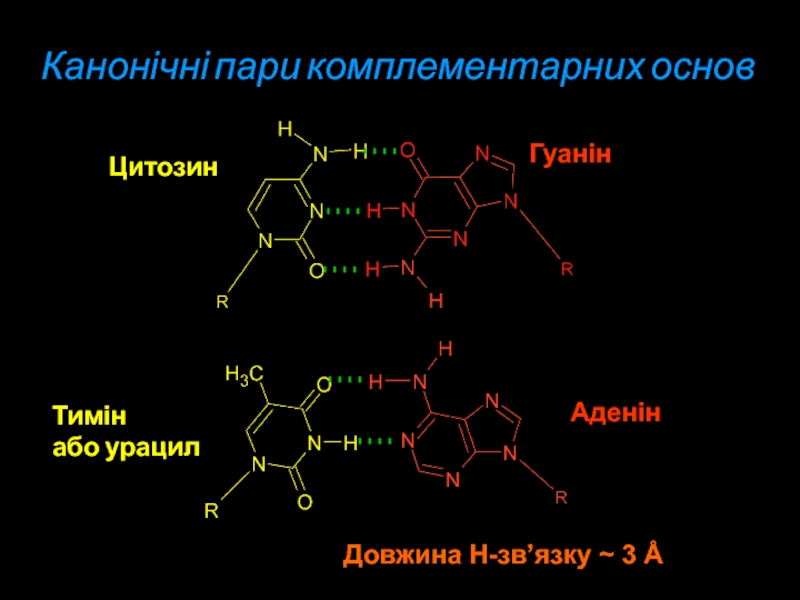
Слайд 20Канонічні пари комплементарних основ
Цитозин
Тимін
або урацил
Гуанін
Аденін
Довжина Н-зв’язку ~ 3 Å
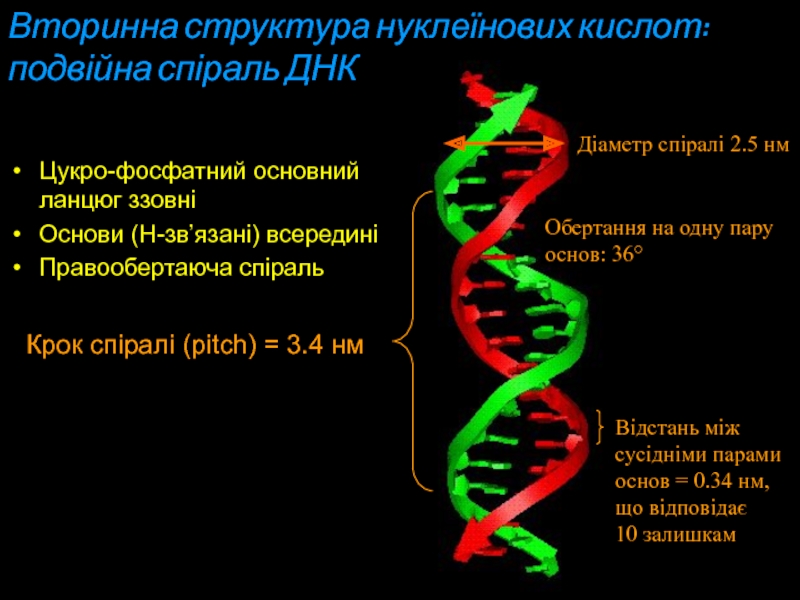
Слайд 21Вторинна структура нуклеїнових кислот:
подвійна спіраль ДНК
Діаметр спіралі 2.5 нм
Цукро-фосфатний
основний ланцюг ззовні
Основи (Н-зв’язані) всередині
Правообертаюча спіраль
Обертання на
одну пару основ: 36°
Крок спіралі (рitch) = 3.4 нм
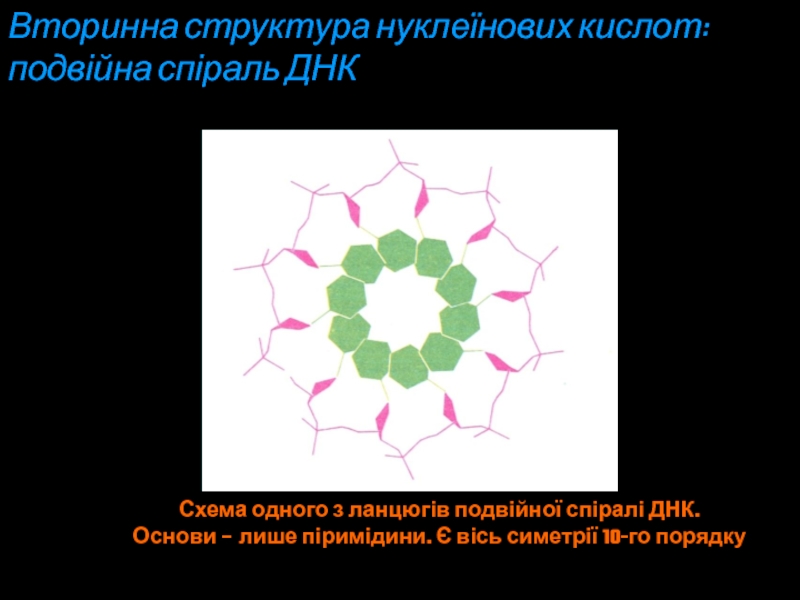
Слайд 22Схема одного з ланцюгів подвійної спіралі ДНК.
Основи – лише піримідини.
Є вісь симетрії 10-го порядку
Вторинна структура нуклеїнових кислот:
подвійна спіраль
ДНКСлайд 23Вторинна структура нуклеїнових кислот:
подвійна спіраль ДНК
Модель двохспіральної молекули ДНК.
Два
ланцюги орієнтовані в протилежних напрямках!
Слайд 30Длина ДНК человека
http://nature.web.ru/
В ядре каждой клетки человека содержится
23 пары
хромосом,
они содержат около 3,2 млрд. пар нуклеотидов
Суммарная длина всех
46 молекул ДНК в одной клетке равна прим. 2 м.
Общая длина ДНК во всех клетках человеческого тела
составляет 1011 км, что почти в тысячу раз больше расстояния от Земли до Солнца.
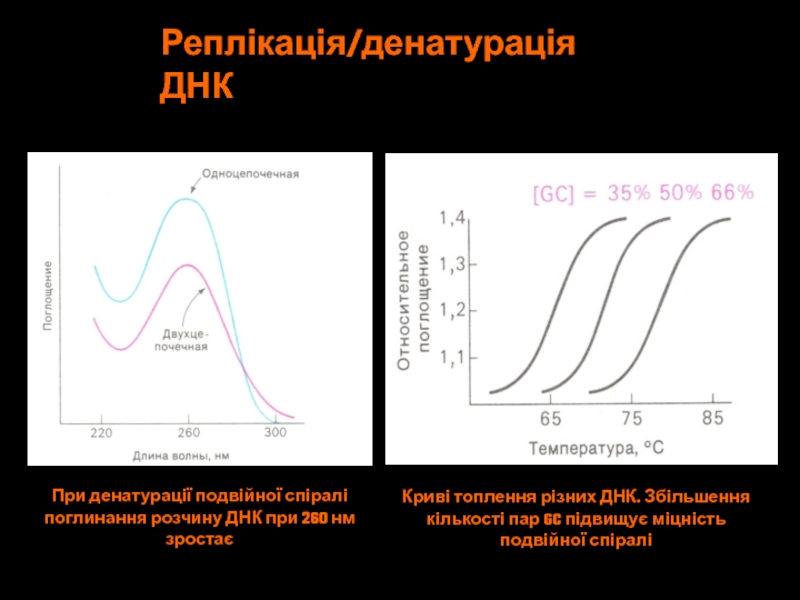
Слайд 32При денатурації подвійної спіралі
поглинання розчину ДНК при 260 нм
зростає
Криві топлення
різних ДНК. Збільшення
кількості пар GC підвищує міцність
подвійної спіралі
Реплікація/денатурація ДНК
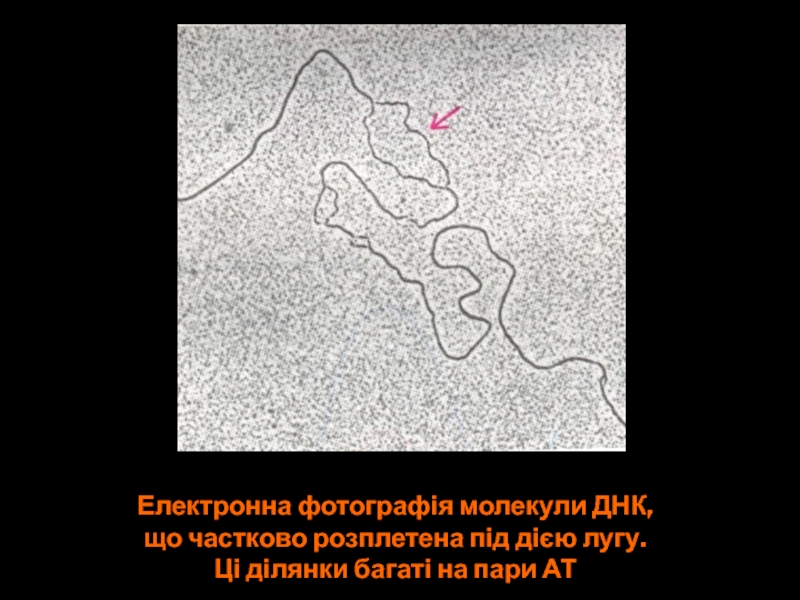
Слайд 33Електронна фотографія молекули ДНК,
що частково розплетена під дією лугу.
Ці ділянки
багаті на пари АТ
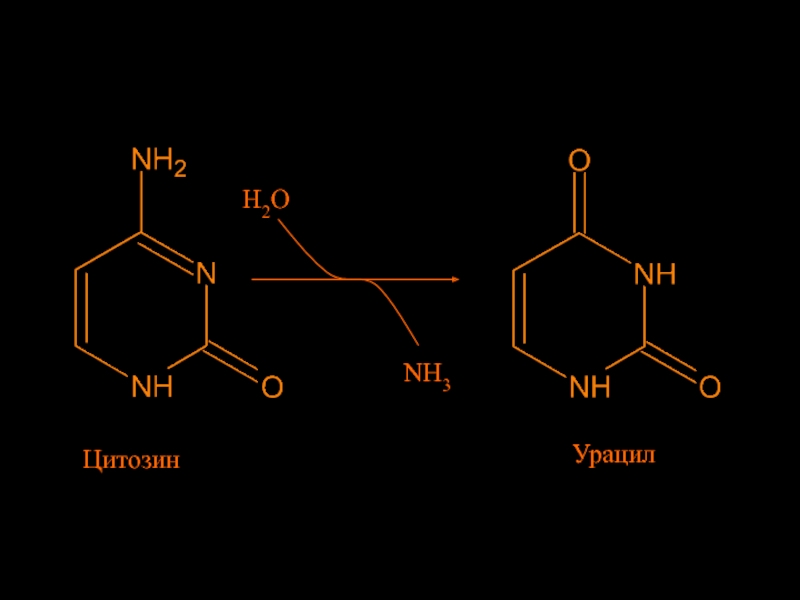
Слайд 34Відмінності між ДНК і РНК
Чому ДНК містить тімін, в той
час як РНК містить урацил??
Цитозин спонтанно (але рідко) дезамінується
з утворенням урацилу Це може призвести до “мутації” пари основ ГЦ на AУ
Спеціальні “ремонтні” ензими розпізнають ці “мутації" та заміщують урацил на цитозин
Але якщо урацил був нормальною основою в ДНК, “ремонтні” ензими не можуть відрізнити урацил, що утворився в результаті дезамінування цитозину
Рішення: замінити урацил на тімін (5-метил-урацил) в ДНК
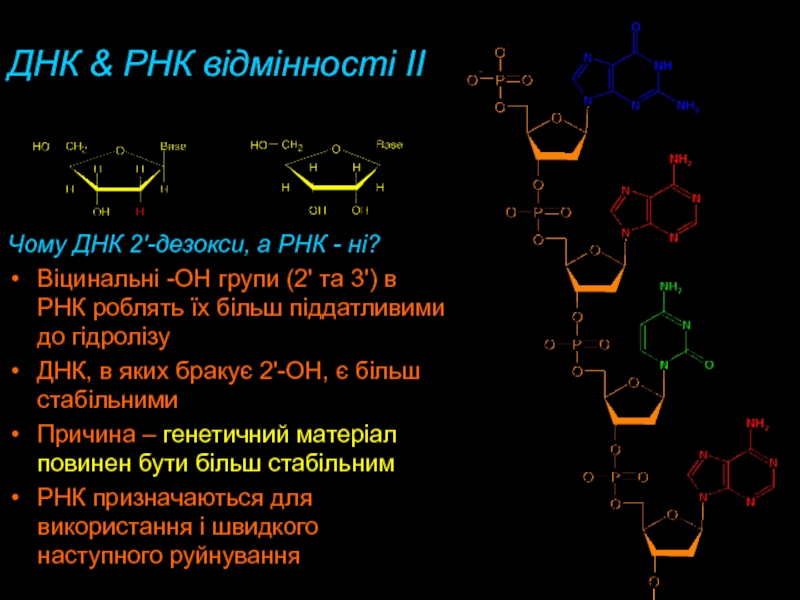
Слайд 36ДНК & РНК відмінності II
Чому ДНК 2'-дезокси, а РНК -
ні?
Віцинальні -OH групи (2' та 3') в РНК роблять
їх більш піддатливими до гідролізу ДНК, в яких бракує 2'-OH, є більш стабільними
Причина – генетичний матеріал повинен бути більш стабільним
РНК призначаються для використання і швидкого наступного руйнування
Слайд 37ДНК & РНК відмінності III
Чому РНК можуть виявляти третинну структуру
( напр., тРНК, рРНК) додатково до вторинної структури?
РНК мають 2’-гідроксильні
групи,потенціально здатні до утворення
додаткових Н-зв’язків
Слайд 38Комплекси металів з основами,
нуклеозидами та нуклеотидами
ГОЛОВНІ ПИТАННЯ:
1.Які атоми пуринів
та піримідинів є центрами приєднання
ня металів у нуклеозидах та нуклеотидах?
2.Наскільки
ефективно фосфат конкурує з основами за іони металів?
3.Чи можливе одночасне приєднання металів до основ
і фосфатних груп?
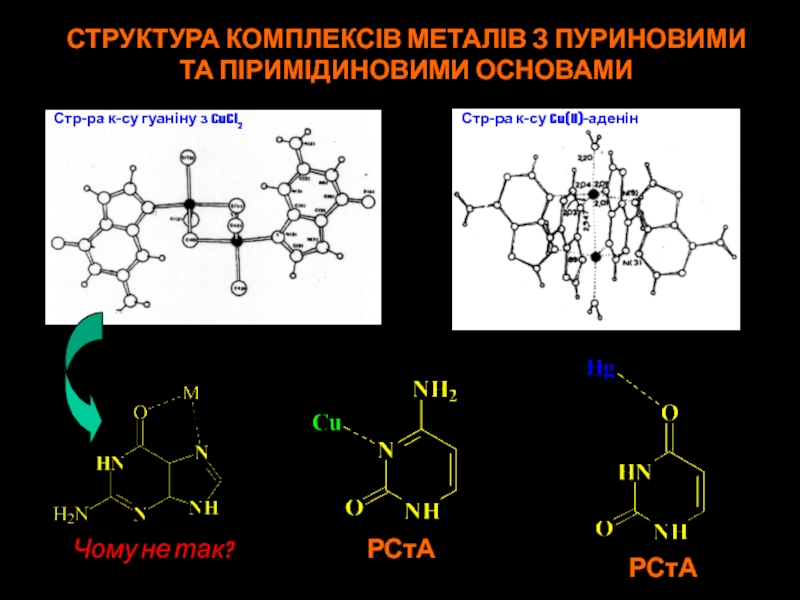
Слайд 40СТРУКТУРА КОМПЛЕКСІВ МЕТАЛІВ З ПУРИНОВИМИ
ТА ПІРИМІДИНОВИМИ ОСНОВАМИ
Чому не так?
РСтА
РСтА
Стр-ра к-су
гуаніну з CuCl2
Стр-ра к-су Cu(II)-аденін
Слайд 41Зв’язування іонів металів з основами, що не
приєднані до рибози не
має безпосереднього
біологічного інтересу, т.я. може приєднуватися
до атомів N9 пуринів та
N1 піримідинів, тоді яку нуклеозидах та нуклеотидах ці атоми не є
донорами електронів
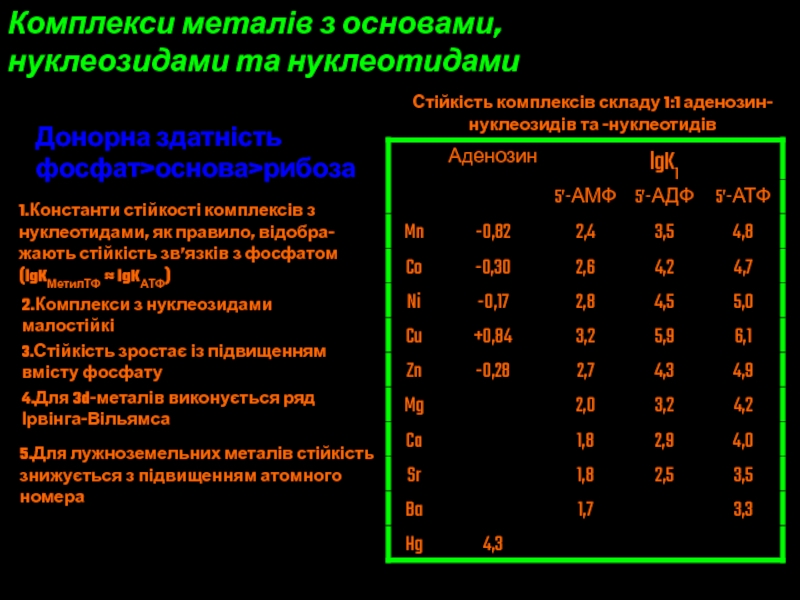
Слайд 42Комплекси металів з основами,
нуклеозидами та нуклеотидами
Стійкість комплексів складу 1:1
аденозин-
нуклеозидів та -нуклеотидів
Донорна здатність
фосфат>основа>рибоза
1.Константи стійкості комплексів з
нуклеотидами, як правило,
відобра-жають стійкість зв’язків з фосфатом
(lgKМетилТФ ≈ lgKАТФ)
2.Комплекси з нуклеозидами
малостійкі
3.Стійкість зростає із підвищенням
вмісту фосфату
4.Для 3d-металів виконується ряд
Ірвінга-Вільямса
5.Для лужноземельних металів стійкість
знижується з підвищенням атомного
номера
Слайд 43Комплекси металів з основами,
нуклеозидами та нуклеотидами
1.Основи нуклеозидів за відносною
стійкістю їх
комплексів з 3d-металами розміщуються як:
G > A,C > U,T
2.Виключно
висока стійкість комплексу ртуті з аденозином відображає суттєво більшу спорідненість основ до таких
металів як ртуть і срібло в порівнянні з 3d-металами. Відносна
спорідненість основ до ртуті(ІІ) відповідає ряду
T > C > A > G
3.Константи стійкості lgK1 комплексів срібла з
аденозином, АМФ, АДФ, АТФ, ДНК рівні 3,9, 4,2, 4,2, 4,3, 4,4,
відповідно, що свідчить про відсутність звязування
сріблом фосфатної групи.
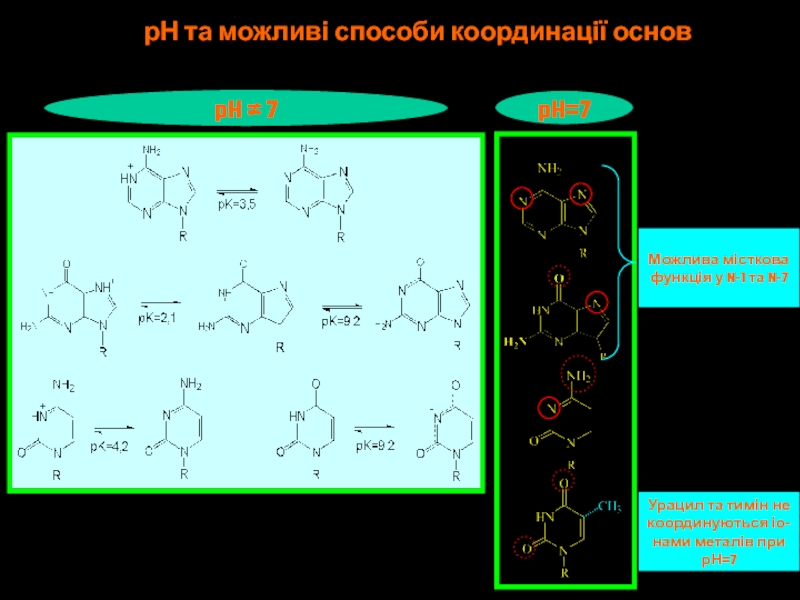
Слайд 44pH ≠ 7
pH=7
Можлива місткова
функція у N-1 та N-7
Урацил та
тимін не
координуються іо-
нами металів при
рН=7
рН та можливі способи координації основ
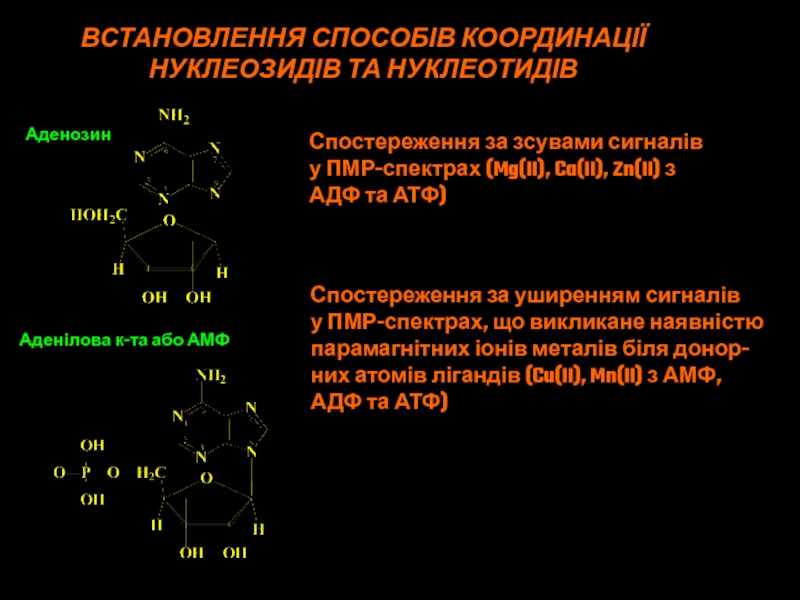
Слайд 45ВСТАНОВЛЕННЯ СПОСОБІВ КООРДИНАЦІЇ
НУКЛЕОЗИДІВ ТА НУКЛЕОТИДІВ
Спостереження за зсувами сигналів
у ПМР-спектрах
(Mg(II), Ca(II), Zn(II) з
АДФ та АТФ)
Спостереження за уширенням сигналів
у ПМР-спектрах, що викликане наявністю парамагнітних іонів металів біля донор-них атомів лігандів (Cu(II), Mn(II) з АМФ,
АДФ та АТФ)
Аденозин
Аденілова к-та або АМФ
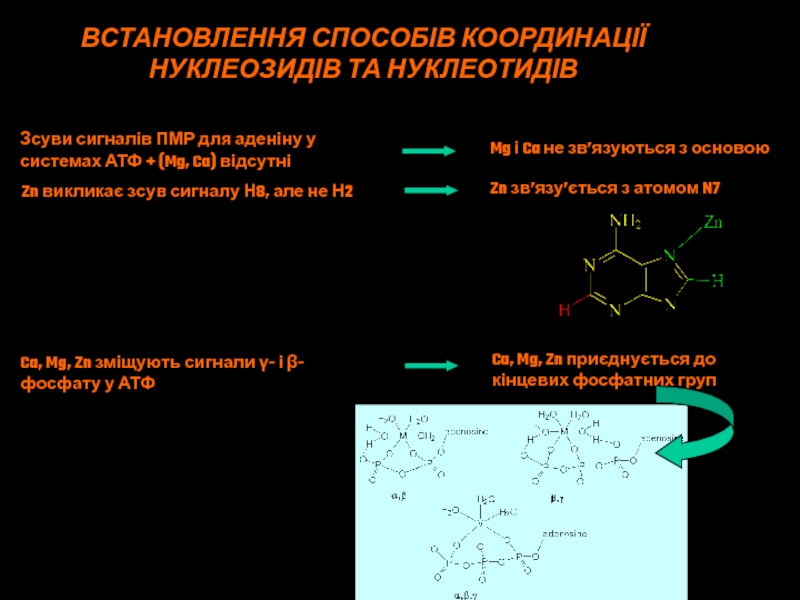
Слайд 46ВСТАНОВЛЕННЯ СПОСОБІВ КООРДИНАЦІЇ
НУКЛЕОЗИДІВ ТА НУКЛЕОТИДІВ
Зсуви сигналів ПМР для аденіну у
системах АТФ + (Mg, Ca) відсутні
Mg і Ca не зв’язуються
з основоюZn викликає зсув сигналу Н8, але не Н2
Zn зв’язу’ється з атомом N7
Ca, Mg, Zn зміщують сигнали γ- і β-
фосфату у АТФ
Ca, Mg, Zn приєднується до
кінцевих фосфатних груп
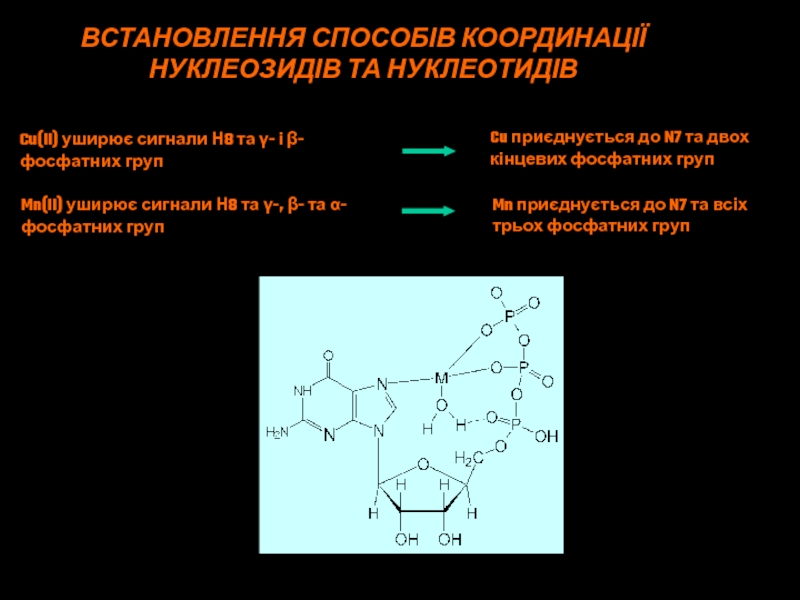
Слайд 47ВСТАНОВЛЕННЯ СПОСОБІВ КООРДИНАЦІЇ
НУКЛЕОЗИДІВ ТА НУКЛЕОТИДІВ
Cu(II) уширює сигнали Н8 та γ-
і β-
фосфатних груп
Cu приєднується до N7 та двох
кінцевих фосфатних
групMn(II) уширює сигнали Н8 та γ-, β- та α-
фосфатних груп
Mn приєднується до N7 та всіх
трьох фосфатних груп
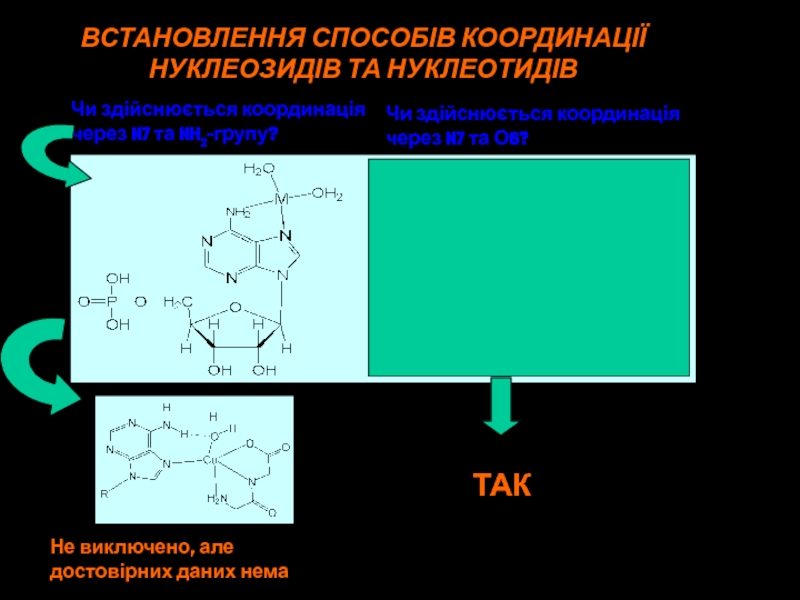
Слайд 48ВСТАНОВЛЕННЯ СПОСОБІВ КООРДИНАЦІЇ
НУКЛЕОЗИДІВ ТА НУКЛЕОТИДІВ
Чи здійснюється координація
через N7 та NH2-групу?
Не
виключено, але
достовірних даних нема
ТАК
Чи здійснюється координація
через N7 та О6?
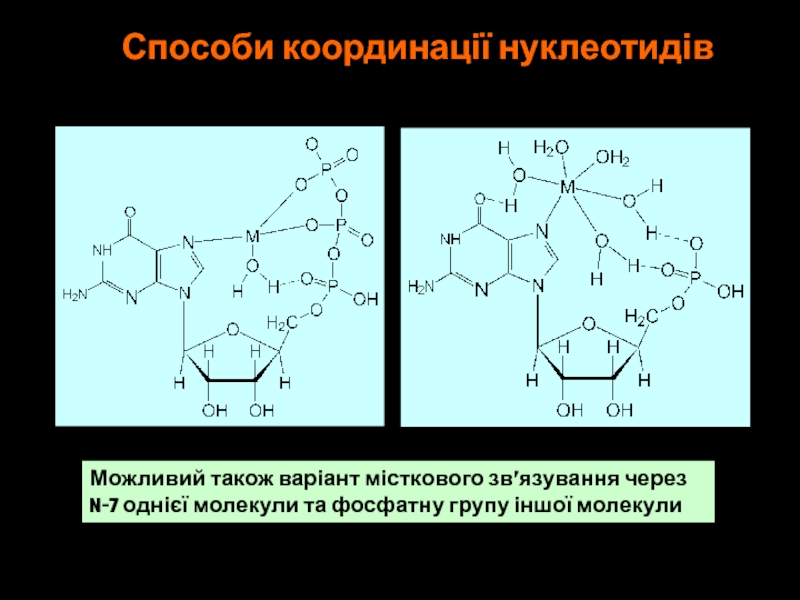
Слайд 49Способи координації нуклеотидів
Можливий також варіант місткового зв’язування через
N-7 однієї молекули
та фосфатну групу іншої молекули
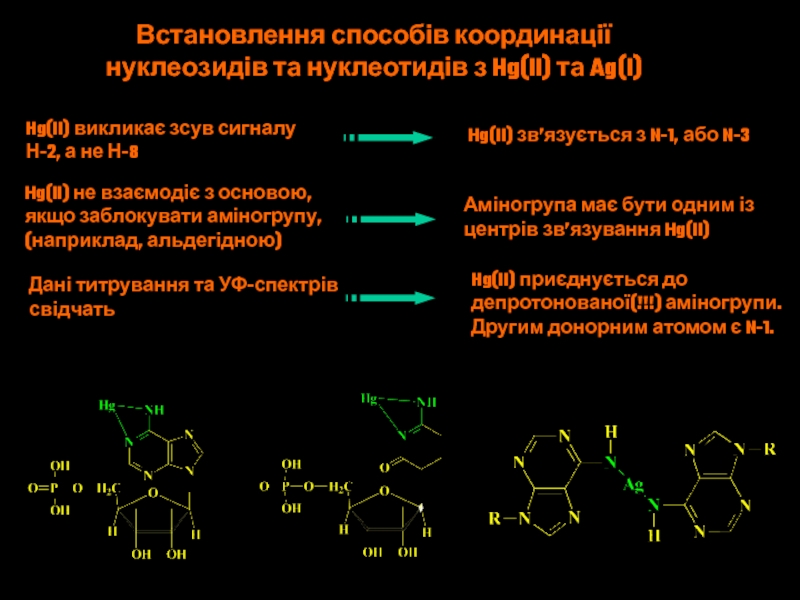
Слайд 50Встановлення способів координації
нуклеозидів та нуклеотидів з Hg(II) та Ag(I)
Hg(II)
викликає зсув сигналу
Н-2, а не Н-8
Hg(II) зв’язується з N-1,
або N-3Hg(II) не взаємодіє з основою,
якщо заблокувати аміногрупу,
(наприклад, альдегідною)
Аміногрупа має бути одним із
центрів зв’язування Hg(II)
Дані титрування та УФ-спектрів
свідчать
Hg(II) приєднується до
депротонованої(!!!) аміногрупи.
Другим донорним атомом є N-1.
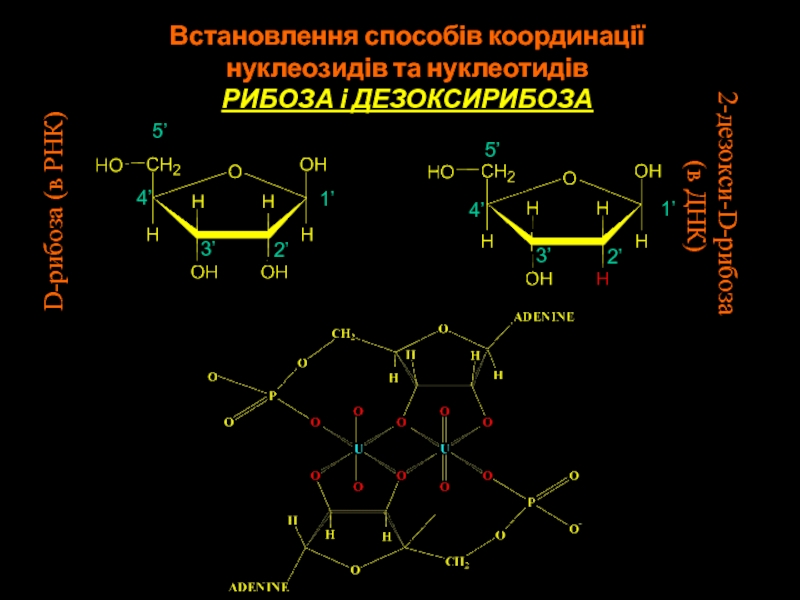
Слайд 522-дезокси-D-рибоза
(в ДНК)
D-рибоза (в РНК)
1’
1’
2’
2’
3’
3’
4’
4’
5’
5’
Встановлення способів координації
нуклеозидів та нуклеотидів
РИБОЗА
і ДЕЗОКСИРИБОЗА
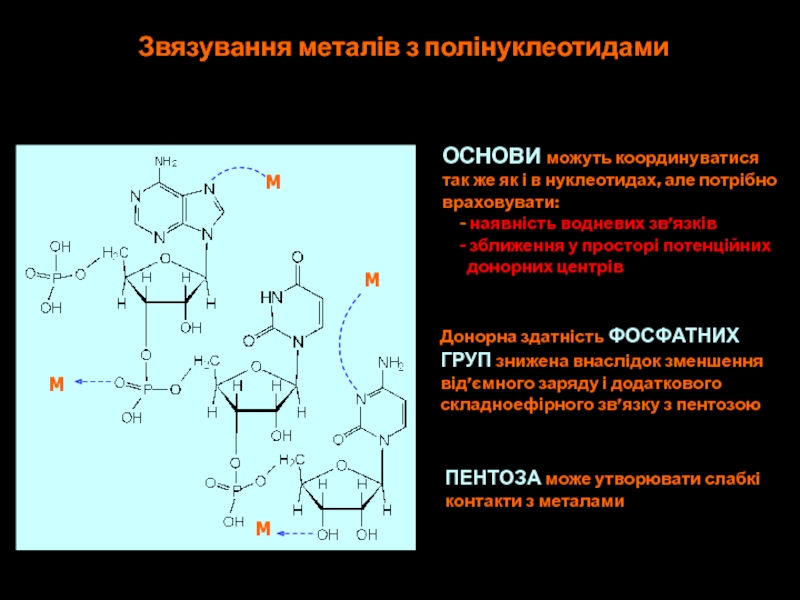
Слайд 53M
M
M
Звязування металів з полінуклеотидами
M
ОСНОВИ можуть координуватися
так же як і в
нуклеотидах, але потрібно
враховувати:
- наявність водневих зв’язків
- зближення у просторі потенційнихдонорних центрів
Донорна здатність ФОСФАТНИХ
ГРУП знижена внаслідок зменшення
від’ємного заряду і додаткового
складноефірного зв’язку з пентозою
ПЕНТОЗА може утворювати слабкі
контакти з металами
Слайд 55Комплексоутворення в системах
M2+ - полінуклеотид
Визначення місць зв’язування металу з
“полілігандною”
макромолекулою не несе інформації про будову комплексів,
що утворюються
Слайд 56ВПЛИВ ІОНІВ МЕТАЛІВ НА СТРУКТУРУ ДНК
1. Стабілізація подвійної спіралі за
рахунок утворення неспецифічних (електростатич-
ні зв’язки за участю іонів лужних металів
та магнію), або специфічних (утворення ко-валентних зв’язків) контактів, що веде до нейтралізації негативних зарядів на подвій-
ній спіралі. Відносна спорідненість до фосфату змінюється в ряду:
Mg2+ > Co2+ > Ni2+ > Mn2+ > Zn2+ > Cd2+ > Cu2+ > (Ag+ Hg2+ Pb2+)
2. Зв’язування з основами веде, як правило, до розриву водневих зв’вязків між
комплементарними основами, що, в свою чергу, дестабілізує подвійну спіраль
(зменшується Ттопл.ДНК)
3. Cu2+ та Zn2+ не приводять до незворотнього розкручування ДНК, утворюючи попе-
речні зв’язки (містки) у денатурованій ДНК. При створенні сприятливих умов (темпе-
ратура, концентрація електролітів) відбувається регенерація подвійної спіралі.
Mg2+ зв’язується з фосфатними групами, поперечних зв’язків не утворює і ренатура-
ція денатурованої ДНК неможлива.
4. Hg2+ та Ag+ зв’язуються з основами настільки міцно, що вони у стехіометричних
кількостях розміщуються між ланцюгами подвійної спіралі, розривають водневі
зв’язки N-H…N між основами і утворюють більш стабільний місток N-Ag(Hg)-N.
5. Висока спорідненість іонів важких металів до донорних атомів основ веде до
мутагенезу, або до протипухлинних препаратів.
Слайд 59РОЛЬ МЕТАЛІВ У РЕПЛІКАЦІЇ ДНК
ДНК-полімераза І має у своєму
складі 1-2
іони цинку, які можуть
бути виділені з білкової молеку-
ли і повернуті
назад без виратиактивності
За 1 сек ДНК-полімераза І приєд-
нує до полінуклеотидного лан-
цюга 10 нуклеотидів
Іон Mg2+ виконує роль містка
між ферментом та термінальною
фосфатною групою, сприяє ви-
вільненню дифосфату. Іони Mg2+
сприяють входженню в ланцюг
ДНК лише дезоксинуклеотидів
Заміна Mg2+ на Mn2+ веде до зміни селективності проходження процесу реплікації: іон
Mn2+ вбудовує в ланцюг як рибо- так і дезоксирибонуклеотиди.
Мультиферментний комплекс, що містить ДНК-полімеразу ІІІ синтезує більшу части-
ну нової ДНК (приєднує біля 150 нуклеотидів за 1 сек), а ДНК-полімераза І заповнює
деякі пробіли та видаляє затравочну РНК
Слайд 63Репарація ділянки ДНК послідовною дією специфічної
ендонуклеази, ДНК-полімерази та ДНК-лігази
Слайд 64мРНК
Протеїн
ДНК
Транскрипція
Трансляція
“Центральна догма” молекулярної біології
Редуплікація
Передача інформації в клітинах
Протеїн, лінійна послідовність
амінокислот,
кодується ДНК, лінійною послідовністю нуклеотидів
Слайд 65ТРАНСКРИПЦІЯ
1.Копіювання коду ДНК (синтез мРНК) здійснюється за допомогою
РНК-полімераз. Вони
потребують ДНК як матрицю, рибонуклеозид-
трифосфати та іони металів.
РНК-полімераза із
E.coli складається із 5 субодиниць (М = 500 000)і містить 2 іони цинку, що не виділяються при діалізі з хелатуючими
лігандами
Роль активатора у процесі транскрипції проявляють Mg2+, Mn2+, Co2+:
Mg2+ сприяє вбудовуванню в полімерний ланцюг РНК
рибонуклеотидів, а не дезоксирибонуклеотидів
Mn2+ та Co2+ каталізують реакцію синтезу РНК набагато
ефективніше, ніж Mg2+, але вбудовують як рибонуклеотиди,
так і дезоксирибонуклеотиди.
Інші метали не ефективні при синтезі РНК
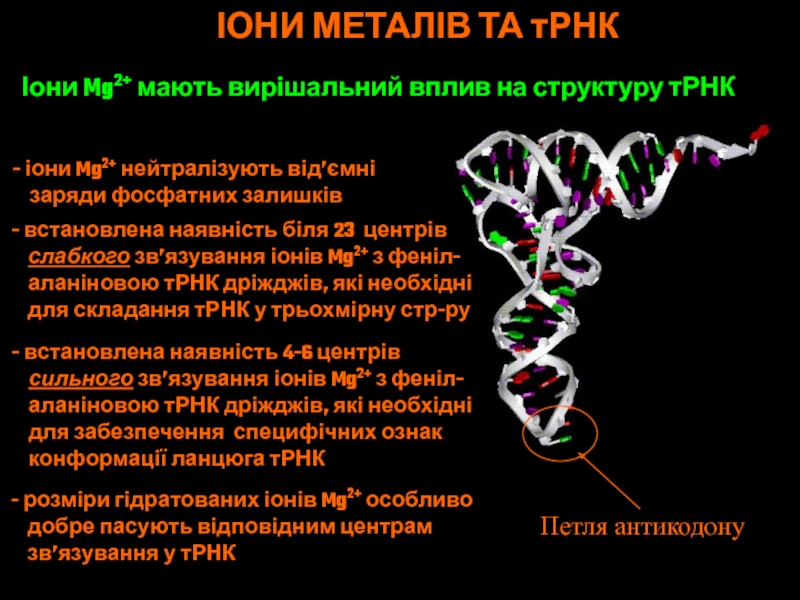
Слайд 67Петля антикодону
ІОНИ МЕТАЛІВ ТА тРНК
Іони Mg2+ мають вирішальний вплив на
структуру тРНК
іони Mg2+ нейтралізують від’ємні
заряди фосфатних
залишків встановлена наявність біля 23 центрів
слабкого зв’язування іонів Mg2+ з феніл-
аланіновою тРНК дріжджів, які необхідні
для складання тРНК у трьохмірну стр-ру
встановлена наявність 4-6 центрів
сильного зв’язування іонів Mg2+ з феніл-
аланіновою тРНК дріжджів, які необхідні
для забезпечення специфічних ознак
конформації ланцюга тРНК
розміри гідратованих іонів Mg2+ особливо
добре пасують відповідним центрам
зв’язування у тРНК
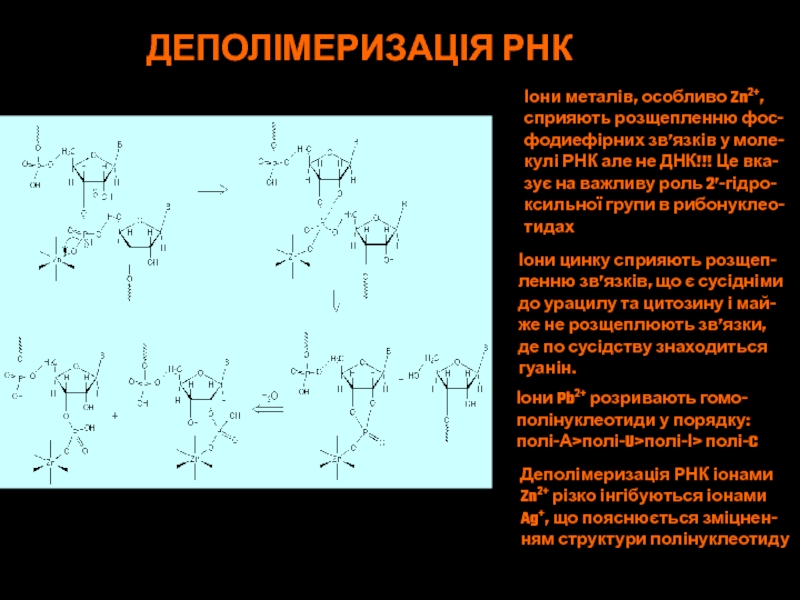
Слайд 68ДЕПОЛІМЕРИЗАЦІЯ РНК
Іони металів, особливо Zn2+,
сприяють розщепленню фос-
фодиефірних зв’язків у
моле-
кулі РНК але не ДНК!!! Це вка-
зує на важливу роль
2’-гідро-ксильної групи в рибонуклео-
тидах
Іони цинку сприяють розщеп-
ленню зв’язків, що є сусідніми
до урацилу та цитозину і май-
же не розщеплюють зв’язки,
де по сусідству знаходиться
гуанін.
Іони Pb2+ розривають гомо-
полінуклеотиди у порядку:
полі-А>полі-U>полі-І> полі-C
Деполімеризація РНК іонами
Zn2+ різко інгібуються іонами
Ag+, що пояснюється зміцнен-
ням структури полінуклеотиду
Слайд 70
ТРАНСЛЯЦИЯ – перевод генетической информации
с «языка» последовательности
нуклеотидов (мРНК)
на «язык» последовательности аминокислот (белок)
В трансляции участвуют:
-
АРСаза- транспортная РНК тРНК
- матричная РНК мРНК
- рибосома
(рибосомная РНК рРНК)
Слайд 73ТРАНСЛЯЦІЯ
Синтез поліпептидних ланцюгів на рибосомах
вимагає оптимальної концентрації іонів Mg2+
(біля
10 мМ)
При концентрації вищій за оптимальну
у поліпептидний ланцюг можуть
включатисяпомилкові амінокислоти
Слайд 75РНК – фермент: рибозим
Скорости превращения
Спонтанно – 1 молекула/год
Рибозим – 107
молекул/год
Энзим - 1010 молекул/год
Слайд 76 Функции нуклеиновых кислот
ДНК
1.Активное хранение генетической информации. Организация вместе с белками структуры
хромосом эукариот.
2. Передача генетической информации. Роль матрицы в синтезе
ДНК и РНК – репликация и транскрипция.РНК
Передача генетической информации – транскрипция
Синтез полипептидных цепей белка:
Матрица в синтезе белка – мРНК
Активация и транспорт аминокислот – тРНК
Организация вместе с белками структуры рибосом – рРНК
3. Катализ - рибозимы