Слайд 1НУКЛЕОФИЛЬНОЕ ЗАМЕЩЕНИЕ ГАЛОГЕНА И ДРУГИХ ФУНКЦИОНАЛЬНЫХ ГРУПП
1.Нуклеофильное замещение галогена в
молекуле органического соединения
(Механизмы SN1, SN2, SNAr, SNEA )
2.Нуклеофильное замещение
гидроксильной группы
(Механизмы SN1, SN2, SNAr, SNi )
3.Нуклеофильное замещение сульфогруппы в аренах
(Механизм SNAr)
Слайд 2Механизм SN1 (мономолекулярный)
включает две стадии: диссоциация алкилгалогенида на ионы и
взаимодействие катиона с нуклеофилом;
во многих случаях, алкилгалогенид диссоциирует с последовательным
образованием:
- контактной ионной пары (а),
- сольватно-разделенной ионной пары (b)
сольватированных ионов (с).
Каждый из продуктов диссоциации может взаимодействовать с реагентом.
Слайд 3Стереохимия SN1 - реакций
Нуклеофильная атака
ионной пары (а) приводит
к обращению конфигурации (асимметрия углерода в значительной мере сохраняется).
ионной
пары (б) - к преимущественному обращению конфигурации, одна сторона катиона экранируется сольватированным галогенид-ионом, но селективность снижается, и рацемизация увеличивается.
свободного катиона (с) - полная рацемизация.
Однако полная рацемизация обычно не наблюдается (рацемизация составляет от 5 до 20 %), процесс завершается до появления в реакционной массе значительного количества сольватированного катиона.
Слайд 4Скорость SN1 - реакций
Лимитирующая стадия - образование карбокатиона
Стабильность катиона
определяет реакционную способность галогенида, поэтому
Скорость процесса зависит от концентрации
алкилгалогенида и не зависит от концентрации нуклеофила.
Побочные реакции карбокатиона : изомеризация углеродной цепи, элиминирование (EI) и др.:
Слайд 5Механизм SN2 — одностадийное синхронное (бимолекулярное) замещение :
Нуклеофил Nu–
атакует субстрат «с тыла» с образованием переходного состояния. При этом
атом углерода изменяет sp3-гибридизацию на sp2-. Одна доля р-орбитали перекрывается с нуклеофилом, а вторая — с уходящей группой. Связь С–Nu образуется одновременно с разрывом связи С–Y, поэтому реакция всегда сопровождается обращением конфигурации.
Побочная реакция - элиминирования Е2.
Скорость реакции зависит: от пространственных факторов, величины положительного заряда на атоме углерода субстрата, силы нуклеофила и в кинетической области от концентрации как нуклеофила, так и алкилгалогенида.
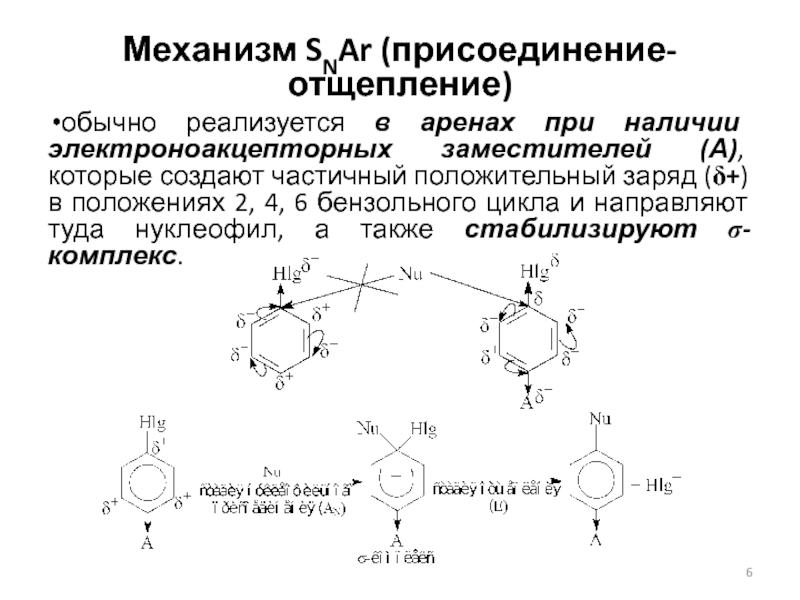
Слайд 6Механизм SNAr (присоединение-отщепление)
обычно реализуется в аренах при наличии электроноакцепторных заместителей
(А), которые создают частичный положительный заряд (d+) в положениях 2,
4, 6 бензольного цикла и направляют туда нуклеофил, а также стабилизируют s-комплекс.
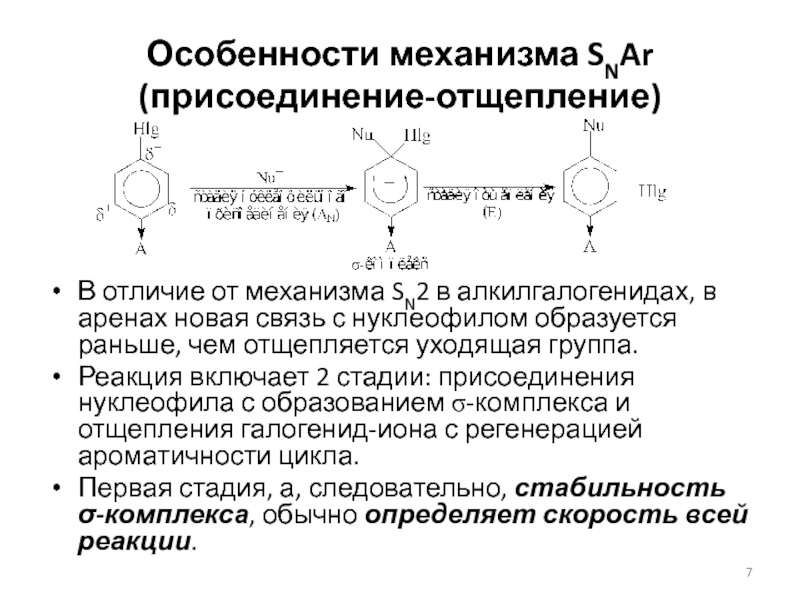
Слайд 7Особенности механизма SNAr (присоединение-отщепление)
В отличие от механизма SN2 в алкилгалогенидах,
в аренах новая связь с нуклеофилом образуется раньше, чем отщепляется
уходящая группа.
Реакция включает 2 стадии: присоединения нуклеофила с образованием s-комплекса и отщепления галогенид-иона с регенерацией ароматичности цикла.
Первая стадия, а, следовательно, стабильность -комплекса, обычно определяет скорость всей реакции.
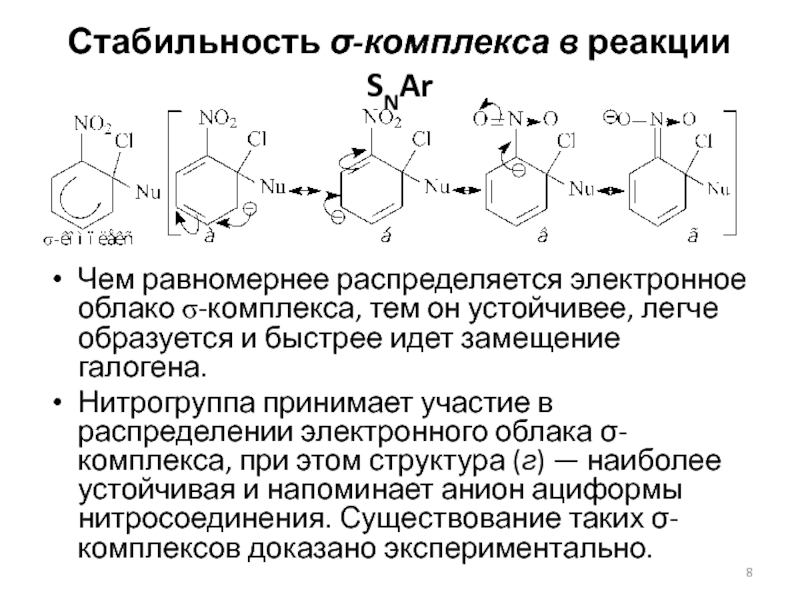
Слайд 8Стабильность -комплекса в реакции SNAr
Чем равномернее распределяется электронное облако s-комплекса,
тем он устойчивее, легче образуется и быстрее идет замещение галогена.
Нитрогруппа принимает участие в распределении электронного облака -комплекса, при этом структура (г) — наиболее устойчивая и напоминает анион ациформы нитросоединения. Существование таких -комплексов доказано экспериментально.
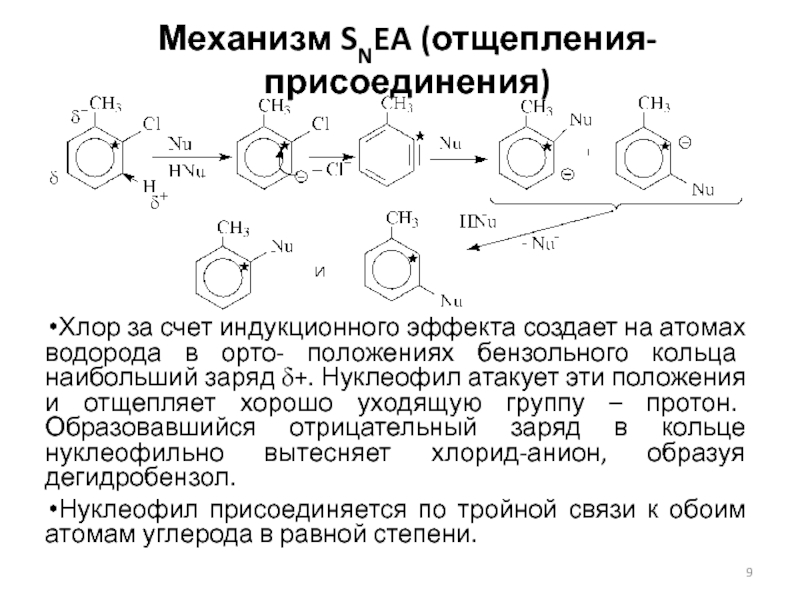
Слайд 9Механизм SNEA (отщепления-присоединения)
Хлор за счет индукционного эффекта создает на атомах
водорода в орто- положениях бензольного кольца наибольший заряд d+. Нуклеофил
атакует эти положения и отщепляет хорошо уходящую группу – протон. Образовавшийся отрицательный заряд в кольце нуклеофильно вытесняет хлорид-анион, образуя дегидробензол.
Нуклеофил присоединяется по тройной связи к обоим атомам углерода в равной степени.
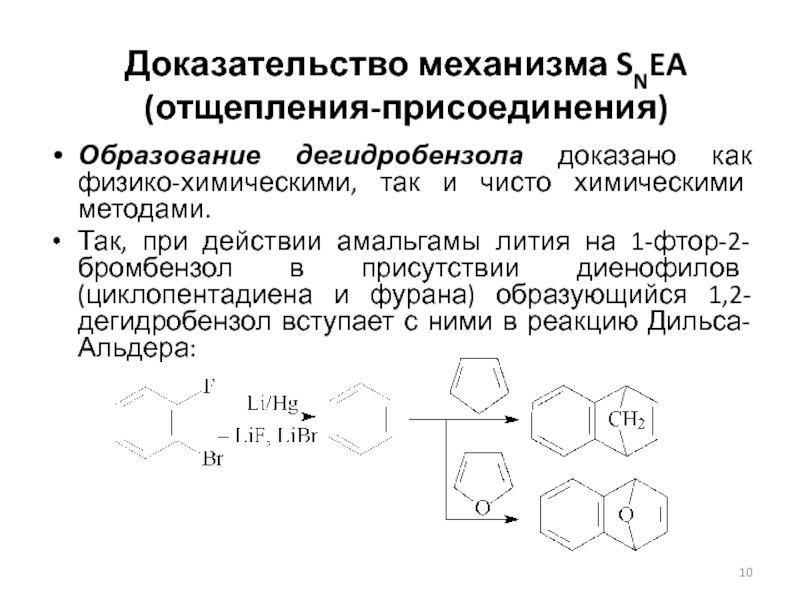
Слайд 10Доказательство механизма SNEA (отщепления-присоединения)
Образование дегидробензола доказано как физико-химическими, так и
чисто химическими методами.
Так, при действии амальгамы лития на 1-фтор-2-бромбензол
в присутствии диенофилов (циклопентадиена и фурана) образующийся 1,2-дегидробензол вступает с ними в реакцию Дильса-Альдера:
Слайд 11Влияние строения алифатического субстрата на механизм замещения галогена
Увеличение разветвленности
радикала создаёт стерические препятствия для прямой нуклеофильной атаки и увеличивает
стабильность промежуточного карбкатиона, поэтому при переходе от первичного алкилгалогенида к третичному в одних и тех же условиях механизм реакции изменяется от бимолекулярного до мономолекулярного.
Этот процесс не является резким и зависит от ряда конкретных условий. Принципиально возможно протекание реакции по двум механизмам одновременно.
Слайд 12Влияние аллил- и бензилгалогенидов на механизм замещения галогена
Первичные аллил-
и бензилгалогениды образуют очень устойчивые карбокатионы и легко реагируют как
по SN1, так и по SN2 механизму (преимущественно реализуется SN1-механизм). Разветвленные радикалы – только по SN1-механизму.
При этом возможна аллильная перегруппировка. Если для первичных аллилгалогенидов создать условия для SN2 механизма, она не имеет место:
Слайд 13Влияние строения ароматического субстрата на механизм замещения галогена
электроноакцепторные заместители
в орто-, пара-положениях способствуют замещению галогена по механизму SNAr (через
присоединение-отщепление);
электронодонорные — направляют реакцию по механизму SNEA (отщепления-присоединения), через дегидробензол.
Слайд 14Влияние строения алифатического субстрата на скорость SN1 реакции
- Скорость SN1
реакции алкилгалогенидов возрастает по мере увеличения устойчивости карбкатиона в ряду
от метилгалогенида к первичному, вторичному, третичному, аллильному и бензильному
- Находящиеся в α-положении к реакционному центру предельные, фенильные и винильные радикалы, а также атомы, имеющие неподеленную пару электронов, способствуют распределению электронного облака частицы, стабилизируют катион и ускоряют реакцию.
Слайд 15Влияние строения алифатического субстрата на скорость SN2 реакции
Скорость SN2 реакции
алкилгалогенидов возрастает в прямо противоположном направлении, наблюдаемом при SN1 замещении,
если не учитывать наибольшую активность первичных аллил- и бензилгалогенидов.
Метильные и первичные галогениды реагируют очень гладко, вторичные — значительно хуже, а третичные часто не реагируют вообще, что объясняется, в основном, пространственными препятствиями для атаки нуклеофила, которые играют в SN2 замещении важную роль.
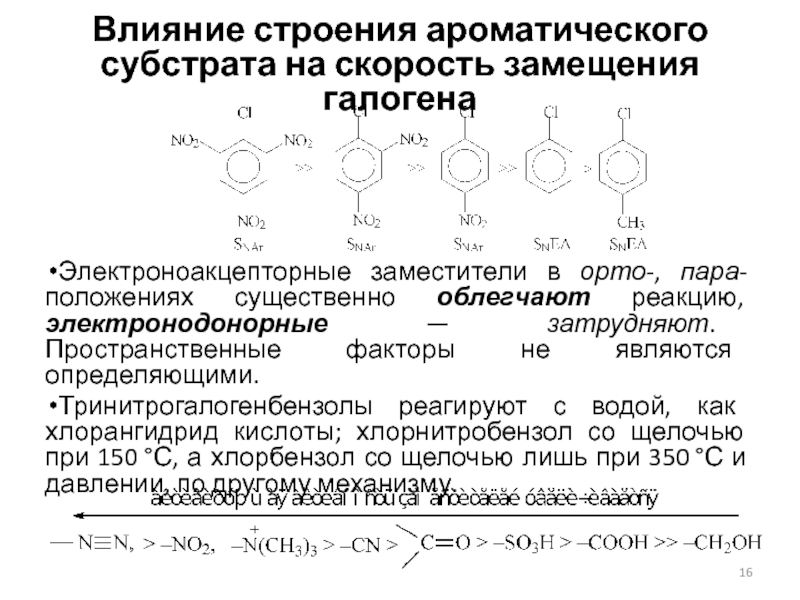
Слайд 16Влияние строения ароматического субстрата на скорость замещения галогена
Электроноакцепторные заместители в
орто-, пара-положениях существенно облегчают реакцию, электронодонорные — затрудняют. Пространственные факторы
не являются определяющими.
Тринитрогалогенбензолы реагируют с водой, как хлорангидрид кислоты; хлорнитробензол со щелочью при 150 °С, а хлорбензол со щелочью лишь при 350 °С и давлении, по другому механизму.
Слайд 17Влияние галогена на реакционную способность галогенидов
- Галоген является уходящей группой
и акцептором электронов. Способность галогена «уходить» уменьшается (снижается стабильность аниона),
а электроноакцепторные свойства, наоборот, увеличивается в ряду:
- В алкилгалогенидах большее значение имеет способность группы уходить, и реакционная способность их уменьшается в ряду: RI > RBr > RCl > RF.
- В галогенаренах величина положительного заряда реакционного центра зависит не только от заместителей в ядре, но и от электроотрицательности замещаемого галогена. Поэтому их реакционная способность возрастает в ряду ArI < ArBr < ArCl < ArF.
Слайд 18Влияние нуклеофила на реакцию
чем выше нуклеофильность (активность) реагента, тем вероятнее
механизм SN2, слабые нуклеофилы способствуют протеканию реакции по механизму SN1;
при
повышении активности нуклеофила скорость реакций SN2, SNAr и SNEA увеличивается, а SN1 — не меняется;
при увеличении силы нуклеофила возрастает вероятность побочных реакций (например, реакции элиминирования), особенно в реакциях, реализующих механизм SN1.
На практике часто приходится сравнивать нуклеофильность частиц, но она зависит от многих факторов и невозможно построить некий постоянный ряд их активности. Так, в протонных растворителях нуклеофильность анионов Hlg– увеличивается от фторида к иодиду, а в апротонных — наоборот.
Слайд 19Влияние растворителя на нуклеофильное замещение
- столь велико, что часто определяет
механизм реакции.
Полярные протонные растворители (вода, спирты, аммиак, карбоновые кислоты)
способствуют SN1 механизму, т.к. они сольватируют и ускоряют диссоциацию алкилгалогенида и стабилизируют ионы.
С увеличением полярности и кислотности растворителя скорость SN1 реакции увеличивается. Многие процессы, протекающие в апротонных растворителях по SN2 механизму, в растворах минеральных кислот идут по SN1 механизму.
Апротонные нуклеофильные растворители (ацетон, ацетонитрил, диметилсульфоксид и др.), сольватируют главным образом катион и способствуют SN2 механизму.
Они не содействуют диссоциации галогенида, но отсутствие сольватации увеличивает активность нуклеофила.
Слайд 20Выбор растворителя для SN2 реакции
Необходимо учитывать:
распределение зарядов в
переходном состоянии. Если оно полярнее исходных реагентов, повышение полярности растворителя
увеличивает скорость реакции, и наоборот (теория Хьюза - Ингольда):
специфическую сольватацию нуклеофила, которая уменьшает активность атакующей частицы.
растворяющую способность растворителя по отношению к реагенту и субстрату. Применяют растворители, которые проявляют липофильные и гидрофильные свойства (метанол, ацетон, диоксан); их смеси с водой; диполярные, апротонные диметилсульфоксид, диметилформамид.
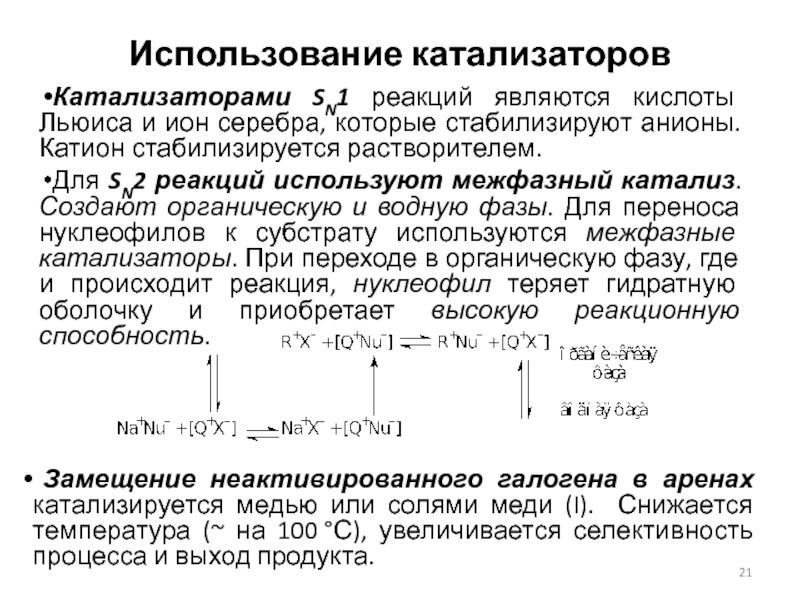
Слайд 21Использование катализаторов
Катализаторами SN1 реакций являются кислоты Льюиса и ион серебра,
которые стабилизируют анионы. Катион стабилизируется растворителем.
Для SN2 реакций используют межфазный
катализ. Создают органическую и водную фазы. Для переноса нуклеофилов к субстрату используются межфазные катализаторы. При переходе в органическую фазу, где и происходит реакция, нуклеофил теряет гидратную оболочку и приобретает высокую реакционную способность.
Замещение неактивированного галогена в аренах катализируется медью или солями меди (I). Снижается температура (~ на 100 °С), увеличивается селективность процесса и выход продукта.
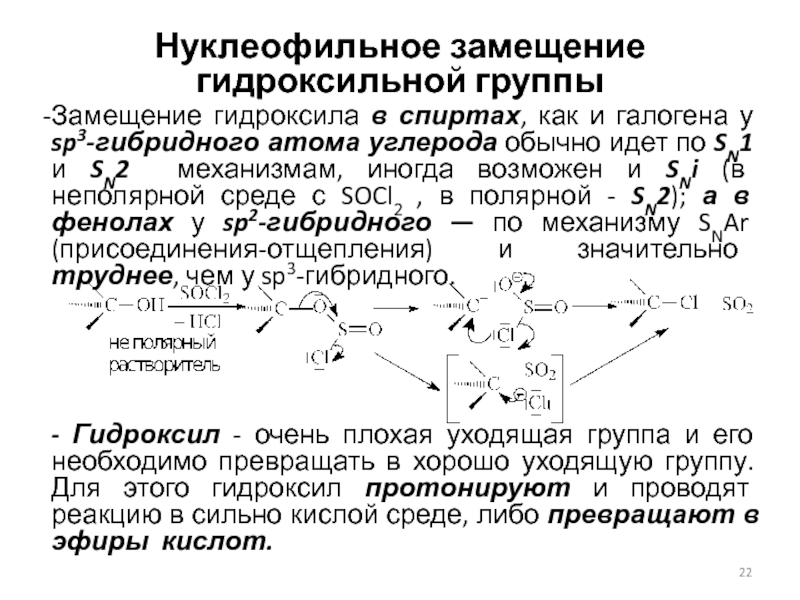
Слайд 22Нуклеофильное замещение гидроксильной группы
Замещение гидроксила в спиртах, как и галогена
у sp3-гибридного атома углерода обычно идет по SN1 и SN2
механизмам, иногда возможен и SNi (в неполярной среде с SOCl2 , в полярной - SN2); а в фенолах у sp2-гибридного — по механизму SNAr (присоединения-отщепления) и значительно труднее, чем у sp3-гибридного.
- Гидроксил - очень плохая уходящая группа и его необходимо превращать в хорошо уходящую группу. Для этого гидроксил протонируют и проводят реакцию в сильно кислой среде, либо превращают в эфиры кислот.
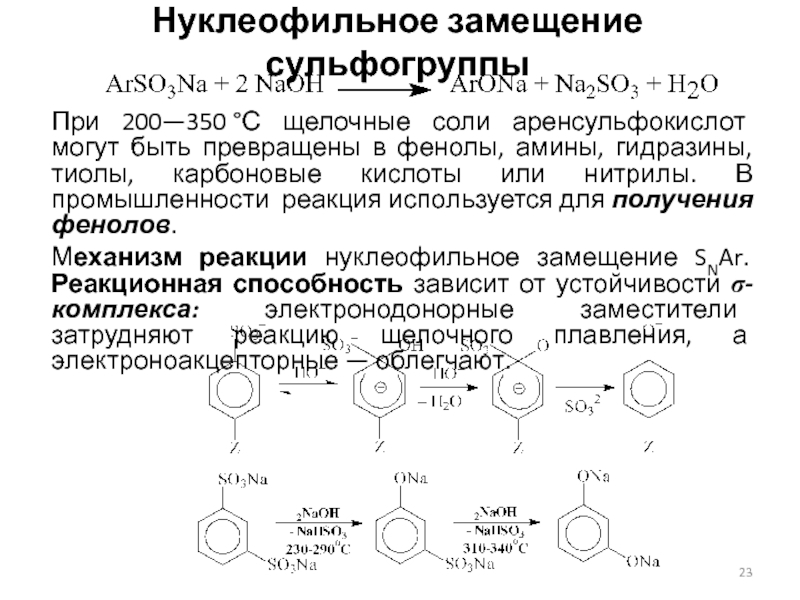
Слайд 23Нуклеофильное замещение сульфогруппы
При 200—350 °С щелочные соли аренсульфокислот могут быть превращены
в фенолы, амины, гидразины, тиолы, карбоновые кислоты или нитрилы. В
промышленности реакция используется для получения фенолов.
Механизм реакции нуклеофильное замещение SNAr. Реакционная способность зависит от устойчивости s-комплекса: электронодонорные заместители затрудняют реакцию щелочного плавления, а электроноакцепторные — облегчают.
Слайд 24Самостоятельно
Гидролиз галогенидов
Получение простых эфиров
Получение тиоспиртов, тиоэфиров
Получение аминов
Получение цианидов
Получение сульфокислот
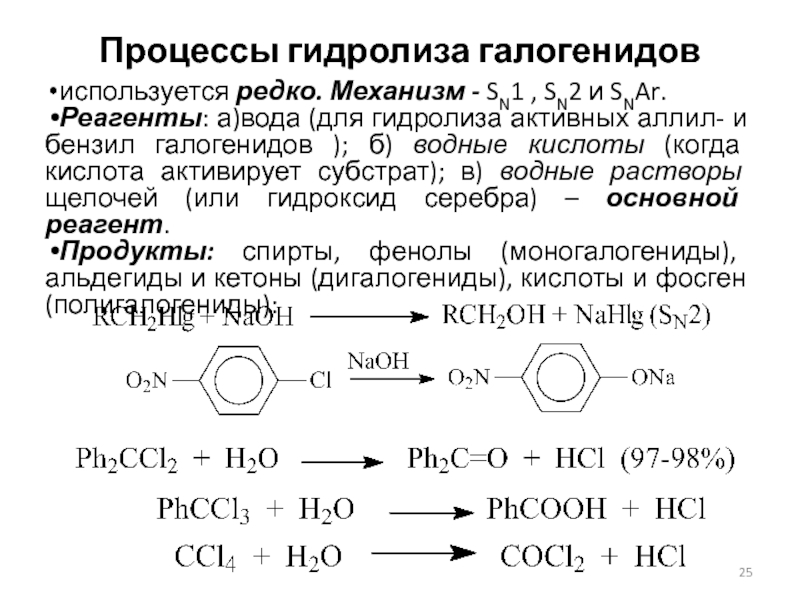
Слайд 25Процессы гидролиза галогенидов
используется редко. Механизм - SN1 , SN2 и
SNAr.
Реагенты: а)вода (для гидролиза активных аллил- и бензил галогенидов
); б) водные кислоты (когда кислота активирует субстрат); в) водные растворы щелочей (или гидроксид серебра) – основной реагент.
Продукты: спирты, фенолы (моногалогениды), альдегиды и кетоны (дигалогениды), кислоты и фосген (полигалогениды):
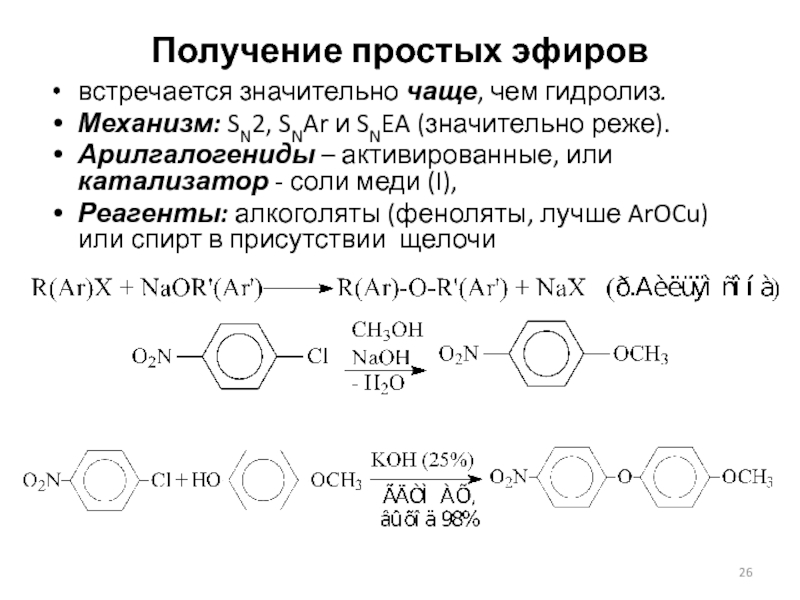
Слайд 26Получение простых эфиров
встречается значительно чаще, чем гидролиз.
Механизм: SN2, SNAr
и SNEA (значительно реже).
Арилгалогениды – активированные, или катализатор - соли
меди (I),
Реагенты: алкоголяты (феноляты, лучше ArOCu) или спирт в присутствии щелочи
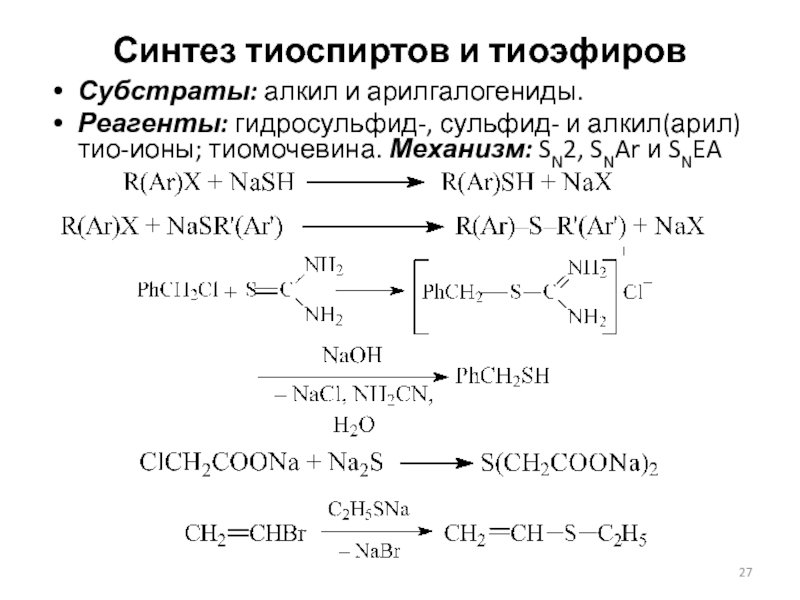
Слайд 27Синтез тиоспиртов и тиоэфиров
Субстраты: алкил и арилгалогениды.
Реагенты: гидросульфид-, сульфид-
и алкил(арил)тио-ионы; тиомочевина. Механизм: SN2, SNAr и SNEA
Слайд 28Замена атома галогена на аминогруппы
Особенности реакций неактивированных галогенаренов с аммиаком
и аминами (механизм, условия реакции, катализаторы)
Особенности реакций активированных галогенаренов с
аммиаком и аминами (механизм, условия реакции, катализаторы)
Надо знать:
особенности реакции первичных, вторичных и третичных алкилгалогенидов с аммиаком и аминами (механизм, условия реакции, полиалкилирование, выход, побочные реакции). Селективные методы получения аминов (из сульфамидов, реакция Габриэля, из азометинов).
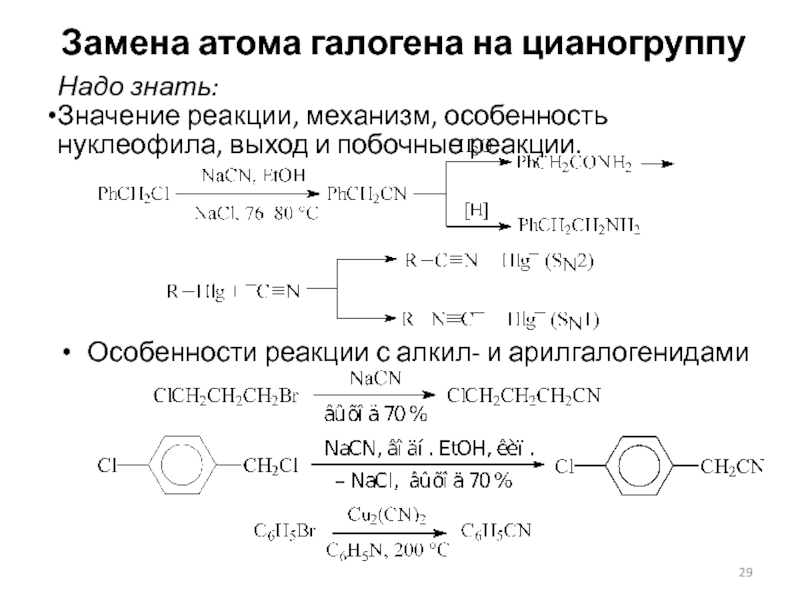
Слайд 29Замена атома галогена на цианогруппу
Особенности реакции с алкил- и арилгалогенидами
Надо
знать:
Значение реакции, механизм, особенность нуклеофила, выход и побочные реакции.
Слайд 30Замена атома галогена на группу -SO3Na
Реагенты в реакции Штреккера -
сульфиты калия и натрия
Механизм реакции SN2 или SNAr,
поэтому в
случае использования первичных алкилгалогенидов выходы сульфокислот составляют 70—90 %, вторичных— 20—25 %. Третичные алкилгалогениды превращаются в олефины.