Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
О Б Щ А Я ИММУНОЛОГИЯ
Содержание
- 1. О Б Щ А Я ИММУНОЛОГИЯ
- 2. Иммунология – наука об иммунитете; изучает
- 3. Иммунитет – способ защиты организма от генетически
- 4. Слайд 4
- 5. Слайд 5
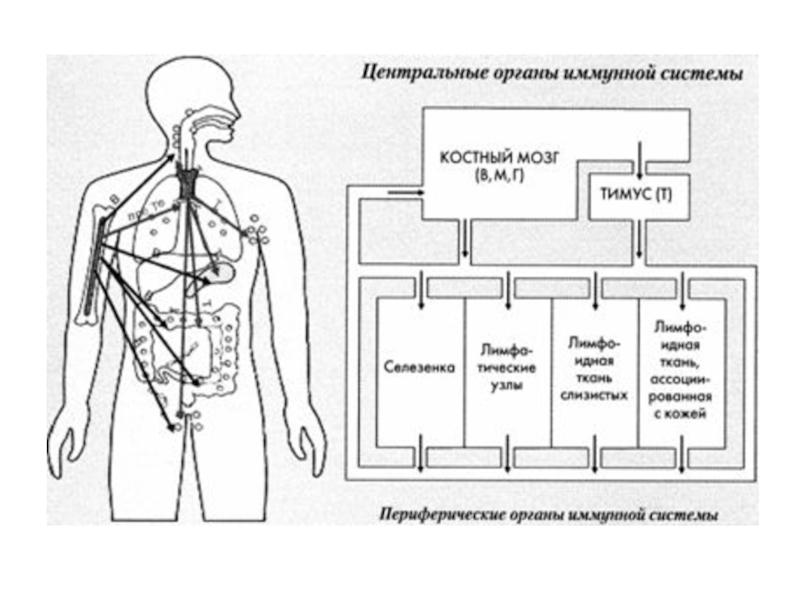
- 6. Органы иммунной системы: ● Центральные: костный мозг-
- 7. Слайд 7
- 8. Слайд 8
- 9. Антигены- вещества, несущие признаки генетической чужеродности и
- 10. ● Иммуногенность зависит от молекулярного веса, подвижности
- 11. ● Специфичность антигенов зависит от особых участков
- 12. ● Антигенными свойствами обладают жгутики, капсула, клеточная
- 13. Основные типы антигенной специфичности (зависят от специфичности
- 14. ● Аутоантигены - вещества организма, к которым
- 15. Клетки иммунной системы:
- 16. Слайд 16
- 17. Слайд 17
- 18. Слайд 18
- 19. СТАДИИ ФАГОЦИТОЗА 1.
- 20. И.И. Мечников (1845-1916) лауреат Нобелевской премии (1908)Фагоцитоз.
- 21. Слайд 21
- 22. Слайд 22
- 23. Молекула антител имеет Y- образную форму и
- 24. Слайд 24
- 25. Основные биологические характеристики антител.1. Специфичность - способность
- 26. Характеристика основных классов иммуноглобулиновIg G. Мономеры, включают
- 27. IgM- антитела преимущественно к антигенам грамотрицательных бактерий,
- 28. IgA. Выделяют сывороточные IgA (мономер) и секреторные
- 29. Кооперация клеток в иммунном ответеВ формировании иммунного
- 30. Клетки иммунной памяти. Поддержание долгоживущих и метаболически
- 31. Первичный и вторичный иммунный ответ.Первичный ответ- при
- 32. I. Классификация в зависимости от природы антигена
- 33. Неинфекционный иммунитет:Трансплантационный иммунитет – возникает при пересадке
- 34. II. Классификация видов иммунитета в зависимости от
- 35. Естественный активный иммунитет – это постинфекционный иммунитет.Естественный
- 36. Классификация иммунитета по распространённости Общий – обусловлен
- 37. КЛАССИФИКАЦИЯ ИММУНИТЕТА ПО ПРОИСХОЖДЕНИЮ
- 38. Слайд 38
- 39. Слайд 39
- 40. ФАКТОРЫ ВРОЖДЁННОГО ИММУНИТЕТА1) Внешние барьеры; 2)
- 41. Внутренние барьеры лимфатические узлы, лимфатические сосуды; гисто-гематические
- 42. Нормальная микрофлора организма(включающая непатогенные и условно-патогенные микроорганизмы)участвует
- 43. NK – клетки (Natural killers) факторы
- 44. Слайд 44
- 45. Фагоцитоз: 1) завершённый и 2) незавершенный При
- 46. ФУНКЦИИ ФАГОЦИТОВ
- 47. Макрофаги выполняют функции:Фагоцитоз (поглощение и уничтожение),Презентация антигена
- 48. Г у м о р а л
- 49. КОМПЛЕМЕНТОМ (С1-9) называют сложную систему белков сыворотки
- 50. Функции компонентов комплемента
- 51. АКТИВАЦИЯ СИСТЕМЫ КОМПЛЕ-МЕНТА
- 52. КАСКАДНЫЙ МЕХАНИЗМ АКТИВАЦИИ КОМПЛЕМЕНТА
- 53. СИСТЕМА ЛАКТОПЕРОКСИДАЗЫ включает 3 компонента:ЛП (фермент лактопероксидаза
- 54. ЛИЗОЦИМ – фермент расщепляющий 1-4β-гликозидные связи
- 55. БЕЛКИ ОСТРОЙ ФАЗЫ – обладают антимикробным действием,
- 56. Церуллоплазмин – белок, связывающий медь, бактериостатическое действиеБелки
- 57. Слайд 57
- 58. Слайд 58
- 59. Гиперчувствительность - специфическая нежелательная повышенная реакция на
- 60. АЛЛЕРГЕН – антиген, вызывающий развитие реакции гиперчувствительностиИнфекционные
- 61. Аллергия (от греч allos -
- 62. I тип — анафилактический.
- 63. II тип — цитотоксический.
- 64. IV тип - гиперчувствительность
- 65. Иммунологическая толерантность - отсутствие иммунного ответа при
- 66. Искусственная иммунологическая толерантность возможна при введении чужеродных
- 67. Типы гиперчувствительности и соответствующие им аллергические и некоторые инфекционные болезни
- 68. Особенности противогрибкового иммунитета Антигены грибов имеют относительно
- 69. Особенности противовирусного иммунитетаФакторы клеточного иммунитета (как врожденного,
- 70. ИнтерфероныРазличают три вида интерферонов (ИФ): -ИФ, -ИФ,
- 71. МЕХАНИЗМ ДЕЙСТВИЯ α-, β-ИНТЕРФЕРОНОВ
- 72. Особенности иммунитета при протозойных инвазияхГуморальные факторы определяют
- 73. Простейшие в процессе эволюции выработали множество механизмов
- 74. Особенности противоглистного иммунитета Ведущую роль в осуществлении
- 75. Противоопухолевый иммунитетОсобенности ПОИ связанны с низкой иммуногенностью
- 76. Вирусные опухольассоциированные антигены, по сути, являются белками
- 77. Механизм противоопухолевого иммунитета до сих пор слабо
- 78. Комбинация опухолевых маркеров согласно предполагаемому виду злокачественного заболевания
- 79. Иммунологическая память – способность организма давать ускоренную
- 80. Отличия в динамике образования иммуноглобулинов при иммунном
- 81. Клонально-селекционная теория (Ф. Бернет, 1959, С.
- 82. Основные положения клонально-селекционной теории Ф. БернетаВ организме
- 83. Скачать презентанцию
Слайды и текст этой презентации
Слайд 3Иммунитет – способ защиты организма от генетически чужеродных веществ (экзогенного
и эндогенного происхождения), направленный на поддержание и сохранение гомеостаза, то
есть структурной и функциональной целостности организма, биологической (антигенной) индивидуальности каждого организма и вида в целом.Слайд 6Органы иммунной системы:
● Центральные: костный мозг- кроветворный орган, вилочковая
железа (тимус), лимфоидная ткань кишечника- осуществляют образование и созревание иммунокомпетентных
клеток.● Периферические: селезенка, лимфатические узлы, скопления лимфоидной ткани в собственном слое слизистых оболочек кишечного типа - обеспечивают адекватный иммунный ответ на антигенную стимуляцию- “обработку” антигена, его распознавание и клональную пролиферацию лимфоцитов (антиген- зависимую дифференцировку).
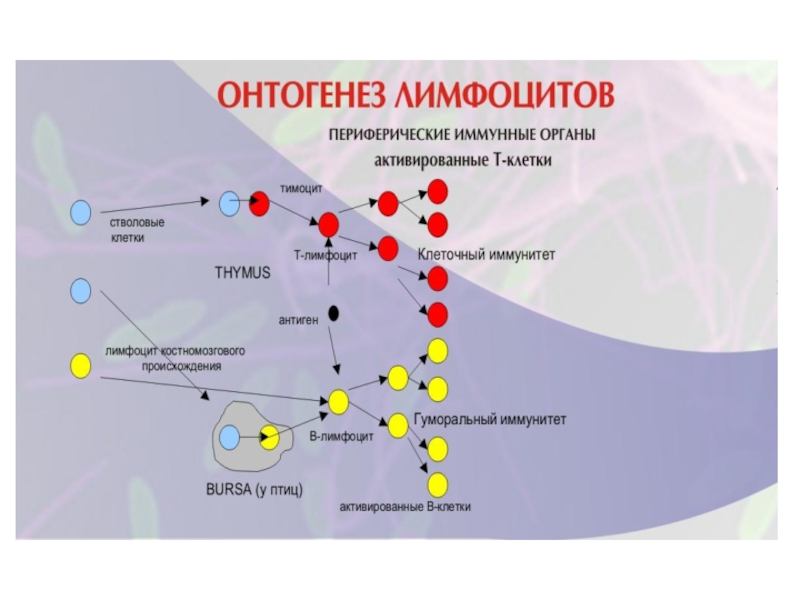
● Иммунокомпетентные клетки продуцируются костным мозгом как клетки- предшественники, которые становятся лимфоцитами.
● Лимфоциты подразделяют на два класса- Т и В.
Предшественники Т- лимфоцитов мигрируют в тимус, где созревают в клетки, способные участвовать в иммунном ответе.
У человека В- лимфоциты созревают в костном мозге (у птиц в сумке Фабрициуса - бурса).
Зрелые В- и Т- лимфоциты заселяют периферические лимфоузлы.
Слайд 9Антигены- вещества, несущие признаки генетической чужеродности и вызывающие развитие иммунных
реакций
● Свойства антигенов:
- чужеродность,
- иммуногенность - способность вызывать
иммунный ответ,
- антигенность - способность АГ избирательно взаимодействовать со специфическими антителами или антиген- распознающими рецепторами лимфоцитов.
Антигенами могут быть белки, полисахариды и нуклеиновые кислоты в комбинации между собой или липидами. Наибольшей иммуногенностью обладают белковые антигены (бактериальные экзотоксины, вирусная нейраминидаза).● Полные антигены всегда проявляют иммуногенные и антигенные свойства.
● Неполные (гаптены) - не способны самостоятельно вызывать иммунный ответ.
Гаптены обладают антигенностью, что обусловливает их специфичность, способность избирательно взаимодействовать с антителами или рецепторами лимфоцитов, определяться иммунологическими реакциями.
Гаптены могут стать иммуногенными (полными) при связывании с иммуногенным носителем- белком (шлеппер).
За специфичность антигена отвечает гаптенная часть, за иммуногенность – носитель
Слайд 10● Иммуногенность зависит от молекулярного веса, подвижности молекул антигена, формы,
структуры, способности к изменению, степени гетерогенности антигена (чужеродность для макроорганизма),
степени эволюционной дивергенции молекул, уникальности и необычности структуры.● Чужеродность определяется молекулярной массой, размерами и строением биополимера, его макромолекулярностью и жесткостью структуры.
● Наиболее иммуногены - белки и другие высокомолекулярные вещества с более высоким молекулярным весом.
● Жесткость структуры связана с наличием ароматических колец в составе аминокислотных последовательностей.
● Антигенность белков является проявлением их чужеродности, а специфичность зависит от аминокислотной последовательности белков, вторичной, третичной и четвертичной (от общей конформации белковой молекулы) структуры, от поверхностно расположенных детерминантных групп и концевых аминокислотных остатков.
Последовательность аминокислот в полипептидных цепочках- генетически детерминированный признак.
● Коллоидное состояние и растворимость - обязательные свойства антигенов.
Слайд 11● Специфичность антигенов зависит от особых участков молекул белков и
полисахаридов - эпитопов.
Эпитопы или антигенные детерминанты- фрагменты молекул антигена,
вызывающие иммунный ответ и определяющие его специфичность. Антигенные детерминанты избирательно реагируют с антителами или антиген-распознающими рецепторами клетки. ● Структура многих антигенных детерминант известна. У белков это обычно фрагменты из 8- 20 выступающих на поверхности аминокислотных остатков, у полисахаридов- выступающие О- боковые дезоксисахаридные цепи в составе ЛПС, у вируса гриппа- гемагглютинин, у вируса иммунодефицита человека- мембранный гликопептид.
● Эпитопы качественно отличаются, к каждому образовываются “свои” антитела.
Антигены, содержащие одну антигенную детерминанту - моновалентные, ряд эпитопов- поливалентные.
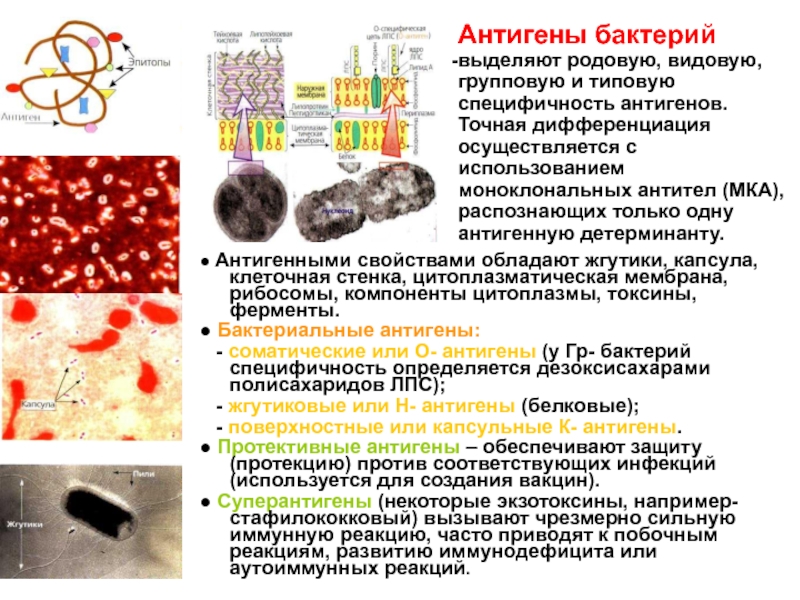
Слайд 12● Антигенными свойствами обладают жгутики, капсула, клеточная стенка, цитоплазматическая мембрана,
рибосомы, компоненты цитоплазмы, токсины, ферменты.
● Бактериальные антигены:
- соматические
или О- антигены (у Гр- бактерий специфичность определяется дезоксисахарами полисахаридов ЛПС);- жгутиковые или Н- антигены (белковые);
- поверхностные или капсульные К- антигены.
● Протективные антигены – обеспечивают защиту (протекцию) против соответствующих инфекций (используется для создания вакцин).
● Суперантигены (некоторые экзотоксины, например- стафилококковый) вызывают чрезмерно сильную иммунную реакцию, часто приводят к побочным реакциям, развитию иммунодефицита или аутоиммунных реакций.
Антигены бактерий
выделяют родовую, видовую, групповую и типовую специфичность антигенов.
Точная дифференциация осуществляется с использованием моноклональных антител (МКА), распознающих только одну антигенную детерминанту.
Слайд 13Основные типы антигенной специфичности
(зависят от специфичности эпитопов)
1. Видовая- характерна
для всех особей одного вида (общие эпитопы).
2. Групповая- внутри вида
(изоантигены, которые характерны для отдельных групп, пример- группы крови АВО).3. Гетероспецифичность - наличие общих антигенных детерминант у организмов различных таксономических групп. Имеются перекрестно- реагирующие антигены у бактерий и тканей макроорганизма.
а. Антиген Форсмана- типичный перекрестно- реагирующий антиген, выявлен в эритроцитах кошек, собак, овец, почке морской свинки.
б. Rh- система эритроцитов. У человека Rh- антигены агглютинируют антитела к эритроцитам обезьян Macacus rhesus.
в. Известны общие антигенные детерминанты эритроцитов человека и палочки чумы, вирусов оспы и гриппа.
г. Белок А стрептококка и ткани миокарда (клапанный аппарат).
● Антигенная мимикрия - обманывает иммунную систему, защищает микроорганизмы от ее воздействия, блокируя системы, распознающие чужеродные структуры.
4. Патологическая. При патологических изменениях тканей происходят изменения химических соединений и изменяет нормальную антигенную специфичность (“ожоговые”, “лучевые”, “раковые” антигены с измененной видовой специфичностью).
Слайд 14● Аутоантигены - вещества организма, к которым могут возникать иммунные
реакции (аутоиммунные реакции), направленные против определенных тканей организма.
Это относится к органам и тканям, в норме не подвергающихся воздействию иммунной системы в связи с наличием барьеров (мозг, хрусталик, паращитовидные железы).5. Стадиоспецифичность - антигены, характерные для определенных стадий развития, связанные с морфогенезом (альфа- фетопротеин характерен для эмбрионального развития, синтез во взрослом состоянии резко увеличивается при раковых заболеваниях печени).
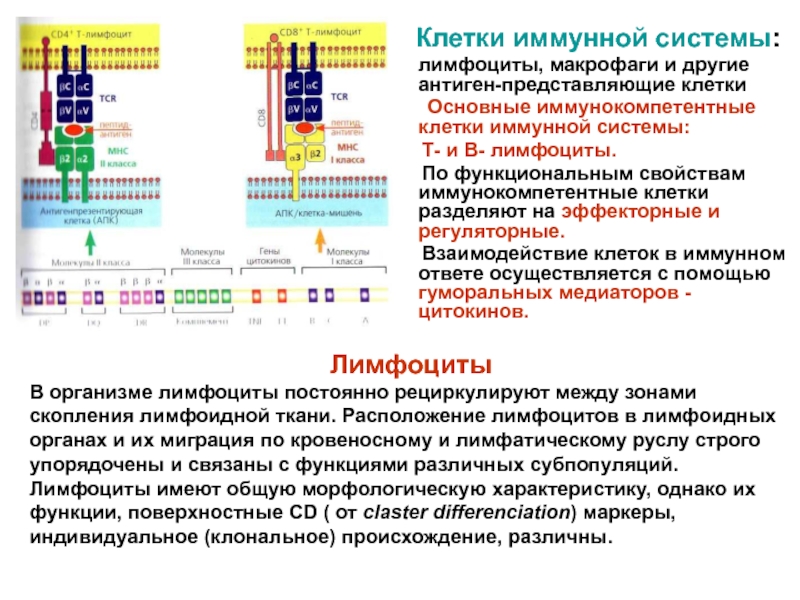
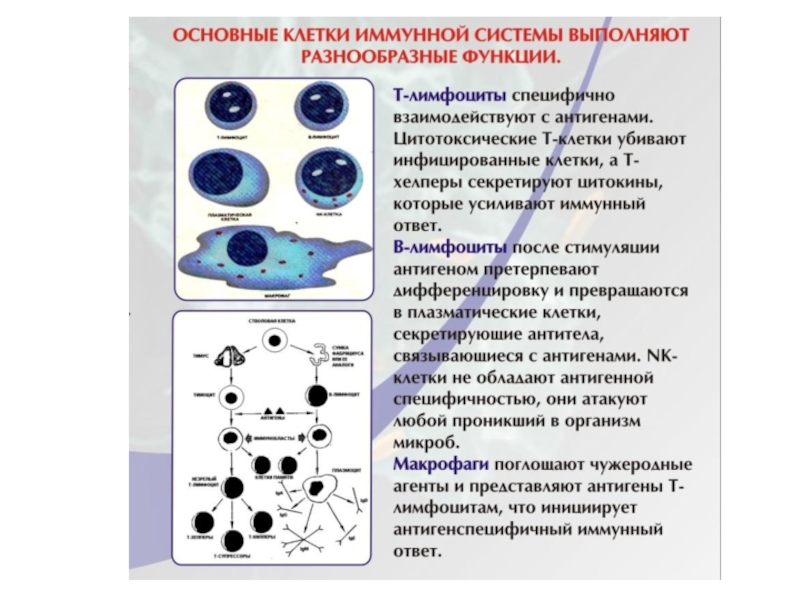
Слайд 15 Клетки иммунной системы:
лимфоциты, макрофаги и
другие антиген-представляющие клетки
Основные иммунокомпетентные клетки иммунной
системы: Т- и В- лимфоциты.
По функциональным свойствам иммунокомпетентные клетки разделяют на эффекторные и регуляторные.
Взаимодействие клеток в иммунном ответе осуществляется с помощью гуморальных медиаторов - цитокинов.
Лимфоциты
В организме лимфоциты постоянно рециркулируют между зонами скопления лимфоидной ткани. Расположение лимфоцитов в лимфоидных органах и их миграция по кровеносному и лимфатическому руслу строго упорядочены и связаны с функциями различных субпопуляций.
Лимфоциты имеют общую морфологическую характеристику, однако их функции, поверхностные CD ( от claster differenciation) маркеры, индивидуальное (клональное) происхождение, различны.
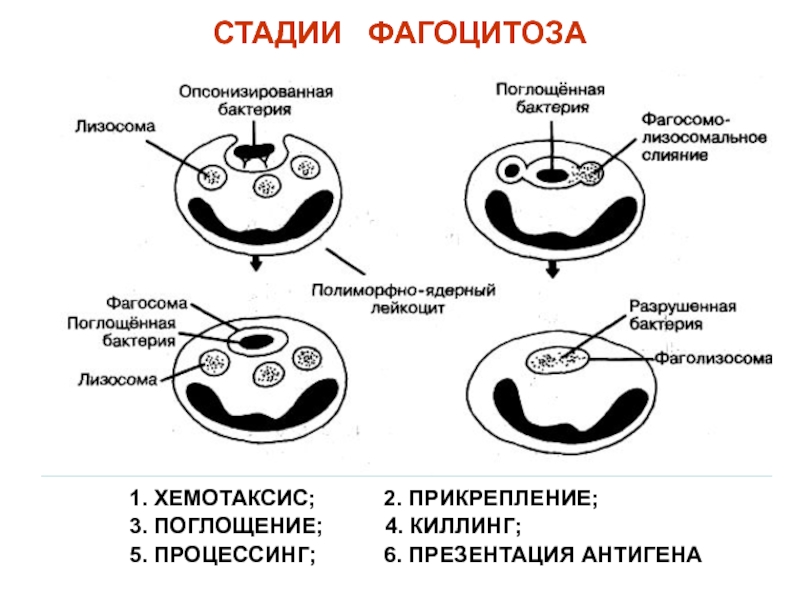
Слайд 19СТАДИИ ФАГОЦИТОЗА
1. ХЕМОТАКСИС;
2. ПРИКРЕПЛЕНИЕ;
3.
ПОГЛОЩЕНИЕ; 4. КИЛЛИНГ; 5. ПРОЦЕССИНГ; 6. ПРЕЗЕНТАЦИЯ АНТИГЕНА
Слайд 20И.И. Мечников (1845-1916) лауреат Нобелевской премии (1908)
Фагоцитоз. Зарисовка поглощения бактерий
микрофагами (полиморфно-ядерными лейкоцитами) морской свинки, сделанная И.И. Мечниковым. Клетки эффективно
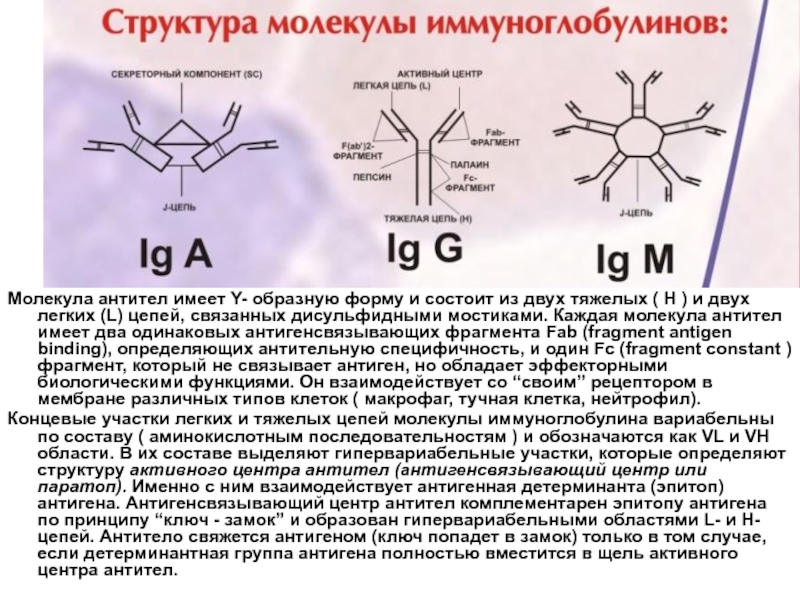
поглощают Proteus vulgaris, но не капсулированные стрептококки (находятся вне фагоцитов).Слайд 23Молекула антител имеет Y- образную форму и состоит из двух
тяжелых ( Н ) и двух легких (L) цепей, связанных
дисульфидными мостиками. Каждая молекула антител имеет два одинаковых антигенсвязывающих фрагмента Fab (fragment antigen binding), определяющих антительную специфичность, и один Fc (fragment constant ) фрагмент, который не связывает антиген, но обладает эффекторными биологическими функциями. Он взаимодействует со “своим” рецептором в мембране различных типов клеток ( макрофаг, тучная клетка, нейтрофил).Концевые участки легких и тяжелых цепей молекулы иммуноглобулина вариабельны по составу ( аминокислотным последовательностям ) и обозначаются как VL и VH области. В их составе выделяют гипервариабельные участки, которые определяют структуру активного центра антител (антигенсвязывающий центр или паратоп). Именно с ним взаимодействует антигенная детерминанта (эпитоп) антигена. Антигенсвязывающий центр антител комплементарен эпитопу антигена по принципу “ключ - замок” и образован гипервариабельными областями L- и Н- цепей. Антитело свяжется антигеном (ключ попадет в замок) только в том случае, если детерминантная группа антигена полностью вместится в щель активного центра антител.
Слайд 25Основные биологические характеристики антител.
1. Специфичность - способность взаимодействия с определенным
(своим) антигеном (соответствие эпитопа антигена и активного центра антител).
2. Валентность-
количество способных реагировать с антигеном активных центров ( это связано с молекулярной организацией- моно- или полимер). Иммуноглобулины могут быть двухвалентными ( IgG ) или поливалентными (пентамер IgM имеет 10 активных центров). Двух- и более валентные антитела навывают полными антителами. Неполные антитела имеют только один участвующий во взаимодействии с антигеном активный центр ( блокирующий эффект на иммунологические реакции, например, на агглютинационные тесты). Их выявляют в антиглобулиновой пробе Кумбса, реакции угнетения связывания комплемента. 3. Афинность - прочность связи между эпитопом антигена и активным центром антител, зависит от их пространственного соответствия.
4. Авидность - интегральная характеристика силы связи между антигеном и антителами, с учетом взаимодействия всех активных центров антител с эпитопами. Поскольку антигены часто поливалентны, связь между отдельными молекулами антигена осуществляется с помощью нескольких антител.
5. Гетерогенность - обусловлена антигенными свойствами антител
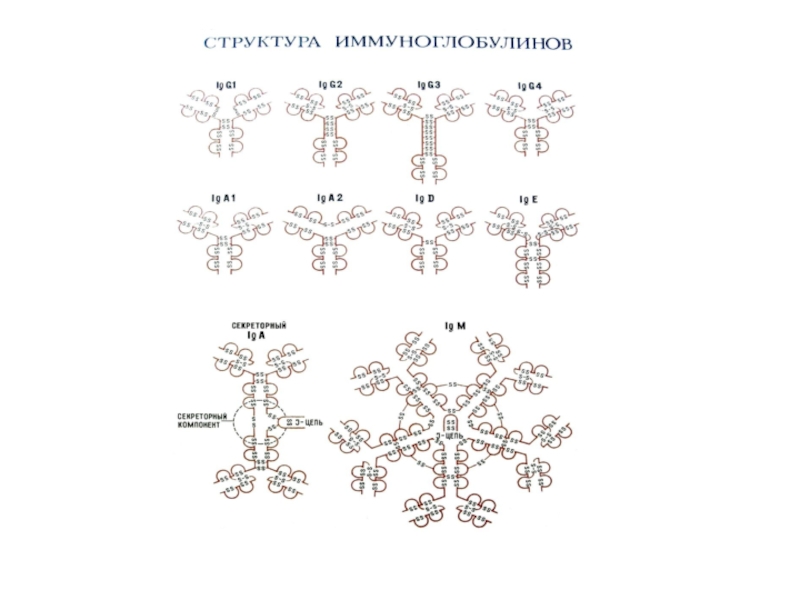
Слайд 26Характеристика основных классов иммуноглобулинов
Ig G. Мономеры, включают четыре субкласса. Концентрация
в крови- от 8 до 17 г/л, период полураспада- около
3- 4 недель.Это основной класс иммуноглобулинов, защищающих организм от бактерий, токсинов и вирусов.
В наибольшем количестве IgG- антитела вырабатываются на стадии выздоровления после инфекционного заболевания (поздние или 7S антитела), при вторичном иммунном ответе.
IgG1 и IgG4 специфически (через Fab- фрагменты) связывают возбудителей (опсонизация), благодаря Fc- фрагментам IgG взаимодействуют с Fc- рецепторам фагоцитов, способствуя фагоцитозу и лизису микроорганизмов.
IgG способны нейтрализовать бактериальные экзотоксины, связывать комплемент.
Только IgG способны транспортироваться через плаценту от матери к плоду (проходить через плацентарный барьер) и обеспечивать защиту материнскими антителами плода и новорожденного. В отличие от IgM- антител, IgG- антитела относятся к категории поздних- появляются позже и более длительно выявляются в крови.
IgM. Молекула представляет собой полимерный Ig из пяти субъединиц, соединенных дисульфидными связями и дополнительной J- цепью, имеет 10 антиген- связывающих центров.
Филогенетически это наиболее древний иммуноглобулин.
IgM- наиболее ранний класс антител, образующихся при первичном попадании антигена в организм. Наличие IgM- антител к соответствующему возбудителю свидетельствует о свежем инфицировании (текущем инфекционном процессе).
Слайд 27IgM- антитела преимущественно к антигенам грамотрицательных бактерий, жгутиковым антигенам.
IgM- основной класс иммуноглобулинов, синтезируемых у новорожденных и
младенцев. IgM у новорожденных- это показатель внутриутробного заражения (краснуха, ЦМВ, токсоплазмоз и другие внутриутробные инфекции), поскольку материнские IgM через плаценту не проходят.Концентрация IgM в крови 0,5- 2,0 г/л (ниже, чем IgG) период полураспада - около недели. IgM способны агглютинировать бактерии, нейтрализовать вирусы, активировать комплемент, активизировать фагоцитоз, связывать эндотоксины грамотрицательных бактерий.
IgM обладают большей, чем IgG авидностью (10 активных центров), аффинность (сродство к антигену) меньше, чем у IgG.
Слайд 28IgA. Выделяют сывороточные IgA (мономер) и секреторные IgA (IgAs). Сывороточные
IgA составляют 1,4- 4,2 г/л. Секреторные IgAs находятся в слюне,
пищеварительных соках, секрете слизистой носа, в молозиве. Они являются первой линией защиты слизистых, обеспечивая их местный иммунитет. IgAs состоят из Ig мономера, J-цепи и гликопротеина (секреторного компонента). Выделяют два изотипа- IgA1 преобладает в сыворотке, субкласс IgA2 - в экстраваскулярных секретах.Секреторный компонент вырабатывается эпителиальными клетками слизистых оболочек и присоединяется к молекуле IgA в момент прохождения последней через эпителиальные клетки. Он повышает устойчивость молекул IgAs к действию протеолитических ферментов. Основная роль IgA- обеспечение местного иммунитета слизистых. Они препятствуют прикреплению бактерий к слизистым, обеспечивают транспорт полимерных иммунных комплексов с IgA, нейтрализуют энтеротоксин, активируют фагоцитоз и систему комплемента.
IgE. Представляет мономер, в сыворотке крови находится в низких концентрациях. Основная роль- своими Fc- фрагментами прикрепляется к тучным клеткам (мастоцитам) и базофилам и опосредует реакции гиперчувствительности немедленного типа. К IgE относятся “антитела аллергии”- реагины. Уровень IgE повышается при аллергических состояниях, гельминтозах. Антигенсвязывающие Fab- фрагменты молекулы IgE специфически взаимодействует с антигеном (аллергеном), сформировавшийся иммунный комплекс взаимодействует с рецепторами Fc- фрагментов IgE, встроенных в клеточную мембрану базофила или тучной клетки. Это является сигналом для выделения гистамина, других биологически активных веществ и развертывания острой аллергической реакции.
IgD. Мономеры IgD обнаруживают на поверхности развивающихся В- лимфоцитов, в сыворотке находятся в крайне низких концентрациях. Их биологическая роль точно не установлена. Полагают, что IgD участвуют в дифференциации В-клеток, способствуют развитию антиидиотипического ответа, участвуют в аутоиммунных процессах.
Слайд 29Кооперация клеток в иммунном ответе
В формировании иммунного ответа включаются все
звенья иммунной системы: системы макрофагов, Т- и В- лимфоцитов, комплемента,
интерферонов и главная система гистосовместимости.Выделяют следующие этапы межклеточной кооперации:
1. Поглощение и процессинг антигена макрофагом.
2. Представление процессированного антигена макрофагом с помощью белка главной системы гистосовместимости класса 2 Т- хелперам.
3. Узнавание антигена Т- хелперами и их активация.
4. Узнавание антигена и активация В- лимфоцитов.
5. Дифференциация В- лимфоцитов в плазматические клетки, синтез антител.
6. Взаимодействие антител с антигеном, активация систем комплемента и макрофагов, интерферонов.
7. Представление при участии белков МНС класса 1 чужеродных антигенов Т- киллерам, разрушение инфицированных чужеродными антигенами клеток Т- киллерами.
8. Индукция Т- и В- клеток иммунной памяти, способных специфически распознавать антиген и участвовать во вторичном иммунном ответе ( антигенстимулированные лимфоциты).
Слайд 30Клетки иммунной памяти. Поддержание долгоживущих и метаболически малоактивных клеток памяти,
рециркулирующих в организме, является основой длительного сохранения приобретенного иммунитета. Состояние
иммунной памяти обусловлено не только длительностью жизни Т- и В- клеток памяти, но и их антигенной стимуляцией. Длительное сохранение антигенов в организме обеспечивается дендритными клетками (депо антигенов), сохраняющими их на своей поверхности.Дендритные клетки - популяции отросчатых клеток лимфоидной ткани костномозгового (моноцитарного) генеза, представляющая антигенные пептиды Т- лимфоцитам и сохраняющая антигены на своей поверхности. К ним относятся фолликулярные отросчатые клетки лимфоузлов и селезенки, клетки Лангерханса кожи и дыхательных путей, М- клетки лимфатических фолликулов пищеварительного тракта, дендритные эпителиальные клетки тимуса.
Слайд 31Первичный и вторичный иммунный ответ.
Первичный ответ- при первичном контакте с
возбудителем (антигеном), вторичный- при повторном контакте. Основные отличия:
- продолжительность скрытого
периода (больше- при первичном);- скорость нарастания антител (быстрее- при вторичном);
- количество синтезируемых антител (больше- при повторном контакте);
- последовательность синтеза антител различных классов (при первичном более длительно преобладают IgM, при вторичном- быстро синтезируются и преобладают IgG- антитела).
Вторичный иммунный ответ обусловлен формированием клеток иммунной памяти. Пример вторичного иммунного ответа- встреча с возбудителем после вакцинации.
Слайд 32I. Классификация в зависимости от природы антигена
1. Противоинфекционный
иммунитет:
Антибактериальный:
а) Стерильный - микроорганизмы из организма
удаляются, а иммунитет сохраняется (при подавляющем большинстве инфекций); б) Нестерильный – для поддержания иммунитета необходимо присутствие в организме небольшого количества микроорганизмов (например, при туберкулёзе).
Антитоксический – направлен против факторов патогенности микробов – токсинов.
Противовирусный – против вирусов,
Противогрибковый – против грибов,
Противопаразитарный – против патогенных простейших и гельминтов.
2. Неинфекционный иммунитет:
Слайд 33Неинфекционный иммунитет:
Трансплантационный иммунитет – возникает при пересадке органов, тканей, переливании
крови, лейкоцитарной массы. Этот вид иммунитета связан с уникальностью набора
антигенов главного комплекса гистосовместимости (ГКГС) на поверхности клеток у каждого индивидуума. Набор этих антигенов идентичен только у однояйцевых близнецов.Противоопухолевый иммунитет (изучается онкоиммунологией) – реакции иммунной системы на антигены опухолевых клеток.
Репродуктивный иммунитет - реакции иммунной системы матери на антигены плода, так как он генетически чужероден, то есть содержит антигены отца (например, при несовместимости матери и плода по Rh-фактору).
Аутоиммунитет – иммунный ответ на собственные молекулы, клетки, которые распознаются как «чужеродные» и повреждаются, уничтожаются, при этом развиваются аутоиммунные заболевания – системная красная волчанка (СКВ), ревматизм, ревматоидный артрит, склеродермия, рассеянный склероз и др.
Слайд 34II. Классификация видов иммунитета в зависимости от происхождения
1. Врождённый, видовой,
естественный иммунитет - генетически обусловленная невосприимчивость организмов одного вида к
возбудителям болезней организмов других видов (например, животные не болеют некоторыми заболеваниями человека – сифилисом, гонореей, дизентерией), и, наоборот, люди не болеют чумкой собак, куриной холерой).2. Приобретённый иммунитет – возникает в течение жизни человека. Приобретённый иммунитет бывает естественный и искусственный, а каждый из них может быть активным или пассивным.
Слайд 35Естественный активный иммунитет – это постинфекционный иммунитет.
Естественный пассивный иммунитет –
при передаче готовых защитных факторов (антител, лимфоцитов, цитокинов) через плаценту
(трансплацентарный) или с грудным молоком (sIgA).Искусственный активный иммунитет – индуцируется после введения в организм биопрепаратов, содержащих антигены – вакцины и анатоксины.
Искусственный пассивный иммунитет – создаётся после введения готовых антител в составе лечебно-профилактических сывороток и иммуноглобулинов.
Слайд 36Классификация иммунитета по распространённости
Общий – обусловлен сывороточными антителами, клетками ИС
в крови, лимфе и тканях.
Местный – иммунитет определённого биотопа организма,
например, полости рта, верхних дыхательных путей, конъюнктивы, влагалища, кишечника и т. д.создаёт невосприимчивость во входных воротах инфекций за счёт факторов врождённого иммунитета (фагоциты, лизоцим, комплемент и др.), а также приобретённого иммунитета: а) клеточных (лимфоциты – например, в слизистой оболочке кишечника на 100 эпителиальных клеток приходится 40 лимфоцитов) и гуморальных (sIgA), содержащегося в слюне, слёзной жидкости, молозиве, грудном молоке, кишечной, бронхиальной слизи.Слайд 40ФАКТОРЫ ВРОЖДЁННОГО ИММУНИТЕТА
1) Внешние барьеры; 2) Внутренние барьеры;
3)
Клеточные; 4)
ГуморальныеВнешние барьеры
кожа и слизистые оболочки (барьерная функция; слущивание поверхностных слоёв эпителия; движение наружу ресничек мерцательного эпителия верхних дыхательных путей; кислая реакция секретов потовых и сальных желез, содержащих молочную, жирные кислоты, нормальное значение рН кожи 5,5, что подавляет размножение бактерий; кислотность желудочного сока у устьев обкладочных клеток рН составляет 1-2 единицы, в желудочном соке (в зависимости от уровня кислотопродуцирующей функции) – 3-6 и более и т.д.);
Слайд 41Внутренние барьеры
лимфатические узлы, лимфатические сосуды;
гисто-гематические барьеры (препятствуют проникновению
микробов из крови в глаз, репродуктивную систему (плацентарный барьер), головной
мозг (гемато-энцефалический барьер);мембраны клеток являются барьером для посторонних частиц и молекул.
Слайд 42Нормальная микрофлора организма
(включающая непатогенные и условно-патогенные микроорганизмы)
участвует в созревании и
функционировании лимфоидной (иммунной) системы (гнотобионты при введении непатогенных бактерий гибнут);
обеспечивает колонизационную резистентность – то есть предупреждает заселение организма хозяина посторонними микроорганизмами за счёт: а) блокирования рецепторов клеток слизистых от адгезинов патогенных микробов (нормальная микрофлора формирует экологический барьер на поверхности слизистых оболочек), б) продукции бактерицидных веществ: лизоцима (например, Lactobacillus fermentum), органических кислот (например, лактобактерии и бифидобактерии создавая в кишечнике кислую среду, препятствуют размножению гнилостной и газообразующей микрофлоры), бактериоцинов – антибиотикоподобных веществ, подавляющих размножение других бактерий (например, E. coli образуют колицины, Lactobacillus sp. образуют лактоцины).
Слайд 43NK – клетки (Natural killers)
факторы врождённого иммунитета
Дифференцируются из
общей лимфоидной клетки предшественника
Составляют 2 - 15% всех мононуклеарных клеток
крови, в тканях локализованы в печени (большинство), красной пульпе селезёнки, слизистых оболочках особенно репродуктивных органовМаркерные молекулы CD16 и CD56
Цитотоксичность в отношении клеток-мишеней с помощью перфорин-гранзимового механизма
Не формируют клеток иммунологической памяти
Слайд 45Фагоцитоз: 1) завершённый и 2) незавершенный
При незавершённом фагоцитозе факультативные
и облигатные внутриклеточные паразиты не только сохраняют жизнеспособность, но даже
размножаются внутри фагоцитов, а также становятся недоступными для действия антибиотиков и химиопрепаратов.Основные механизмы незавершенности фагоцитоза и персистирования микробов:
блокада слияния фагосом и лизосом (у токсоплазм, микоплазм, вирусов гриппа);
резистентность к действию бактерицидных факторов лизосом (стафилококки, стрептококки группы А, гонококки);
способность микроорганизмов быстро покидать фагосомы и находиться в цитоплазме (риккетсии).
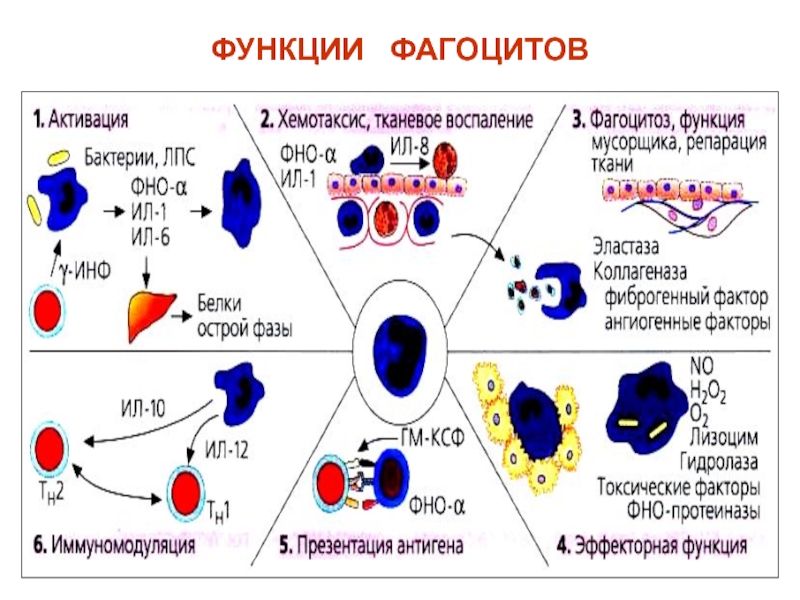
Слайд 47Макрофаги выполняют функции:
Фагоцитоз (поглощение и уничтожение),
Презентация антигена (Аг-представляющая),
Секреторная функция –
макрофаги продуцируют цитокины: ИЛ-1, 3, 6, 8, 10, 15, фактор
некроза опухоли-альфа (ФНО-),- и -интерфероны, простагландины, лейкотриены, факторы комплемента, ферменты.
Слайд 48Г у м о р а л ь н ы
е факторы врождённого иммунитета
Комплемент
Лактопероксидаза
Лизоцим
Белки острой фазы
Интерферон
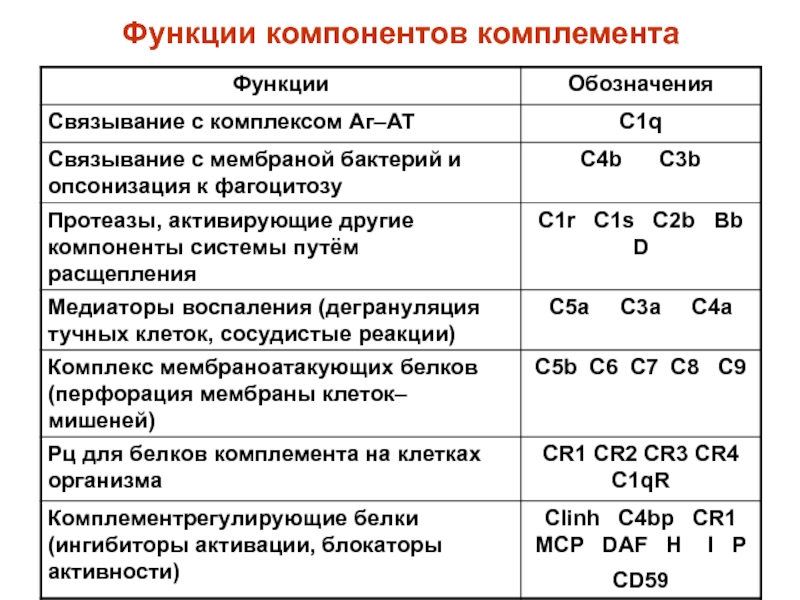
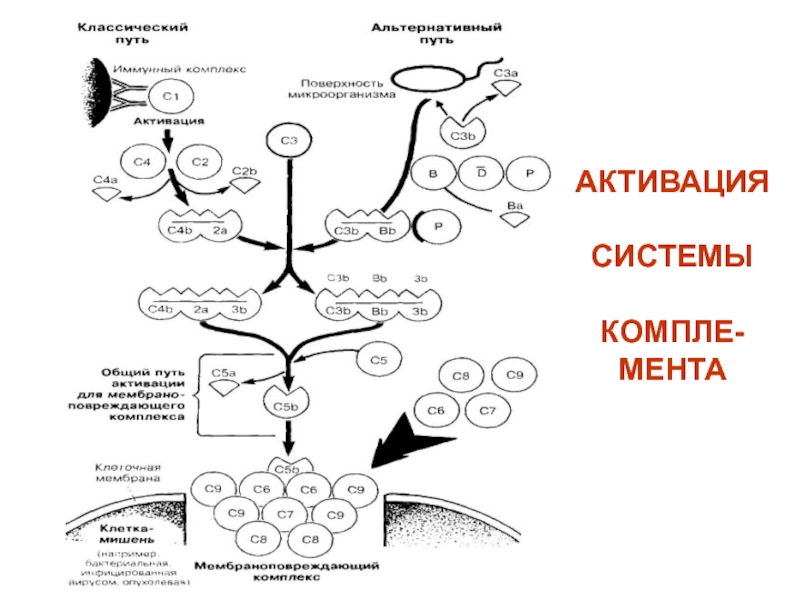
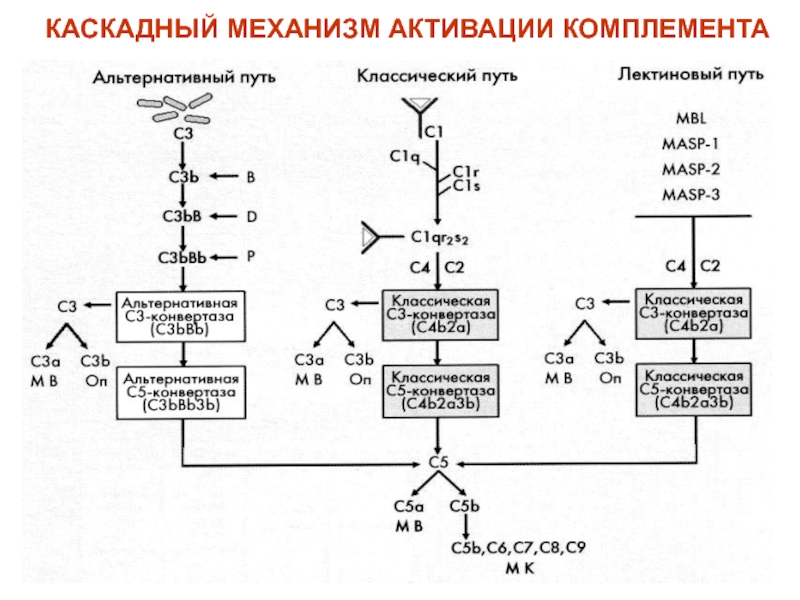
(неспецифическая антивирусная активность)Слайд 49КОМПЛЕМЕНТОМ (С1-9) называют сложную систему белков сыворотки крови (более 20),
обладающих ферментативной активностью. В условиях физиологической нормы компоненты комплемента находятся
в неактивной форме. Активация системы комплемента протекает классическим, альтернативным и лектиновым путями в виде цепной реакции (каскада реакций). При этом каждый предыдущий компонент каскада активизирует несколько последующих за счёт их ферментативного расщепления. В результате активации образуется Мембрано-Атакующий Комплекс (МАК) – С5b-C9, формирующий поры в клетке-мишени, что приводи к её лизису.Слайд 53СИСТЕМА ЛАКТОПЕРОКСИДАЗЫ включает 3 компонента:
ЛП (фермент лактопероксидаза – гемсодержащий катионный
белок) обнаружена во внешних секретах: слюне, слёзной жидкости, грудном молоке.
Ион
тиоцианата (SCN-) является “вездесущим” ионом организма человека. Он образуется в результате детоксикации цианидов в печени и почках. Перекись водорода – это наименее стабильный компонент системы. Наиболее вероятным эндогенным источником перекиси водорода являются полиморфно-ядерные лейкоциты, а в кишечнике, по-видимому, лактобациллам.
Неспецифическое антимикробное (бактерицидное) действие системы лактопероксидазы проявляется в том, что продукт лактопероксидазной реакции – ион гипотиоцианата (ОSCN-) – окисляет сульфгидрильные группы белковых компонентов бактериальной клетки. Это приводит к изменению электрохимического состояния её оболочки, нарушению жизненно важных процессов обмена веществ, в частности гликолиза, и в конечном итоге к гибели микробов.
Антимикробное действие системы лактопероксидазы выявлено в отношении стрептококков, стафилококков, псевдомонад, молочно-кислых бактерий, эшерихий, шигелл, сальмонелл. Среди стрептококков оральной микрофлоры, находящейся в постоянном контакте со слюной, содержащей систему ЛП, обнаружены штаммы, резистентные к её действию.
Слайд 54ЛИЗОЦИМ – фермент расщепляющий
1-4β-гликозидные связи между N-ацетилглюкозамином
и N-ацетилмурамовой кислотой пептидогликана клеточной стенки бактерий
В норме содержится во
всех биологических жидкостях (за исключением мочи и ликвора)В физиологических концентрациях эффективен против грамположительных бактерий
Слайд 55БЕЛКИ ОСТРОЙ ФАЗЫ – обладают антимикробным действием, способствуют фагоцитозу, активации
комплемента, защищают ткани от повреждения в воспалительном очаге. Белки острой
фазы образуются в печени, их выработку стимулируют цитокины ИЛ-1, 6, -ФНО.С-реактивный белок (СРБ - получил название благодаря способности связываться с С-полисахаридом Streptococcus pneumoniae) - СРБ взаимодействует с полисахаридами клеточной стенки бактерий, грибов и активирует комплемент, который лизирует микробы или их опсонизирует; СРБ присоединяется к фосфатидилхолину (ФЛ ЦПМ), например, нейтрофилов усиливая фагоцитоз; СРБ подавляет продукцию супероксиданиона и ферментов фагоцитами, таким образом защищая ткани от повреждения.
Слайд 56Церуллоплазмин – белок, связывающий медь, бактериостатическое действие
Белки связывающие железо –
трансферрин, гаптоглобин, гемопексин, в результате при дефиците железа скорость размножения
бактерий резко уменьшается; Сывороточный Р-амилоид (активирует комплемент)Сывороточный А-амилоид (по химической природе является липопротеином, хемоаттрактант для нейтрофилов, моноцитов и лимфоцитов – повышен при туберкулёзе, ревматоидном артрите);
Ингибиторы протеаз – антитрипсин, антихимотрипсин, макроглобулин – препятствуют повреждению тканей протеазами гранулоцитов в очаге воспаления, при воспалении концентрация увеличивается в 2-3 раза;
Факторы свёртывания крови - фибриноген и фактор фон Виллебранда – препятствуют распространению инфекции в результате образования сгустков в сосудах зоны воспаления.
Слайд 59Гиперчувствительность - специфическая нежелательная повышенная реакция на Аг(аллерген), приводящая к
развитию патологических изменений в организме.
Аллергия - (от греч. allos
– другой, ergon - действие) – специфическая повышенная чувствительность к антигенам (аллергенам) в результате неадекватной реакции иммунной системы, опосредованная IgE. Атопия — IgE–опосредованная аллергия.
Слайд 60АЛЛЕРГЕН – антиген, вызывающий развитие реакции гиперчувствительности
Инфекционные – Аг бактерий,
вирусов, грибов, простейших.
Ингаляционные аллергены:
а) растительного происхождения, например, пыльца растений,
вызывает поллиноз в виде ринита, конъюктивита и бронхоспазма;б) животного происхождения (эпидермальные антигены, антигены клещей и др.);
в) бытовые аллергены (пыль и др.).
Пищевые аллергены – яйца, молоко, сыр, мясо, орехи, шоколад, ракообразные, моллюски, рыба, бобовые, ягоды, зелень, пряности, овощи, грибы, пищевые добавки, смеси.
Лекарственные аллергены – антибиотики, сульфаниламиды, гормоны (инсулин, АКТГ, ТСГ), сыворотки, витамины (тиамин и др.), ферменты и др.
Промышленные – полимеры, пестициды, металлы, др.
Слайд 61 Аллергия (от греч allos - другой) - специфическая
повышенная чувствительность к антигенам (аллергенам), в результате неадекватной реакции иммунной
системыАллергия может проявляться по типу гиперчувствительности немедленного типа и гиперчувствительности замедленного типа.
Гиперчувствительность немедленного типа - гиперчувствительность, обусловленная антителами (IgE,
IgG, IgM) против аллергенов.
Развивается через несколько минут или часов после воздействия аллергена: расширяются сосуды, повышается их проницаемость развиваются зуд, бронхоспазм, сыпь, отеки.
Поздняя фаза ГНТ дополняется действием продуктов эозиноофилов и нейтрофилов.
К ГНТ относятся I, II и III типы гиперчувствительности (по Джеллу и Кумбсу):
I тип - анафилактический, обусловленный действием IgE;
II тип - цитотоксический, обусловленный действием IgG, IgM;
III тип - иммунокомплексный, развивающийся при образовании иммунного комплекса IgG, IgM с антигенами.
Гиперчувствительность замедленного типа относится к IV типу .
Обусловлена взаимодействием антигена (аллергена) с макрофагами и ТН1 -лимфоцитами, стимулирующими клеточный иммунитет.
Развивается через 1-3 сут после воздействия аллергена: происходит уплотнение и воспаление ткани, в результате ее инфильтрации Т-лимфоцитами и макрофагами
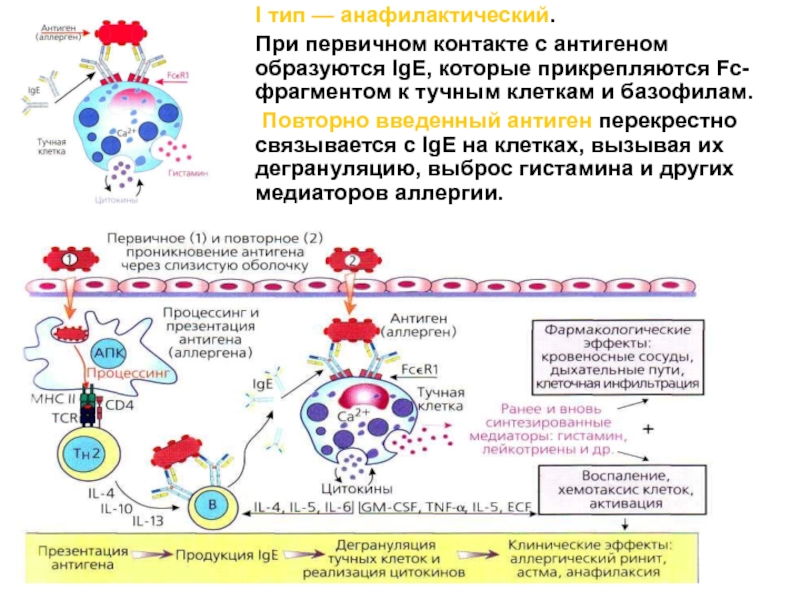
Слайд 62 I тип — анафилактический.
При первичном контакте с антигеном образуются IgE, которые прикрепляются Fc-фрагментом
к тучным клеткам и базофилам.Повторно введенный антиген перекрестно связывается с IgE на клетках, вызывая их дегрануляцию, выброс гистамина и других медиаторов аллергии.
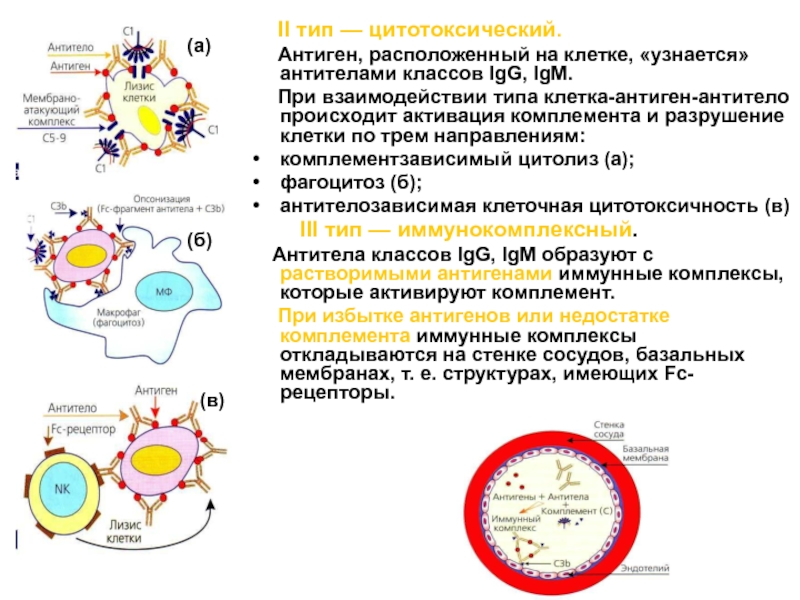
Слайд 63 II тип — цитотоксический.
Антиген, расположенный на клетке, «узнается» антителами классов IgG, IgM.
При взаимодействии типа клетка-антиген-антитело происходит активация комплемента и разрушение клетки по трем направлениям:комплементзависимый цитолиз (а);
фагоцитоз (б);
антителозависимая клеточная цитотоксичность (в)
III тип — иммунокомплексный.
Антитела классов IgG, IgM образуют с растворимыми антигенами иммунные комплексы, которые активируют комплемент.
При избытке антигенов или недостатке комплемента иммунные комплексы откладываются на стенке сосудов, базальных мембранах, т. е. структурах, имеющих Fc-рецепторы.
(а)
(б)
(в)
Слайд 64
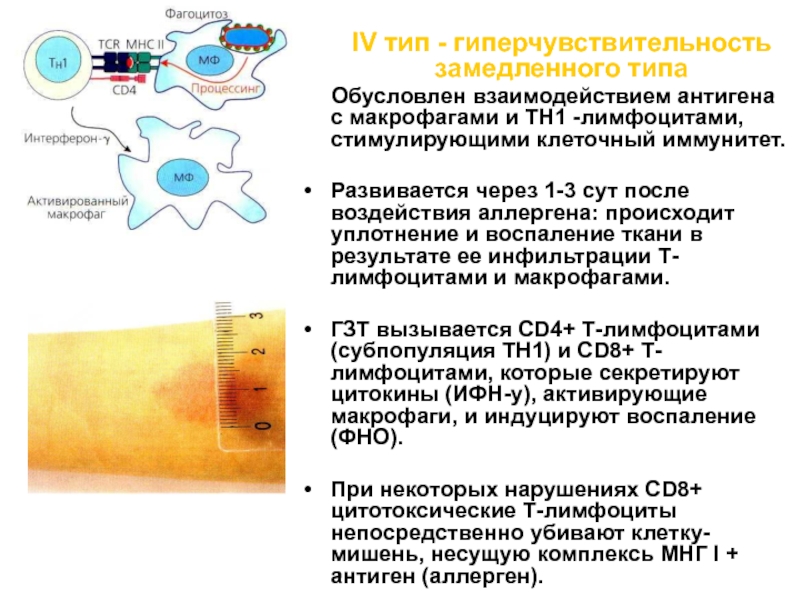
IV тип - гиперчувствительность замедленного типа
Обусловлен взаимодействием антигена с макрофагами и ТН1 -лимфоцитами,
стимулирующими клеточный иммунитет.Развивается через 1-3 сут после воздействия аллергена: происходит уплотнение и воспаление ткани в результате ее инфильтрации Т-лимфоцитами и макрофагами.
ГЗТ вызывается CD4+ Т-лимфоцитами (субпопуляция ТН1) и CD8+ Т-лимфоцитами, которые секретируют цитокины (ИФН-у), активирующие макрофаги, и индуцируют воспаление (ФНО).
При некоторых нарушениях CD8+ цитотоксические Т-лимфоциты непосредственно убивают клетку-мишень, несущую комплексь МНГ I + антиген (аллерген).
Слайд 65Иммунологическая толерантность
- отсутствие иммунного ответа при наличии в организме
антигенов (толерогенов), доступных лимфоцитам.
Наиболее толерогенными являются растворимые антигены, т.
к. не вызывают у макрофагов (АПК) экспрессию соответствующих стимулирующих молекул для иммунного ответа.Естественная иммунологическая толерантность (син. аутотолерантность) - толерантность к антигенам (аутоантигенам) собственных тканей и клеток.
Она обусловлена отрицательной селекцией аутореактивных клонов лимфоцитов.
Толерантность к собственным антигенам организма развивается в процессе онтогенеза за счет уничтожения аутореактивных клонов лимфоцитов.
Т-лимфоциты подвергаются отрицательной селекции в тимусе, а большинство В-лимфоцитов - в костном мозге.
При травме, длительной инфекции эти антигены опадают в кровь и вызывают иммунный ответ против антигенов «забарьерного органа».
Слайд 66Искусственная иммунологическая толерантность возможна при введении чужеродных антигенов плоду или
сразу после рождения (т. е. в период «иммунологической незрелости»), при
разрушении или подавлении иммунной системы в результате облучения, введения цитотоксических агенов и др.Иммунологическая толерантность развивается по следующим направлениям:
делеция клона лимфоцитов, связавших антиген своими рецепторами и (вместо активации) погибающих в результате сигнала на апоптоз;
анергия клона лимфоцитов из-за отсутствия активации лимфоцитов, связавших антиген своими Т- или В-клеточными рецепторами.
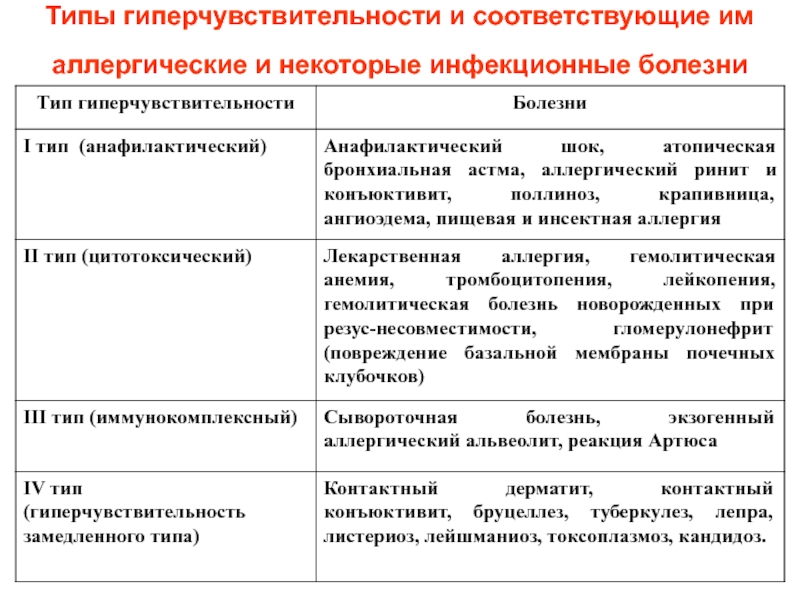
Слайд 67Типы гиперчувствительности и соответствующие им аллергические и некоторые инфекционные болезни
Слайд 68Особенности противогрибкового
иммунитета
Антигены грибов имеют относительно низкую иммуногенность: они практически не
индуцируют антителообразование (титры специфических антител остаются низкими), но стимулируют клеточное
звено иммунитета.Основными действующими факторами противогрибкового иммунитета являются активированные макрофаги, которые осуществляют антителозависимую клеточно-опосредованную цитотоксичность в отношении грибов.
При микозах наблюдается аллергизация макроорганизма:
- Кожные и глубокие микозы сопровождаются, как правило, ГЗТ.
- Грибковые поражения слизистых дыхательных и мочеполовых путей вызывают аллергизацию по типу ГНТ (реакция I типа).
Напряженность противогрибкового иммунитета оценивается по результатам кожно-аллергических проб с грибковыми аллергенами.
Слайд 69Особенности противовирусного иммунитета
Факторы клеточного иммунитета (как врожденного, так и приобретенного)
составляет основу противовирусного иммунитета:
NK-клетки
ЦТЛ (цитотоксические лимфоциты)
Осуществляют уничтожение вирус-инфицированных клеток с
помощью: 1) перфорин-гранзимового механизма и 2) путем индукции их апоптоза.2) Факторы приобретенного гуморального иммунитета (антитела), взаимодействуют с внеклеточными вирусами, нарушая прикрепление вирусов и генерализацию вирусной инфекции:
нарушают их адгезию к чувствительным клеткам (блокируют начальный этап инфекционного процесса);
- sIgA – фактор гуморального приобретенного местного иммунитета во входных воротах инфекций
образуя иммунные комплексы, делают вирусы доступными для фагоцитоза
3) Факторы гуморального врожденного иммунитета
Интерфероны
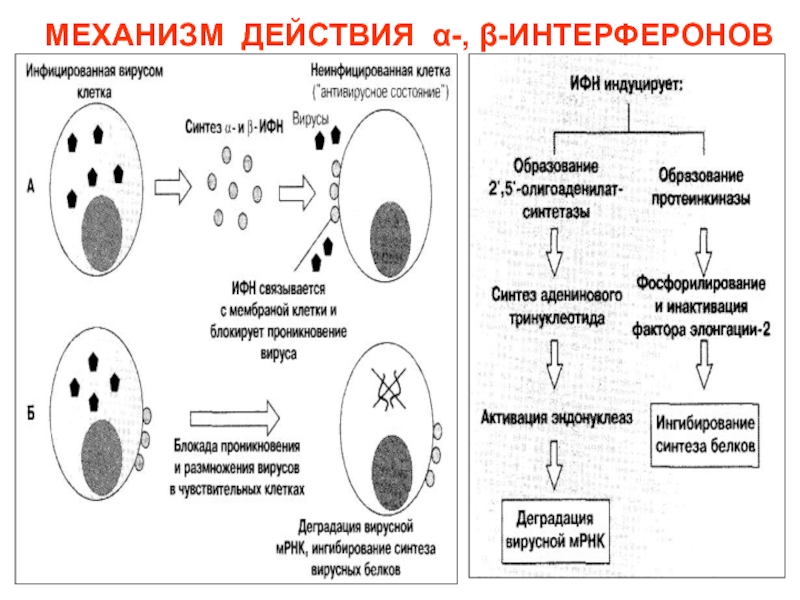
Слайд 70Интерфероны
Различают три вида интерферонов (ИФ): -ИФ, -ИФ, -ИФ:
- -ИФ – лейкоцитарный (продуцируется макрофагами),
- -ИФ – фибробластный (продуцируется фибробластами), - -ИФ – иммунный (продуцируется Т-хелперами 1-го типа).
Интерфероны не действует непосредственно на вирусы ни на внеклеточный, ни на внутриклеточный.
Антивирусное действие интерферонов связано с повышением активности ряда ферментов клетки-мишени.
Для интерферонов характерна видовая специфичность (в отношении вирусов человека эффективны человеческие интерфероны)
Слайд 72Особенности иммунитета при протозойных инвазиях
Гуморальные факторы определяют напряженность иммунитета, когда
возбудитель находится в крови – при малярии, трипаносомозах.
Клеточные факторы
превалируют при размножении паразитов в тканях.В антипротозойном иммунитете участвуют эозинофилы, которые привлекаются хемотаксическими продуктами паразитов. Эозинофилы имеют на поверхности Fc-рецепторы и поэтому могут связываться с антителами, опсонизирующими паразитов. При этом эозинофилы выделяют цитотоксины (например, основной белок эозинофилов, катионные белки, пероксидаза).
Слайд 73Простейшие в процессе эволюции выработали множество механизмов уклонения от иммунологического
надзора хозяина:
- африканские трипаносомы характеризуются антигенной изменчивостью в
течение жизненного цикла при паразитировании у одного хозяина;- для лейшманий, токсоплазм, трипаносом характерен незавершенный фагоцитоз, причем паразиты размножаются в фагоцитах и недоступны для факторов иммунитета и лекарств.
Выраженная антигенная изменчивость простейших даже в течение одного жизненного цикла, низкая эффективность гуморальных и клеточных механизмов элиминации возбудителей не позволили до сих пор создать ни одной эффективной вакцины против них.
Иммунитет при протозойных инвазиях, как правило, носит «нестерильный» характер, то есть обеспечивается латентным персистированием паразитов.
Слайд 74Особенности противоглистного
иммунитета
Ведущую роль в осуществлении иммунной защиты макроорганизма от глистной
инвазии играют эозинофилы, которые осуществляют антителозависимую клеточно-опосредованную цитотоксичность. Эти клетки
«распознают» паразитов, «отмеченных» специфическими IgE или IgA. Активированный эозинофил, дегранулируя, выделяет ряд токсических субстанций (ферменты, белковые токсины), губительно действующих на гельминты.Антигены гельминта, связываясь также с рецепторными комплексами тучных клеток слизистой оболочки, вызывают их дегрануляцию. Экскретированные биологически активные соединения вызывают интенсивную перистальтику, удаляющую паразита или его останки из просвета кишки.
Эозинофилы и тучные клетки синтезируют цитокины и липидные медиаторы, потенцирующие воспалительную реакцию в месте внедрения гельминта. Глистная инвазия сопровождается аллергизацией, в основном, по типу ГЗТ.
Слайд 75Противоопухолевый иммунитет
Особенности ПОИ связанны с низкой иммуногенностью раковых клеток. Эти
клетки практически не отличаются от нормальных. Специфический антигенный «репертуар» опухолевых
клеток скуден. В число опухоль-ассоциированных антигенов входит группа раково-эмбриональных антигенов, продукты онкогенов, некоторые вирусные антигены и гиперэкспрессируемые нормальные белки.в 60-х годах XX в., Г. И. Абелев (в опытах на мышах) и Ю.С. Татаринов (при обследовании людей) обнаружили в сыворотке крови больных первичным раком печени эмбриональный вариант сывороточного альбумина — альфа-фетопротеин (АФП). К настоящему моменту опухольассоциированные антигены обнаружены и охарактеризованы для многих опухолей, и были даже клонированы их гены. Однако не все опухоли содержат специфические маркерные антигены, и не все маркеры обладают строгой тканевой специфичностью.
В зависимости от природы выделяют вирусные, эмбриональные, нормальные гиперэкспрессируемые и мутантные антигены, ассоциируемые с опухолями.
Слайд 76Вирусные опухольассоциированные антигены, по сути, являются белками онковирусов. Эмбриональные антигены
в норме синтезируются в зародышевом периоде. Это, например, альфа-фетопротеин; хорионический
гонадотропин (ХГЧ) в норме синтезируется в плаценте, а также при хориокарциноме и других опухолях. В меланоме в большом количестве синтезируется нормальный фермент тирозиназа.Опухольассоциированные антигены являются слабыми иммуногенами, хотя в отдельных случаях могут индуцировать реакцию цитотоксических Т-лимфоцитов (Т-киллеров) и распознаваться в составе молекул МНС (HLA) I класса. Слабому иммунологическому распознаванию опухолевых клеток способствует отсутствие воспалительной реакции в месте онкогенеза, а также их иммуносупрессивная активность — биосинтез ряда «негативных» цитокинов ТФР-β и др.), а также экранирование раковых клеток противоопухолевыми антителами. Направленные против опухольассоциированных антигенов специфические антитела, в сущности, не угнетают рост опухолей, а, наоборот, вызывают иммунодепрессию.
Слайд 77Механизм противоопухолевого иммунитета до сих пор слабо изучен. Считается, что
основную роль в нем играют активированные макрофаги; определенное значение имеют
также естественные киллеры.Защитная функция гуморального иммунитета во многом спорная — специфические антитела могут экранировать антигены опухолевых клеток, не вызывая их цитолиза.
Между состоянием иммунной защиты и развитием новообразований существует тесная связь. Об этом свидетельствует повышенная заболеваемость злокачественными новообразованиями индивидуумов с иммунодефицитами и престарелых в связи с понижением активности ИС. Иммуносупрессивная химиотерапия также нередко сопровождается пролиферативными процессами. Поэтому в лечении опухолей нашли применение иммуномодуляторы (ИЛ, ИНФ), адъюванты (вакцина БЦЖ, мурамилдипептиды и др.).
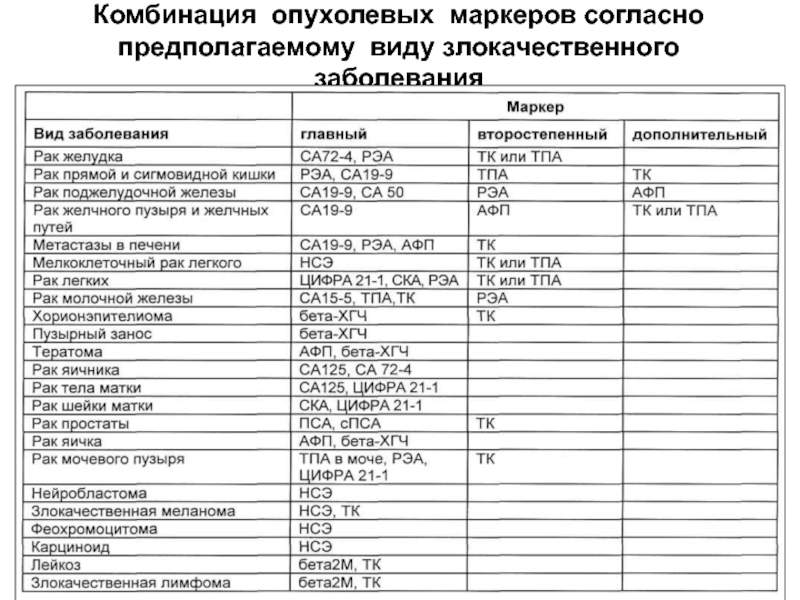
В последнее время получила распространение иммунодиагностика рака, которая основана на определении в сыворотке крови раковоэмбриональных и опухоль-ассоциированных антигенов. В настоящее время удается диагностировать некоторые формы рака печени, желудка, кишечника и др.
Слайд 79Иммунологическая память – способность организма давать ускоренную иммунологическую реакцию на
повторное введение антигена, то есть реагировать по типу вторичного иммунного
ответа.Иммунологическая память проявляется как в отношении гуморального, клеточного ответа, так и реакций гиперчувствительности, трансплантационного иммунитета.
После первичного ответа на антиген в организме образуются долгоживущие Т- и В-клетки памяти, сохраняющие многие годы способность реагировать на повторное введение антигена, так как несут рецепторы к нему. Клетки памяти представляют собой ту часть Т- и В- лимфоцитов, которые прошли антигензависимую дифференцировку и прекратили деление после 2-3 циклов. При повторной встрече с тем же антигеном клетки памяти быстро превращаются в клетки-эффекторы. В-лимфоциты быстро трансформируются в плазматические клетки и вырабатывают антитела по вторичному типу.
Слайд 80Отличия в динамике образования иммуноглобулинов при иммунном ответе
При первичном иммунном
ответе латентный период (от контакта с антигеном до выработки антител)
составляет 3-5 дней, а при вторичном иммунном ответе – несколько часов.Скорость синтеза, количество и аффинитет антител при вторичном ответе больше, чем при первичном.
При вторичном иммунном ответе сразу синтезируются иммуноглобулины класса Ig G.
Феномен иммунологической памяти используется при вакцинации, когда необходимо создать высокий уровень иммунитета и поддерживать его длителььное время на этом уровне. Это осуществляют 2-3 кратными прививками при первичной вакцинации и ревакцинациях (периодические повторные причвивки). Например, против дифтерии прививают ребенка на втором году жизни, в детском саду, школе, армии и так далее с интервалами 5 – 7 лет.
Слайд 81Клонально-селекционная теория
(Ф. Бернет, 1959, С. Тонегава, 1988)
Согласно теории, в организме предсуществуют клоны клеток, которые
способны вырабатывать антитела на любые антигены. Попавший в организм антиген вызывает активацию «своего» клона лимфоцитов («селекция»), который избирательно размножается и вырабатывает специфические антитела. Если доза антигенов велика, то клон «своих» лимфоцитов элиминируется, устраняется из общей популяциии организм теряет способность реагировать на свой антиген, то есть становится толерантным к нему. Таким образом формируется толерантность к собственным тканям в эмбриогенезе. Теория Ф. Бернета объясняет многие иммунологические реакции (антителообразование, гетерогенность антител, толерантность, иммунологическую память), однако не объясняет предсуществования клонов лимфоцитов, способных отвечать на любые антигены. Некоторую ясность в этот вопрос внес С. Тогенгава, который обосновал с генетической точки зрения возможность образования специфических иммуноглобулинов ко всем мыслимым антигенам. Согласно теории в организме происходят рекомбинации, мутации генов, детерминирующих V-сегменты (вариабельные участки) цепей иммуноглобулинов, в результате образуются миллиарды вариантов генов, и соответственно миллиарды вариантов антител.Слайд 82Основные положения клонально-селекционной теории Ф. Бернета
В организме исходно присутствуют клоны
клеток, несущие рецепторы ко всем возможным антигенам.
Антиген является селективным фактором.
Антиген при попадании в организм связывается с наиболее соответствующим ему (комплементарным) рецептором или антителом. Если связывание достаточно прочное, то этот клон вступает в пролиферацию и дифференцировку, поддерживая дальнейший иммунный ответ.Клоны клеток, способные реагировать с собственными тканями, элиминируются из организма еще в эмбриональном периоде.