Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Общая характеристика d- элементов
Содержание
- 1. Общая характеристика d- элементов
- 2. Слайд 2
- 3. Хром и его соединенияАвтор: С.Чеснакова
- 4. Слайд 4
- 5. FeO *Cr2O3 хромистый железнякВ природе
- 6. Получение хрома1. Восстановление коксом, алюминием или кремнием2. Электролиз расплава солей
- 7. Химические свойства хрома1. С неметаллами (N2,C, P,
- 8. 3. С кислотами4. С солями (в растворе)
- 9. 4. С щелочными расплавами окислителей5. С солями, разлагающимися с образованием кислорода
- 10. Слайд 10
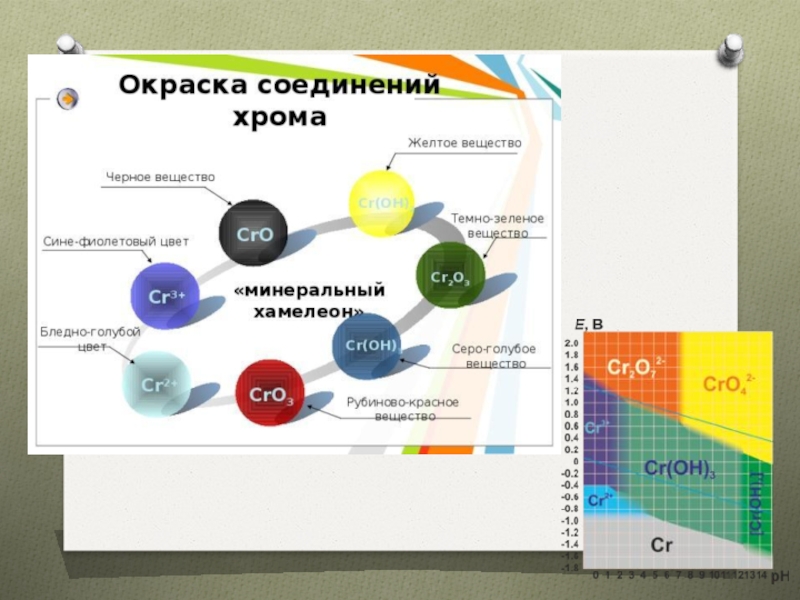
- 11. Соединения хрома (+2)CrO –черное вещество, основный оксид
- 12. Cr(OH)2 -нерастворимое основание желтого цветаCr2+
- 13. Соединения хрома (+3)Cr2O3 – темно-зеленый, амфотерныйПолучение
- 14. Химические свойства Cr2O3 1-2. Сплавление с оксидами,
- 15. Гидроксид хрома (+3)ПолучениеХимические свойства
- 16. Соли хрома(+3)Cr3+ или [Cr(H2O)6] 3+ сине-фиолетовый растворГидролиз:Окисление солей в разных средахKCr(SO4)3 * 12 H2O–хромо-калиевые квасцы
- 17. МеCrO2 -хромат (3)или хромит
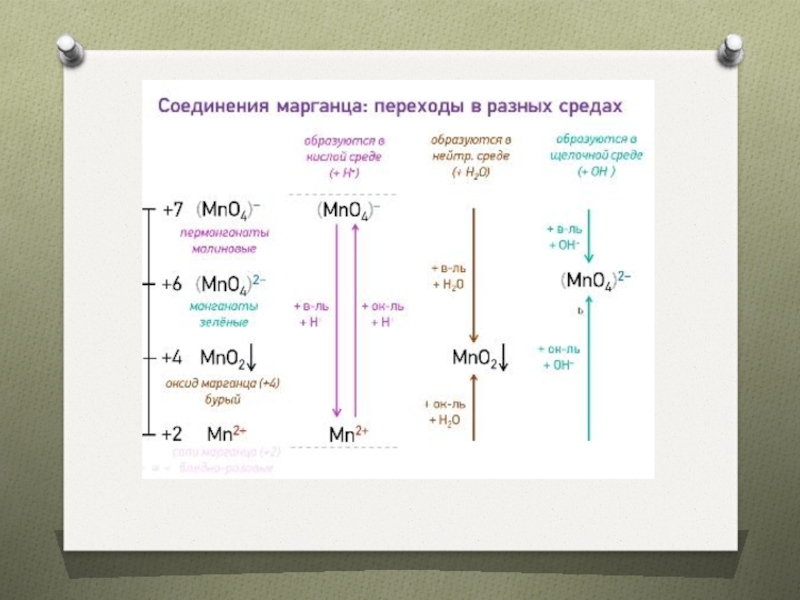
- 18. HMnO44HMnO4=2 H2O + 4МnO2 + 3O2 KMnO4 2КMnO4= К2MnO4 + МnO2 + O2 (200—240°С)4КМnO4 + 2Н2O→МnO2↓+ 3O2↑ + 4КОН (t)
- 19. Слайд 19
- 20. Пн 4мая – 1вариант досрочныйВт 5 мая
- 21. Домашнее заданиеПросмотреть презентациюВыучить уравнения по тренажеруРешить тесты Решить задания 1-13
- 22. Скачать презентанцию
Хром и его соединенияАвтор: С.Чеснакова
Слайды и текст этой презентации
Слайд 14Химические свойства Cr2O3
1-2. Сплавление с оксидами, гидроксидами, карбонатами =хромат
3 (хромит)
3. С щелочными расплавами окислителей = хромат (6)
4. С
кислыми солями (сплавление) = соли хрома (3)Слайд 16Соли хрома(+3)
Cr3+ или [Cr(H2O)6] 3+ сине-фиолетовый раствор
Гидролиз:
Окисление солей в разных
средах
KCr(SO4)3 * 12 H2O–хромо-калиевые квасцы
Слайд 18HMnO4
4HMnO4=2 H2O + 4МnO2 + 3O2
KMnO4
2КMnO4= К2MnO4 + МnO2 + O2 (200—240°С)
4КМnO4 + 2Н2O→МnO2↓+
3O2↑ + 4КОН (t)
Слайд 20Пн 4мая – 1вариант досрочный
Вт 5 мая – качественные реакции
ОВ
Ср 6 мая – 2 вариант досрочный
Чт 7 мая- качественные
реакции НВПт 8 мая – вариант 10














![Общая характеристика d- элементов Соли хрома(+3)Cr3+ или [Cr(H2O)6] 3+ сине-фиолетовый растворГидролиз:Окисление солей в разных средахKCr(SO4)3 * 12 H2O–хромо-калиевые квасцы Соли хрома(+3)Cr3+ или [Cr(H2O)6] 3+ сине-фиолетовый растворГидролиз:Окисление солей в разных средахKCr(SO4)3 * 12 H2O–хромо-калиевые квасцы](/img/tmb/7/628531/1c57d9b7e6f9f9c0605fe9f76d844eb6-800x.jpg)