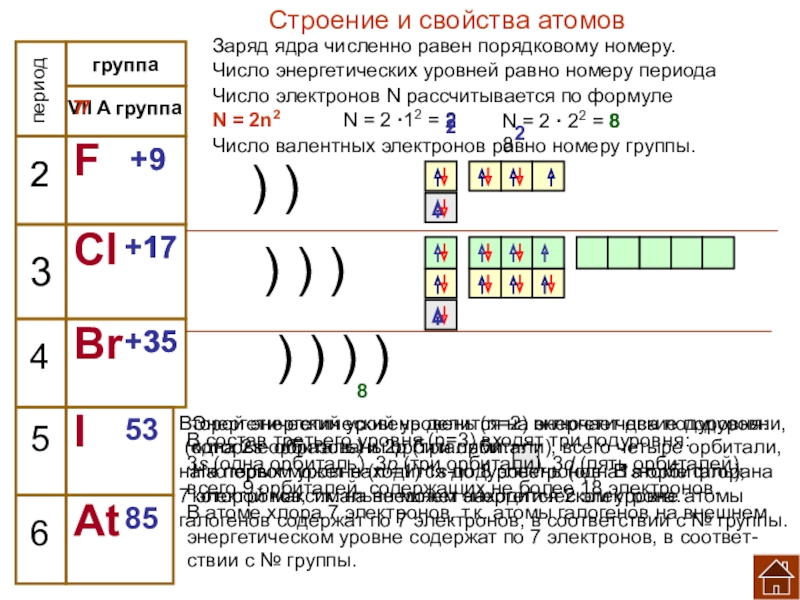
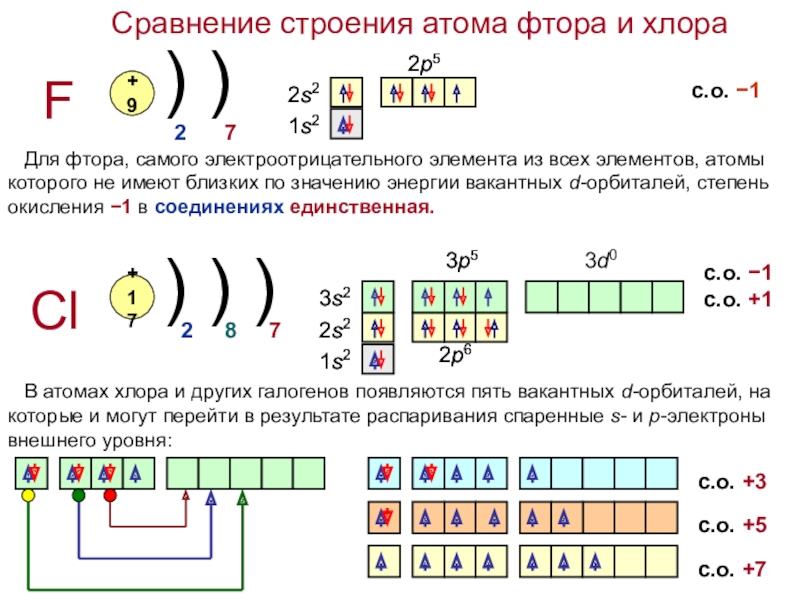
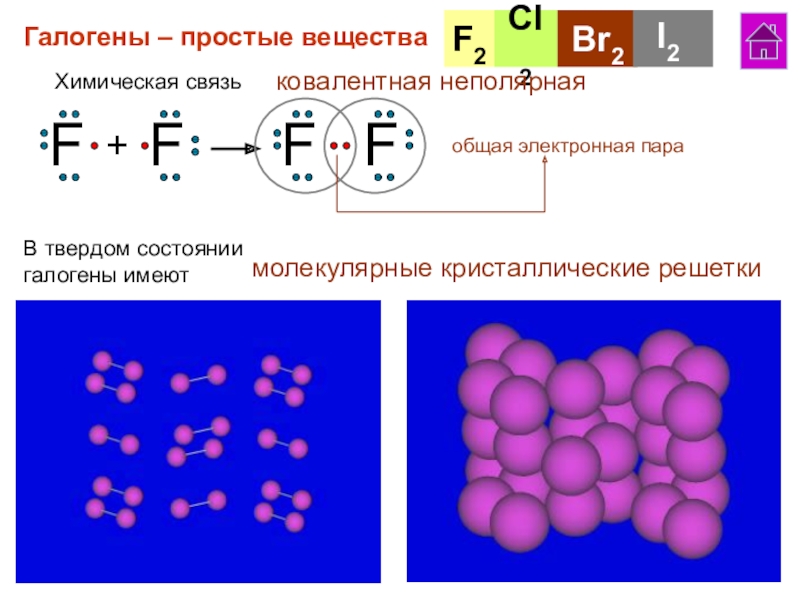
галогенов в ПСХЭ.
Перечислите химические элементы ─ галогены и
дайте им краткую
характеристику: выпишите их
их символы и названия.
Объясните характер изменений [(увеличение),
(усиление)] или [(уменьшение), (ослабление)]
в подгруппе галогенов с ростом порядкового
номера:
заряда ядра (Z);
2. количества электронов на внешнем слое;
3. радиус атома, нм;
4. прочность связи валентных электронов
с ядром;
5. электроотрицательность (ЭО);
6. неметаллические свойства;
7. окислительные свойства;
увеличивается
не изменяется
увеличивается
уменьшается
уменьшается
ослабляются
ослабляются
0,04 0,073 0,085, 0,105
F Cl Br I
ЭО 3,98 3,16 2,96 2,66 2,2
F Cl Br I At