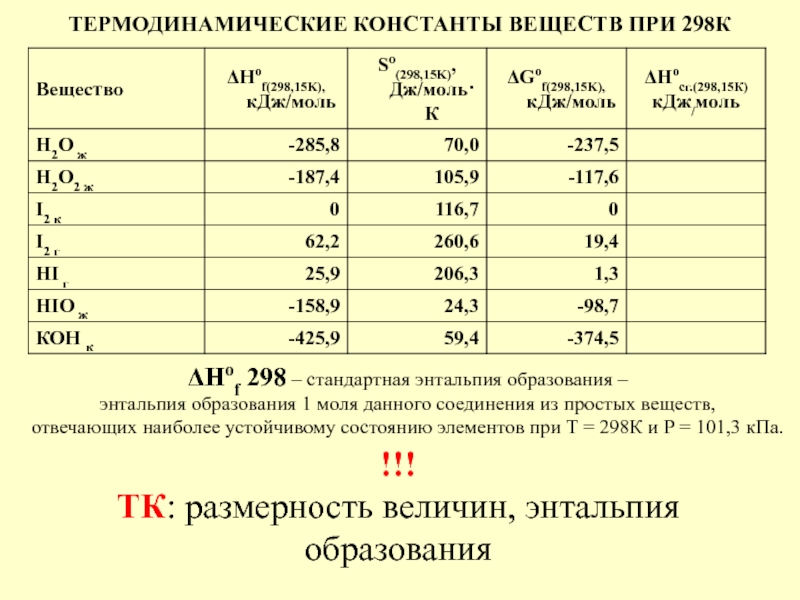
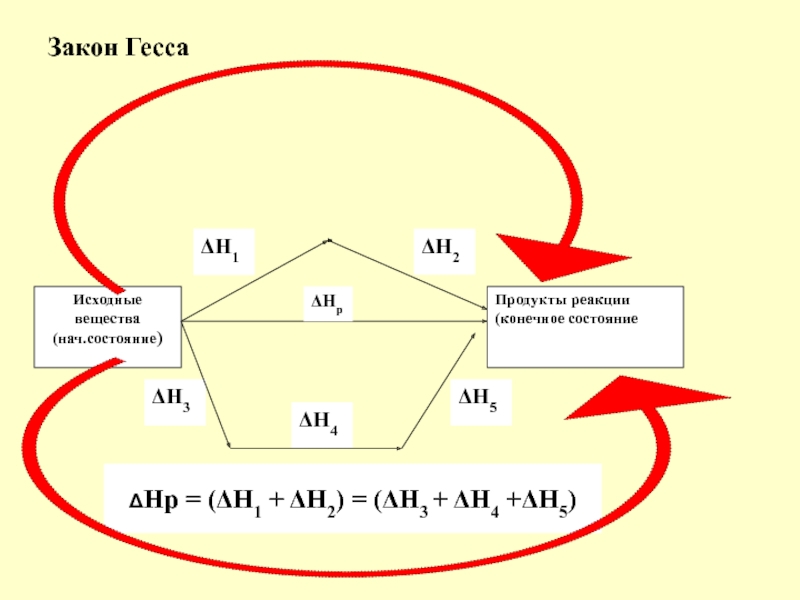
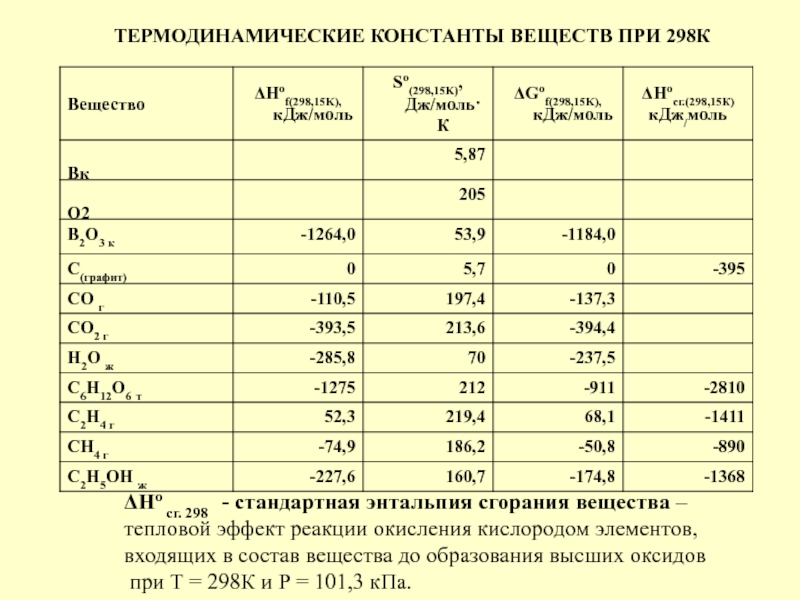
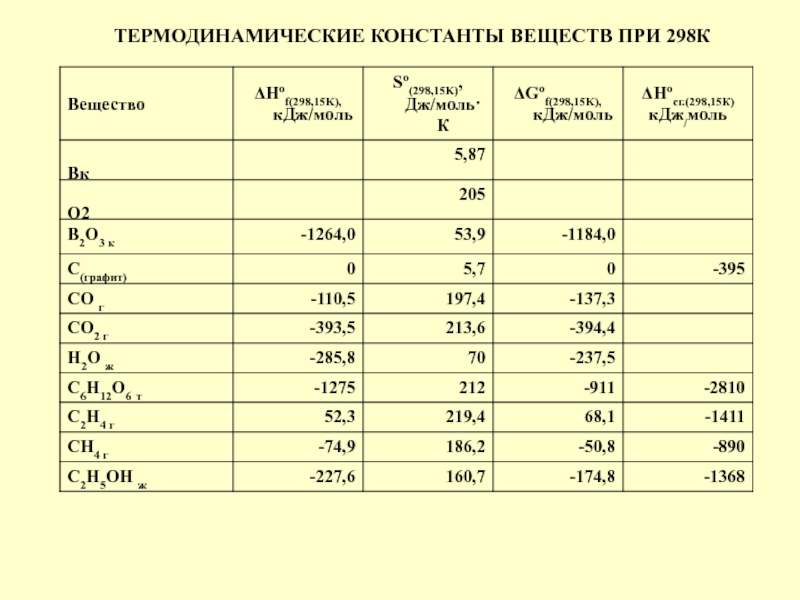
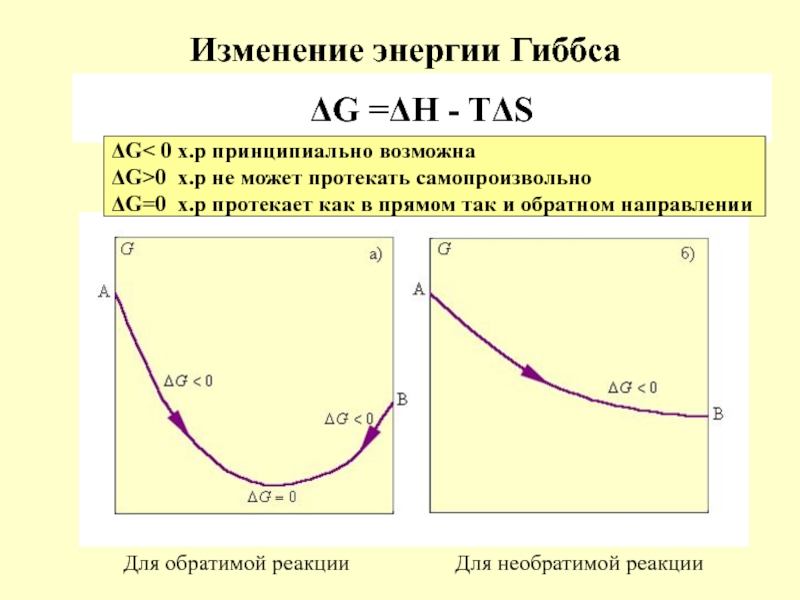
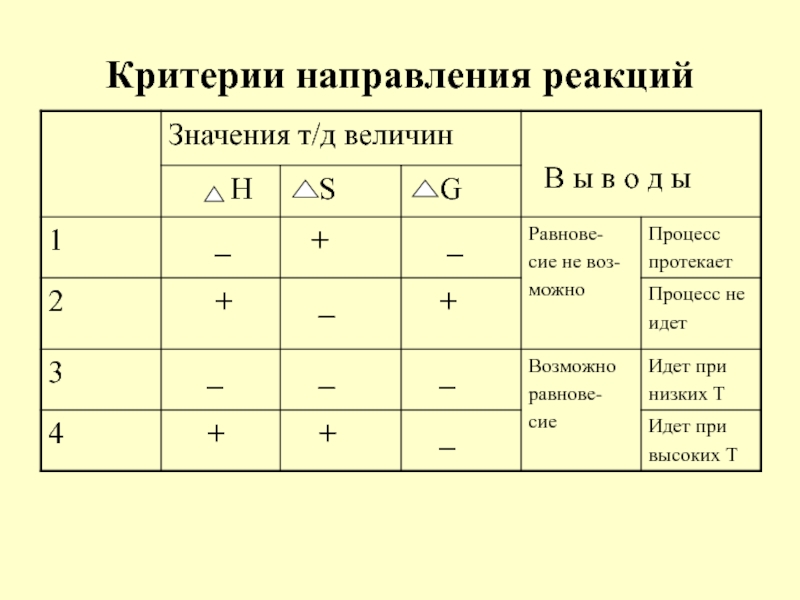
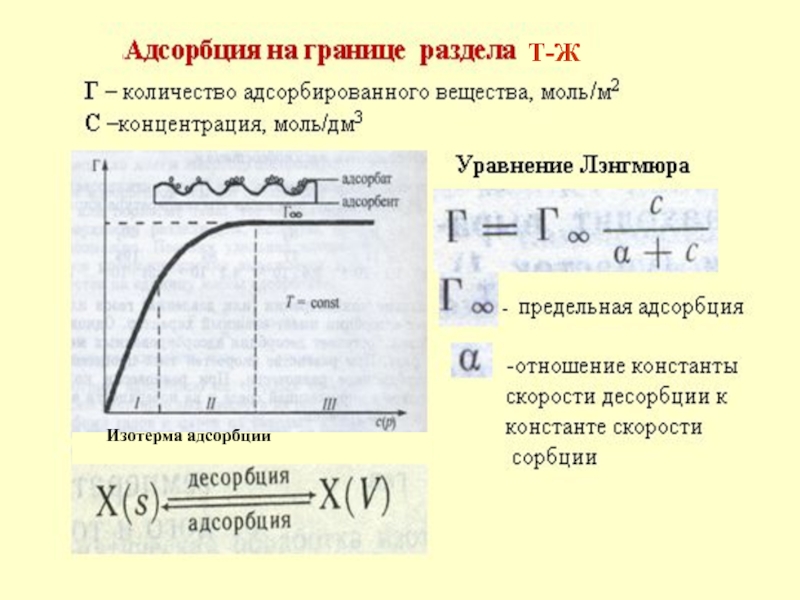
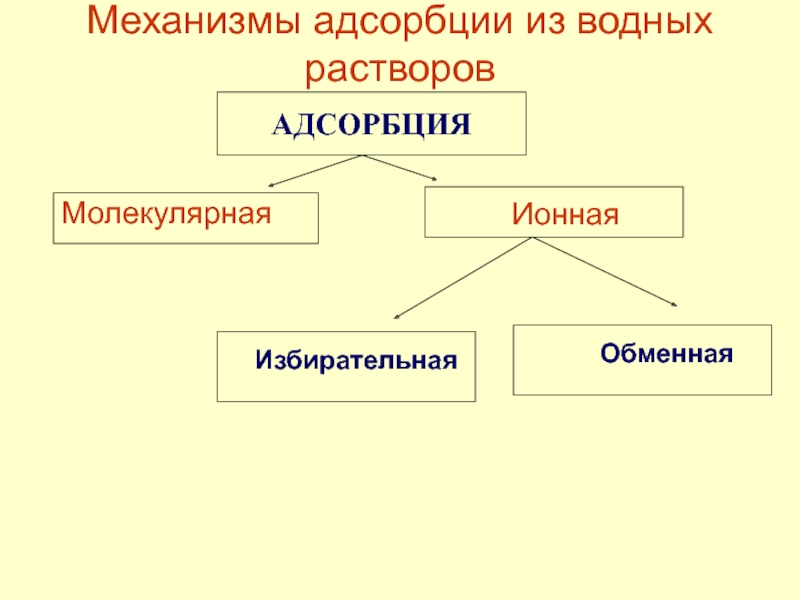
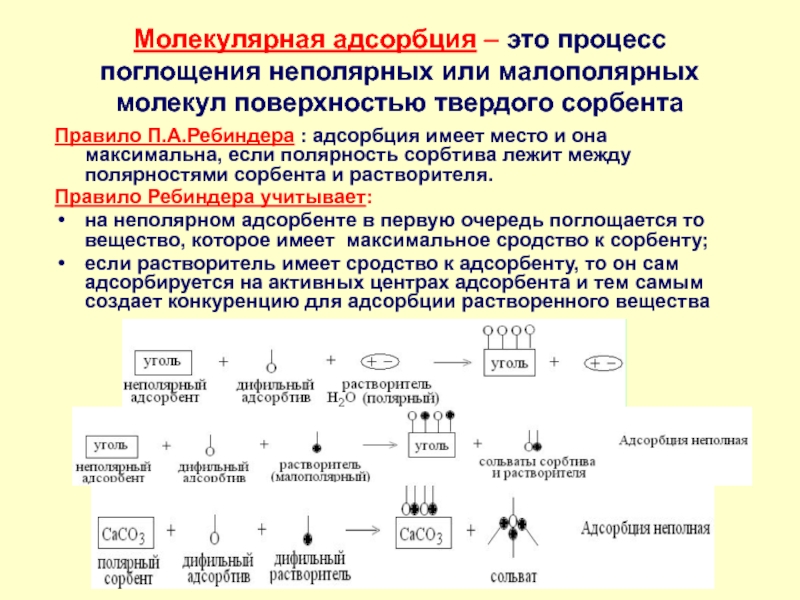
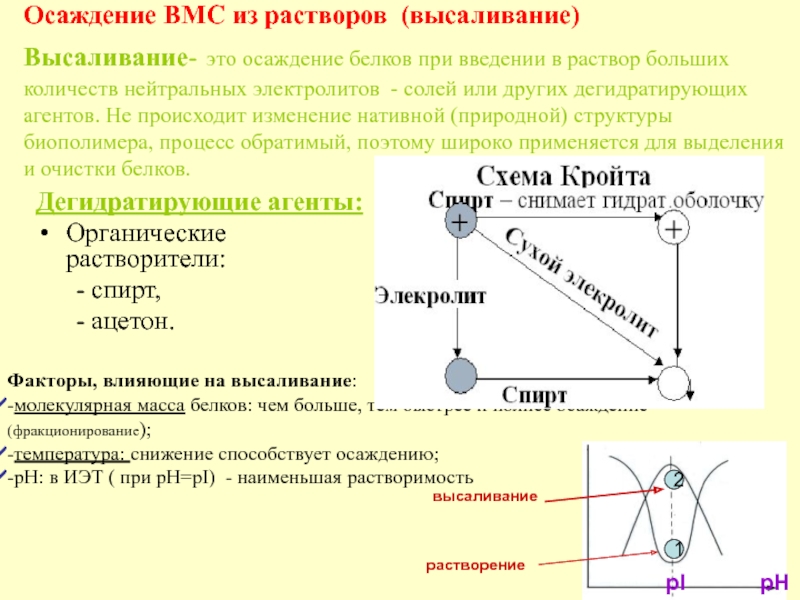
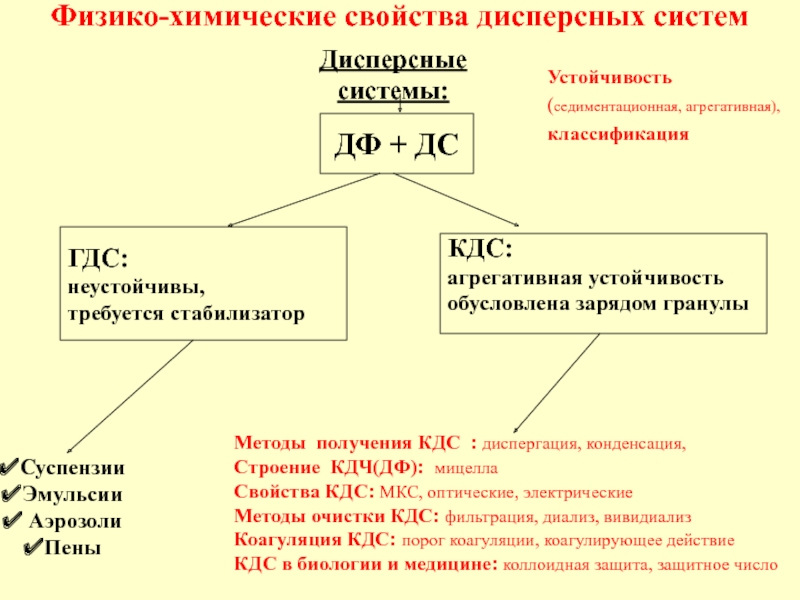
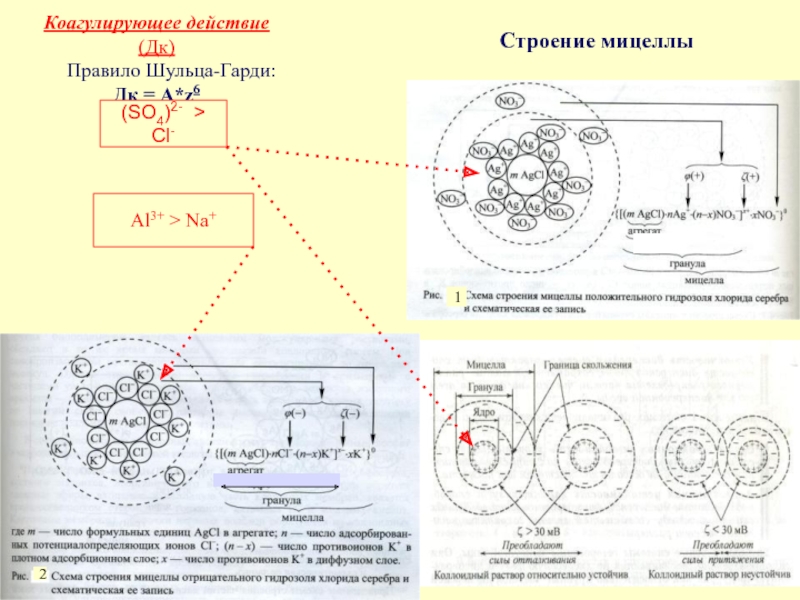
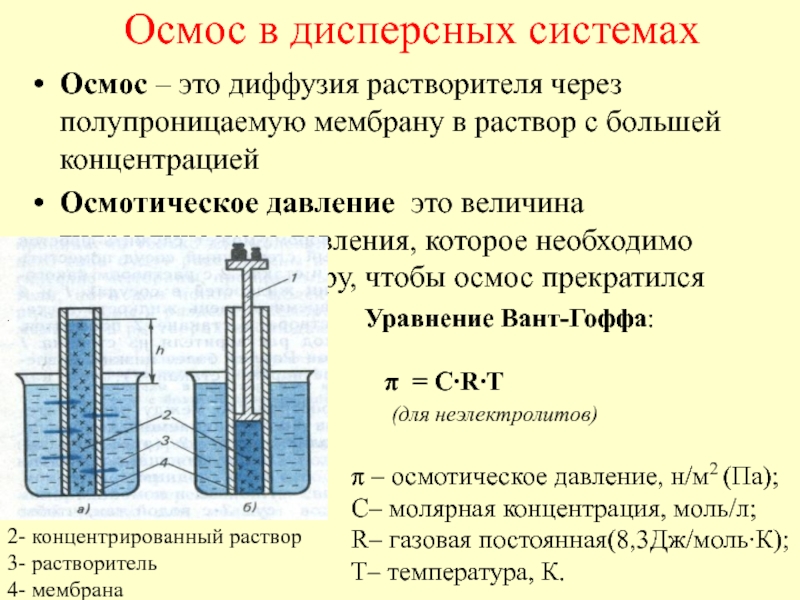
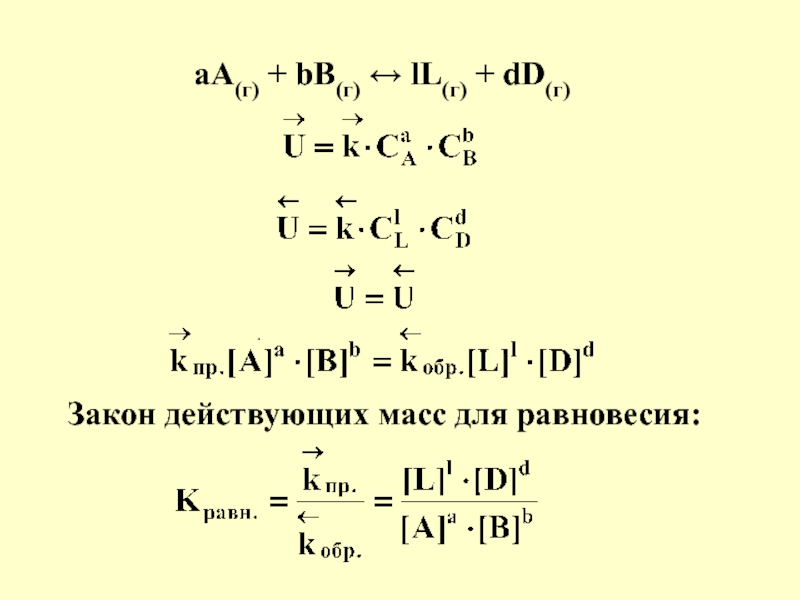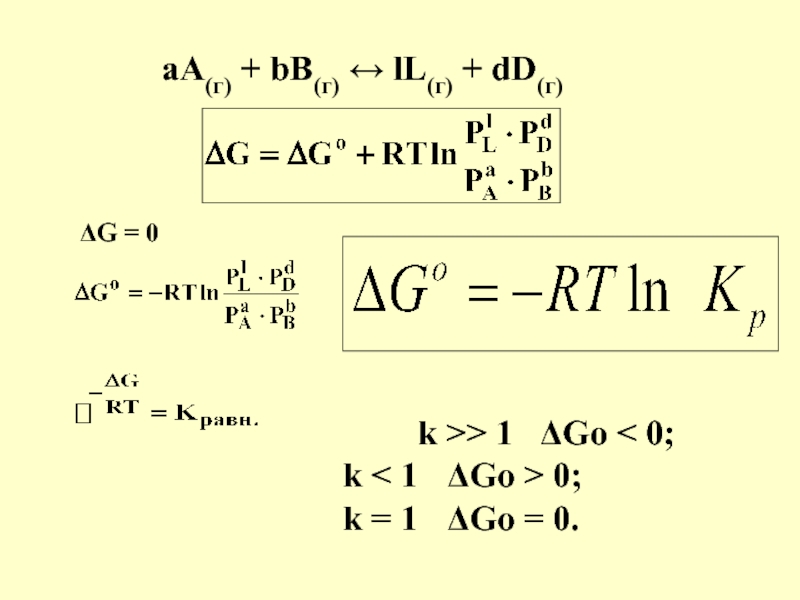в качестве лекарственных средств и применил в области химиотерапии, за
что ему присудили в 1908г.Нобелевскую премию«Медик без довольного познания химии совершенен быть не может !»
М.В.Ломоносов
XV-XVI в – швейцарский врач Парацельс Т.(1493-1591)
впервые стал успешно применять неорганические вещества для лечения
больных и был убежден, что цель химии –изготовление лекарств, а не золота и серебра.
XVI-XVIII вв химия практически развивалась врачами, отделяясь от алхимии.
XVIII в – шведский фармацевт Шееле(1742-1786), будучи помошником аптекаря, открыл кислоты растительного и животного происхождения – винную, лимонную, яблочную, молочную, мочевую. Наиболее важные его открытия – кислород и азот.
врач Майер(1814-1878) и английский ученый Д.Джоуль( 1818 – 1889)
стали основоположниками I начала термодинамики.
XIX в - русский врач И.М.Сеченов (1829-1905) стал основоположником внедрения физической химии в медицину
М.В.Ломоносов
(1711- 1765 )