Слайд 1ОГЭ
Вторник
15:00 – 16:30
Занятие 1.
15-01-2018
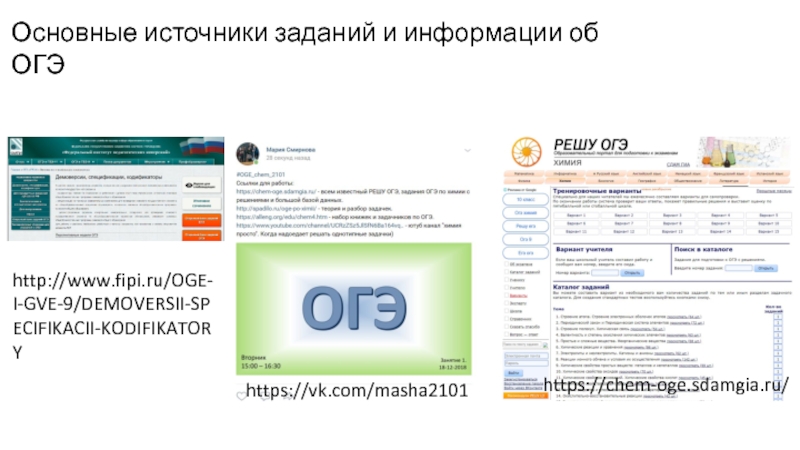
Слайд 2Основные источники заданий и информации об ОГЭ
http://www.fipi.ru/OGE-I-GVE-9/DEMOVERSII-SPECIFIKACII-KODIFIKATORY
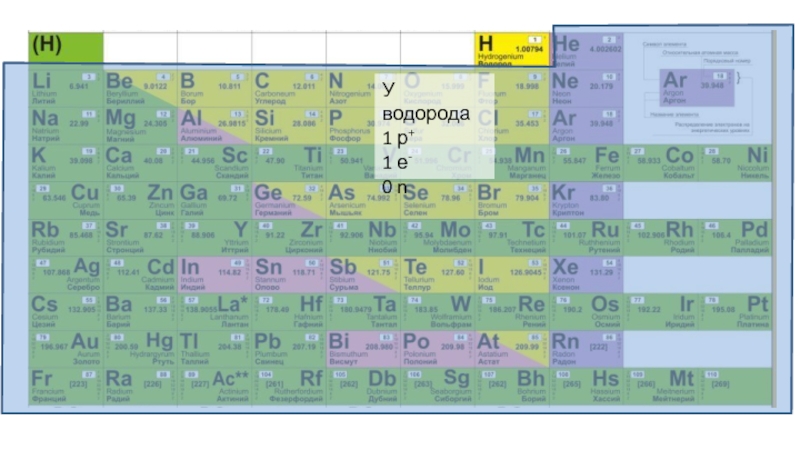
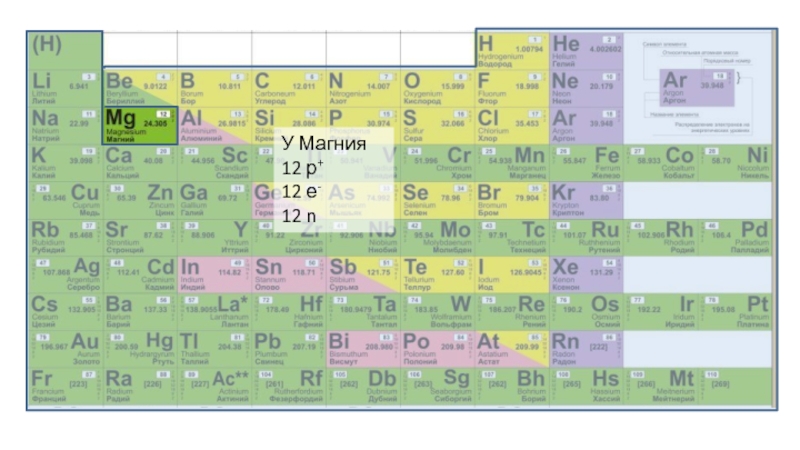
Слайд 5Атом – неделимая частичка вещества, носитель свойств этого вещества.
Молекулярные вещества
состоят из молекул, а молекулы из атомов.
Атом состоит из
ядра и орбиталей.
В ядре находятся нейтроны (n) и протоны (p+).
На орбиталях «сидят» электроны (е-).
Количество протонов равно количеству электронов.
|p+|=|e-|
Относительная атомная масса равна сумме количества протонов и нейтронов
A = n + p+
Порядковый номер элемента равен количеству протонов и количеству электронов.
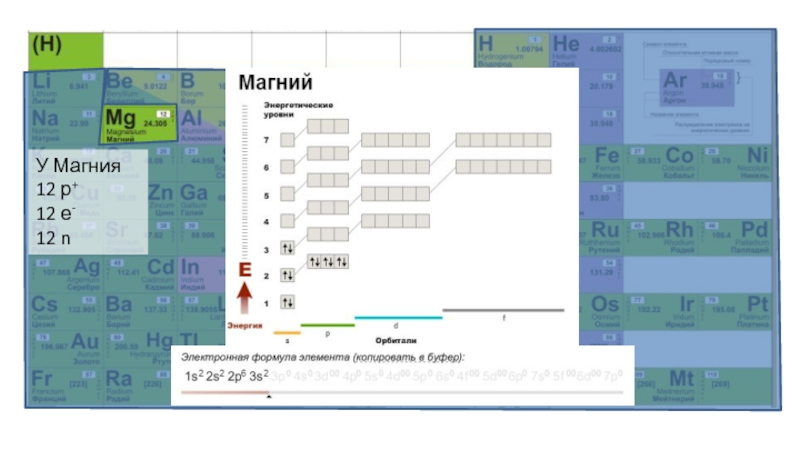
Слайд 8Электроны в атоме распределяются по орбиталям. Это распределение можно записать
электронной формулой.
На первой орбитале помещается только 2 электрона, на
второй 8, на третьей 8 + 10, на четвертой 8 + 10 + 14
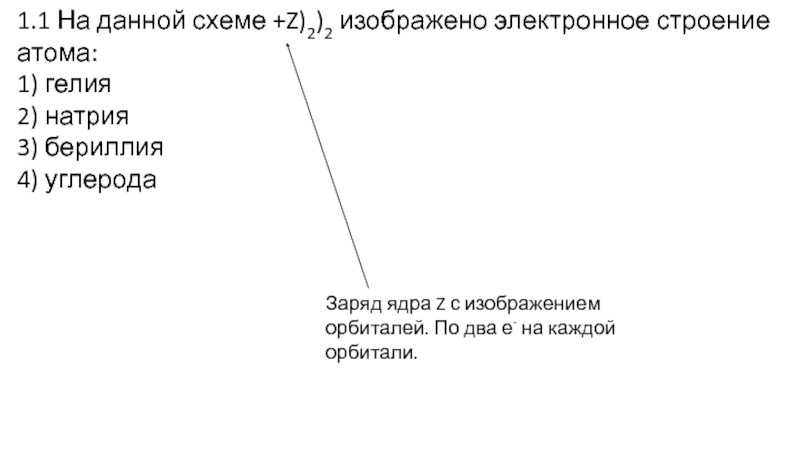
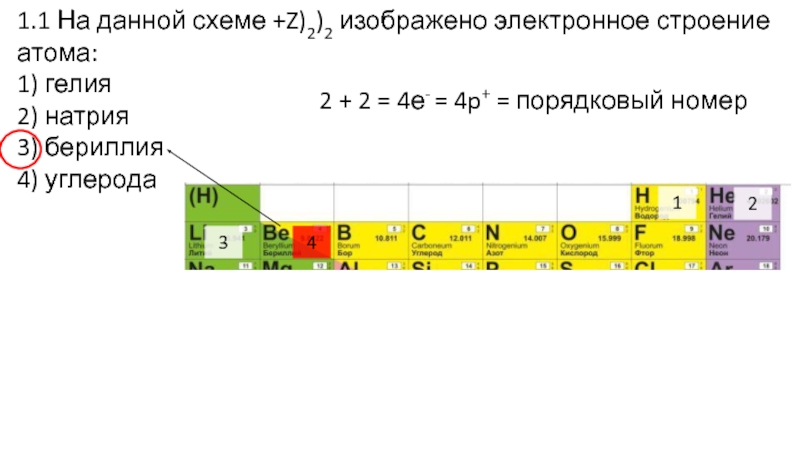
Слайд 121.1 На данной схеме +Z)2)2 изображено электронное строение атома:
1) гелия
2)
натрия
3) бериллия
4) углерода
Заряд ядра Z с изображением орбиталей. По два
е- на каждой орбитали.
Слайд 131.1 На данной схеме +Z)2)2 изображено электронное строение атома:
1) гелия
2)
натрия
3) бериллия
4) углерода
2 + 2 = 4е- = 4p+ =
порядковый номер
1
2
3
4
Слайд 141.2 Число электронов на внешнем энергетическом уровне элемента с порядковым
номером 13 равно:
13
1
3
8
Слайд 151.2 Число электронов на внешнем энергетическом уровне элемента с порядковым
номером 13 равно:
13
1
3
8
Порядковый номер элемента равен числу протонов и электронов.
На
первом уровне находится 2 электрона (13-2=11)
Но втором 8 (11-8=3)
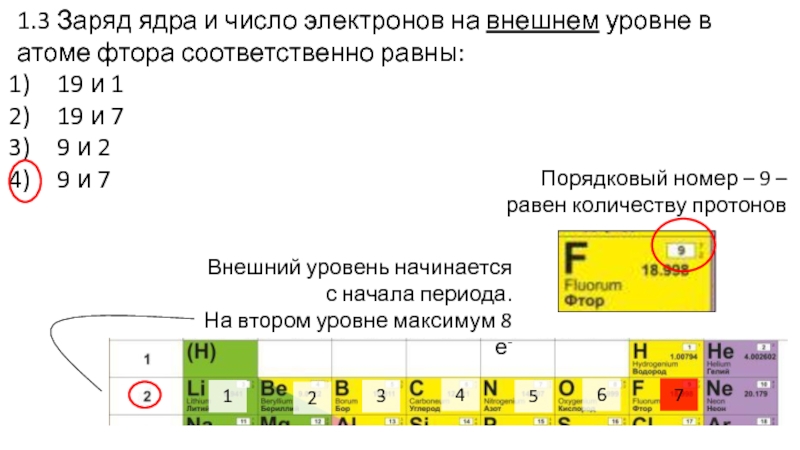
Слайд 161.3 Заряд ядра и число электронов на внешнем уровне в
атоме фтора соответственно равны:
19 и 1
19 и 7
9 и 2
9
и 7
Слайд 171.3 Заряд ядра и число электронов на внешнем уровне в
атоме фтора соответственно равны:
19 и 1
19 и 7
9 и 2
9
и 7
Порядковый номер – 9 – равен количеству протонов
Внешний уровень начинается с начала периода.
На втором уровне максимум 8 е-
1
2
3
4
5
6
7
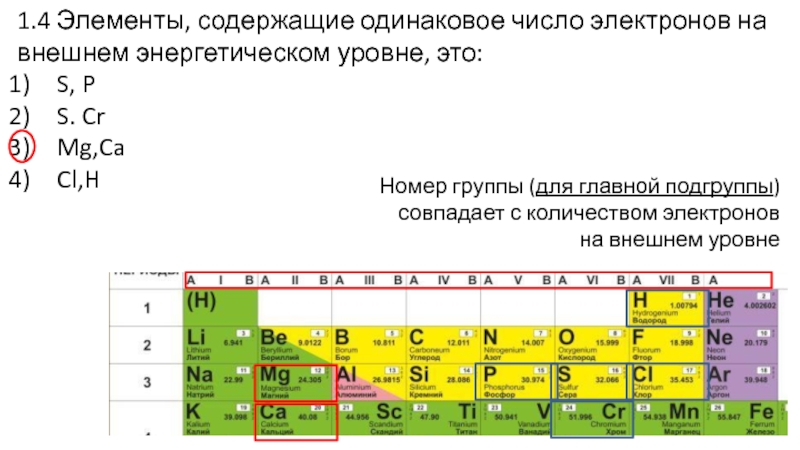
Слайд 181.4 Элементы, содержащие одинаковое число электронов на внешнем энергетическом уровне,
это:
S, P
S. Cr
Mg,Ca
Cl,H
Слайд 191.4 Элементы, содержащие одинаковое число электронов на внешнем энергетическом уровне,
это:
S, P
S. Cr
Mg,Ca
Cl,H
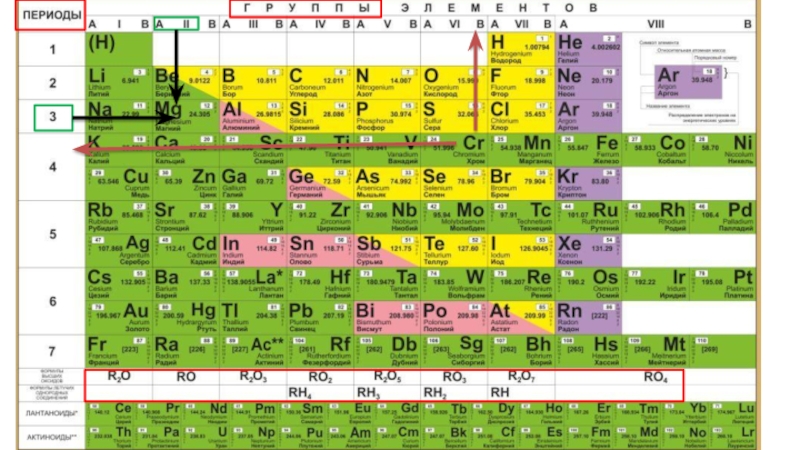
Номер группы (для главной подгруппы) совпадает с
количеством электронов на внешнем уровне
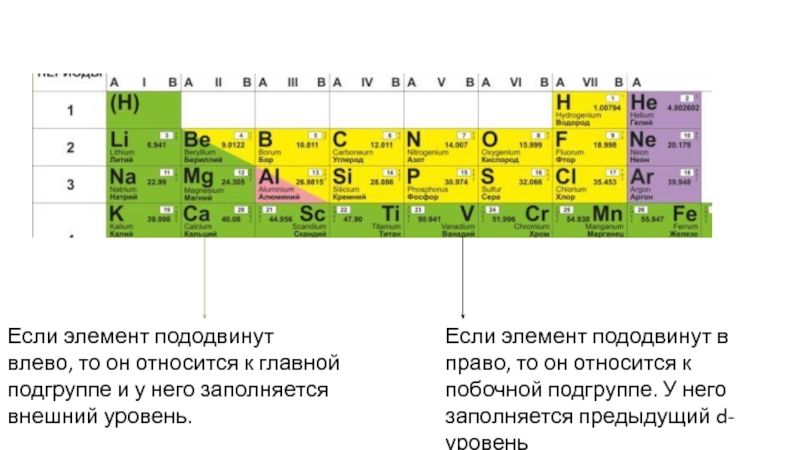
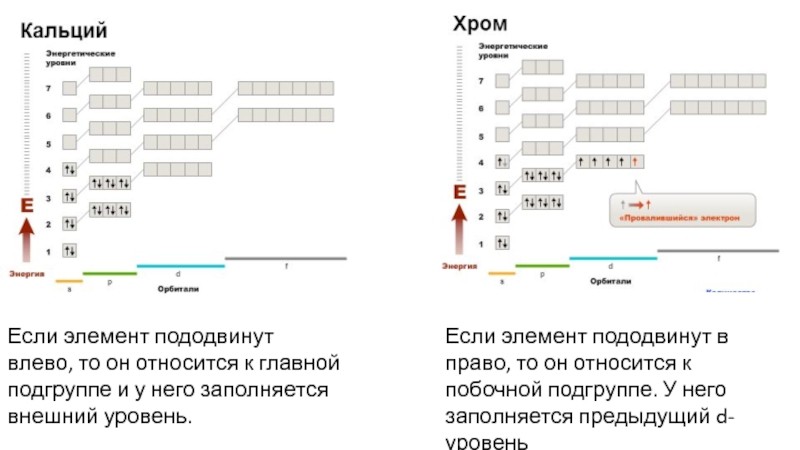
Слайд 20Если элемент пододвинут в право, то он относится к побочной
подгруппе. У него заполняется предыдущий d-уровень
Если элемент пододвинут влево, то
он относится к главной подгруппе и у него заполняется внешний уровень.
Слайд 21Если элемент пододвинут в право, то он относится к побочной
подгруппе. У него заполняется предыдущий d-уровень
Если элемент пододвинут влево, то
он относится к главной подгруппе и у него заполняется внешний уровень.
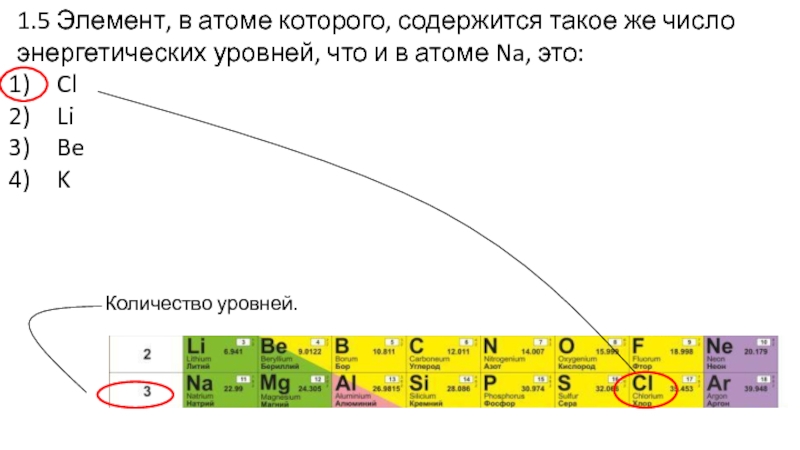
Слайд 221.5 Элемент, в атоме которого, содержится такое же число энергетических
уровней, что и в атоме Na, это:
Cl
Li
Be
K
Слайд 231.5 Элемент, в атоме которого, содержится такое же число энергетических
уровней, что и в атоме Na, это:
Cl
Li
Be
K
Количество уровней.
Слайд 241.6 Схема распределения электронов по энергетическим уровням атома кремния:
)2)4
)2)8)2
)2)8)4
2)4)8
Слайд 251.6 Схема распределения электронов по энергетическим уровням атома кремния:
)2)4
)2)8)2
)2)8)4
2)4)8
Всегда группы
отражают, количество электронов на внешнем уровне, а периоды количество энергетических
уровней.
Кремний находится в главной подгруппе 4 группы и в 3 периоде, поэтому у него на внешнем уровне 4 электрона, а всего уровней три.
Слайд 261.7 Одинаковое число электронов содержат частицы:
Na+, He
Mg2+, Cl-
K+, Cl-
S, Ne
Слайд 271.7 Одинаковое число электронов содержат частицы:
Na+, He
Mg2+, Cl-
K+, Cl-
S, Ne
Обозначения
заряда над символом химического элемента означает, что к обычной его
конфигурации прибавили или отняли электрон.
Помним, что электрон имеет отрицательный заряд, поэтому если мы его прибавляем, то получаем ОТРИЦАТЕЛЬНО заряженный ион:
Cl + e- = Cl-
Na – e- = Na+
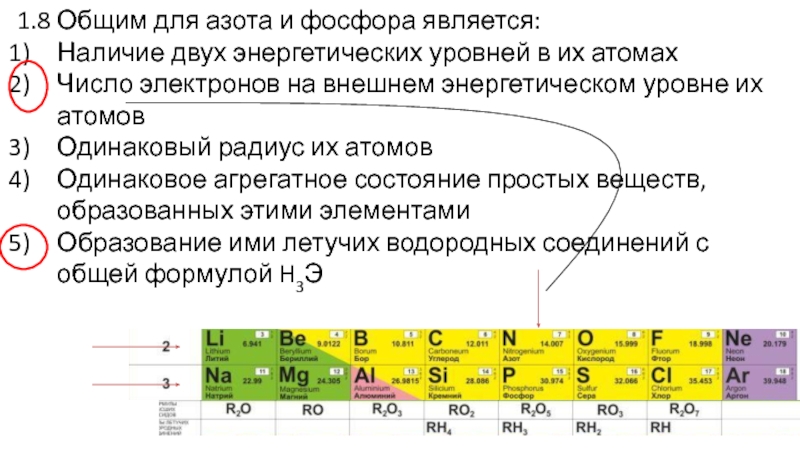
Слайд 281.8 Общим для азота и фосфора является:
Наличие двух энергетических уровней
в их атомах
Число электронов на внешнем энергетическом уровне их атомов
Одинаковый
радиус их атомов
Одинаковое агрегатное состояние простых веществ, образованных этими элементами
Образование ими летучих водородных соединений с общей формулой H3Э
Слайд 291.8 Общим для азота и фосфора является:
Наличие двух энергетических уровней
в их атомах
Число электронов на внешнем энергетическом уровне их атомов
Одинаковый
радиус их атомов
Одинаковое агрегатное состояние простых веществ, образованных этими элементами
Образование ими летучих водородных соединений с общей формулой H3Э
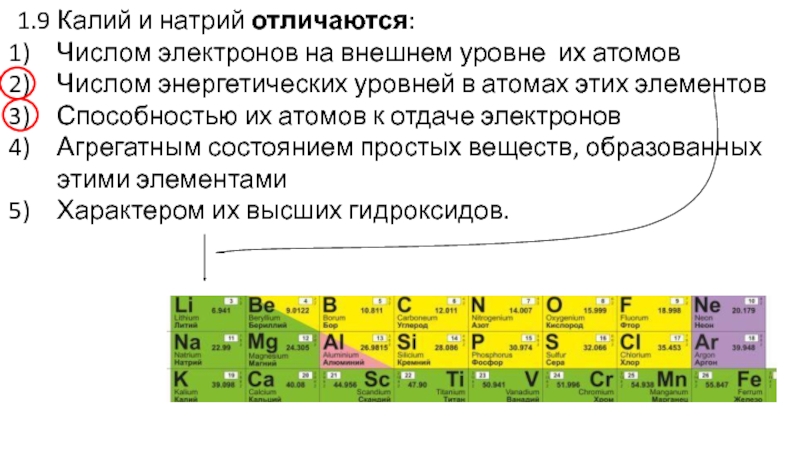
Слайд 301.9 Калий и натрий отличаются:
Числом электронов на внешнем уровне их
атомов
Числом энергетических уровней в атомах этих элементов
Способностью их атомов к
отдаче электронов
Агрегатным состоянием простых веществ, образованных этими элементами
Характером их высших гидроксидов.
Слайд 311.9 Калий и натрий отличаются:
Числом электронов на внешнем уровне их
атомов
Числом энергетических уровней в атомах этих элементов
Способностью их атомов к
отдаче электронов
Агрегатным состоянием простых веществ, образованных этими элементами
Характером их высших гидроксидов.
Слайд 32Будет 10 тестовых вопросов, каждый на отдельном слайде.
На каждый вопрос
30 секунд, потом слайд переключается.
Слайд 332.1Семь электронов на внешнем уровне в атоме:
Кислорода
Фосфора
Хлора
калия
Слайд 342.2 В атоме кальция общее число электронов и число электронных
слоев соответственно равны:
20 и 4
21 и 3
20 и 3
28 и
4
Слайд 352.3 Для какого атома и иона, характерно подобное электронное строение:
Ca,
Cr3+
Ne, Mg2+
Ne, Al
F, Al3+
Слайд 362.4 Электронная формула атома 1s22s22p63s23p2. Химический знак и формула водородного
соединения этого элемента
O, H2O
C, CH4
Si, SIH4
Cl,HCl
Слайд 372.5 Четыре электрона на внешнем уровне имеет атом
Кислорода
Кремния
Азота
Аргона
Слайд 382.6 Заряд атома магния
+ 12
+25
+3
+5
Слайд 392.7 Химический знак элемента, электронная формула которого 1s22s22p63s23p5
S
O
Cl
F
Слайд 402.8 Электронная формула атома калия
1s22s22p63s23p64s1
1s22s22p63s23p64s2
1s22s22p63s23p6
1s22s22p63s23p54s1
Слайд 412.9 Распределение электронов по электронным слоям 2e-, 8e-, 8e-, 1e-
cсоответствует химическому элементу. Который в периодической системе находится:
В 3-м периоде,
IIБ группе
В 2-м периоде, IVБ группе
В 4-м периоде, IA группе
В 4-м периоде, IIA группе
Слайд 422.10 На приведённом рисунке изображена модель атома:
Кремния
Серы
Кислорода
углерода