ОМСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ
КАФЕДРА ОБЩЕЙ И БИООРГАНИЧЕСКОЙ ХИМИИЛекция:
Свойства растворов электролитов
Основные понятия теории электролитической диссоциации. Степень диссоциации. Константа диссоциации.
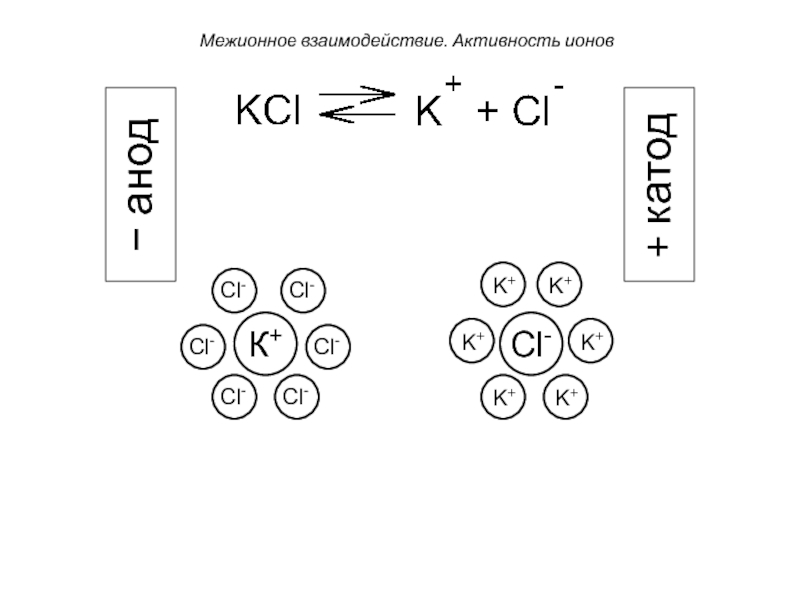
Межионные взаимодействия. Активность ионов.
Ионная сила раствора.
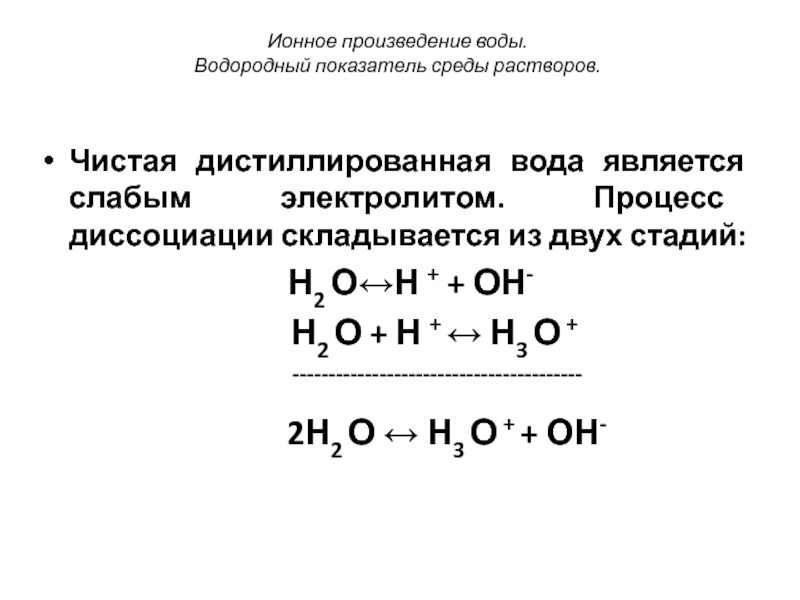
Ионное произведение воды. Водородный показатель среды.
Лектор: Ирина Викторовна Ганзина
кандидат биологических наук
доцент кафедры общей и биоорганической химии

















![ОМСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ
КАФЕДРА ОБЩЕЙ И БИООРГАНИЧЕСКОЙ Константа диссоциации воды при 25˚С, определенная методом электрической проводимости, равна:Kд = Константа диссоциации воды при 25˚С, определенная методом электрической проводимости, равна:Kд = [H+] ·[OH-] / [H2O] = 1,8](/img/thumbs/4915fff90228eb2c510f690e3fee8653-800x.jpg)

![ОМСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ
КАФЕДРА ОБЩЕЙ И БИООРГАНИЧЕСКОЙ Преобразуем математическое выражение: [Н + ]·[ОН-] = К дис · [Н2 Преобразуем математическое выражение: [Н + ]·[ОН-] = К дис · [Н2 О]= 1,8 ·10-16 ·55,6 =](/img/thumbs/b2d9e5b903c426657710b44fc038e5e1-800x.jpg)