Слайд 1 Органические реагенты — это органические соединения, которые в результате химического
взаимодействия позволяют обнаружить или количественно определить ионы или соединения вследствие
образования продуктов с различными аналитическими свойствами.
Продуктами реакций могут быть комплексные соединения или новые органические вещества, образующиеся в результате окислительно -восстановительной реакции (окислительно-восстановительные индикаторы) либо синтеза, или же иные формы самого реагента (кислотно-основные индикаторы). Помимо участия в реакциях этого типа органический реагент в растворе может адсорбироваться осадком, причем эта адсорбция сопровождается изменением цвета реагента (адсорбционные индикаторы).
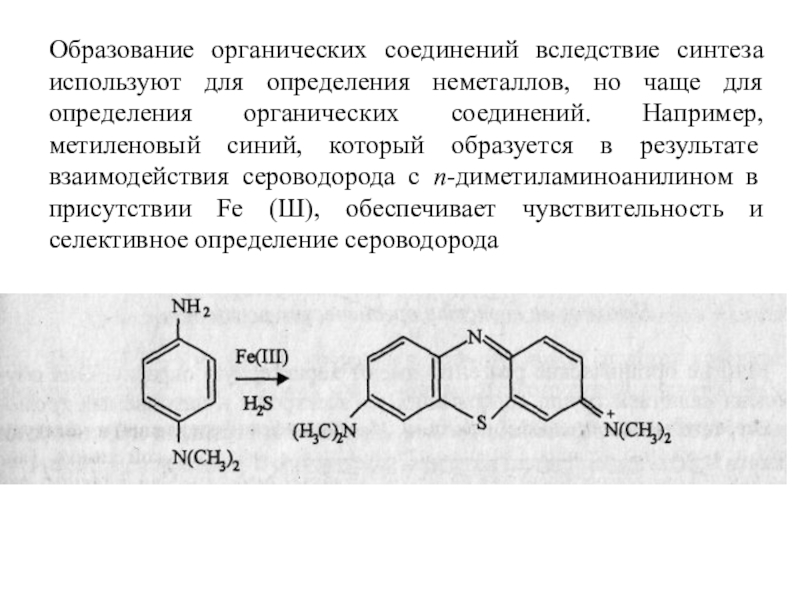
Слайд 2Образование органических соединений вследствие синтеза используют для определения неметаллов, но
чаще для определения органических соединений. Например, метиленовый синий, который образуется
в результате взаимодействия сероводорода с п-диметиламиноанилином в присутствии Fe (Ш), обеспечивает чувствительность и селективное определение сероводорода
Слайд 3 Для определения органических соединений используют разнообразные реакции синтеза окрашенных продуктов.
Пример: реакция Фудживары для определения полигалоидных алифатических соединений (хлороформа, тетрахлорида
углерода, бромоформа, дихлоруксусной кислоты). Эта реакция основана на образовании в качестве промежуточного продукта производных глутаконового альдегида, имеющих довольно интенсивную окраску
Слайд 4 Разнообразие органических реагентов и реакций с ними дает много преимуществ
органическим реагентам перед неорганическими, поэтому органические реагенты применяют в химическом
анализе гораздо чаще неорганических.
Области применения органических реагентов не ограничиваются обнаружением и количественным определением. Их применяют для разделения и концентрирования (например, в различных видах хроматографии), растворения или осаждения комплексных соединений (при получении индивидуальных соединений), маскирования одних ионов в присутствии других для повышения избирательности реакции.
Слайд 5Учитывая установленные закономерности комплексообразования и факторы, влияющие на свойства органических
реагентов и их комплексов, можно синтезировать новый органический реагент с
более выгодными свойствами для решения конкретной аналитической задачи.
Слайд 6
СВОЙСТВА ОРГАНИЧЕСКИХ РЕАГЕНТОВ
Многие органические реагенты имеют характерную окраску. Она обусловлена
наличием групп, содержащих π - электроны и называемых хромофорами, или
хромофорными группами. Наиболее известными хромофорами являются =С =С=, =С = О, =С = S, =С = N-, -0-N = N-, -N = O,
-О-N=O, =C=C-C=C=.
В общем случае молекула, содержащая хромофорные группы, имеет полосу поглощения в ультрафиолетовой или видимой областях спектра, соответствующую π - переходу, интенсивно окрашенные органические реагенты содержат несколько хромофорных групп, соединенных сопряженными (двойными) связями, т. е. имеется π - сопряженная система, в которой π -электроны делокализованы и не принадлежат какой-либо одной связи.
Слайд 7 Помимо хромофорных групп в органических реагентах могут присутствовать атом или
группа, который влияет на электронную структуру хромофора. Различают ауксохромные (-F
< -СН3 < -С1 < -Вг < ОН < -ОСН3 < -NН2 < -NНСН3 < -N(СН3)2 < -NНС6Н5) и антиауксо-хромные (-NН3 < -SО2NH2 < -СОO- < -СN <
-СООСН3 < СОСН3 <-СНО < -NО2) группы. Первые обычно действуют как электродонорные, вторые – электроноакцепторные заместители
Слайд 8 Повышение электронной плотности на ауксохроме и ее снижение на антиауксохроме
приводят к сдвигу в длинноволновую область полос поглощения реагентов и
комплексов и, наоборот, снижение электронной плотности на ауксохроме и ее повышение на антиауксохроме приводит к сдвигу полос поглощения в коротковолновую область. Этими эффектами широко пользуются в фотометрическом анализе для углубления окраски комплексов и повышения контрастности реакции комплексообразования.
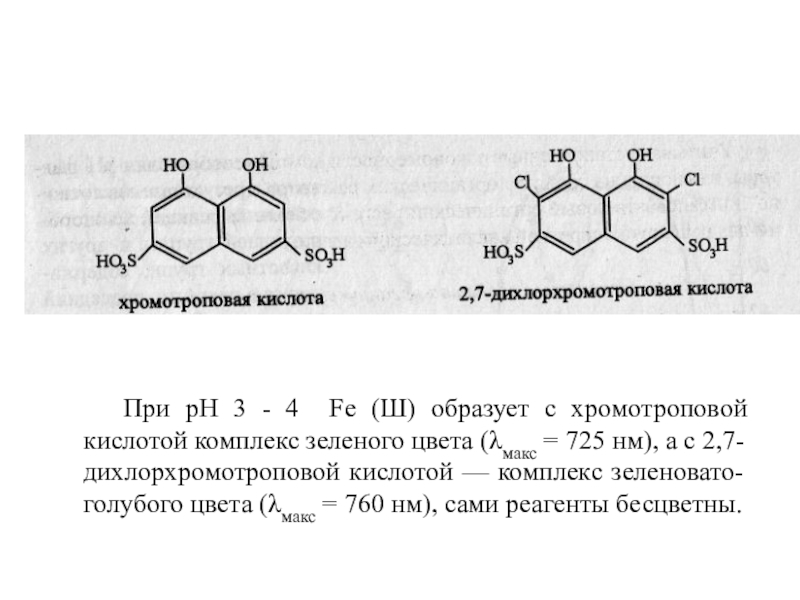
В качестве примера можно привести комплексы железа (III) с хромотроповой кислотой (рКа = 5,5) и 2,7-дихлорхромотроповой кислотой (рКа = 3,1 ):
Слайд 9 При рН 3 - 4 Fe (Ш) образует с хромотроповой
кислотой комплекс зеленого цвета (λмакс = 725 нм), а с
2,7-дихлорхромотроповой кислотой — комплекс зеленовато-голубого цвета (λмакс = 760 нм), сами реагенты бесцветны.
Слайд 10 Флуоресцирующие органические реагенты представляют собой сложные ароматические или гетероароматические соединения
с π - сопряженной системой, обладающие жесткими плоскими структурами. К
таким реагентам относятся окси- или аминопроизводные антрахинона, флавоны (морин, кверцетин и др.), некоторые ксантеновые красители (родамин, флуоресцеин), 8-оксихинолин. Надо отметить, что поглощение (переходы π →π*) и испускание (переходы π ← π*) излучения происходят на хромофорных группах. Ауксохромные заместители, как правило, усиливают выход флуоресценции из-за увеличения вероятности перехода между низшим возбужденным и основным состоянием.
Слайд 11Большинство органических реагентов мало растворимо в воде и хорошо в
органических растворителях. Растворимость в воде определяется числом доступных для гидратации
функциональных групп. Обычно эти группы входят в состав молекул, содержащих большие алифатические углеводородные цепи или ароматические кольца, которые придают этим молекулам гидрофобные свойства, что и обусловливает их низкую растворимость в воде. Увеличение гидрофобности молекулы органического реагента путем введения гидрофобных заместителей, приводит к снижению растворимости в воде. Уменьшение растворимости в водных растворах сопровождается повышением растворимости в неполярных органических растворителях. Для повышения растворимости органического реагента в воде вводят гидрофильные группы типа -SО-3, -РО3Н-, -АsО3Н-, -СОO- .
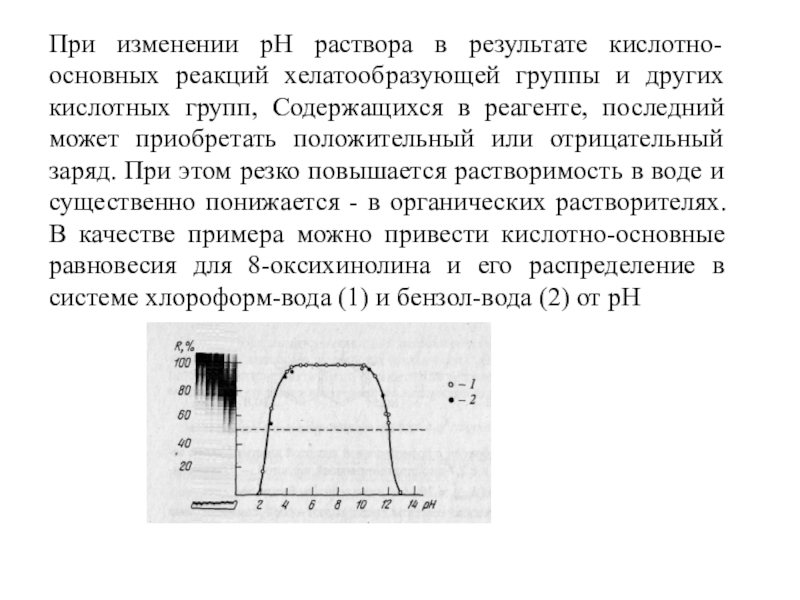
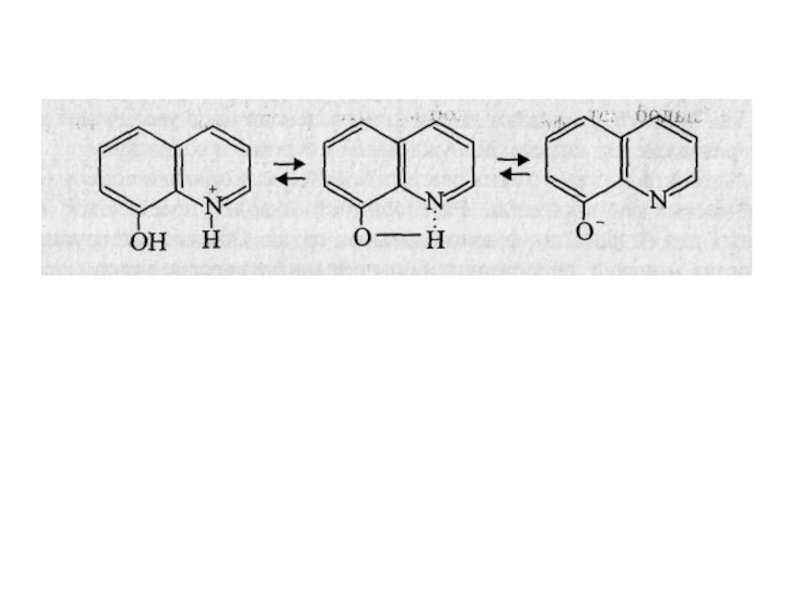
Слайд 12При изменении рН раствора в результате кислотно-основных реакций хелатообразующей группы
и других кислотных групп, Содержащихся в реагенте, последний может приобретать
положительный или отрицательный заряд. При этом резко повышается растворимость в воде и существенно понижается - в органических растворителях. В качестве примера можно привести кислотно-основные равновесия для 8-оксихинолина и его распределение в системе хлороформ-вода (1) и бензол-вода (2) от рН
Слайд 14Функционально-аналитические группировки
В большинстве реакций с органическими реагентами продуктами реакции и
являются комплексные соединения. Поэтому органические реагенты главным образом используются для
обнаружения, определения, разделения и
концентрирования ионов металлов.
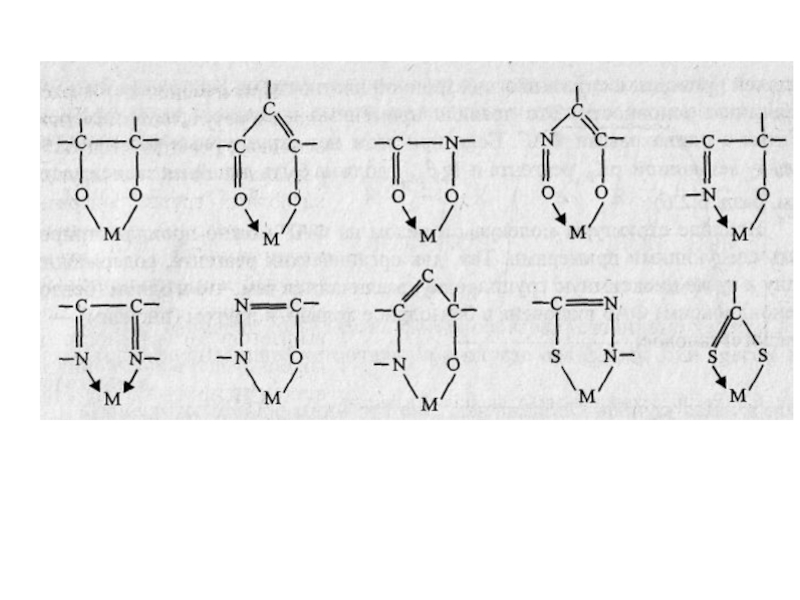
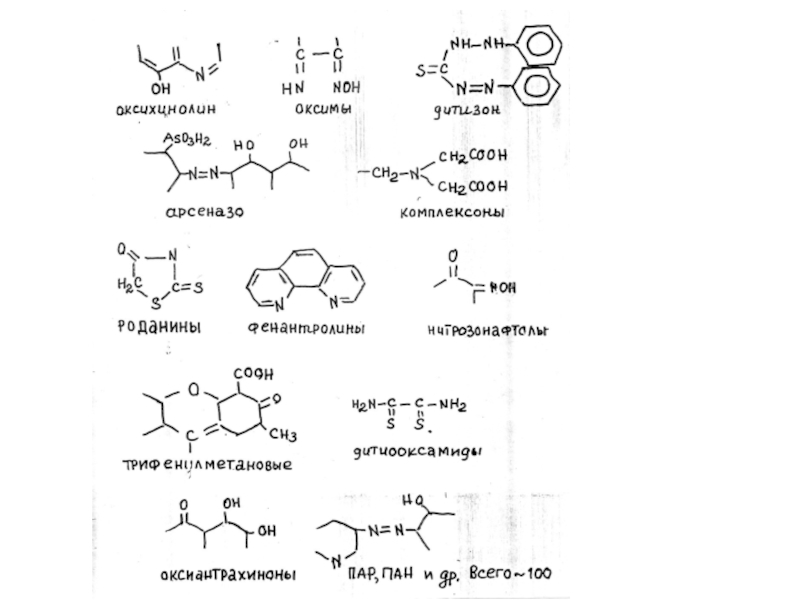
Реакционная способность органических реагентов по отношению к ионам металлов определяется прежде всего наличием функциональной аналитической группировки. Функционально-аналитическая группировка (ФАГА) — это сочетание различных функциональных групп, содержащих одинаковые или разные по природе атомы, и пространственно расположенных для возможности замыкания цикла при комплексообразовании. Некоторые наиболее часто встречающиеся функционально-аналитические группы представлены ниже
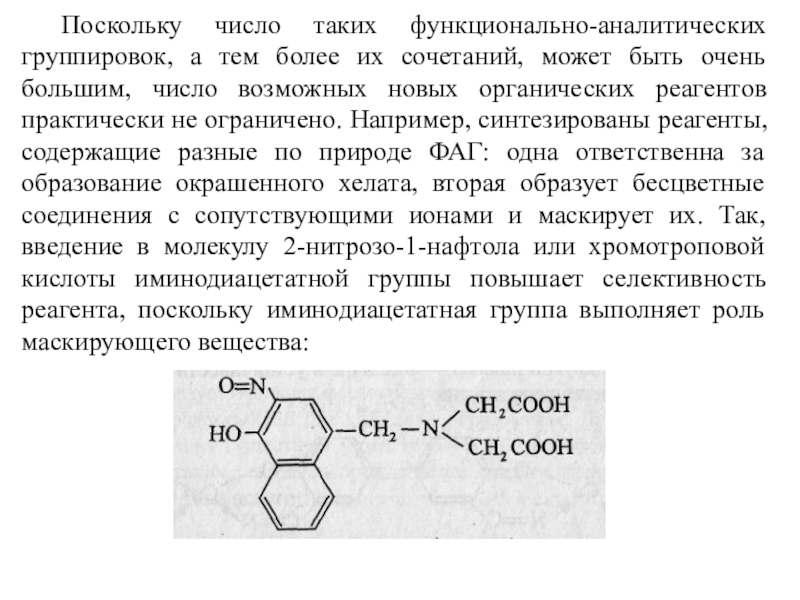
Слайд 15 Поскольку число таких функционально-аналитических группировок, а тем более их сочетаний,
может быть очень большим, число возможных новых органических реагентов практически
не ограничено. Например, синтезированы реагенты, содержащие разные по природе ФАГ: одна ответственна за образование окрашенного хелата, вторая образует бесцветные соединения с сопутствующими ионами и маскирует их. Так, введение в молекулу 2-нитрозо-1-нафтола или хромотроповой кислоты иминодиацетатной группы повышает селективность реагента, поскольку иминодиацетатная группа выполняет роль маскирующего вещества:
Слайд 16 Иминодиацетатная группа образует бесцветные комплексы, а система сопряженных связей при
комплексообразовании вызывает появление окраски. Внешний эффект при определении или обнаружении
обоими реагентами одинаков, однако селективность второго реагента выше.
Свойства ФАГ зависят от структуры молекулы в целом, от строения ФАГ, от природы донорных атомов, размера цикла, образующегося вследствие комплексообразования, от стерического влияния заместителей. Кроме того, введение подходящего заместителя (электронодонорного или электроноакцепторного) может существенно изменить основность донорных атомов ФАГ. В этом случае справедливо общее правило: введение электронодонор-ных заместителей повышает основность донорного атома ФАГ и, следовательно, его донорную способность, а введение электроноакцепторных заместителей приводит к снижению электронной плотности на донорном атоме и к снижению основности. Это правило применимо к хелатообразующим реагентам с одинаковыми ФАГА.