Слайд 1Основы химической кинетики
Лекция 6
Слайд 2СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Раздел химии, изучающий механизмы химических реакций и скорости
их протекания, называется химической кинетикой.
Химические реакции классифицируют на гомогенные и
гетерогенные:
Гомогенные реакции характеризуются отсутствием поверхности раздела между реагентами, поэтому реакции протекают во всем объеме системы.
При гомогенных реакциях реагирующие вещества находятся в одном агрегатном состоянии.
Например:
а) Реакции между газообразными веществами:
б) Реакции в растворах:
Слайд 3СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Гетерогенные реакции характеризуются наличием поверхности раздела
фаз, где
протекает взаимодействие субстрата и реагента.
При гетерогенных реакциях реагирующие вещества
находятся в разных
агрегатных состояниях.
Например:
Слайд 4СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Скорость химической реакции определяется изменением концентрации
реагирующих веществ в
единицу времени:
Если измерять концентрации веществ в молях на литр, а
время – в секундах,
то единицей измерения скорости реакции будет моль/(л·с).
Слайд 5СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
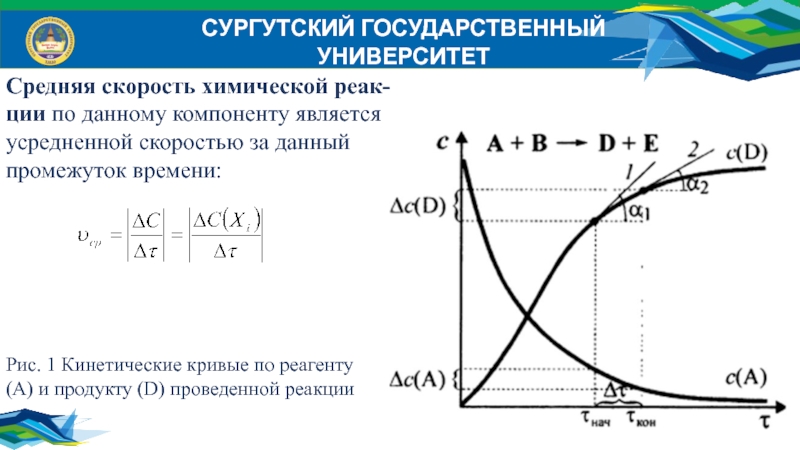
Средняя скорость химической реак-
ции по данному компоненту является
усредненной скоростью за данный
промежуток времени:
Рис. 1 Кинетические кривые по
реагенту
(А) и продукту (D) проведенной реакции
Слайд 6СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Истинная скорость химической реакции характеризуется ее скорость в
данный
промежуток времени :
Средняя скорость химической реакции по данному компоненту – это усредненная
скорость за данный промежуток времени :
Слайд 7СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Механизм – это путь, т.е. последовательность элементарных актов
взаимодействия реагентов, через которые протекает реакция.
Классификация химических процессов по механизму:
Простые
или элементарные реакции – это реакции, протекающие в одну
стадию.
Для таких реакций химическое уравнение полностью отражает, какие частицы и в каких соотношения непосредственно участвуют в элементарном акте взаимодействия.
Например:
а)
б)
в)
Слайд 8СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Сложные реакции – это реакции, протекающие в несколько
стадий, каждая из которых является простой реакцией.
Например: реакция
является сложной и протекает через множество стадий, протекание которых идет по радикальному механизму:
Зарождение цепей:
Развитие (рост) цепей:
Обрыв цепей:
Слайд 9СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
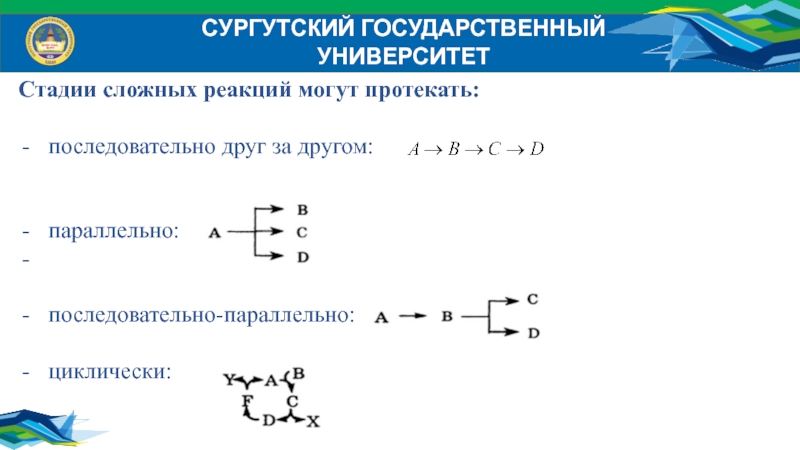
Стадии сложных реакций могут протекать:
последовательно друг за другом:
параллельно:
последовательно-параллельно:
циклически:
Слайд 10СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
ФАКТОРЫ, ВЛИЯЮЩИЕ НА СКОРОСТЬ ГОМОГЕННОЙ РЕАКЦИИ
1. Природа реагирующих
веществ;
2. Концентрация реагентов;
3. Температура;
4. Катализатор.
Слайд 11СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
ВЛИЯНИЕ ПРИРОДЫ РЕАГИРУЮЩИХ ВЕЩЕСТВ
В зависимости от природы реагентов,
скорость реакции будет меняться:
Реакции между молекулами и атомами протекают обычно
медленно:
2. Между ионами и радикалами – быстро:
Слайд 12СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
ВЛИЯНИЕ КОНЦЕНТРАЦИИ РЕАГЕНТОВ
Закон действующих масс: скорость простой гомогенной
реакции при постоянной температуре пропорциональна произведению концентрации реагирующих веществ, возведенных
в степени, численно равные их стехиометрическим коэффициентам:
где a, b – стехиометрические коэффициенты;
[A], [B]- молярные концентрации реагентов, моль/л;
k – константа скорости реакции.
Значение константы скорости реакции численно равно скорости реакции при концентрациях реагентов, равных 1 моль/л.
Слайд 13СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Кинетическое уравнение химической гетерогенной реакции :
имеет вид:
-
константа скорости реакции;
- порядок реакции по газообразному или растворенному
компоненту.
Слайд 14СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Константа скорости реакции I порядка
если моль/л
а - исходная концентрация субстрата;
(а-х) – текущая концентрация субстрата
х – концентрация продукта реакции, образующегося к моменту времени τ;
Слайд 15СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Тогда,
В состоянии равновесия:
т.е.
Слайд 16СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Интегрируем с разделением переменных:
Получаем выражение:
где J – постоянная
интегрирования;
при х=0 и τ=0
Слайд 17СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
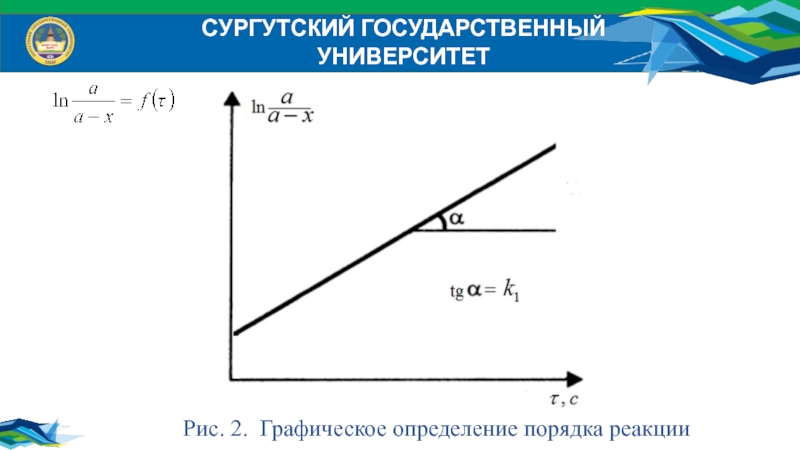
Преобразуем:
Выразим константу скорости реакции:
Проверить правильность анализа можно графическим
либо аналитическим методом.
Слайд 18СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Рис. 2. Графическое определение порядка реакции
Слайд 19СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Для анализа удобно пользоваться полупериодом реакции, т.е. когда
прореагировало 0,5 субстрата.
Тогда,
т.е.
Тогда время полупревращения будет:
Слайд 20СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Константа скорости реакции II порядка
а - исходная концентрация субстрата;
(а-х) – текущая концентрация субстрата;
х – концентрация продукта реакции, образующегося к моменту времени τ;
Слайд 21СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Тогда,
В состоянии равновесия:
т.е.
Слайд 22СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Интегрируем с разделением переменных:
Получаем выражение:
где J – постоянная
интегрирования
при х=0 и τ=0
Слайд 23СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Преобразуем:
Выразим константу скорости реакции:
Проверить правильность анализа можно графическим
либо
аналитическим методом.
Слайд 24СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
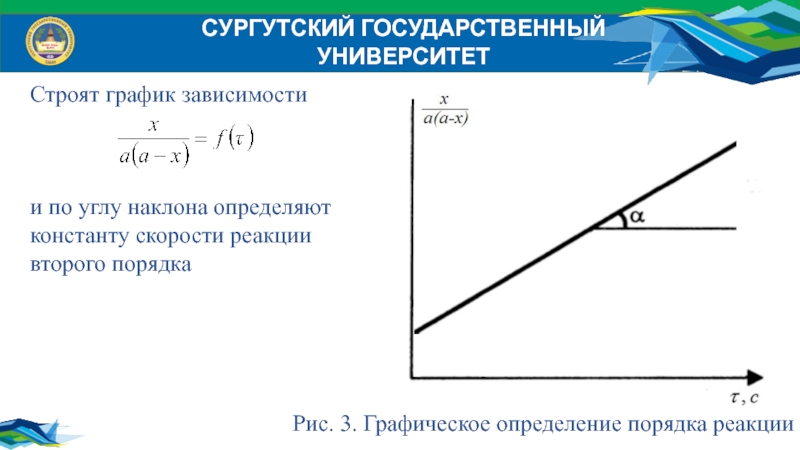
Строят график зависимости
и по углу наклона определяют
константу скорости реакции
второго порядка
Рис. 3. Графическое определение порядка реакции
Слайд 25СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
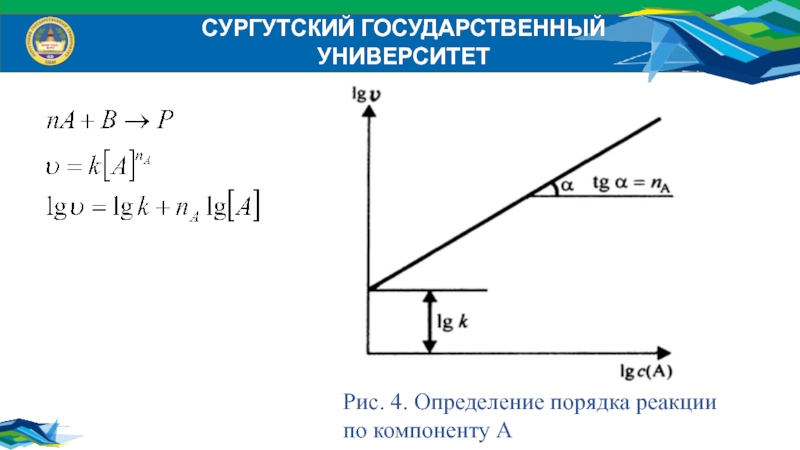
Порядок реакции по реагенту равен показателю степени, в
которую надо
возвести концентрацию данного реагента в кинетическом уравнении
сложной реакции,
чтобы вычисленная по этому уравнению скорость была
равна скорости, найденной экспериментально.
где - порядок реакции по реагентам А и В соответственно.
Слайд 26СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Рис. 4. Определение порядка реакции
по компоненту А
Слайд 27СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
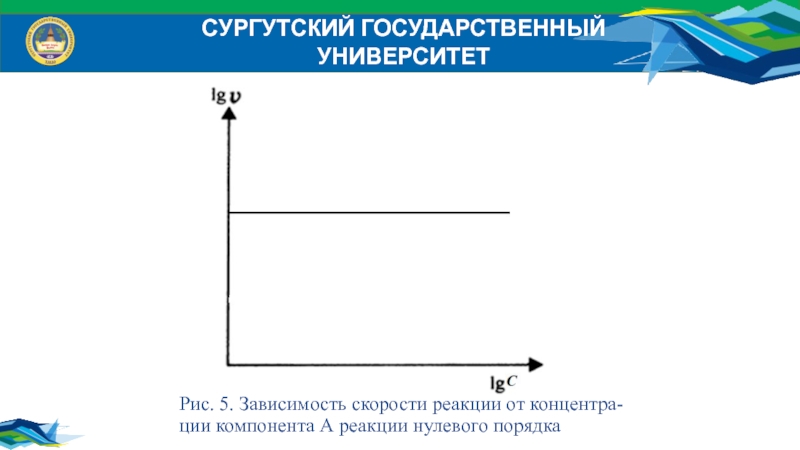
Рис. 5. Зависимость скорости реакции от концентра-
ции компонента
А реакции нулевого порядка
Слайд 28СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
2. Метод подстановки в формулы
Заключается в том,
что опытные результаты (текущие концентрации
веществ в моменты времени (t)
последовательно подставляются в
интегральные кинетические уравнения реакций нулевого ( ),
первого ( ), второго ( ) порядков и
определяется, какое из уравнений дает практически постоянную величину константы скорости. Именно это уравнение и определяет порядок исследуемой реакции.
Слайд 29СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Молекулярность реакции
определяет число молекул, участвующих в элементарном акте
взаимодействия.
Молекулярность часто не совпадает с порядком реакции, т.к.
трудно представить одновременное взаимодействие трех или более молекул
Слайд 30СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
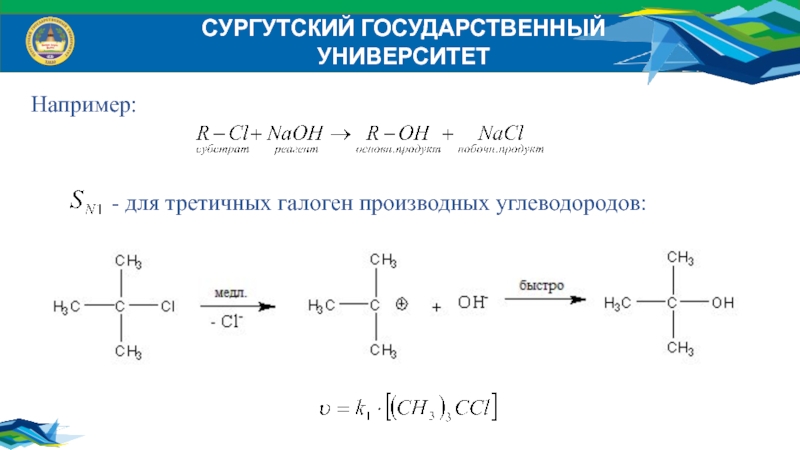
Например:
- для третичных галоген производных углеводородов:
Слайд 31СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
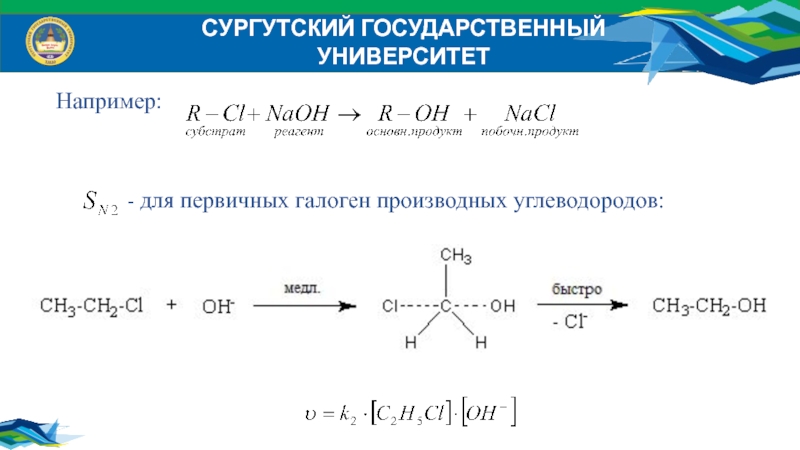
Например:
- для первичных галоген производных углеводородов:
Слайд 32Количественные закономерности константы скорости реакции от температуры
константа скорости реакции;
экспонента;
предэкспоненциальный множитель, равный числу соударений молекул в реакционной смеси.
Аэксп < < < Атеор
число соударений;
число активных соударений.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Слайд 33Число активных соударений представляет собой энтропийный фактор:
Тогда получаем уравнение Вант-Гоффа:
СУРГУТСКИЙ
ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Слайд 34СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
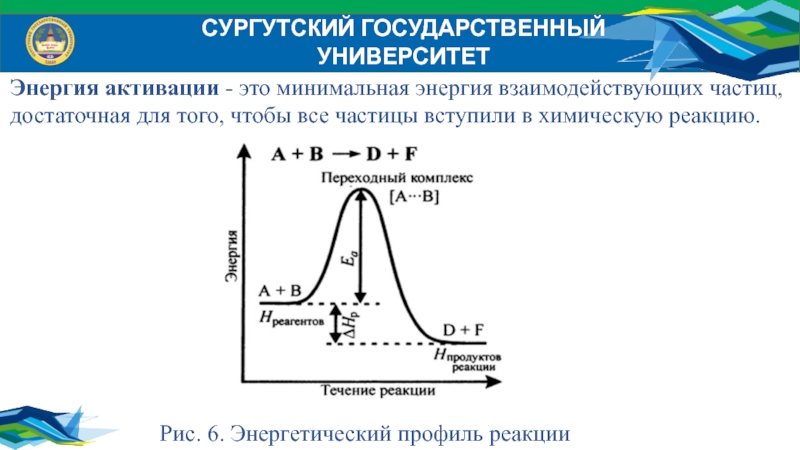
Энергия активации - это минимальная энергия взаимодействующих частиц,
достаточная для того, чтобы все частицы вступили в химическую реакцию.
Рис. 6. Энергетический профиль реакции
Слайд 35СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Энергия активации является очень важной энергетической характеристикой
реакции,
которая связана с константой скорости реакции уравнением
Аррениуса:
где
константа скорости реакции при температуре Т, К;
предэкспоненциальный коэффициент (коэффициент Аррениуса,
учитывающий частоту столкновения частиц, ориентированных
определенным образом;
основание натурального логарифма;
энергия активации, Дж/моль;
- универсальная газовая постоянная.
Слайд 36СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
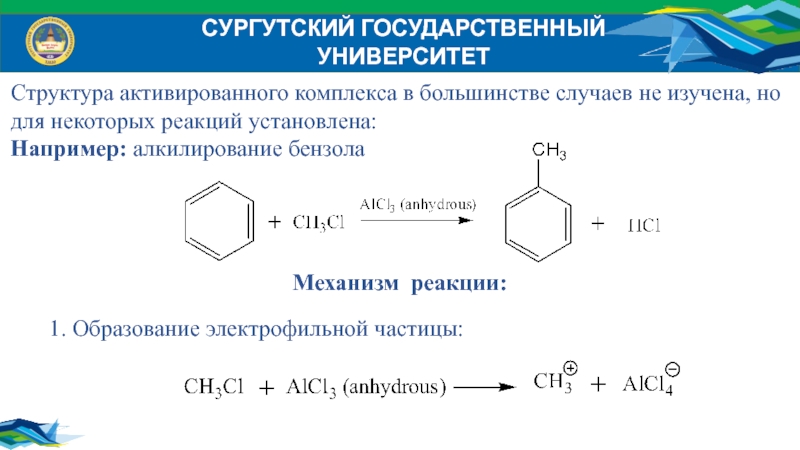
Структура активированного комплекса в большинстве случаев не изучена,
но
для некоторых реакций установлена:
Например: алкилирование бензола
Механизм реакции:
1. Образование электрофильной частицы:
Слайд 37СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
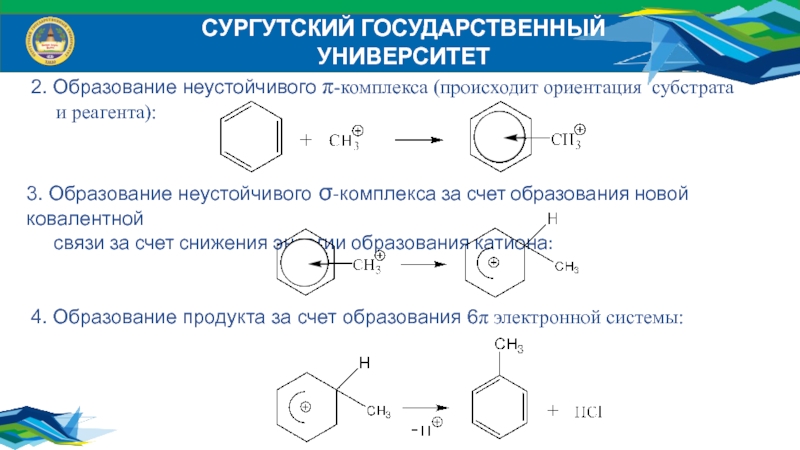
4. Образование продукта за счет образования 6π электронной
системы:
3. Образование неустойчивого σ-комплекса за счет образования новой ковалентной
связи за счет снижения энергии образования катиона:
2. Образование неустойчивого π-комплекса (происходит ориентация субстрата
и реагента):
Слайд 38СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Значение энергии активации реакции можно определить, измерив
константы
скорости этой реакции при двух разных температурах и
используя следующее
уравнение:
- константы скорости реакции при температурах .
Слайд 39СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Энергия активации - это минимальная энергия взаимодействующих частиц,
достаточная для того, чтобы все частицы вступили в химическую реакцию:
где
константа скорости реакции при температуре Т, К;
абсолютные температуры, К;
энергия активации, Дж/моль;
- универсальная газовая постоянная.
Слайд 40СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА СКОРОСТЬ РЕАКЦИИ
Уравнение Вант-Гоффа: с увеличением
температуры на каждые 10°С (К) скорость химической реакции возрастает в
2 – 4 раза:
γ (гамма) - температурный коэффициент скорости реакции, показывающий, во сколько раз увеличивается скорость реакции при увеличении температуры на каждые 10 К;
- скорости реакции при температурах соответственно.
Слайд 41СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Теория активных столкновений
Не каждое столкновение приводит к акту
химического взаимодействия;
К химическому взаимодействию приводят только те столкновения, в которых
участвуют частицы, обладающие энергией, необходимой для данного взаимодействия (энергией активации);
При соударении частицы должны быть определенным образом с ориентированы относительно друг друга.
Слайд 42СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
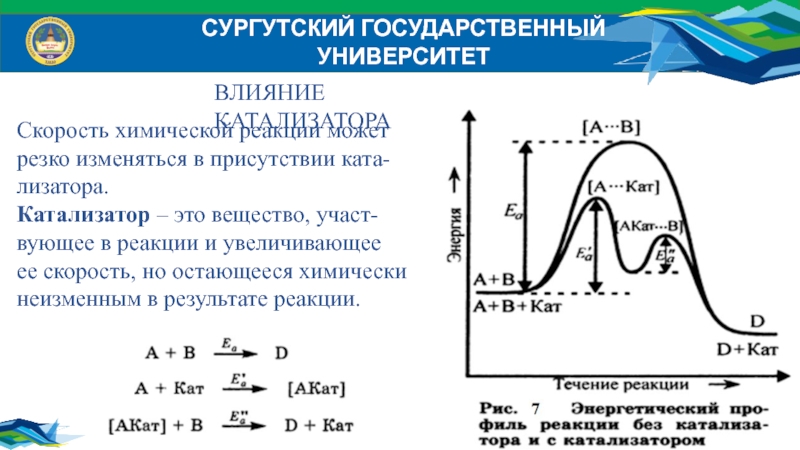
ВЛИЯНИЕ КАТАЛИЗАТОРА
Скорость химической реакции может
резко изменяться в
присутствии ката-
лизатора.
Катализатор – это вещество, участ-
вующее в реакции и увеличивающее
ее
скорость, но остающееся химически
неизменным в результате реакции.
Слайд 43СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Химические реакции бывают необратимые и обратимые:
Необратимые химические
реакции – это реакции, протекающие только
в одном направлении до полного
израсходования одного из реагирующих
веществ.
Слайд 44СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Обратимые – это реакции, в которых одновременно протекают
две
взаимно противоположные реакции – прямая и обратная.
Примером обратимых процессов
являются реакции образования и
разложения иодоводорода или сложного эфира:
Слайд 45СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
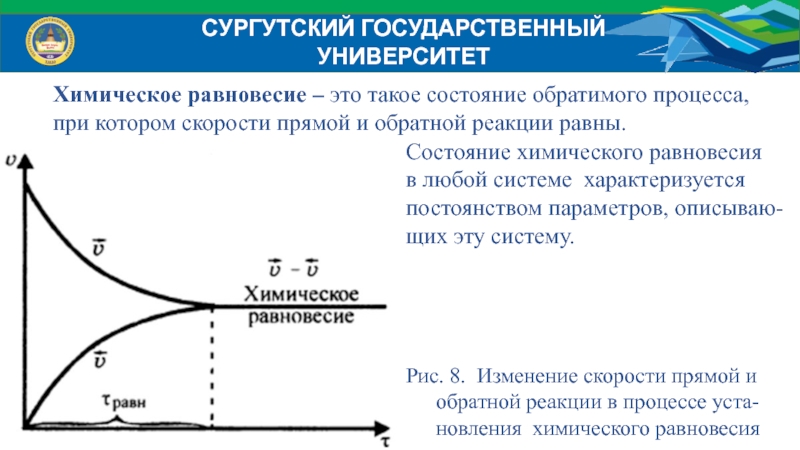
Химическое равновесие – это такое состояние обратимого процесса,
при
котором скорости прямой и обратной реакции равны.
Состояние химического равновесия
в любой
системе характеризуется
постоянством параметров, описываю-
щих эту систему.
Рис. 8. Изменение скорости прямой и
обратной реакции в процессе уста-
новления химического равновесия
Слайд 46СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Особенности состояния химического равновесия
Динамический характер химического равновесия –
прямая и обратная реакции не прекращаются, а протекают с равными
скоростями;
Постоянство состояния химического равновесия во времени – при неизменных внешних условиях состав равновесной системы не меняется (равновесные концентрации постоянны);
Подвижность равновесия – при изменении внешних условий происходит смещение химического равновесия, т.е. установление новых равновесных концентраций всех реагирующих веществ;
Возможность подхода к состоянию равновесия с двух сторон – как со стороны исходных веществ, так и со стороны продуктов реакции.
Слайд 47СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Выведем, чему равна константа равновесия процесса, протекающего
в гомогенной
системе:
В состоянии химического равновесия скорость прямой реакции равна
скорости обратной
реакции:
Слайд 48СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Константа химического равновесия обратимого процесса равна отношению произведения
равновесных концентраций продуктов реакции к произведению концентраций исходных веществ в
степенях их стехиометрических коэффициентов:
Если Кравн > 1, то в системе выше содержание конечных продуктов, т.е. равновесие смещено влево (←);
Если Кравн < 1, то в системе выше содержание исходных веществ, т.е. равновесие смещено вправо (→);
Слайд 49СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Смещение химического равновесия
Влияние температуры;
Концентрации веществ;
Давления (в системах газообразных
веществ);
Влияние катализатора.
Принцип Ле Шателье:
Если на систему, находящуюся в состоянии химического
равновесия, ока-
зывать воздействие путем изменения концентрации реагентов, давления или температуры в системе, то равновесие всегда смещается в направле-нии той реакции, протекание которой ослабляет это воздействие.
Слайд 50СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Влияние концентрации реагентов
на смещение химического равновесия
Слайд 51СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Влияние давления реагентов
на смещение химического равновесия
Слайд 52СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Влияние температуры на состояние химического равновесия:
Слайд 53СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Влияние катализатора
Катализатор не вызывает смещения химического равновесия, а
лишь ускоряет его наступление
Слайд 54СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Принцип адаптивных перестроек
Любая живая система при воздействии на
нее перестраивается так, чтобы уменьшить это воздействие.
Слайд 55Спасибо за внимание!
Вопросы?
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ