Слайд 1ОСОБЕННОСТИ СТРОЕНИЯ, РЕАКЦИОННОЙ СПОСОБНОСТИ
И МЕТОДЫ СИНТЕЗА АЗОТСОДЕРЖАЩИХ СОЕДИНЕНИЙ
Слайд 2НИТРОСОЕДИНЕНИЯ
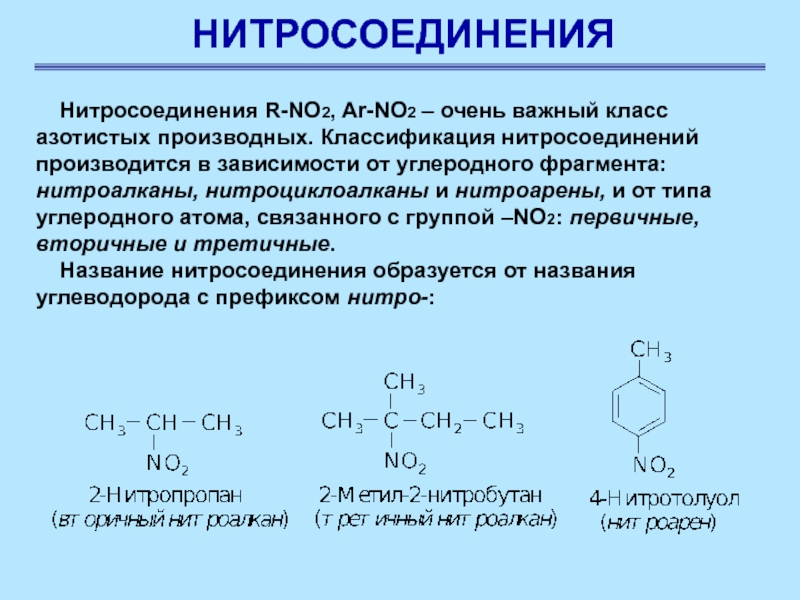
Нитросоединения R-NO2, Ar-NO2 – очень важный класс азотистых производных.
Классификация нитросоединений производится в зависимости от углеродного фрагмента: нитроалканы, нитроциклоалканы
и нитроарены, и от типа углеродного атома, связанного с группой –NO2: первичные, вторичные и третичные.
Название нитросоединения образуется от названия углеводорода с префиксом нитро-:
Слайд 3НИТРОСОЕДИНЕНИЯ
Строение и физические свойства
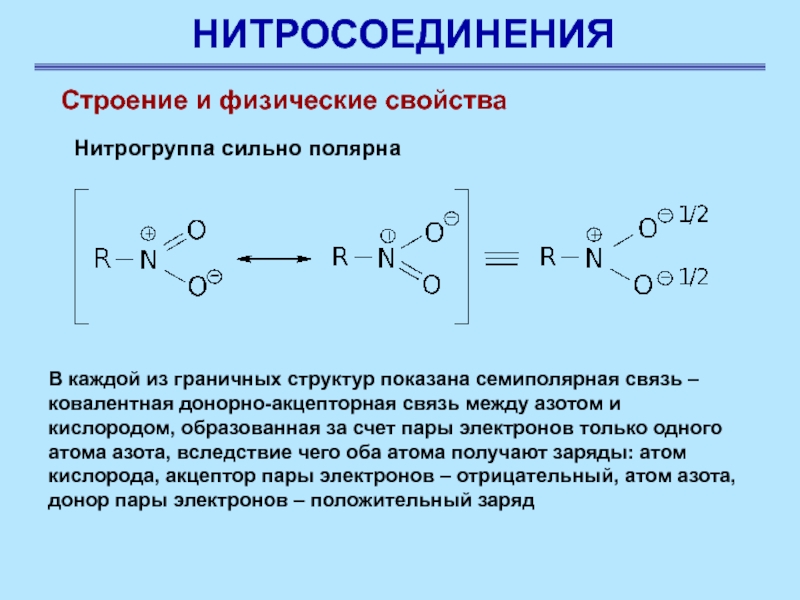
Нитрогруппа сильно полярна
В каждой
из граничных структур показана семиполярная связь – ковалентная донорно-акцепторная связь
между азотом и кислородом, образованная за счет пары электронов только одного атома азота, вследствие чего оба атома получают заряды: атом кислорода, акцептор пары электронов – отрицательный, атом азота, донор пары электронов – положительный заряд
Слайд 4НИТРОСОЕДИНЕНИЯ
Строение и физические свойства
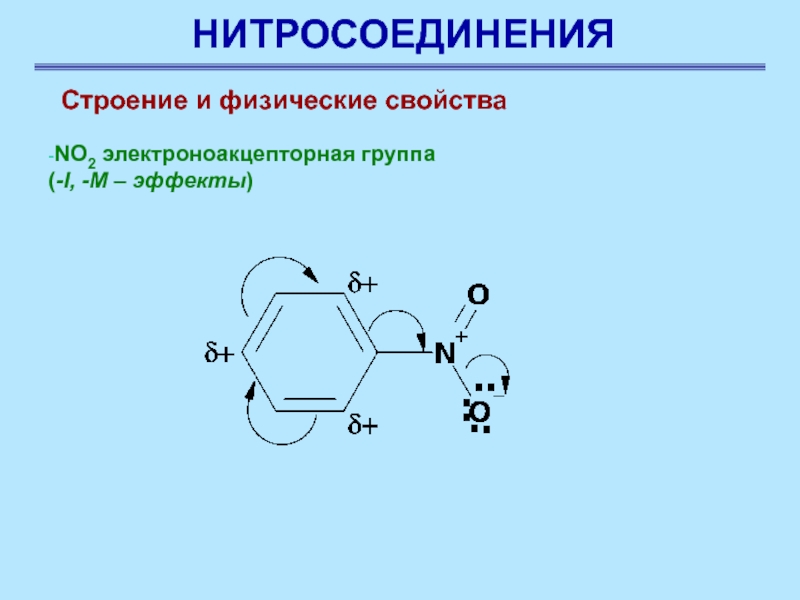
-NO2 электроноакцепторная группа
(-I, -M –
эффекты)
Слайд 5НИТРОСОЕДИНЕНИЯ
Строение и физические свойства
Нитроалканы представляют собой бесцветные жидкости
с высокими для их молекулярных масс температурами кипения. Температура кипения
нитрометана 101,2 оС; нитроэтана – 114 оС. Они обладают приятным запахом, перегоняются без разложения, мало растворимы в воде, ядовиты. Нитроалкены и нитроарены – жидкие или твердые вещества желтого цвета. Они тяжелее воды и не растворимы в ней. Эти нитросоединения имеют острый запах и высокотоксичны, особенно нитробензол
Слайд 6НИТРОСОЕДИНЕНИЯ
Химические свойства
Термодинамическая неустойчивость нитросоединений
Молярная теплота разложения нитрометана
около 270 кДж/моль
СН3NO2→ 1/2 N2 + CO2 + 3/2
H2
Значительная энергия и большая скорость такого процесса послужили основой для практического применения нитросоединений в качестве взрывчатых веществ
Слайд 7НИТРОСОЕДИНЕНИЯ
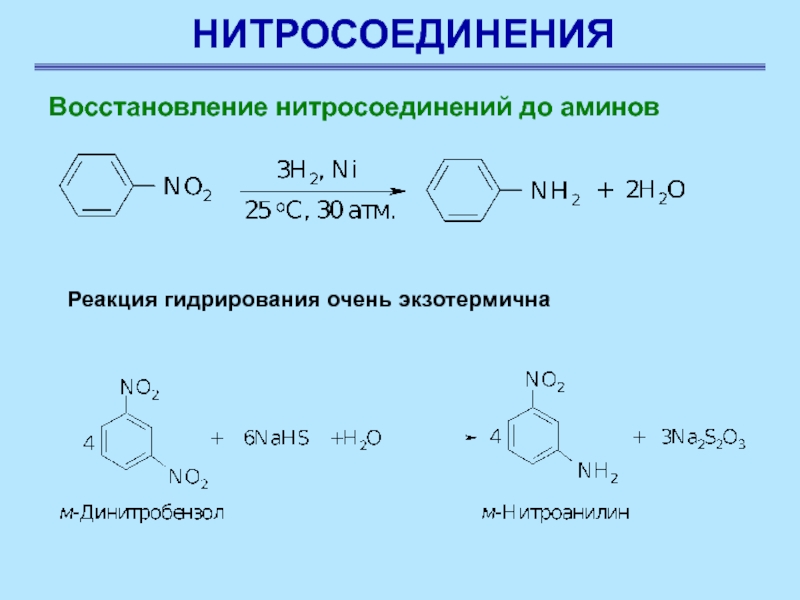
Восстановление нитросоединений до аминов
Восстановление нитросоединений до аминов –
наиболее важная реакция для синтеза азотсодержащих соединений.
Нитроалканы восстанавливают до алкиламинов
оловом или железом в кислой среде, водородом в условиях гетерогенного катализа
∆Н= -356 кДж/моль
Слайд 8НИТРОСОЕДИНЕНИЯ
Восстановление нитросоединений до аминов
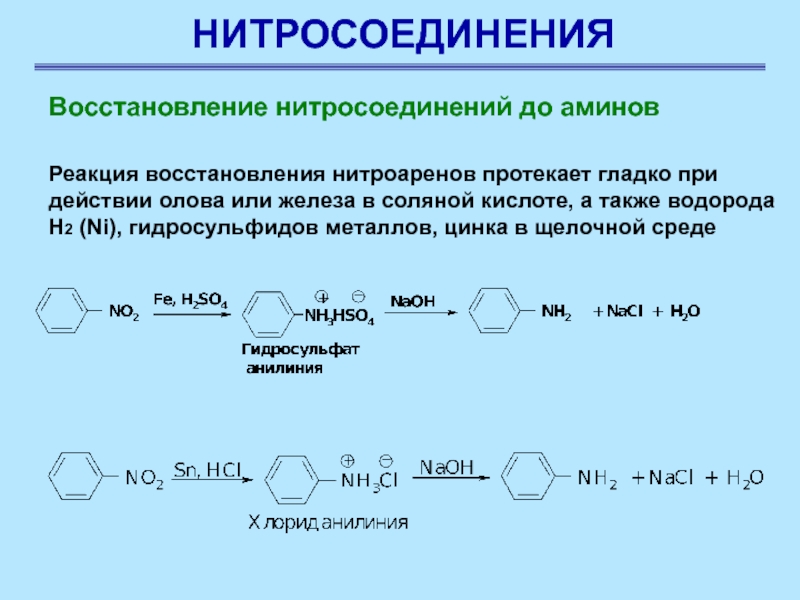
Реакция восстановления нитроаренов протекает гладко
при действии олова или железа в соляной кислоте, а также
водорода Н2 (Ni), гидросульфидов металлов, цинка в щелочной среде
Слайд 9НИТРОСОЕДИНЕНИЯ
Восстановление нитросоединений до аминов
Реакция гидрирования очень экзотермична
Слайд 10НИТРОСОЕДИНЕНИЯ
ЗИНИН
Николай Николаевич (25.VIII.1812–18.II.1880)
академик, возглавлял кафедру общей химии Медико-хирургической
академии в Петербурге, организатор и первый президент Русского химического общества.
Известен своими работами в области ароматических нитросоединений.
Слайд 11НИТРОСОЕДИНЕНИЯ
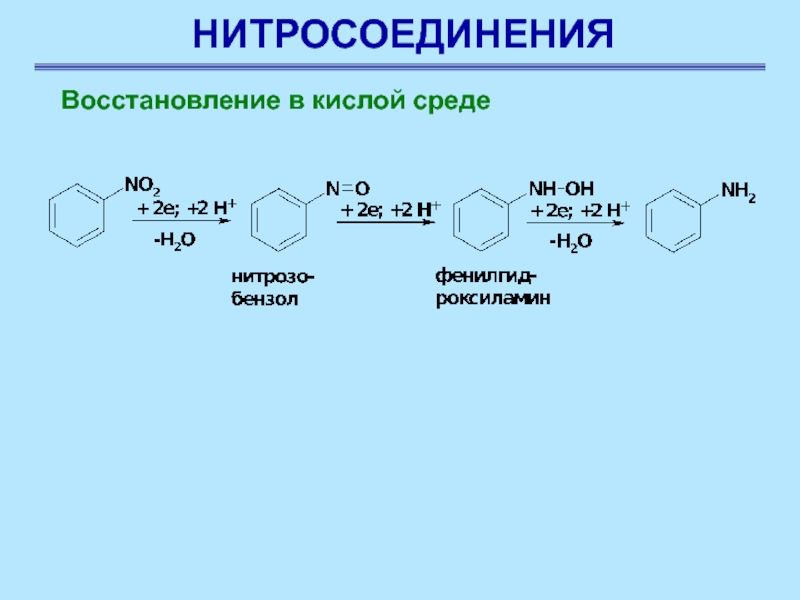
Восстановление в кислой среде
Слайд 12НИТРОСОЕДИНЕНИЯ
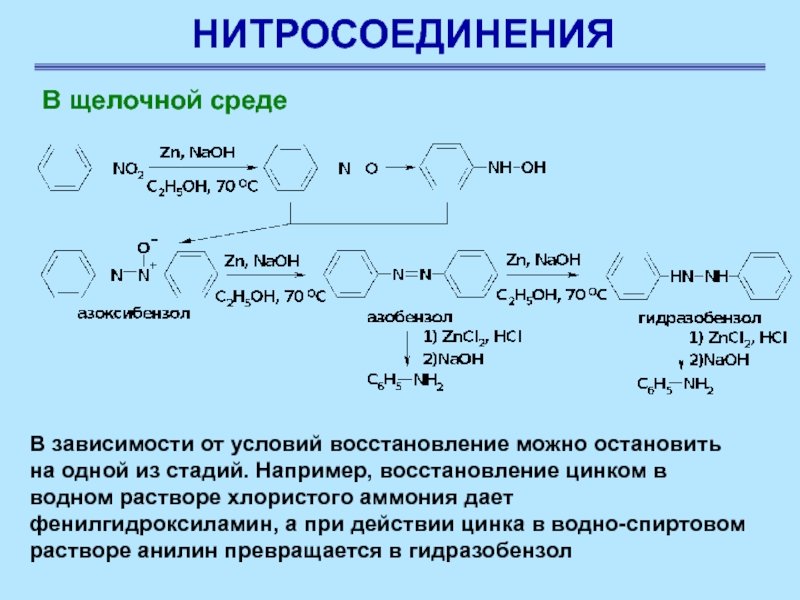
В щелочной среде
В зависимости от условий восстановление можно остановить
на одной из стадий. Например, восстановление цинком в водном растворе
хлористого аммония дает фенилгидроксиламин, а при действии цинка в водно-спиртовом растворе анилин превращается в гидразобензол
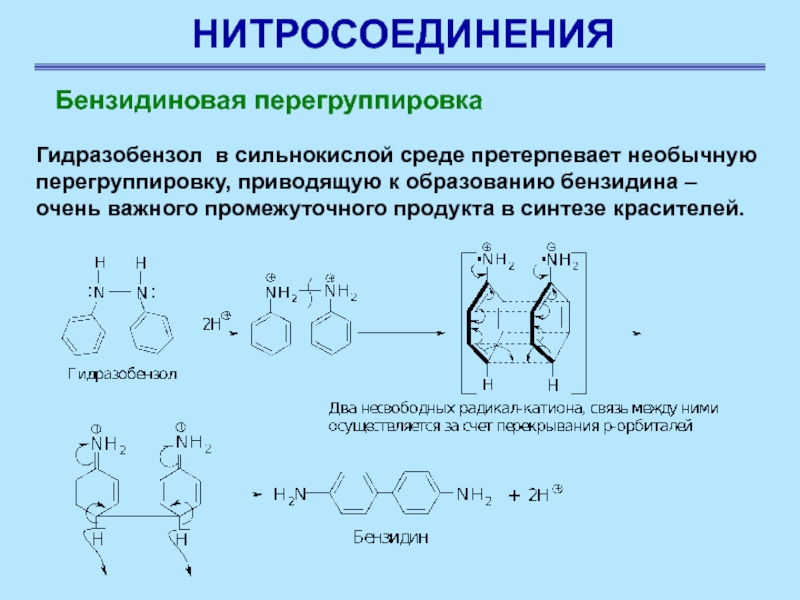
Слайд 13НИТРОСОЕДИНЕНИЯ
Гидразобензол в сильнокислой среде претерпевает необычную перегруппировку, приводящую к
образованию бензидина – очень важного промежуточного продукта в синтезе красителей.
Бензидиновая перегруппировка
Слайд 14НИТРОСОЕДИНЕНИЯ
Реакции с участием α-водородных атомов
Нитрометан обладает настолько сильными
кислотными свойствами, что способен растворяться в едком натре
Слайд 15НИТРОСОЕДИНЕНИЯ
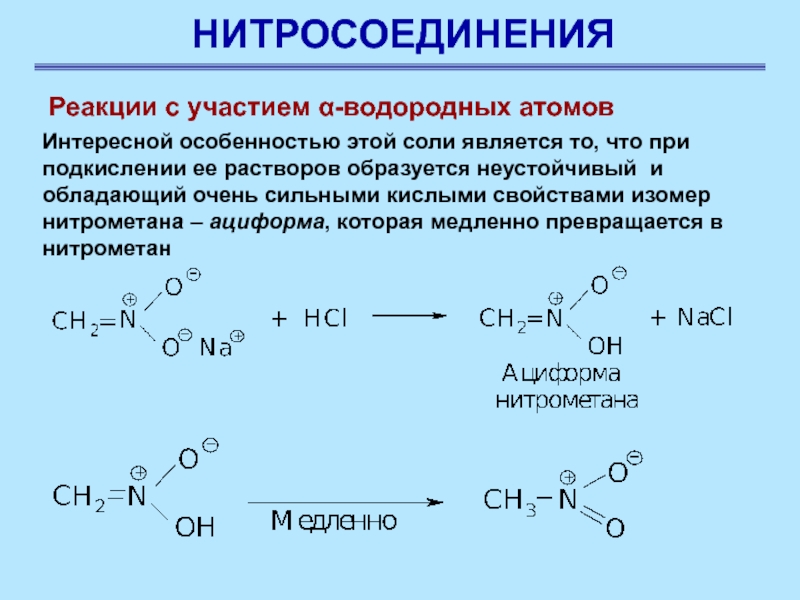
Реакции с участием α-водородных атомов
Интересной особенностью этой соли
является то, что при подкислении ее растворов образуется неустойчивый и
обладающий очень сильными кислыми свойствами изомер нитрометана – ациформа, которая медленно превращается в нитрометан
Слайд 16НИТРОСОЕДИНЕНИЯ
Реакции с участием α-водородных атомов
Первичные и вторичные нитросоединения
вступают с карбонильными соединениями в реакции типа альдольной конденсации
Реакция
Генри
Слайд 17НИТРОСОЕДИНЕНИЯ
Реакции с участием α-водородных атомов
Механизм
Образование под влиянием
основания карбаниона (I) – устойчивого сопряженного основания
Слайд 18НИТРОСОЕДИНЕНИЯ
Реакции с участием α-водородных атомов
Далее происходит взаимодействие муравьиного
альдегида с нуклеофилом (I) и образование промежуточного продукта (II)
Механизм
Слайд 19НИТРОСОЕДИНЕНИЯ
Реакции с участием α-водородных атомов
Механизм
Стабилизация промежуточного продукта
(II) осуществляется за счет переноса протона от более слабого основания
– гидроксид-иона к более сильному
Слайд 20НИТРОСОЕДИНЕНИЯ
Нитрование алканов. Реакция Коновалова
Известно несколько способов нитрования алканов.
По
жидкофазному способу алканы нитруют разбавленной азотной кислотой, с массовой долей
40-50 %
Способы получения
По парофазному способу алканы нитруют в парах при температуре
350-500 оС
Слайд 21НИТРОСОЕДИНЕНИЯ
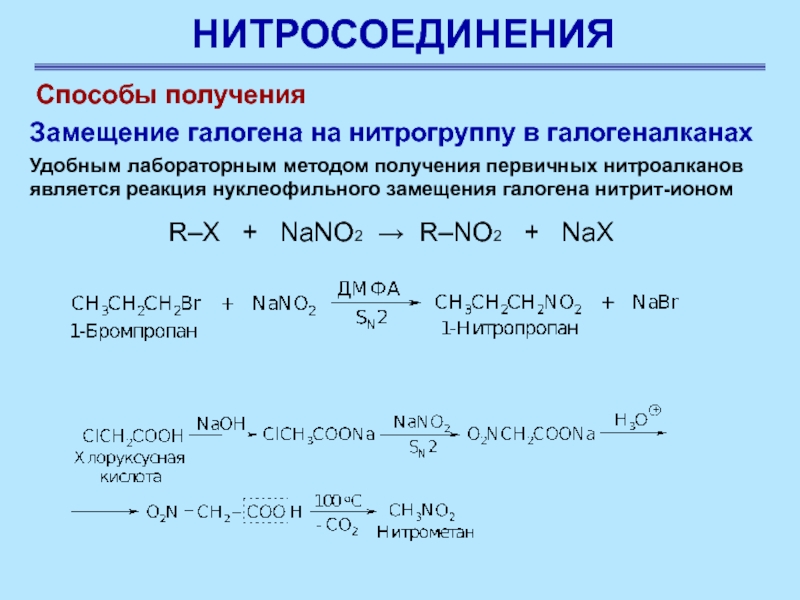
R–X + NaNO2 → R–NO2 +
NaX
Способы получения
Замещение галогена на нитрогруппу в галогеналканах
Удобным
лабораторным методом получения первичных нитроалканов является реакция нуклеофильного замещения галогена нитрит-ионом
Слайд 22НИТРОСОЕДИНЕНИЯ
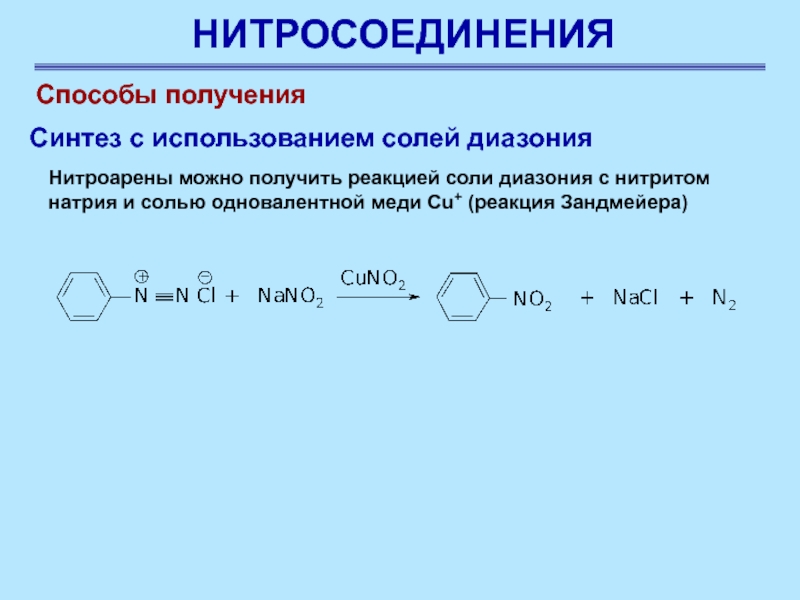
Способы получения
Нитроарены можно получить реакцией соли диазония с
нитритом натрия и солью одновалентной меди Cu+ (реакция Зандмейера)
Синтез
с использованием солей диазония
Слайд 23АМИНЫ
Амины – производные аммиака NH3. В соответствии с числом
алкильных или арильных групп, связанных с азотом, различают
первичные R–NH2,
ArNH2;
вторичные R1–NH–R2, R–NH–Ar;
третичные амины
Слайд 24АМИНЫ
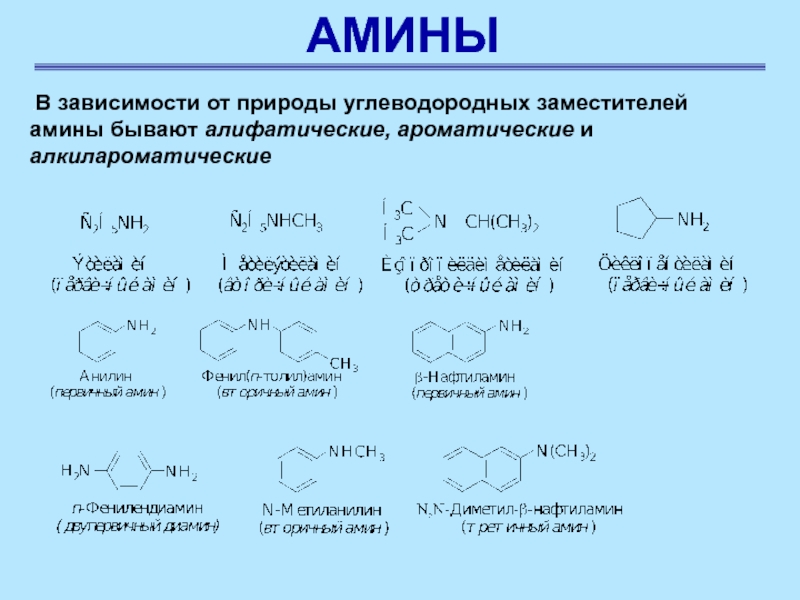
.В зависимости от природы углеводородных заместителей амины бывают
алифатические, ароматические и алкилароматические
Слайд 25АМИНЫ
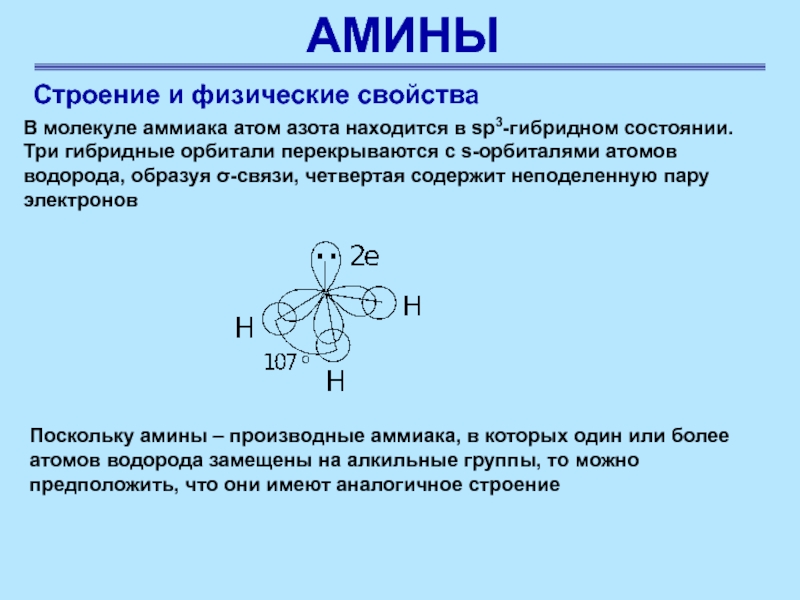
Строение и физические свойства
В молекуле аммиака атом азота
находится в sp3-гибридном состоянии. Три гибридные орбитали перекрываются с s-орбиталями
атомов водорода, образуя σ-связи, четвертая содержит неподеленную пару электронов
Поскольку амины – производные аммиака, в которых один или более атомов водорода замещены на алкильные группы, то можно предположить, что они имеют аналогичное строение
Слайд 26АМИНЫ
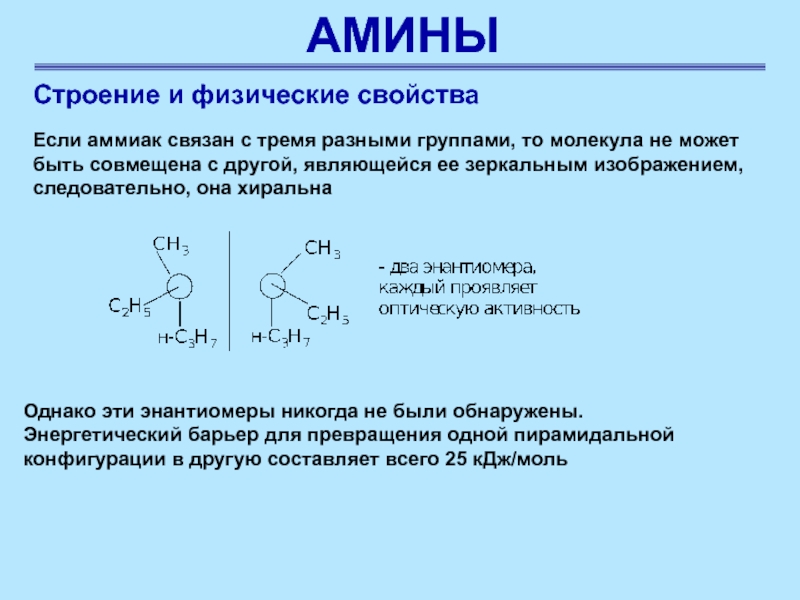
Строение и физические свойства
Если аммиак связан с тремя
разными группами, то молекула не может быть совмещена с другой,
являющейся ее зеркальным изображением, следовательно, она хиральна
Однако эти энантиомеры никогда не были обнаружены. Энергетический барьер для превращения одной пирамидальной конфигурации в другую составляет всего 25 кДж/моль
Слайд 27АМИНЫ
Строение и физические свойства
Простейшие алифатические амины – метиламин,
диметиламин и триметиламин – газы, хорошо растворимые в воде и
обладающие аммиачным запахом. Остальные низшие амины – жидкости с запахом аммиака. Более сложные амины – жидкости с неприятным запахом рыбы. Высшие амины – твердые, не растворимые в воде вещества, лишенные запаха.
При равном числе атомов углерода наиболее высокая температура кипения у первичных аминов, несколько ниже у вторичных и третичных.
Ароматические амины – жидкости или твердые тела с характерным неприятным запахом, сильно токсичны. В воде растворяются мало, накопление аминогрупп ведет к увеличению растворимости
Слайд 28АМИНЫ
Химические свойства
Многие химические свойства аминов обусловлены стремлением аминов
обобществить неподеленную пару электронов азота с протоном, благодаря чему они
являются основаниями, либо с электронодефицитным атомом другой молекулы, что определяет их способность выступать в качестве нуклеофильных реагентов
Слайд 29АМИНЫ
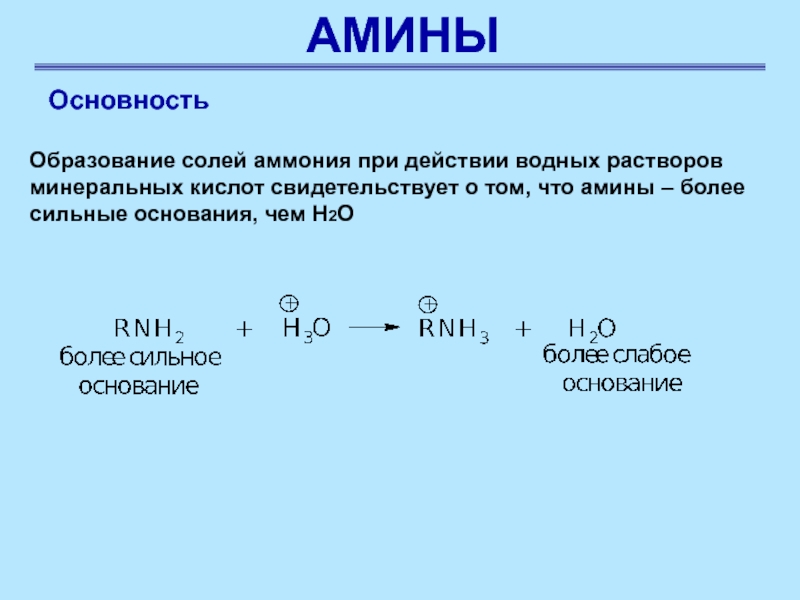
Основность
Образование солей аммония при действии водных растворов минеральных кислот
свидетельствует о том, что амины – более сильные основания, чем
Н2О
Слайд 30АМИНЫ
Основность
Амины вытесняются из солей аммония при действии гидроксид-иона, т.е.
амины более слабые основания, чем гидроксид-ион
Основность убывает в ряду
ОН > RNH2 > H2O
Слайд 31АМИНЫ
Основность
По аналогии с кислотностью основность аминов удобно сравнивать, определяя
степень переноса протона с воды на амин
Чем больше константа
основности Кb, тем сильнее основание. Константа основности Kb для всех трех классов алифатических аминов 10–3–10–4, т.е. алифатические амины более сильные основания, чем аммиак Kb=1,8∙10-5. Для ароматических аминов Kb<10–9
Слайд 32АМИНЫ
Структура и основность
Наличие заместителей оказывает сильное влияние на
основность. Алифатические амины – более сильные основания, чем аммиак
Основность
алифатических аминов увеличивается в ряду
NH3 < R1NH2 < R1–NH–R2
Слайд 33АМИНЫ
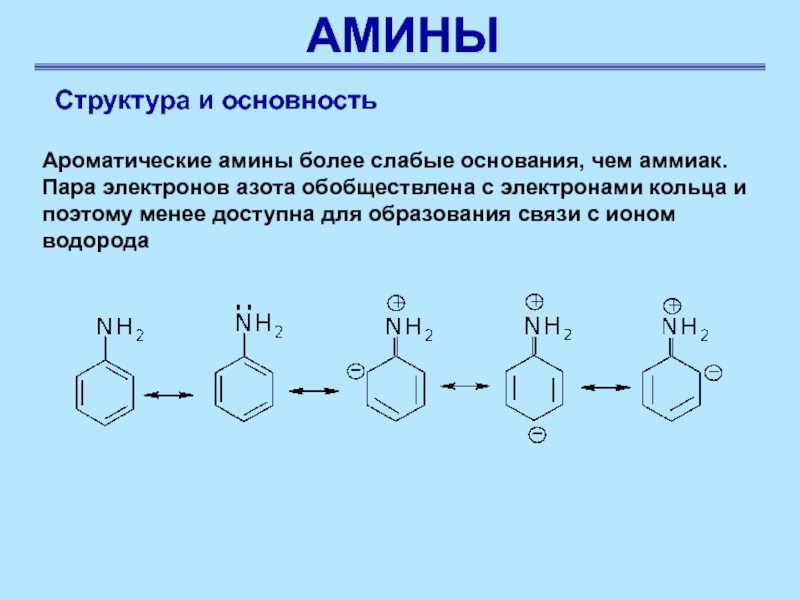
Структура и основность
Ароматические амины более слабые основания, чем
аммиак. Пара электронов азота обобществлена с электронами кольца и поэтому
менее доступна для образования связи с ионом водорода
Слайд 34АМИНЫ
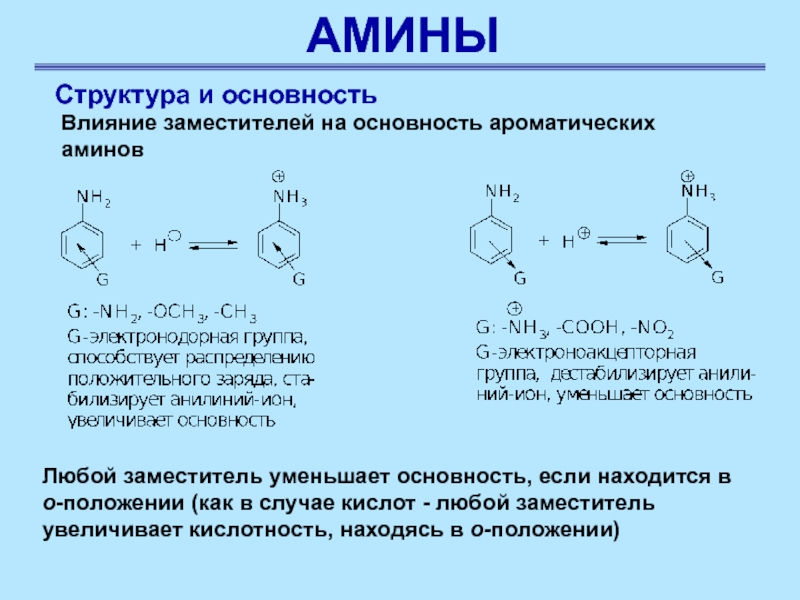
Структура и основность
Влияние заместителей на основность ароматических аминов
Любой
заместитель уменьшает основность, если находится в
о-положении (как в случае кислот - любой заместитель увеличивает кислотность, находясь в о-положении)
Слайд 35АМИНЫ
Структура и основность
Наиболее характерная реакция аминов - образование
солей при взаимодействии с кислотами
Различие в растворимости аминов и
их солей используют для обнаружения и выделения аминов. Органическое соединение, не растворимое в воде, но растворимое в холодной разбавленной соляной кислоте, является основанием, почти наверняка - амином
Слайд 36АМИНЫ
Реакции с участием аминогруппы
Алкилирование
Амины могут реагировать с
алкилгалогенидами, при этом образуется более алкилированный амин
Алкилирование аминов (аминолиз
галогенпроизводных) – реакция нуклеофильного замещения
Слайд 37АМИНЫ
Реакции с участием аминогруппы
Алкилирование
Свободный амин выделяется обработкой
основанием
При аминолизе первичных галогеналканов главный продукт - амин, а
при аминолизе третичных образуется значительное количество алкена
Слайд 38АМИНЫ
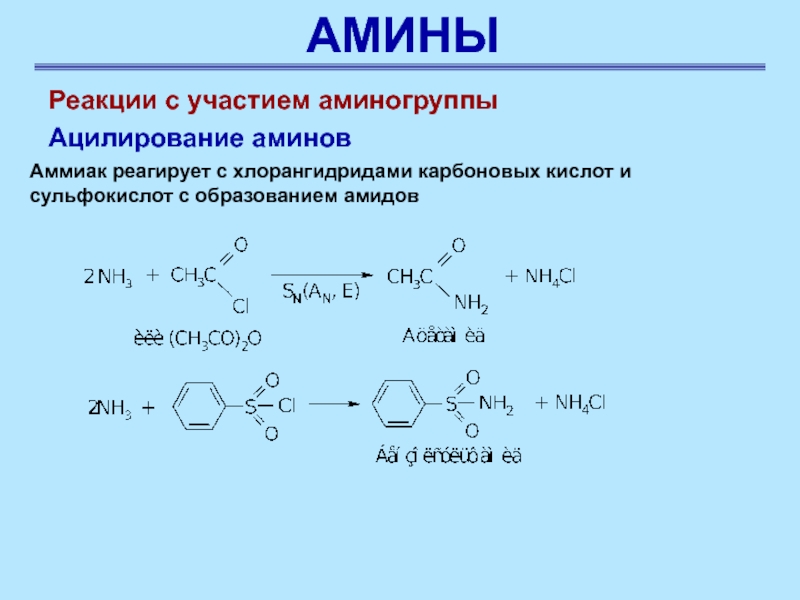
Аммиак реагирует с хлорангидридами карбоновых кислот и сульфокислот с
образованием амидов
Реакции с участием аминогруппы
Ацилирование аминов
Слайд 39АМИНЫ
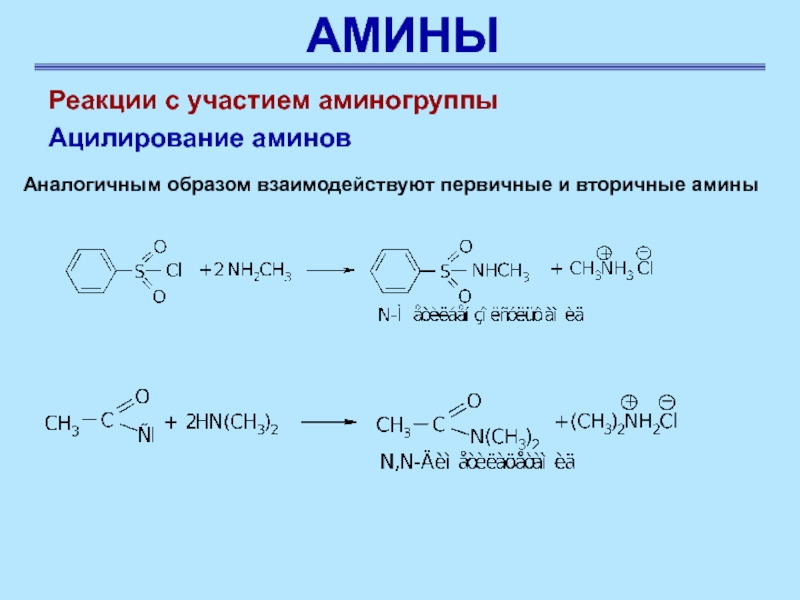
Реакции с участием аминогруппы
Ацилирование аминов
Аналогичным образом взаимодействуют
первичные и вторичные амины
Слайд 40АМИНЫ
Электрофильное замещение в кольце ароматических аминов
При рассмотрении электрофильного
замещения в ароматическом ядре амина, амида или аммонийной соли следует
иметь в виду, что, хотя во всех случаях с углеродом ядра связан атом азота ориентанта, влияние его будет различно
– сильные активирующие о-, п-ориентанты
– менее сильный активирующий о-, п-ориентант
– дезактивирующий м-ориентант
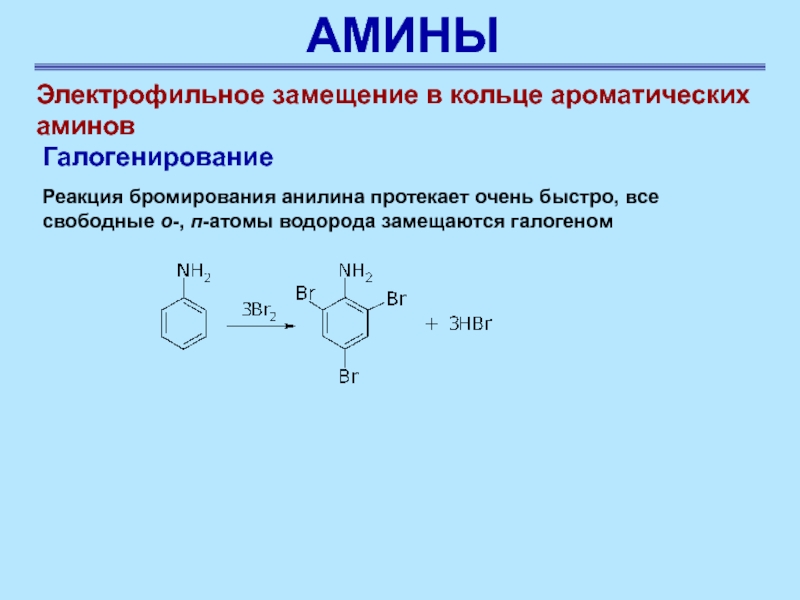
Слайд 41АМИНЫ
Реакция бромирования анилина протекает очень быстро, все свободные о-,
п-атомы водорода замещаются галогеном
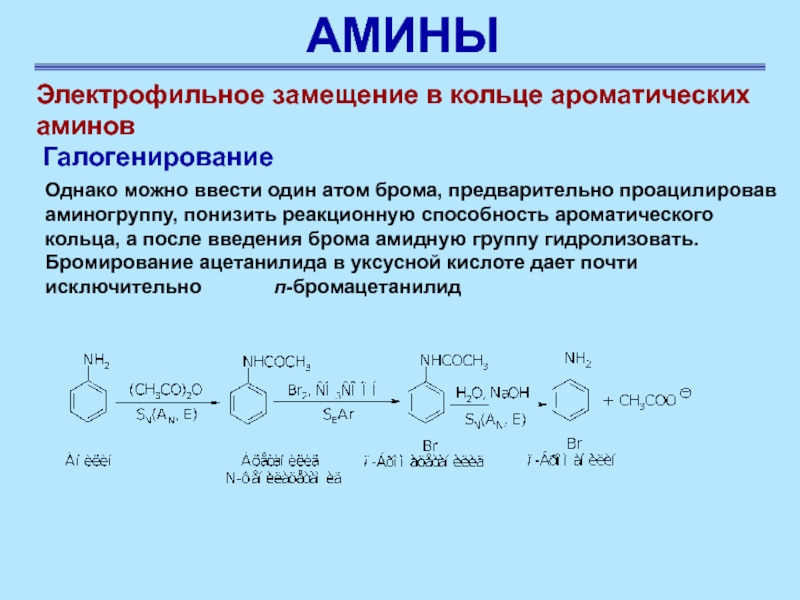
Электрофильное замещение в кольце ароматических аминов
Галогенирование
Слайд 42АМИНЫ
Электрофильное замещение в кольце ароматических аминов
Галогенирование
Однако можно
ввести один атом брома, предварительно проацилировав аминогруппу, понизить реакционную способность
ароматического кольца, а после введения брома амидную группу гидролизовать. Бромирование ацетанилида в уксусной кислоте дает почти исключительно п-бромацетанилид
Слайд 43АМИНЫ
Электрофильное замещение в кольце ароматических аминов
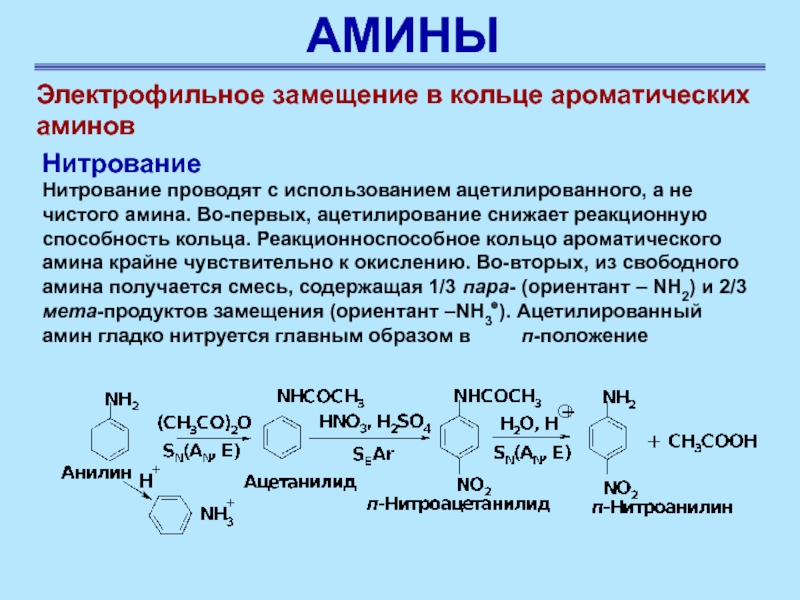
Нитрование
Нитрование проводят
с использованием ацетилированного, а не чистого амина. Во-первых, ацетилирование снижает
реакционную способность кольца. Реакционноспособное кольцо ароматического амина крайне чувствительно к окислению. Во-вторых, из свободного амина получается смесь, содержащая 1/3 пара- (ориентант – NH2) и 2/3 мета-продуктов замещения (ориентант –NH3⊕). Ацетилированный амин гладко нитруется главным образом в п-положение
Слайд 44АМИНЫ
Электрофильное замещение в кольце ароматических аминов
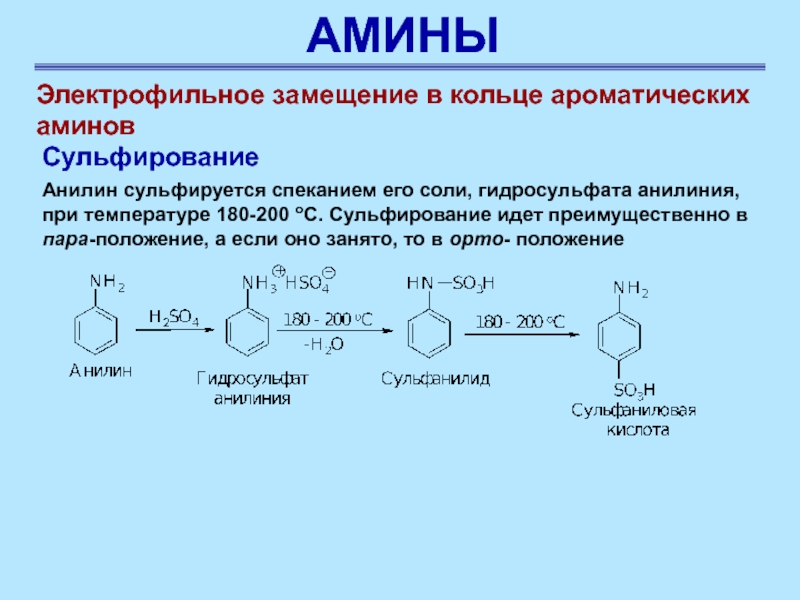
Сульфирование
Анилин сульфируется
спеканием его соли, гидросульфата анилиния, при температуре 180-200 оС. Сульфирование
идет преимущественно в пара-положение, a если оно занято, то в opтo- положение
Слайд 45АМИНЫ
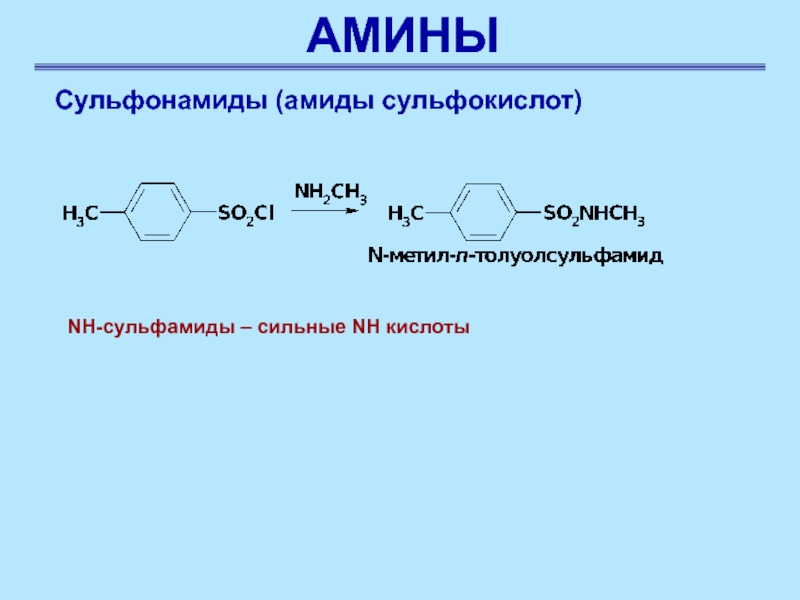
Сульфонамиды (амиды сульфокислот)
NH-сульфамиды – сильные NH кислоты
Слайд 46АМИНЫ
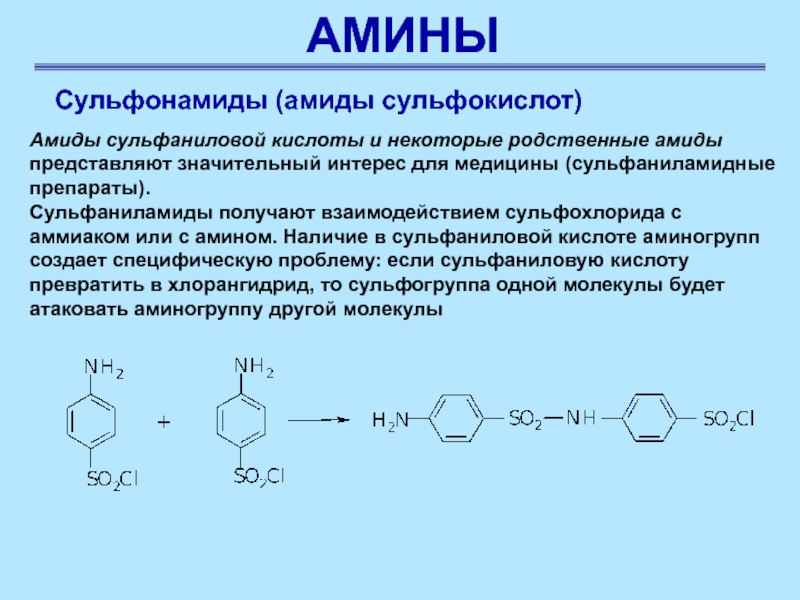
Сульфонамиды (амиды сульфокислот)
Амиды сульфаниловой кислоты и некоторые родственные
амиды представляют значительный интерес для медицины (сульфаниламидные препараты).
Сульфаниламиды получают взаимодействием
сульфохлорида с аммиаком или с амином. Наличие в сульфаниловой кислоте аминогрупп создает специфическую проблему: если сульфаниловую кислоту превратить в хлорангидрид, то сульфогруппа одной молекулы будет атаковать аминогруппу другой молекулы
Слайд 47АМИНЫ
Сульфонамиды (амиды сульфокислот)
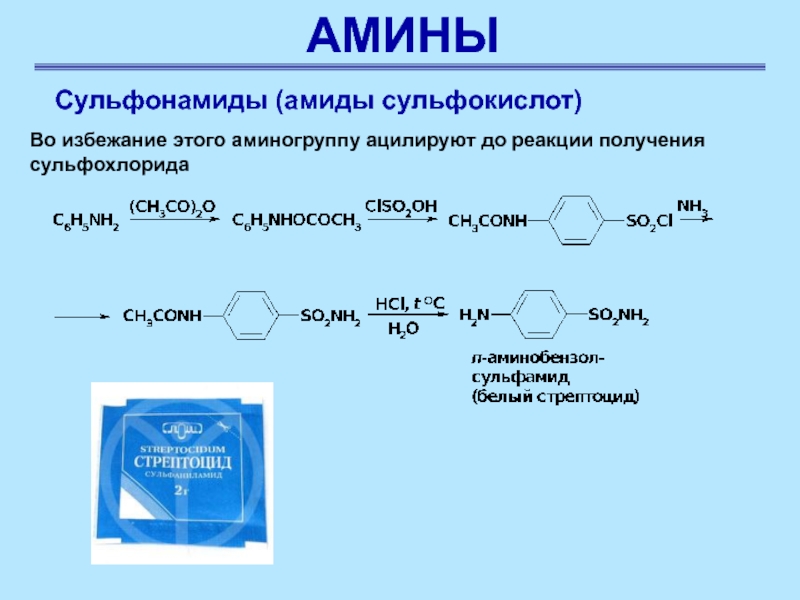
Во избежание этого аминогруппу ацилируют до
реакции получения сульфохлорида
Слайд 48АМИНЫ
Сульфонамиды (амиды сульфокислот)
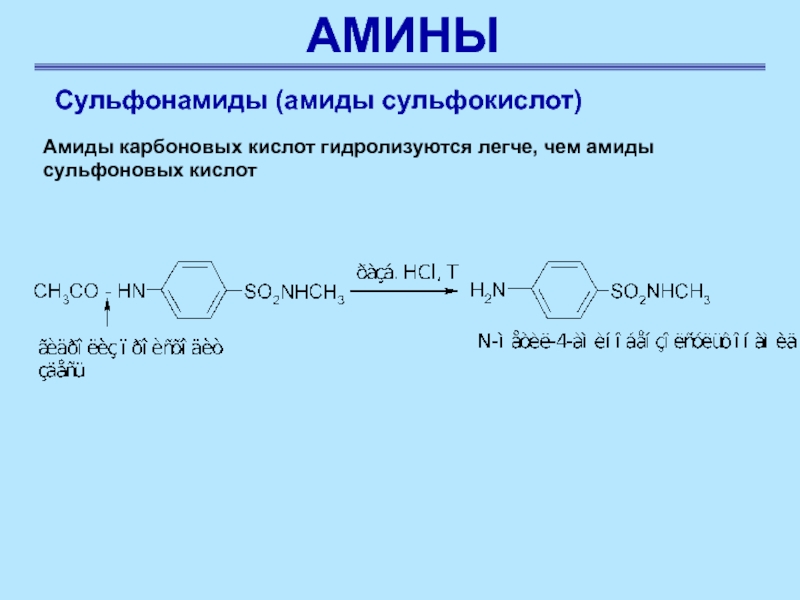
Амиды карбоновых кислот гидролизуются легче, чем
амиды сульфоновых кислот
Слайд 49АМИНЫ
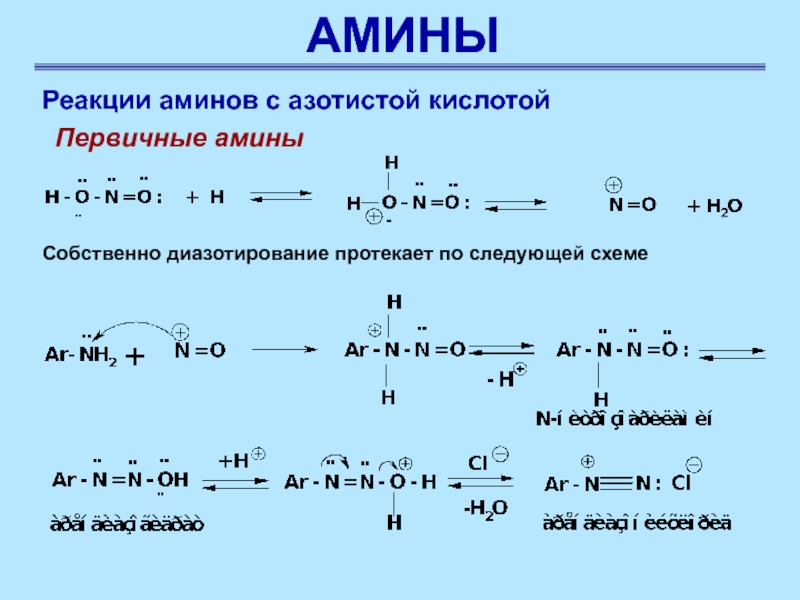
Реакции аминов с азотистой кислотой
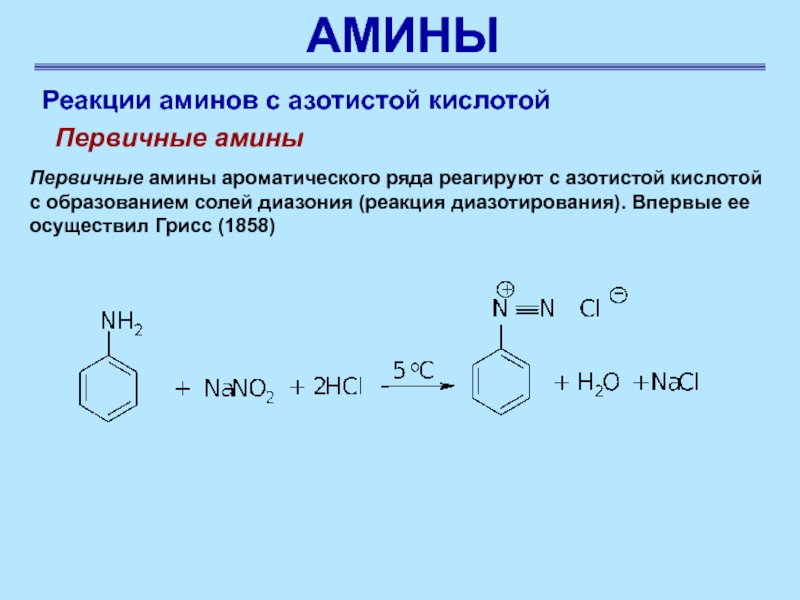
Первичные амины ароматического ряда
реагируют с азотистой кислотой с образованием солей диазония (реакция диазотирования).
Впервые ее осуществил Грисс (1858)
Первичные амины
Слайд 50АМИНЫ
Реакции аминов с азотистой кислотой
Первичные амины
На первой стадии
при взаимодействии нитрита натрия с соляной кислотой образуется азотистая кислота
Азотистая
кислота является более слабой кислотой, чем азотная. Поэтому в отсутствие сильных минеральных кислот электрофильная реакционная способность азотистой кислоты невысока. Увеличить ее можно, проводя реакции с аминами в присутствии сильных минеральных кислот (чаще для этой цели используют хлороводородную кислоту). При этом, по-видимому, происходят протонированне атома кислорода гидроксильной группы, отщепление воды и генерирование нитрозонийкатиона. В соляной кислоте образуется нитрозилхлорид, который и является диазотирующим агентом
Слайд 51АМИНЫ
Реакции аминов с азотистой кислотой
Первичные амины
Собственно диазотирование протекает
по следующей схеме
Слайд 52АМИНЫ
Реакции аминов с азотистой кислотой
Первичные амины
Первичные алифатические амины
также дают соли диазония, но они очень неустойчивы и легко
разлагаются с образованием карбокатионов, при этом выделяется азот. Карбокатион может реагировать с нуклеофилом из среды (вода), претерпевать депротонирование в алкен или в случае сложного карбокатиона подвергаться скелетным перегруппировкам. Алкен также может взаимодействовать с HCl. Образуется смесь спиртов, алкенов и галогеналканов
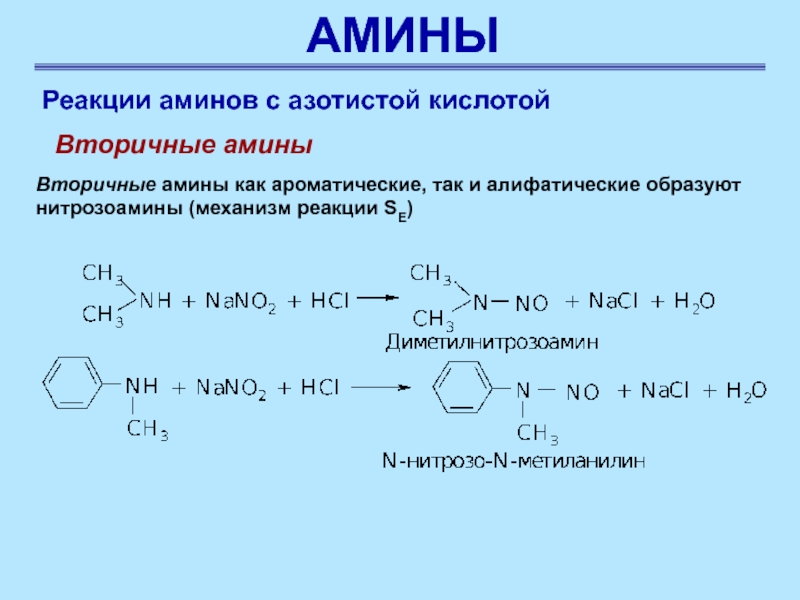
Слайд 53АМИНЫ
Реакции аминов с азотистой кислотой
Вторичные амины
Вторичные амины
как ароматические, так и алифатические образуют нитрозоамины (механизм реакции SE)
Слайд 54АМИНЫ
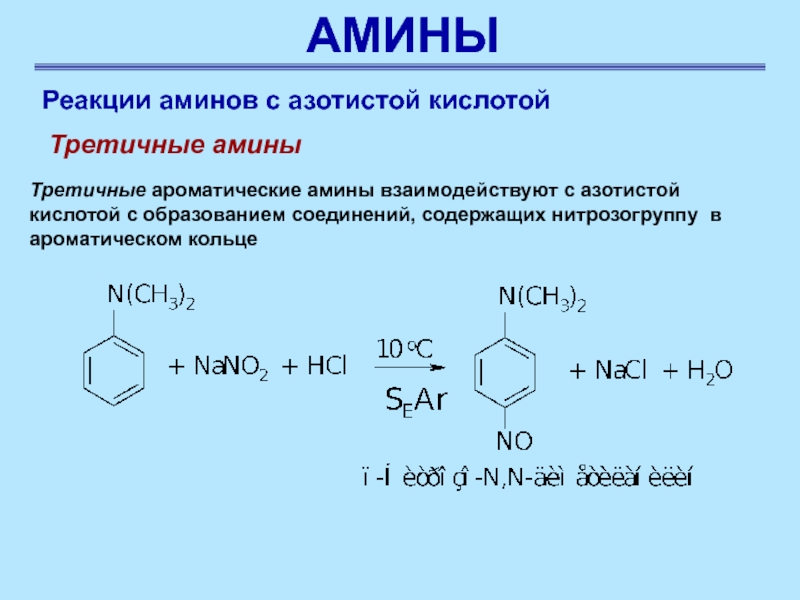
Реакции аминов с азотистой кислотой
Третичные амины
Третичные ароматические
амины взаимодействуют с азотистой кислотой с образованием соединений, содержащих нитрозогруппу
в ароматическом кольце
Слайд 55АМИНЫ
Реакции аминов с азотистой кислотой
Третичные амины
Третичные алифатические
амины в мягких условиях (разбавленные растворы, комнатная температура) не реагируют
с азотистой кислотой. В жестких условиях происходит расщепление третичных аминов с образованием N-нитрозопроизводных вторичных аминов, отщепляющаяся от атома азота группа выделяется в виде альдегида или кетона
Слайд 56АМИНЫ
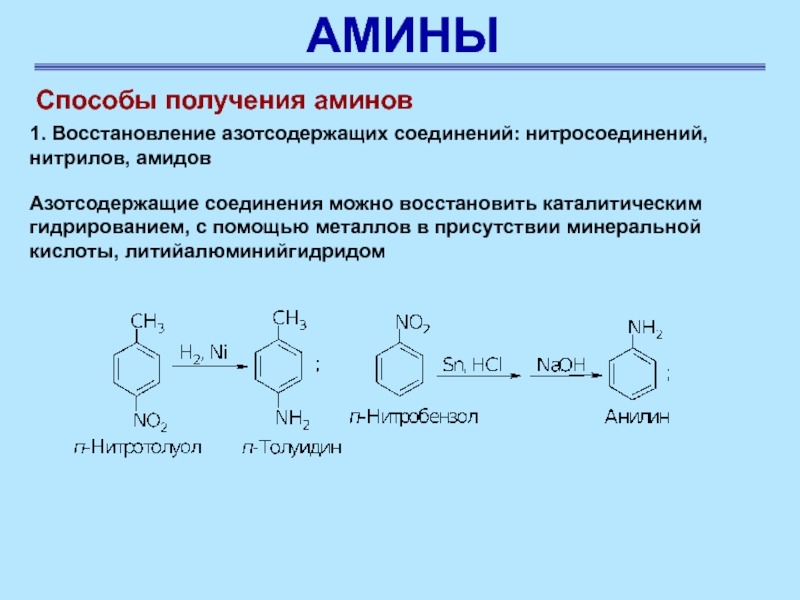
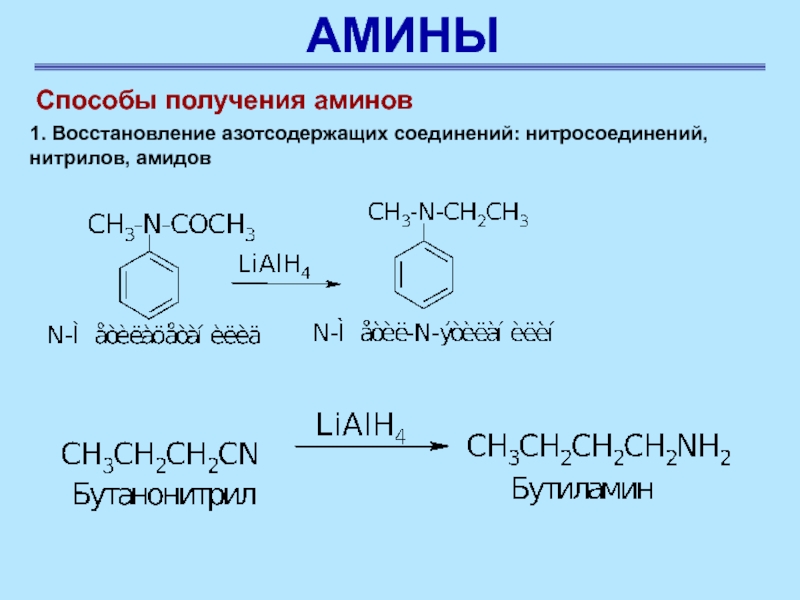
Способы получения аминов
1. Восстановление азотсодержащих соединений: нитросоединений, нитрилов, амидов
Азотсодержащие соединения можно восстановить каталитическим гидрированием, с помощью металлов в
присутствии минеральной кислоты, литийалюминийгидридом
Слайд 57АМИНЫ
Способы получения аминов
1. Восстановление азотсодержащих соединений: нитросоединений, нитрилов, амидов
Слайд 58АМИНЫ
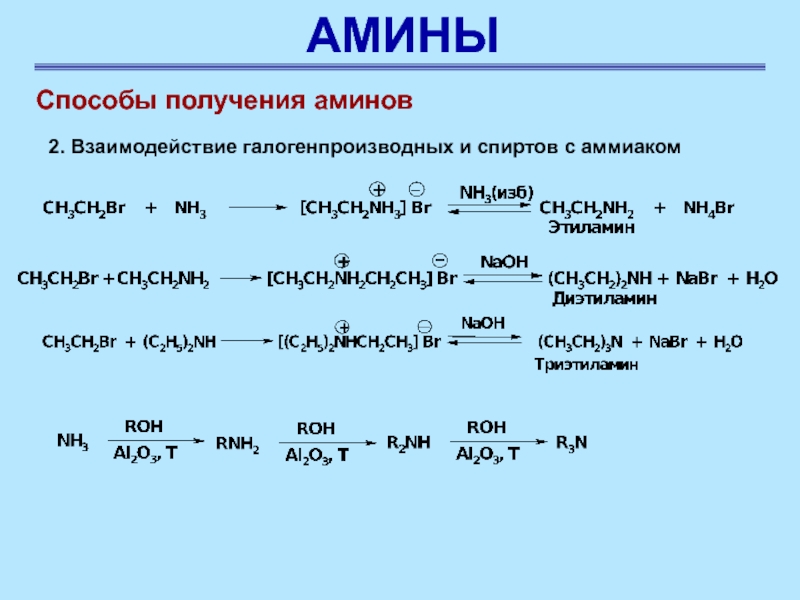
Способы получения аминов
2. Взаимодействие галогенпроизводных и спиртов с аммиаком
Слайд 59АМИНЫ
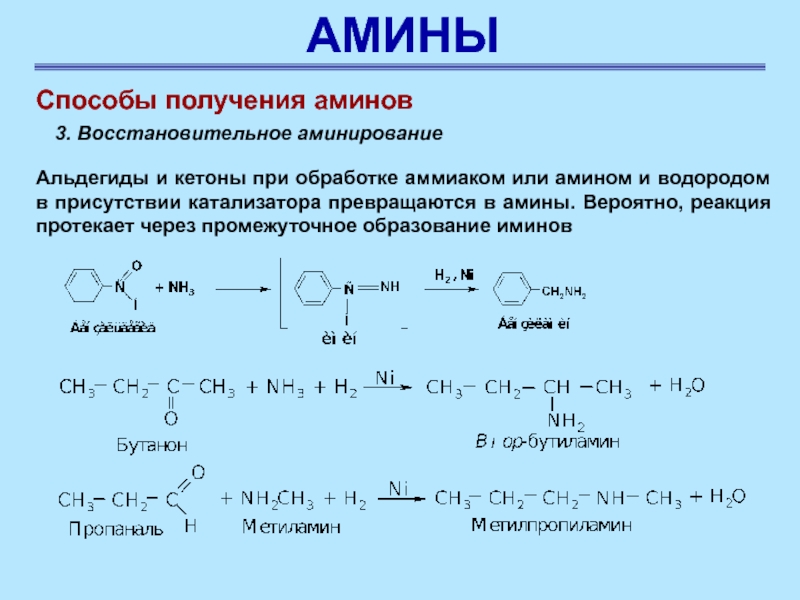
Способы получения аминов
3. Восстановительное аминирование
Альдегиды и кетоны при обработке
аммиаком или амином и водородом в присутствии катализатора превращаются в
амины. Вероятно, реакция протекает через промежуточное образование иминов
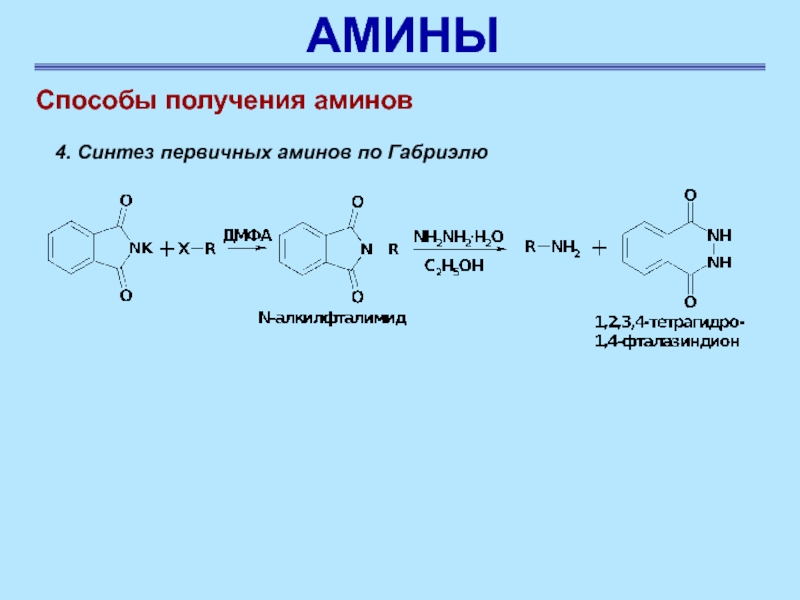
Слайд 60АМИНЫ
Способы получения аминов
4. Синтез первичных аминов по Габриэлю
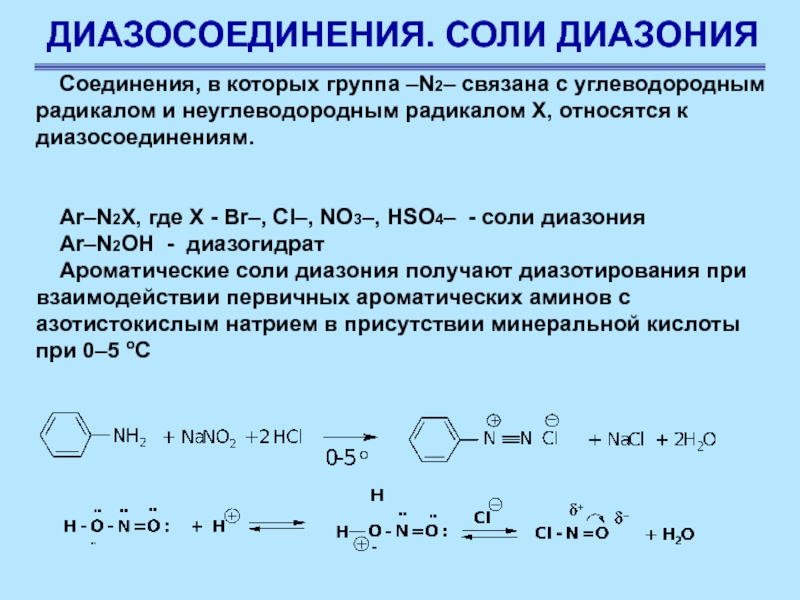
Слайд 61ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ
Соединения, в которых группа –N2– связана с углеводородным
радикалом и неуглеводородным радикалом Х, относятся к диазосоединениям.
Ar–N2X, где X
- Br–, Cl–, NO3–, HSO4– - cоли диазония
Ar–N2OH - диазогидрат
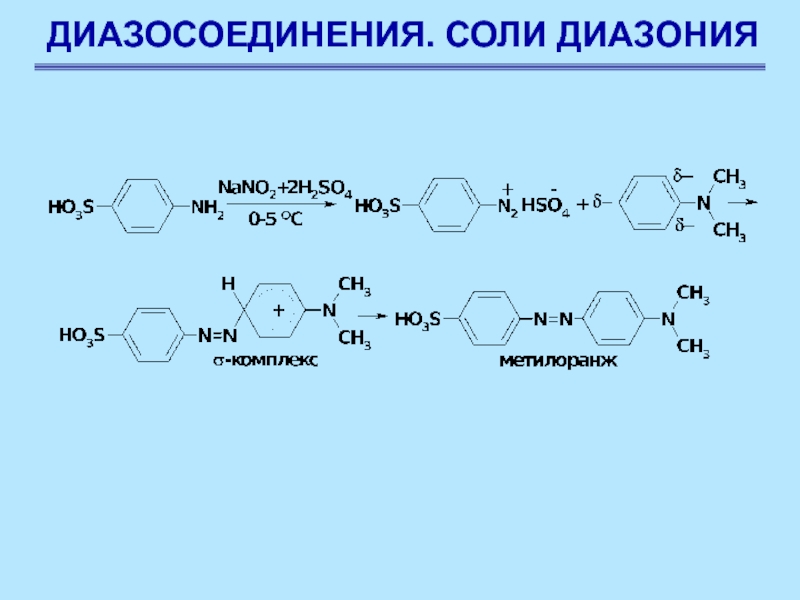
Ароматические соли диазония получают диазотирования при взаимодействии первичных ароматических аминов с азотистокислым натрием в присутствии минеральной кислоты при 0–5 оС
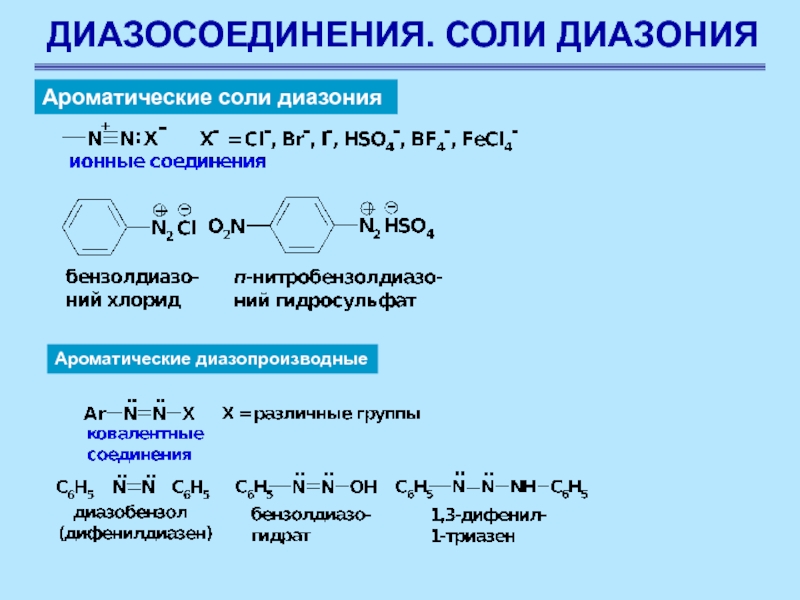
Слайд 62ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ
Ароматические соли диазония
Ароматические диазопроизводные
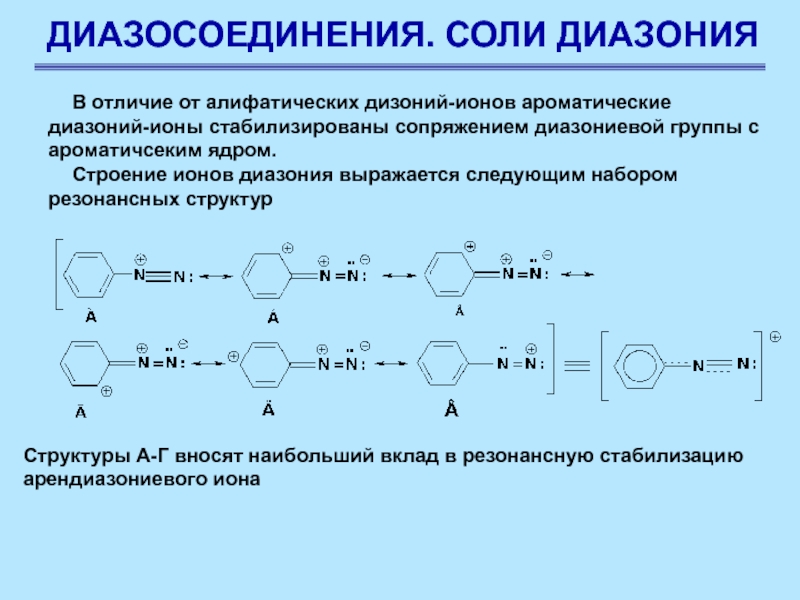
Слайд 63ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ
В отличие от алифатических дизоний-ионов ароматические диазоний-ионы стабилизированы
сопряжением диазониевой группы с ароматичсеким ядром.
Строение ионов диазония выражается следующим
набором резонансных структур
Структуры А-Г вносят наибольший вклад в резонансную стабилизацию арендиазониевого иона
Слайд 64ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ
Гидроксид диазония получают действием гидроокиси серебра на раствор
соли диазония
Слайд 65ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ
Арилдиазонийгидроксид – очень неустойчивое соединений, быстро перегруппировывается в
диазогидрат, который является ОН-кислотой. С избытком NaOH диазогидрат дает соль
– диазотат
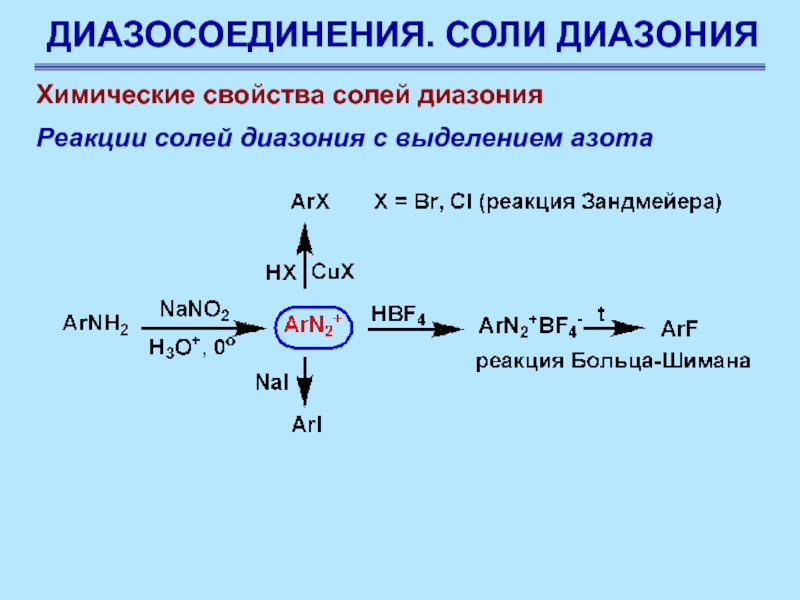
Слайд 66ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ
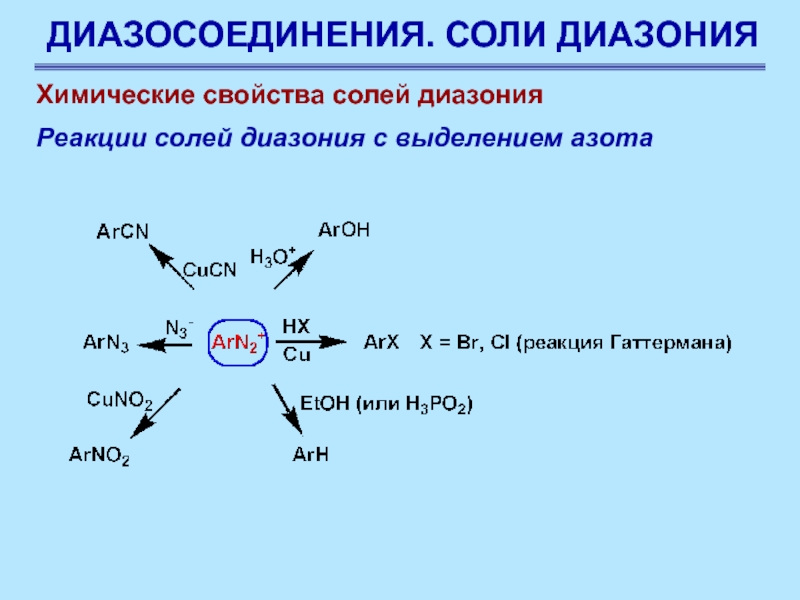
Химические свойства солей диазония
Реакции солей диазония с
выделением азота
Соли диазония ценны в синтезе не только потому,
что они способны давать большое число соединений, но и потому, что их можно получать почти из всех первичных ароматических аминов. Амины получают восстановлением нитросоединений, а они могут быть получены из углеводородов прямым нитрованием
Слайд 67ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ
Химические свойства солей диазония
Реакции солей диазония с
выделением азота
Слайд 68ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ
Химические свойства солей диазония
Реакции солей диазония с
выделением азота
Слайд 69ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ
Химические свойства солей диазония
Реакции солей диазония с
выделением азота
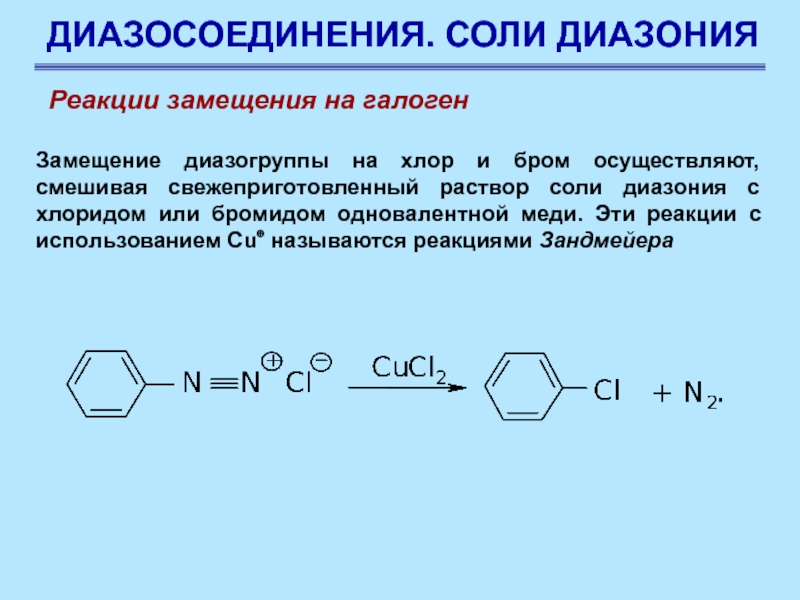
Слайд 70ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ
Замещение диазогруппы на хлор и бром осуществляют, смешивая
свежеприготовленный раствор соли диазония с хлоридом или бромидом одновалентной меди.
Эти реакции с использованием Сu⊕ называются реакциями Зандмейера
Реакции замещения на галоген
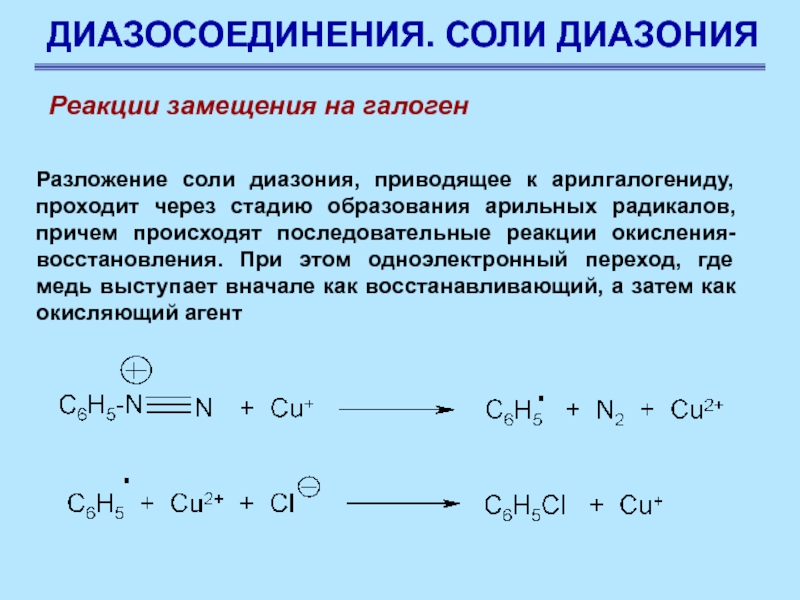
Слайд 71ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ
Разложение соли диазония, приводящее к арилгалогениду, проходит через
стадию образования арильных радикалов, причем происходят последовательные реакции окисления-восстановления. При
этом одноэлектронный переход, где медь выступает вначале как восстанавливающий, а затем как окисляющий агент
Реакции замещения на галоген
Слайд 72ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ
Характер действия металлической меди аналогичен, поскольку на ее
поверхности всегда имеется некоторое количество ионов Сu⊕ . Замещение диазогруппы
на I не требует применения меди Сu⊕ или порошка меди, поскольку сам иодид-ион вызывет разложение диазониевой соли
Реакции замещения на галоген
Слайд 73ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ
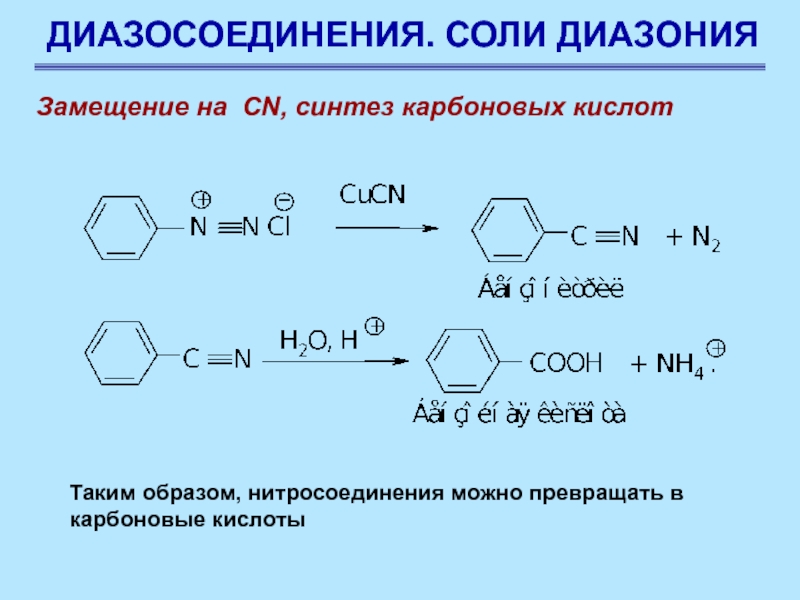
Замещение на CN, синтез карбоновых кислот
Таким образом, нитросоединения
можно превращать в карбоновые кислоты
Слайд 74ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ
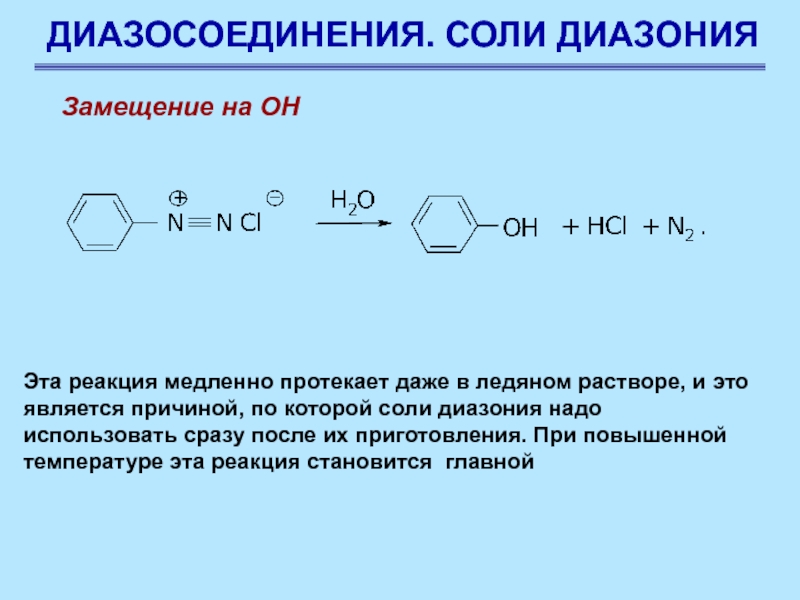
Замещение на ОН
Эта реакция медленно протекает даже в
ледяном растворе, и это является причиной, по которой соли диазония
надо использовать сразу после их приготовления. При повышенной температуре эта реакция становится главной
Слайд 75ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ
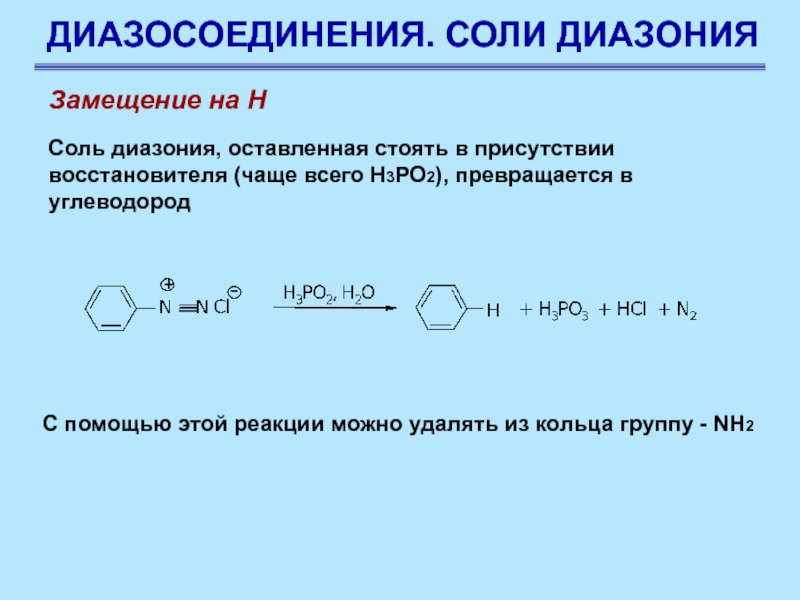
Замещение на Н
Соль диазония, оставленная стоять в присутствии
восстановителя (чаще всего Н3РО2), превращается в углеводород
С помощью этой
реакции можно удалять из кольца группу - NH2
Слайд 76ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ
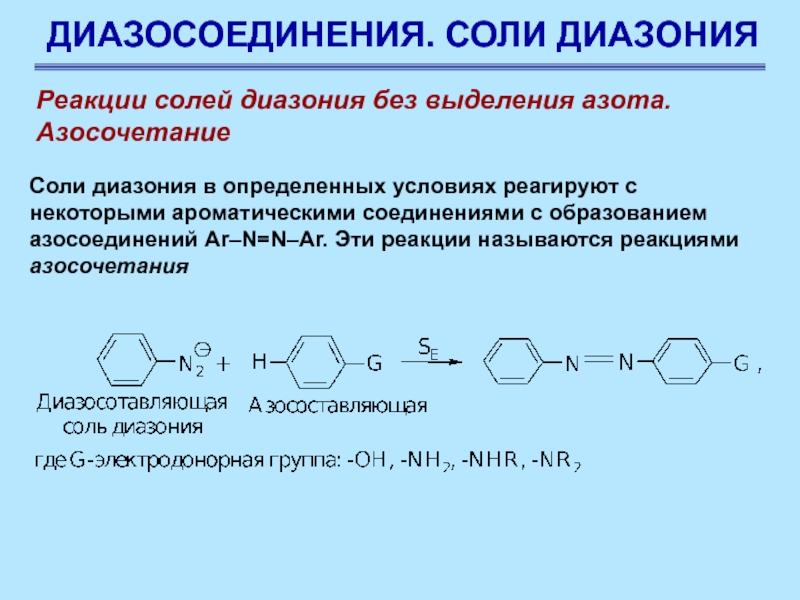
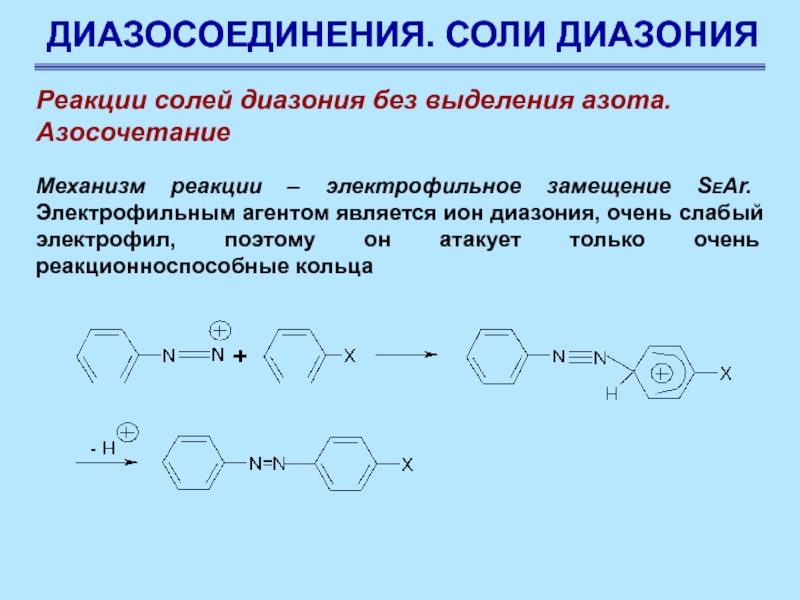
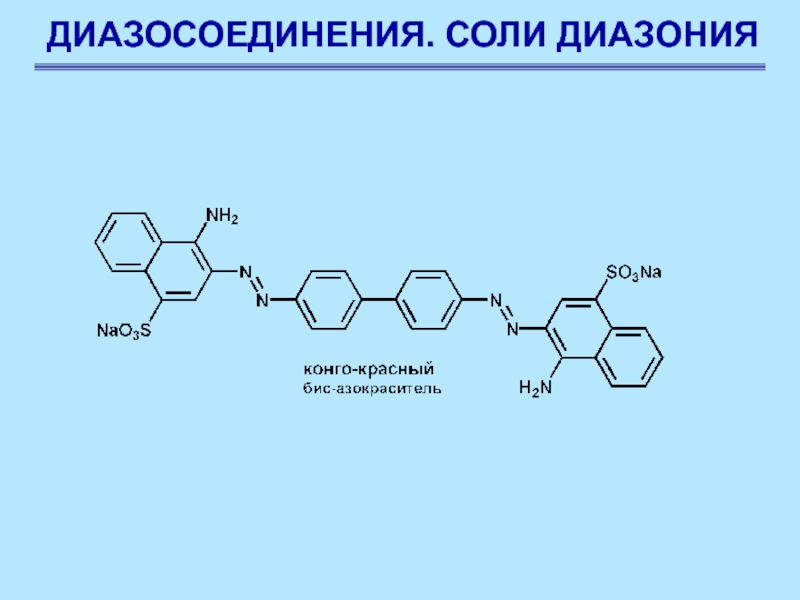
Реакции солей диазония без выделения азота.
Азосочетание
Соли диазония
в определенных условиях реагируют с некоторыми ароматическими соединениями с образованием
азосоединений Ar–N=N–Ar. Эти реакции называются реакциями азосочетания
Слайд 77ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ
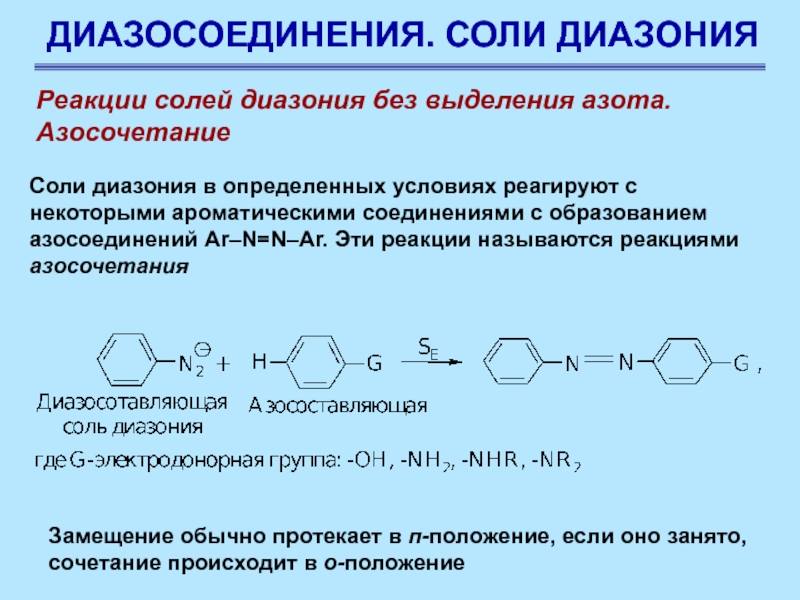
Реакции солей диазония без выделения азота.
Азосочетание
Соли диазония
в определенных условиях реагируют с некоторыми ароматическими соединениями с образованием
азосоединений Ar–N=N–Ar. Эти реакции называются реакциями азосочетания
Замещение обычно протекает в п-положение, если оно занято, сочетание происходит в о-положение
Слайд 78ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ
Реакции солей диазония без выделения азота.
Азосочетание
Механизм реакции
– электрофильное замещение SEAr. Электрофильным агентом является ион диазония, очень
слабый электрофил, поэтому он атакует только очень реакционноспособные кольца
Слайд 79ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ
Реакции солей диазония без выделения азота.
Азосочетание
Поскольку положительнфй
заряд в арендиазониевом ионе делокализован по системе π-связей, включая ароматическое
кольцо, то электрофильность такого катиона не велика. Вследствие этого ион арендиазония может вступать в реакции электрофильного замещения только с соединениями, содержащими сильные электронодонорные заместители
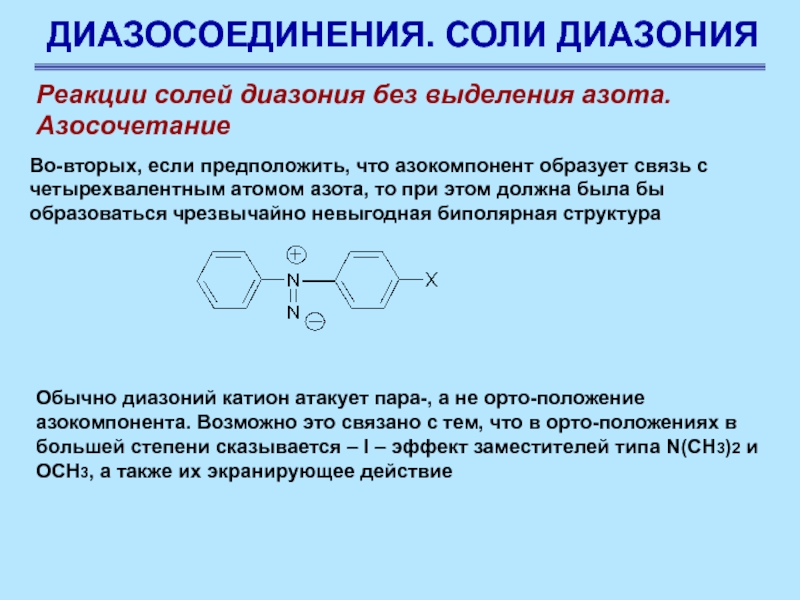
Слайд 80ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ
Реакции солей диазония без выделения азота.
Азосочетание
Диазоний-катион атакует
азокомпонент крайним, а не четырехвалентным атомом азота, на котором должна
быть сосредоточена большая часть положительного заряда диазогруппы. Во-первых, на крайнем атоме азота также имеется переданный по индукции от соседнего атома азота значительный дефицит электронной плотности, при этом одной из резонансных структур диазоний катиона является форма (Е) с секстететом электронов на крайнем атоме азота (нитрен)
Предполагают, что оба атома азота несут приблизительно одинаковые положительные заряды
Слайд 81ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ
Реакции солей диазония без выделения азота.
Азосочетание
Во-вторых, если
предположить, что азокомпонент образует связь с четырехвалентным атомом азота, то
при этом должна была бы образоваться чрезвычайно невыгодная биполярная структура
Обычно диазоний катион атакует пара-, а не орто-положение азокомпонента. Возможно это связано с тем, что в орто-положениях в большей степени сказывается – I – эффект заместителей типа N(CH3)2 и ОСН3, а также их экранирующее действие
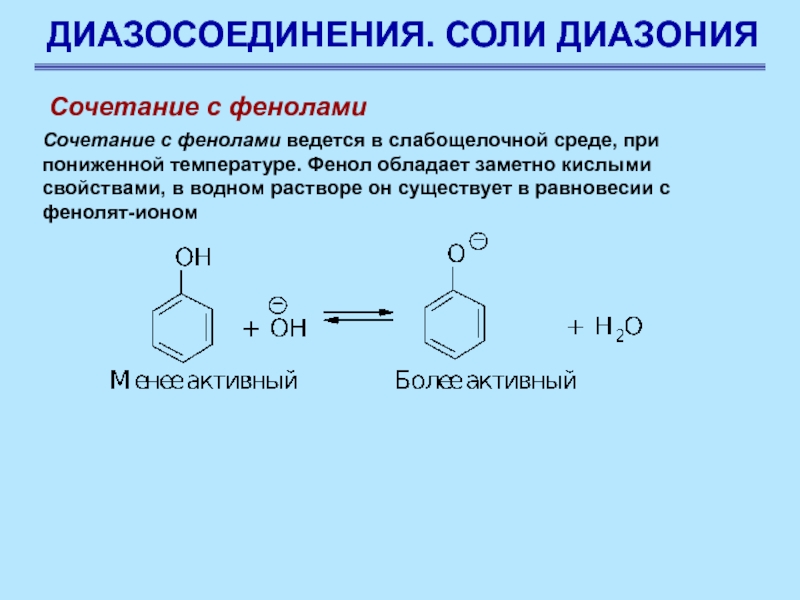
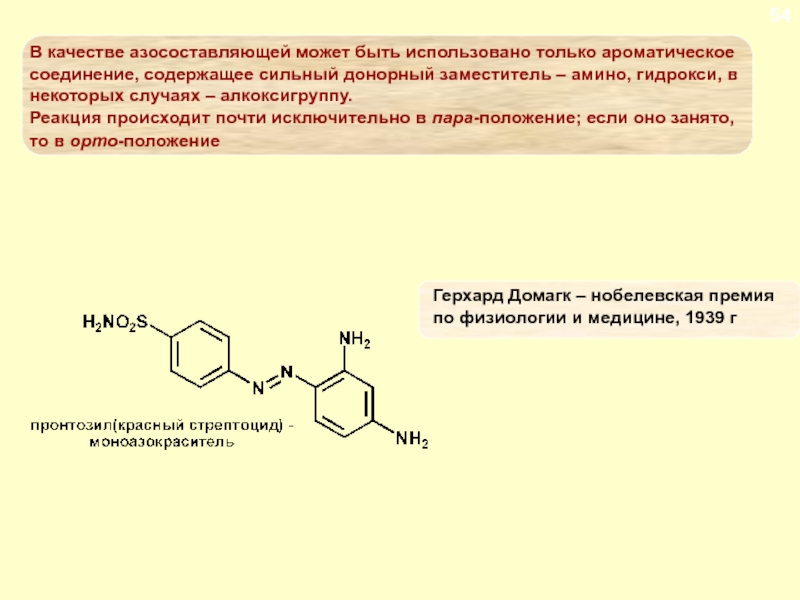
Слайд 82ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ
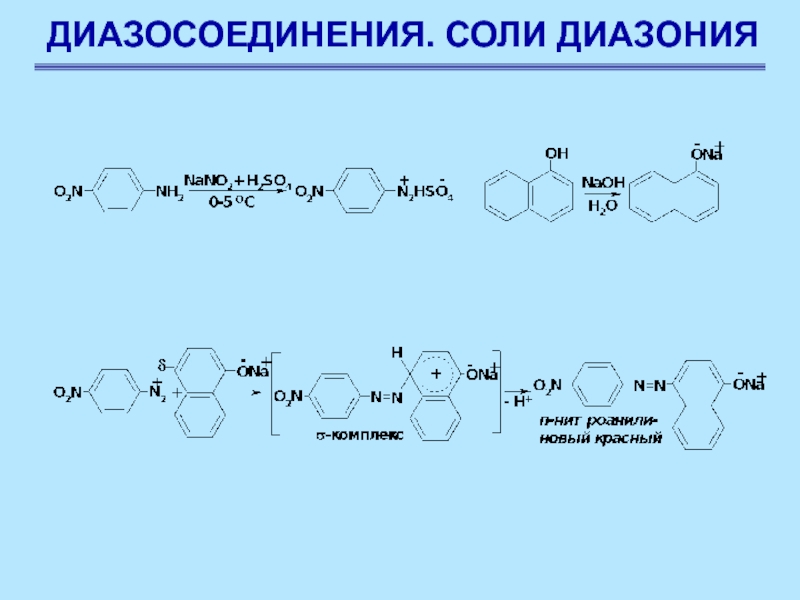
Сочетание с фенолами
Сочетание с фенолами ведется в
слабощелочной среде, при пониженной температуре. Фенол обладает заметно кислыми свойствами,
в водном растворе он существует в равновесии с фенолят-ионом
Слайд 83ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ
Сочетание с фенолами
Наличие полного отрицательного заряда делает
заместитель бóльшим донором электронов. Чем больше щелочность среды, тем выше
содержание фенолят-иона, тем выше скорость азосочетания. С другой стороны, в присутствии ОН ион диазония существует в равновесии с неионизированным соединением. Это значит, что реакции азосочетания будет благоприятствовать низкая концентрация гидроксил-иона, т.е. кислая среда
Слайд 84ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ
Сочетание с фенолами
Условия, при которых протекает реакция
сочетания с фенолами являются компромиссными: раствор не должен быть слишком
щелочным, чтобы концентрация диазотат-иона не стала слишком высокой, и не должен быть слишком кислым, чтобы концентрация фенолят-иона была достаточной для успешного протекания реакции, т.е. поддерживается слабощелочная среда
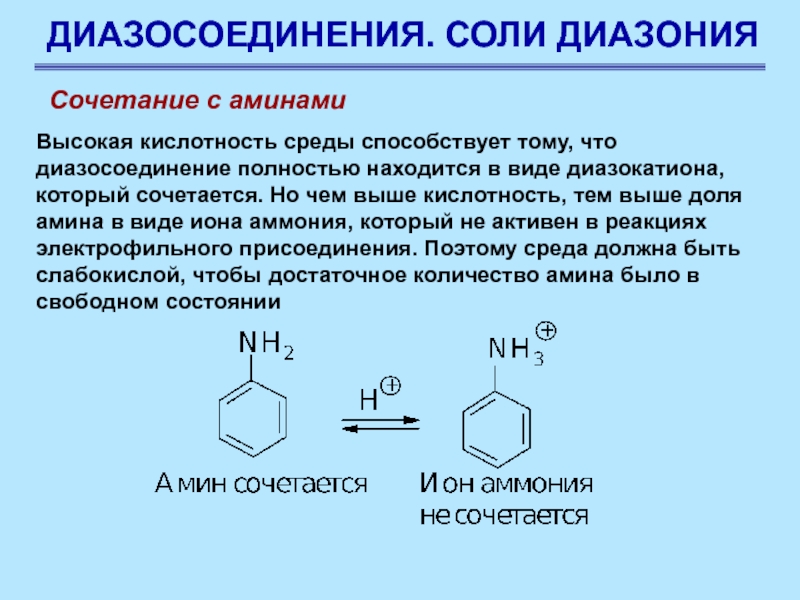
Слайд 85ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ
Сочетание с аминами
Высокая кислотность среды способствует тому,
что диазосоединение полностью находится в виде диазокатиона, который сочетается. Но
чем выше кислотность, тем выше доля амина в виде иона аммония, который не активен в реакциях электрофильного присоединения. Поэтому среда должна быть слабокислой, чтобы достаточное количество амина было в свободном состоянии
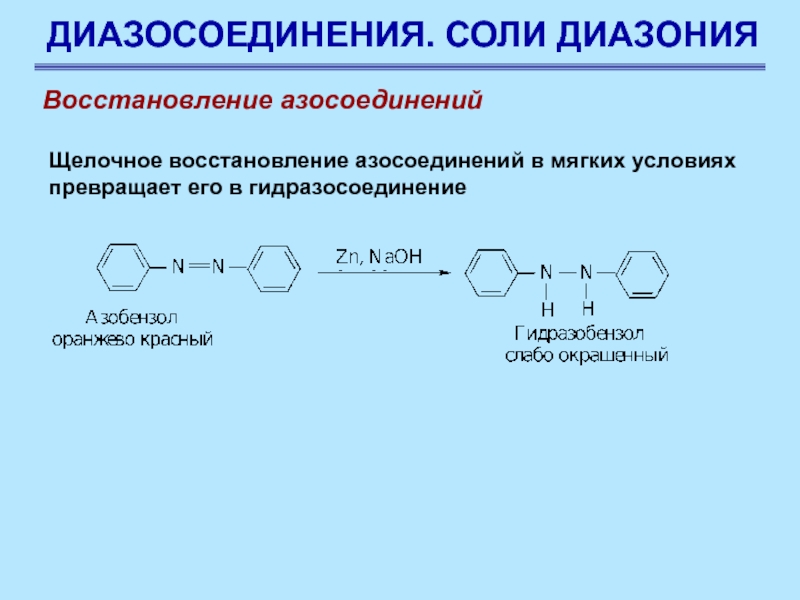
Слайд 90ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ
Восстановление азосоединений
Щелочное восстановление азосоединений в мягких условиях
превращает его в гидразосоединение
Слайд 91ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ
Восстановление азосоединений
Действием более сильных восстановителей азокраситель расщепляется
по связи –N=N–. Эта реакция приводит к образованию двух аминов.
Она очень полезна при определении структуры азасоединений