Слайд 1ПЕТРОХИМИЧЕСКИЕ ПЕРЕСЧЕТЫ
И СПОСОБЫ ПРЕДСТАВЛЕНИЯ ПЕТРОХИМИЧЕСКИХ ДАННЫХ
Слайд 2Петрохимические пересчеты
А. Объединение оксидов по валентности элементов (метод Рота, метод
Левинсона-Лессинга). Методы устарели, в наст. время не применяются.
Б. Объединение оксидов
по их роли в построении породообразующих минералов. (метод Мишель-Леви, метод Озанна, метод Вольфа, метод Заварицкого) .
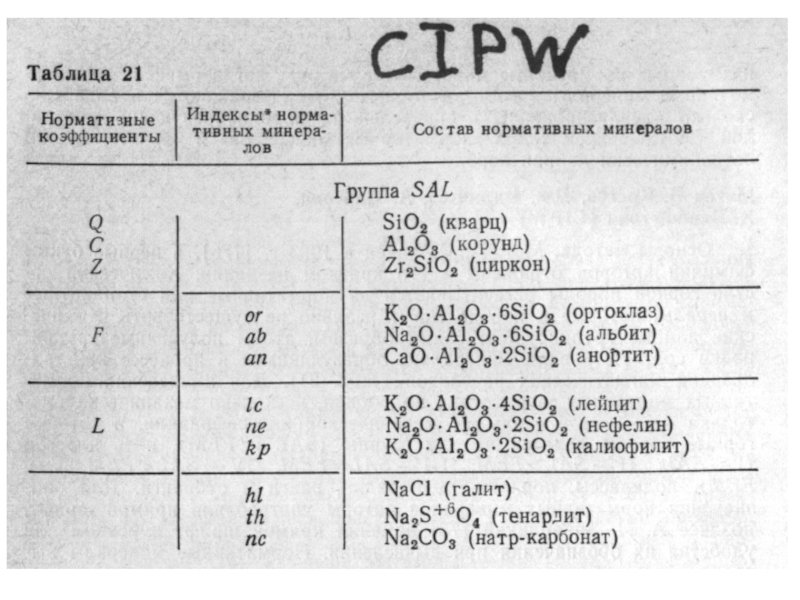
В. Объединение оксидов в группы, соответствующие теоретическим составам наиболее распространенных породообразующих минералов. (метод Ниггли, метод Кросса, Иддингса, Пирсона, Вашингтона CIPW, метод CIPWD (метод Дубровского).
Г. Специальные методы с применением данных по термодинамике минералов.
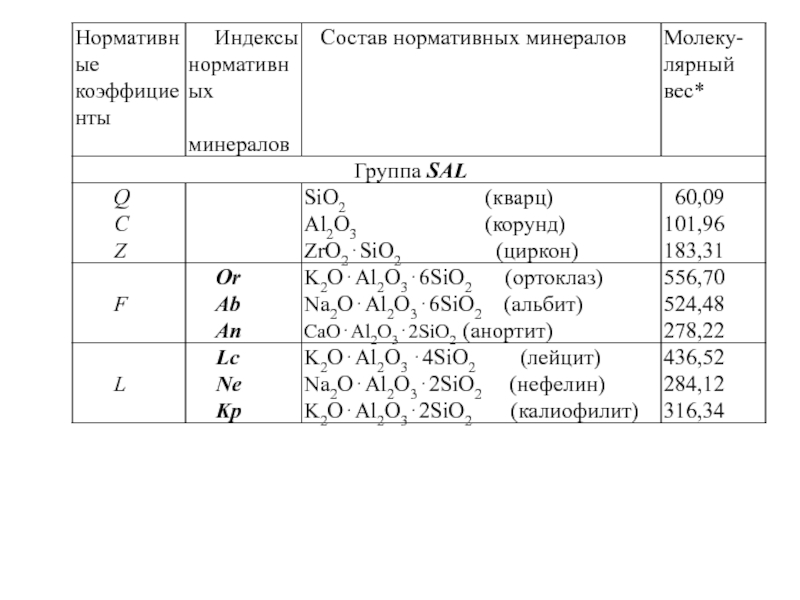
Слайд 3Метод В. Кросса, Дж. Иддингса, А. Пирсона, Х. Вашингтона
CIPW
Метод предложен
в 1903 г.
Химический состав горной породы рассчитывается на нормативные
минералы, которые в породе могут реально не существовать.
Минералы делятся на салические и фемические (SAL, FEM).
Горные породы делятся на пять классов: I –SAL, II – SAL>FEM, III – SAL=FEM, IV – SAL
Слайд 5Основное разделение на классы ведется по сопоставлению весовых соотношений основных
групп
SAL и FEM
Нормативные минералы (НЕ ПУТАТЬ С МОДАЛЬНЫМИ) вычисляются
исходя из их молекулярного состава, согласно общепринятым формулам, написанным в оксидной форме. Минералы делятся на САЛИЧЕСКИЕ (SAL) и ФЕМИЧЕСКИЕ (FEM)
Слайд 6Классы:
I – SAL
II – SAL>FEM
III – SAL=FEM
IV - SAL
FEM
V - FEM
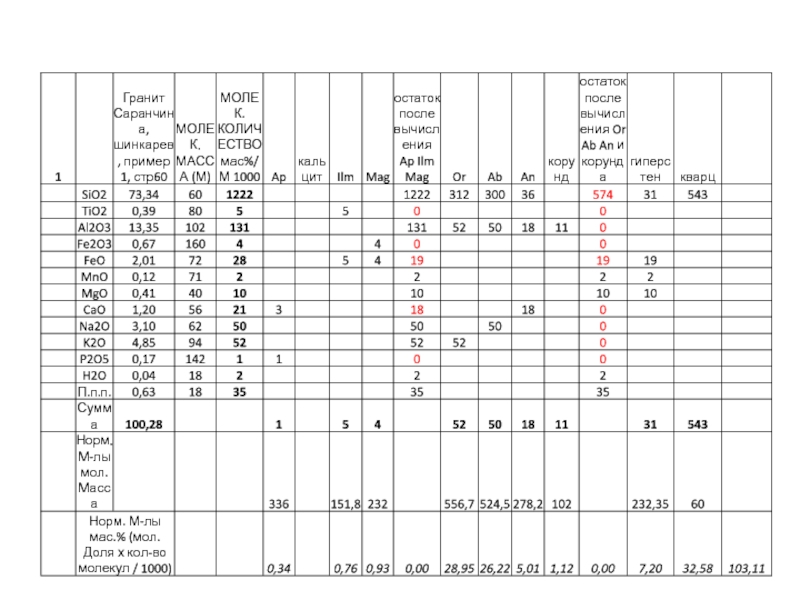
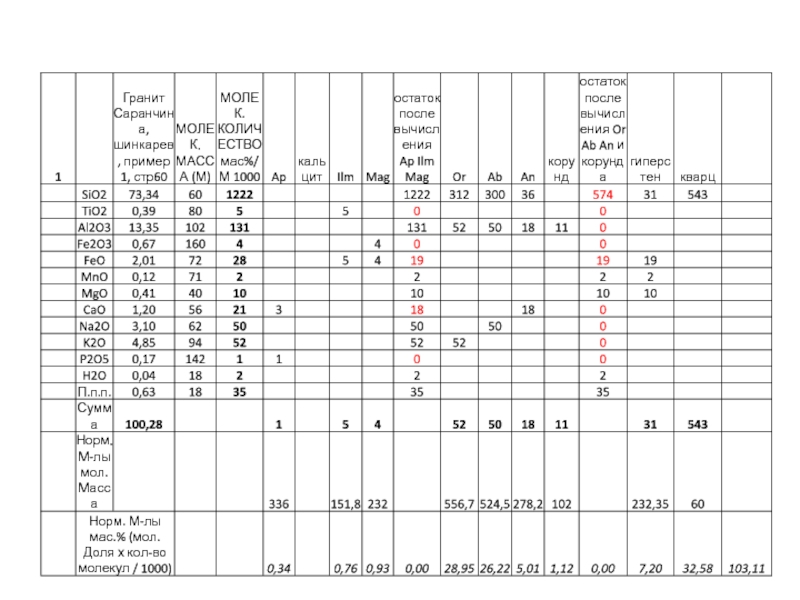
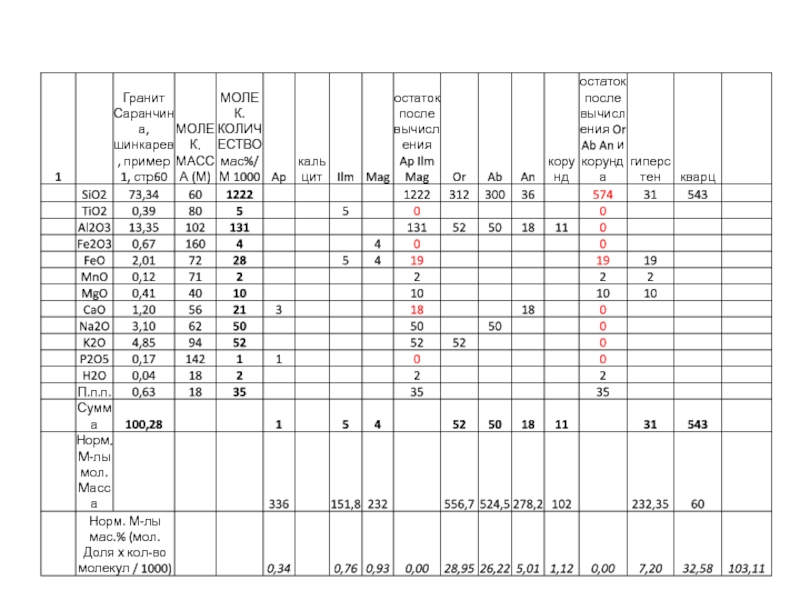
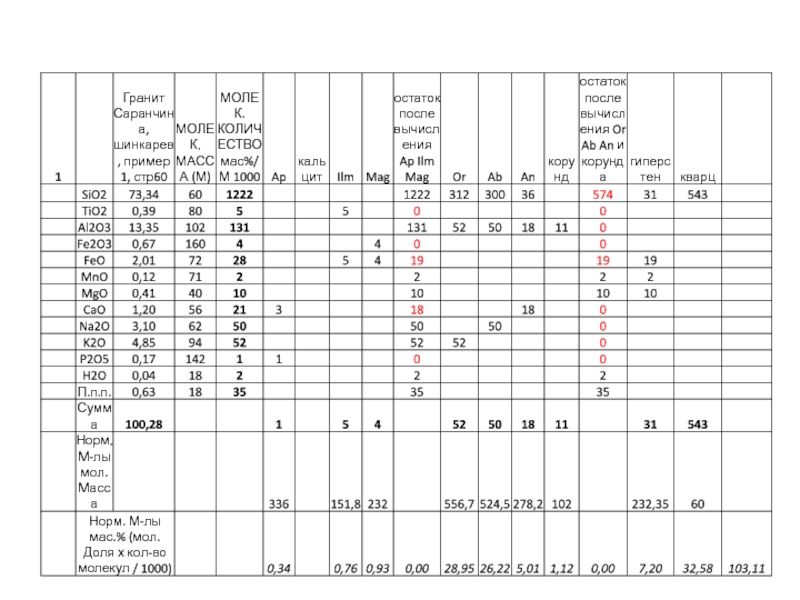
Слайд 13Порядок пересчета
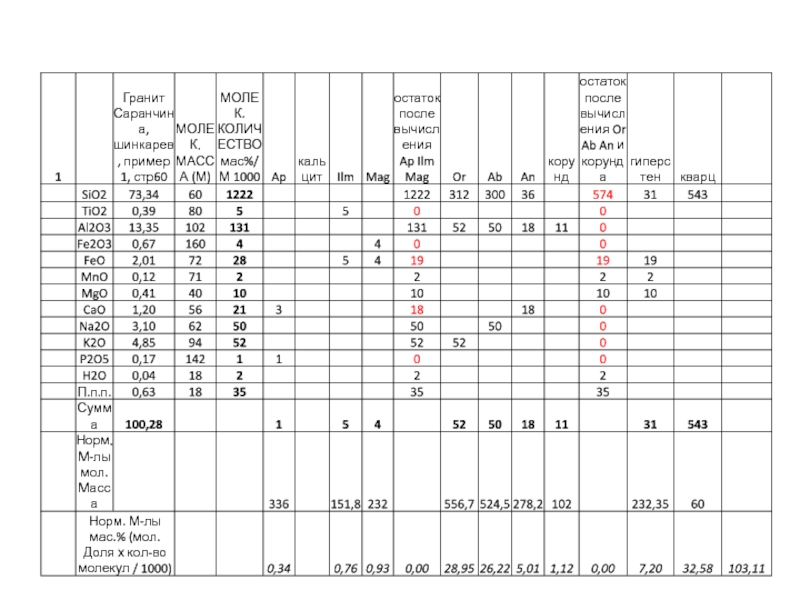
1.Массовые содержания оксидов пересчитываются на молекулярные и атомные количества.
(N(%) / M)
× 1000
2.MnO и NiO присоединяются к FeO
BaO и SrO присоединяются к CaO
Слайд 15В первую очередь вычисляются минералы, содержащие «малые» компоненты (P2O5, Cl,
SO3 и пр.):
а) количество CaO, равное 3.33 P2O5 (или
3 P2O5 + 0.33 F, если последний определен в анализе), соединяются в апатит ap.
б) Na2Oв количестве, равном Cl2, соединяются в hl галит.
в) количество Na2O, равное SO3, соединяется в th тенардит (если порода содержит минералы гаюиновой группы).
г) количество FeO, равное половине количества S, соединяются в пирит pr.
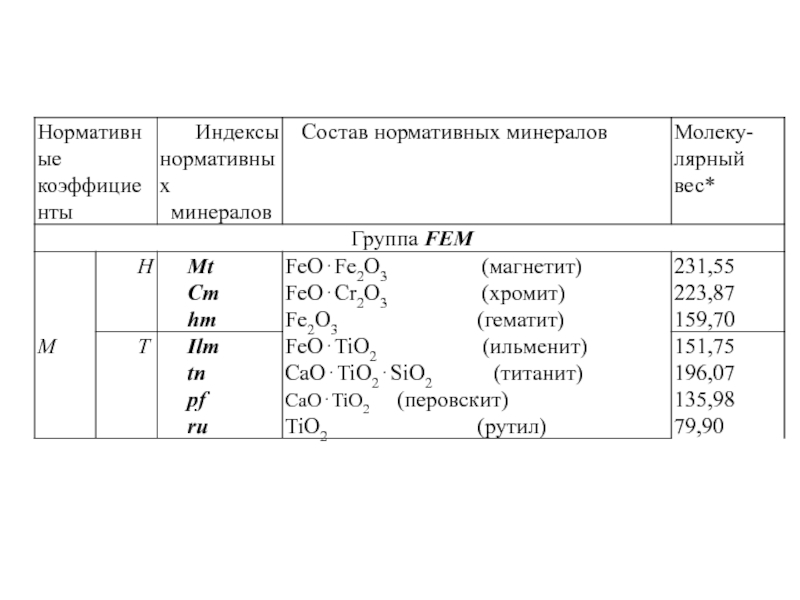
д) количество FeO, равное Cr2O3, соединяются в хромит cm.
Слайд 16е) количество FeO, равное TiO2, соединяются в ильменит ilm; избыток
TiO2 соединяется с CaO и SiO2 в титанит tn, при
условии, что CaO хватит для образования an, в противном случае TiO2 оставляется свободным как рутил ru.
ж) количество CaO, равное половине оставшегося F, соединяется с ним в fr флюорит.
з) если в свежей породе присутствует канкринит или первичный кальцит, то количества Na2O и CaO, равные количеству CO2 , соединяются с ним в первом случае в nc натр-силикат, а во втором случае – в кальцит cc.
и) количество ZrO2 вычисляется для дальнейшего расчета на Z.
Слайд 17После расчета второстепенных минералов приступают к расчету главных породообразующих минералов:
а)
количество Al2O3, равное K2O, соединяется с ним для образования в
дальнейшем ортоклаза ort или лейцита lc.
б) если имеется избыток К2О, т.е. К2О – Al2O3 >0, то этот избыток рассчитывается как кальсилит ks.
в) избыток Al2O3 над К2О соединяется с равным количеством Na2O и в дальнейшем с SiO2 в альбит ab или нефелин ne;
Слайд 18если Na2O больше оставшегося Al2O3 (K2O + Na2О > Al2O3),
то избыток Na2O идет на образование акмита acm.
г) избыток
Al2O3 против суммы K2O + Na2О, т.е. [Al2O3 – (K2O + Na2О)> 0] соединяется с СаО в анортит an.
д) если после формирования an остается избыток Al2O3 , то он считается как С.
е) если СаО больше, чем может соединиться с Al2O3, то избыток его используется для образования молекул диопсида di и волластонита wo.
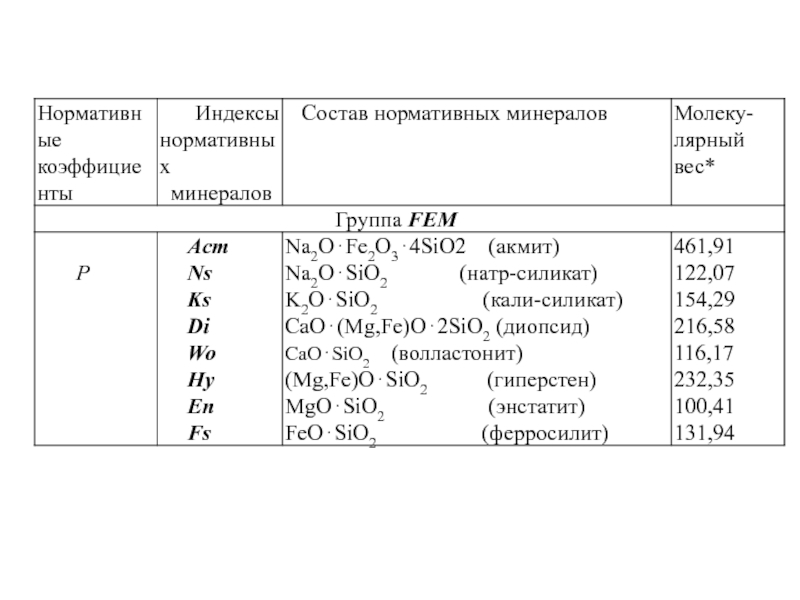
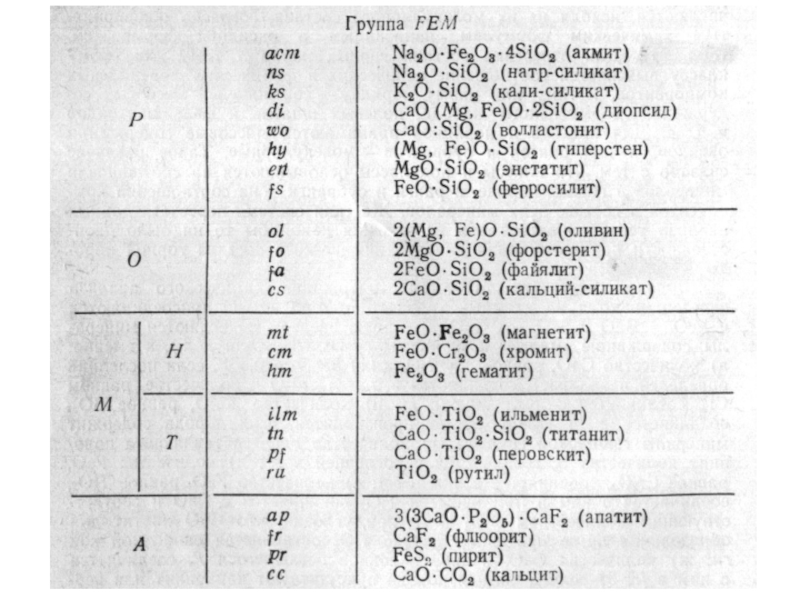
Слайд 20Минералы, содержащие трехвалентное железо, рассчитываются следующим образом:
а) избыток Na2О по
отношению к Al2O3 насыщается Fe2O3 и используется в дальнейшем для
образования акмита acm;
б) в тех редких случаях, когда избыток щелочей больше Fe2O3, остаток [K2O + Na2О – (Al2O3 + Fe2O3) ] идет на образование натр-силиката ns.
в) обычно Fe2O3больше избытка щелочей и оставшийся оксид Fe3+ соединяется с равным количеством FeO (после образования пирита pr и ильменита ilm) в mt.
г) остаток Fe2O3 после образования mt считается как гематит hm.
Слайд 21Все количество MgO и остаток FeO (FeO'), не использованный на
образование mt и ilm, соединяются для дальнейших расчетов в общую
сумму (MgO + FeO'). Можно применять и другой вариант пересчета, используя MgO и FeO' порознь.
Для вычисления силикатов, содержащих СаО, производят следующее:
а) к оставшемуся от формирования an количеству СаО, обозначенному как СаО'', прибавляется такое же количество MgO + FeO' в том же соотношении, которое получилось при их суммировании. Количество полученных оксидов СаО'' + MgO + FeO' используется в дальнейшем для образования диопсида di.
Слайд 23б) В редких случаях остается избыток СаО, который идет на
формирование волластонита wo или кальций-силиката cs.
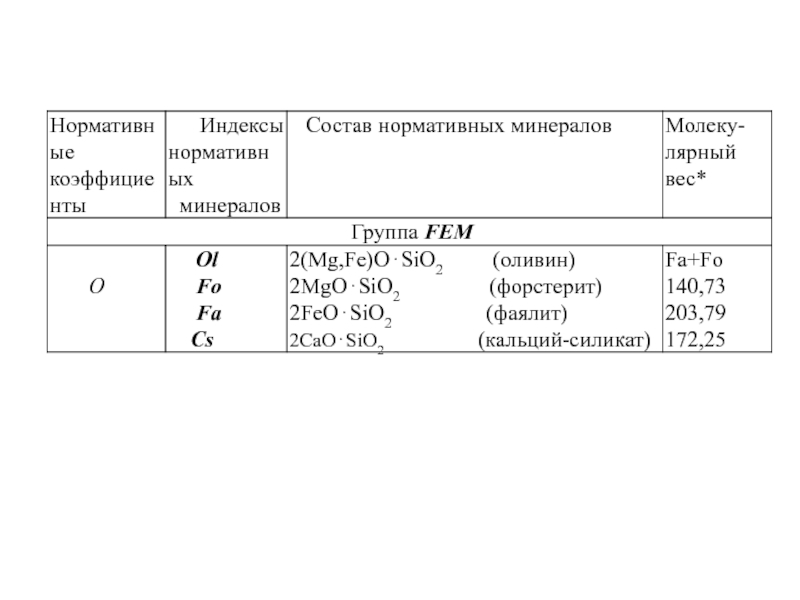
Избыток MgO и FeO,
оставшиеся после формирования di, используется на образование гиперстена hy или оливина ol, эти оксиды могут быть пересчитаны на энстатит en и ферросилит fs, на форстерит fo и фаялит fa.
Слайд 24После формирования всех указанных величин проводится их насыщение кремнеземом и
вычисление количеств молекул соответствующих силикатов:
А) к ZrO2 прибавляется равное количество
SiO2 и таким образом получается Z.
Б) к СаО и TiO2 прибавляется равное количество SiO2 и образуется титанит tn.
В) к избытку щелочей по отношению к Al2O3 и равному ему количеству Fe2O3 прибавляется четырехкратное количество SiO2 и образуется акмит acm.
Слайд 25Г) если имеется переизбыток щелочей, он соединяется с равным количеством
SiO2 в кали-силикат ks или натр-силикат ns.
Д) к K2O
и Al2O3 прибавляется шестикратное количество SiO2 для образования ортоклаза ort.
Е) из Al2O3 и Na2O таким же образом формируется альбит ab.
Ж) для образования анортита an из СаО и Al2O3 используется удвоенное количество SiO2.
Слайд 26З) из СаО'' + MgO + FeO' вычисляется величина di
присоединением равного количества SiO2.
И) если есть остаток СаО, то к
нему присоединяется равное количество SiO2 для образования волластонита wo.
К) чаще бывает, что после формирования di остается избыток MgO + FeO, к нему присоединяется равное количество SiO2 для образования hy.
Часто после насыщения оксидов SiO2 остается избыток последнего. Он вычисляется как Q.
Слайд 27Нередко бывает, что SiO2 не хватает на образование указанных силикатов.
Тогда проводится постепенное высвобождение SiO2 за счет формирования силикатов с
меньшим содержанием SiO2. Для этого из общего количества SiO2 вычитается то его количество, к-рое израсходовано на образование силикатов с максимальным содержанием SiO2, кончая di, т.е. до того, как было рассчитано содержание hy (или en и fs).
Слайд 28В таком случае:
А) Если оставшееся количество SiO2 составляет более половины
MgO + FeO', то вычисляется hy (или en и fs)
и ol (или fo и fa). Решают два простых уравнения:
[hy] +[ol] = SiO2
[hy] +2[ol] = MgO + FeO' ;
Откуда: [ol] = (MgO + FeO') - SiO2
[hy] = 2 SiO2 - (MgO + FeO')
Слайд 29Б) Если SiO2 остается меньше половины суммы MgO + FeO',
то ее отнимают от величины tn (титанит), переводя ее в
pf (перовскит).
Слайд 30В) Если после этого все же не хватает SiO2 для
связывания MgO + FeO' в ol, то необходимо получить требуемое
количество SiO2 за счет того SiO2, который был взят для построения альбита ab. Это осуществляется путем пересчета ab на нефелин ne, полностью или частично.
Определение необходимого количества ab, пересчитываемого на ne делается аналогично пересчету на hy и ol, по уравнениям:
[ab] +[ne] = Na2O
6[ab] +2[ne] = SiO2;
Откуда: [ab] = (SiO2 - 2Na2O) / 4
[ne] = (6 Na2O - SiO2) / 4
Слайд 31Г) редко, но все-же случается, что пересчета ab на ne
недостаточно и приходится изыскивать некоторое количество SiO2 за счет пересчета
ортоклаза or на лейцит lc, частично или полностью. Такой расчет делается по следующим уравнениям:
[or] +[lc] = К2O
6[or] +4[lc] = SiO2;
Откуда: [or] = (SiO2 - 4 К2O) / 2
[lc] = (6 К2O - SiO2) / 2
Слайд 32Д) В случае недостачи кремнезема и после этого пересчета можно
получить еще некоторое количество его пересчетом wo (волластонит) на cs
(кальций-силикат). Если же и эта мера недостаточна, то дополнительное количество SiO2 можно получить, используя следующие три уравнения:
[di] + 2[cs] = CaO
[di] + 2[ol] = MgO + FeO'
2[di] + [ol] + [cs] = SiO2
При этом SiO2 вычисляется как разность между общим количеством SiO2 и количеством его, пошедшим на формирование lc, ne, an, ac, ol.
Слайд 33Е) На самый крайний случай можно освободить еще некоторое количество
SiO2 путем пересчета лейцита lc на kp (калиофилит) по уравнениям:
[lc]
+ [kp] = К2O
4[lc] + 2[kp] = SiO2
Большего количества кремнезема высвободить нельзя и величины ne, an, ac, ol лишать SiO2 не допускается.
Слайд 34После проделанных операций полученные «молекулы» пересчитываются на весовые количества путем
умножения их на соответствующие молекулярные доли (например, or на 556).
Следует помнить, что при первоначальном расчете все молекулярные количества были для удобства умножены на 1000. Для того, чтобы при обратном пересчете получить массовые количества в процентах, следует все произведения «молекул» на их молекулярные массы разделить на 1000.
Слайд 36Петрохимические коэффициенты
В настоящее время используется более 100 различных петрохимических
коэффициентов, в которых используется отношения одной или нескольких групп химических
элементов, нормативных минералов или числовых характеристик.
В качестве единиц измерений чаще всего используются массовые доли петрогенных элементов, атомные или молекулярные количества, соотношения нормативных минералов или разнообразные числовые характеристики.
Слайд 37Коэффициент агпаитости: (Na2O + K2O) / Al2O3 (в молекулярных количествах)
по В.Гольдшмиту или (Na2O + K2O) / (Al2O3 + Fe2O3)
по В.Н.Герасимовскому.
Коэффициент глиноземистости: al' = Al2O3 / (FeO + Fe2O3 + MgO).
Коэффициент железистости: f = (Fe2+ + Fe3+) / Mg (в атомных количествах).
Коэффициент фракционирования: Kф = 100 (FeO + Fe2O3) / (MgO + FeO + Fe2O3).
Слайд 38Коэффициент окисления: Fe2O3 / FeO или Fe2O3 / Fe2O3 +
FeO.
Коэффициент титанистости: 100 TiO2 / (FeO + Fe2O3) (в массовых
содержаниях).
Индекс затвердевания (Х.Куно): 100 MgO / (MgO + FeO + Fe2O3 + Na2O + K2O)
(в массовых содержаниях).
Известково-щелочной индекс (индекс М.Пикока): SiO2 - (Na2O + K2O) - CaO (в массовых содержаниях).