Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
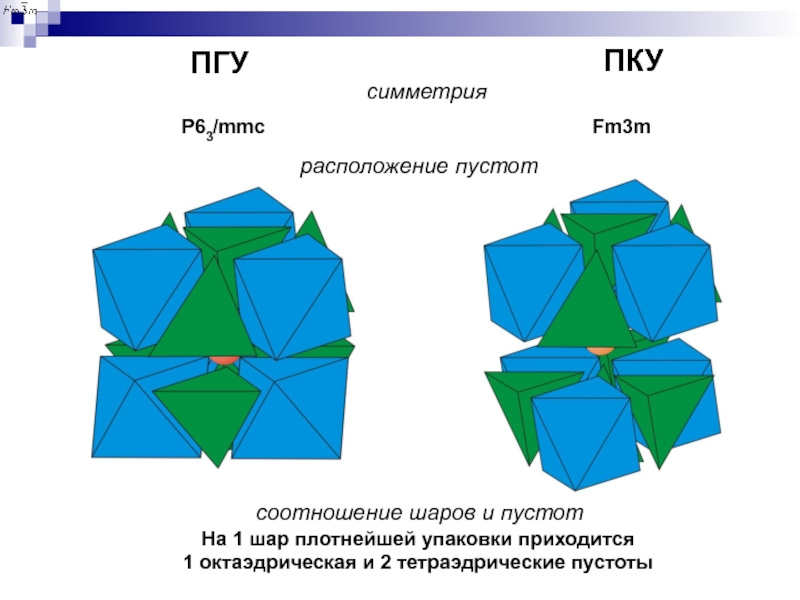
ПКУ
Содержание
- 1. ПКУ
- 2. Слайд 2
- 3. Основные структурные типы
- 4. Структурный тип – совокупность соединений с геометрическим подобными структурами, которые отличаются лишь параметрами элементарной ячейки.
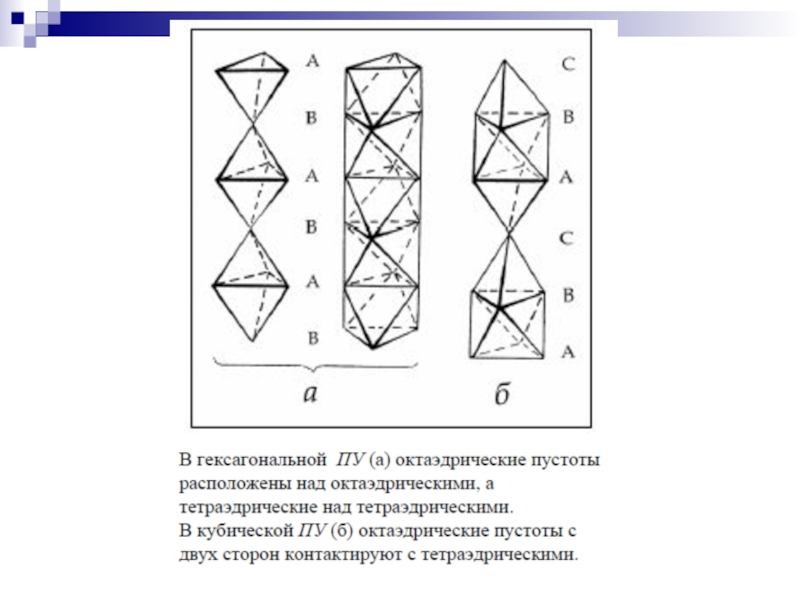
- 5. Структуры простых веществ
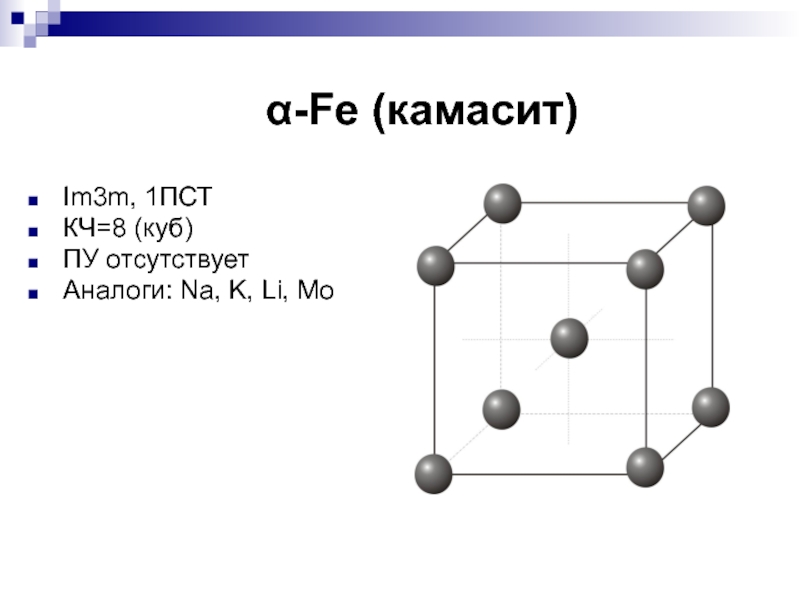
- 6. Im3m, 1ПСТ КЧ=8 (куб)ПУ отсутствует Аналоги: Na, K, Li, Moα-Fe (камасит)
- 7. 1ПСТ.Это означает, что все атомы структуры мы
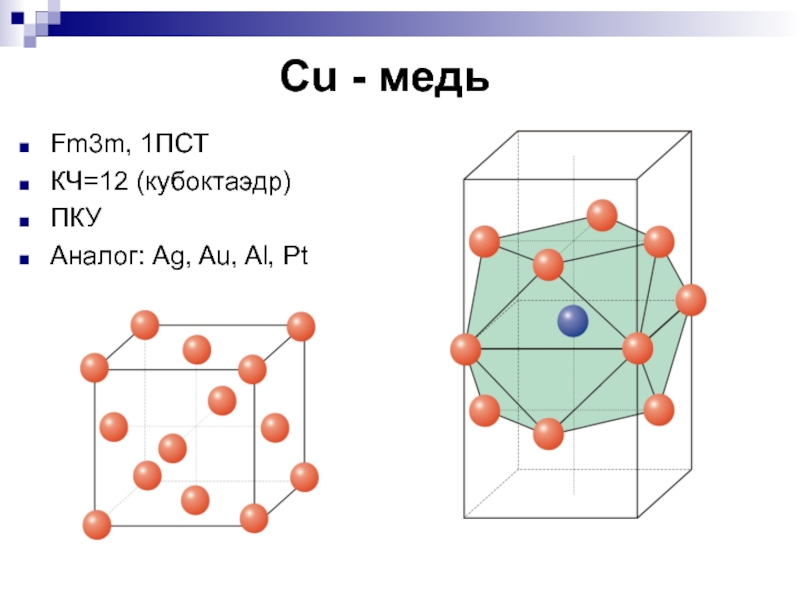
- 8. Cu - медь Fm3m, 1ПСТ КЧ=12 (кубоктаэдр)ПКУАналог: Ag, Au, Al, Pt
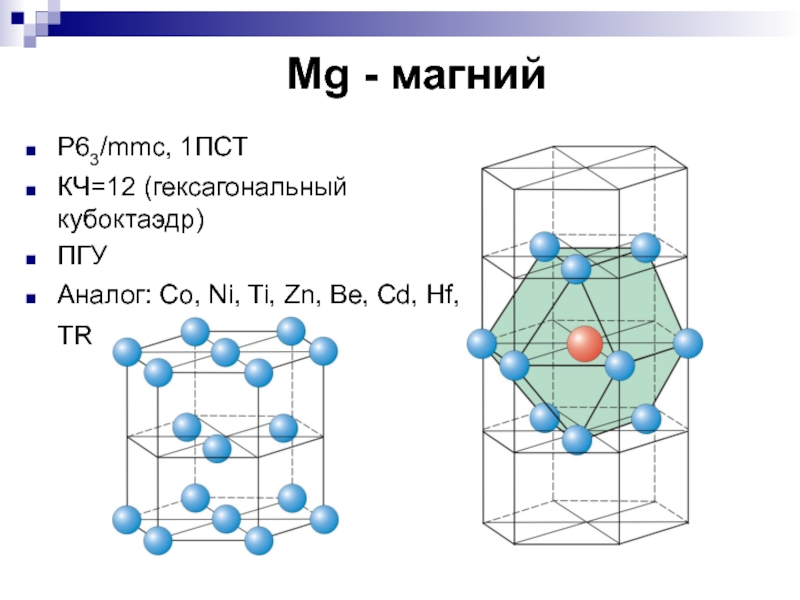
- 9. Mg - магнийP63/mmc, 1ПСТ КЧ=12 (гексагональный
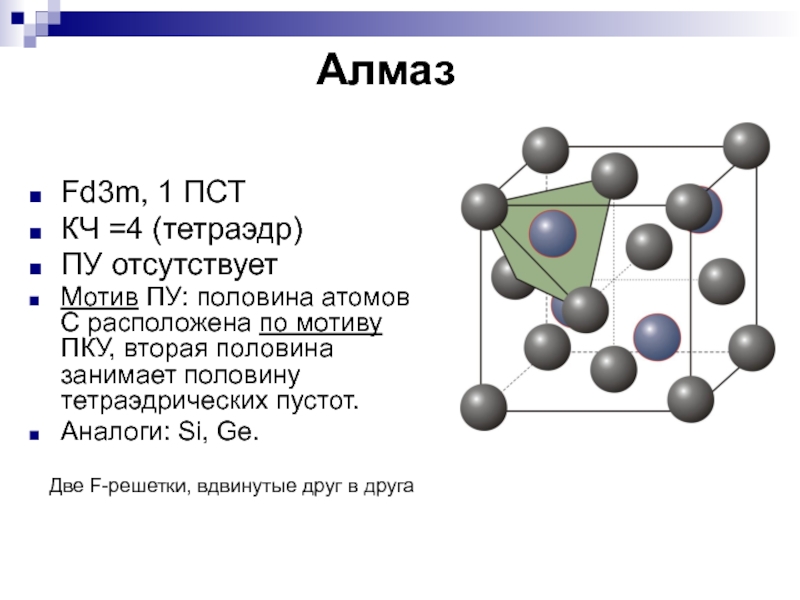
- 10. АлмазFd3m, 1 ПСТКЧ =4 (тетраэдр)ПУ отсутствуетМотив ПУ:
- 11. У атома углерода в основном его состоянии
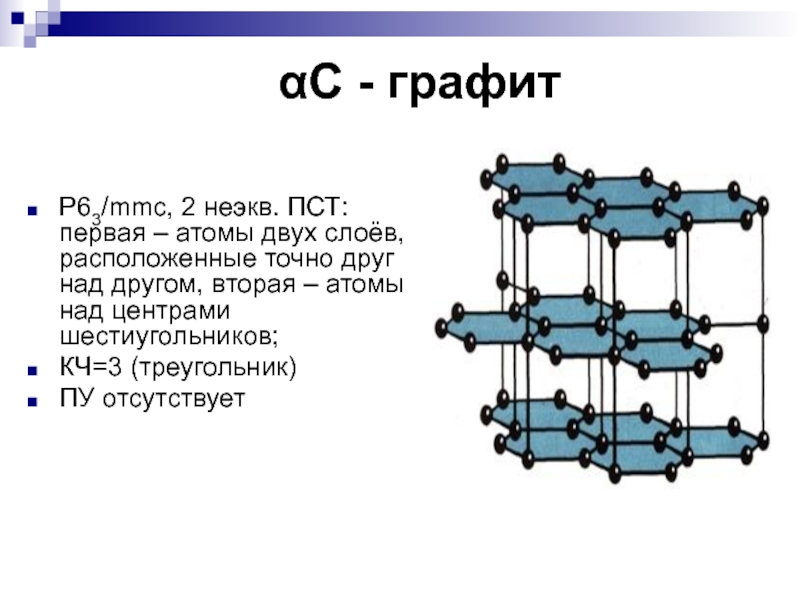
- 12. αС - графитP63/mmc, 2 неэкв. ПСТ: первая
- 13. В атомов углерода в структуре графите характерна
- 14. 2 неэкв. ПСТЭто означает, что для построения
- 15. Структуры веществ с хим. формулой АB
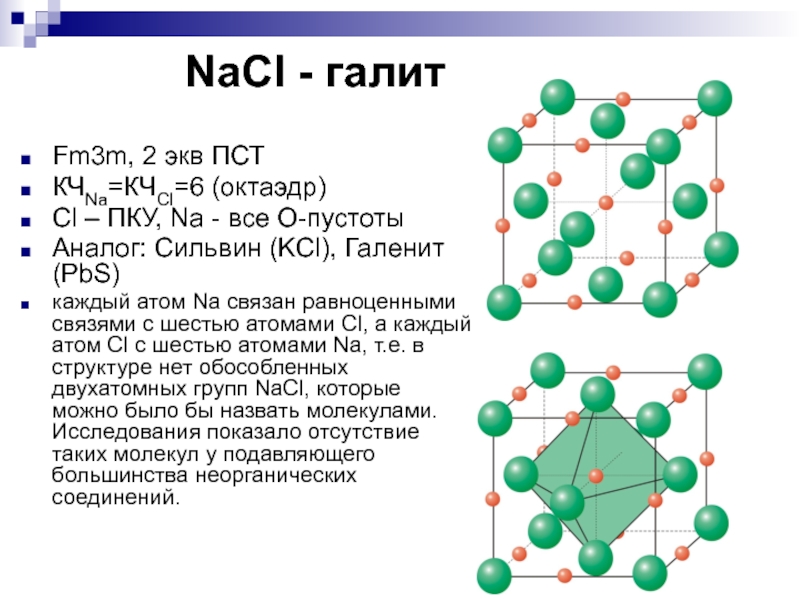
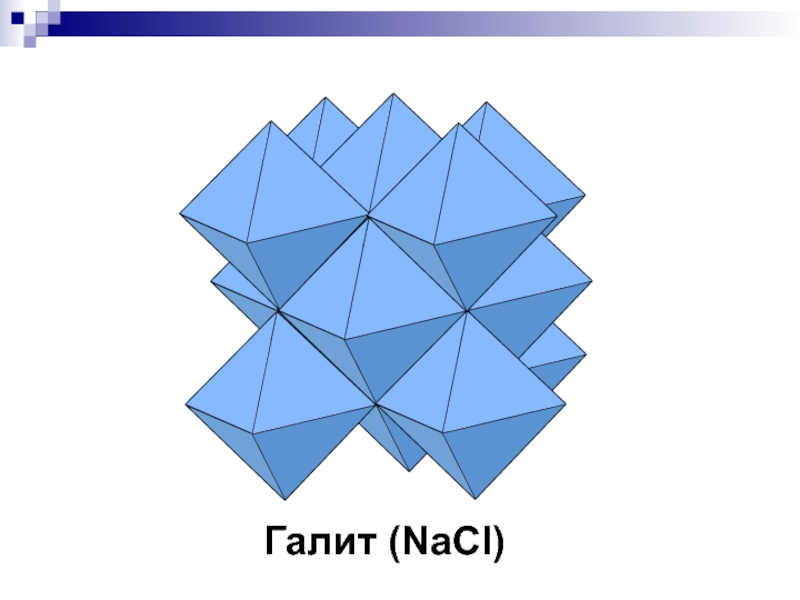
- 16. NaCl - галитFm3m, 2 экв ПСТКЧNa=КЧCl=6
- 17. 2 экв. ПСТВсю структур можно получить из
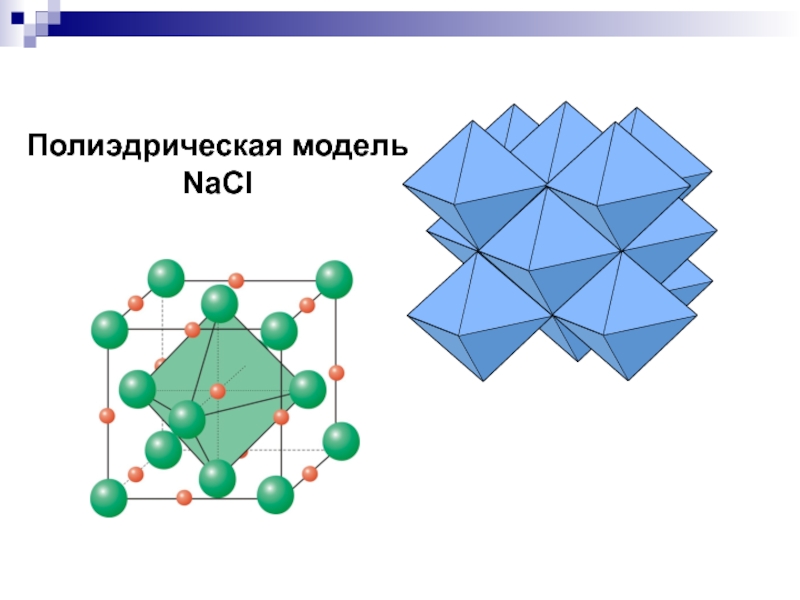
- 18. Полиэдрическая модель NaCl
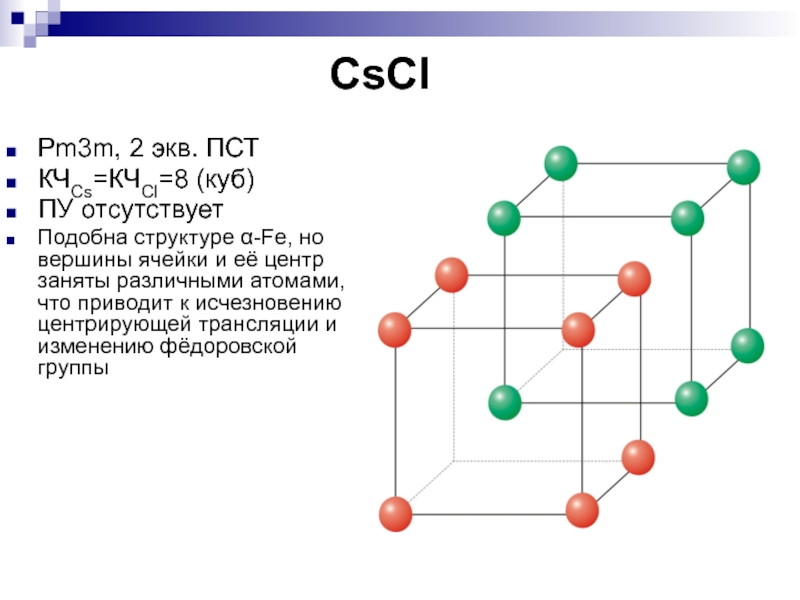
- 19. CsClPm3m, 2 экв. ПСТКЧCs=КЧCl=8 (куб)ПУ отсутствуетПодобна структуре
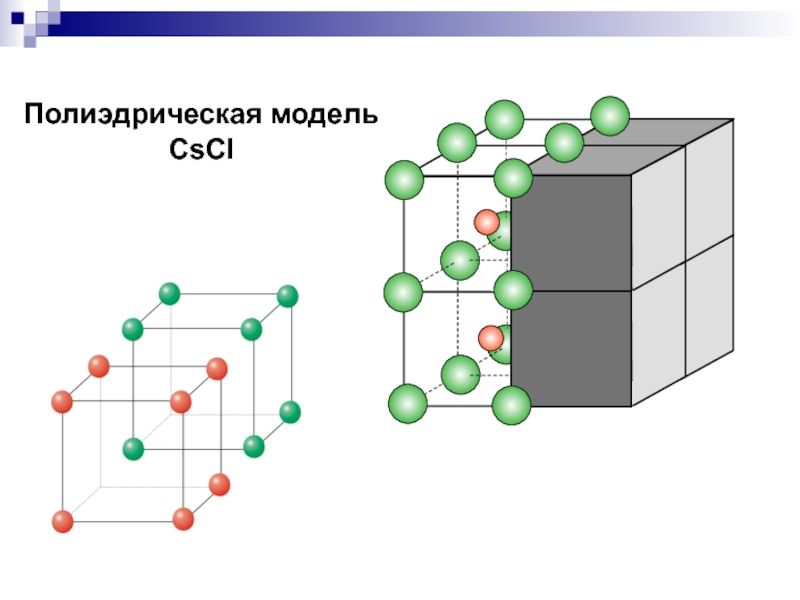
- 20. Полиэдрическая модель CsCl
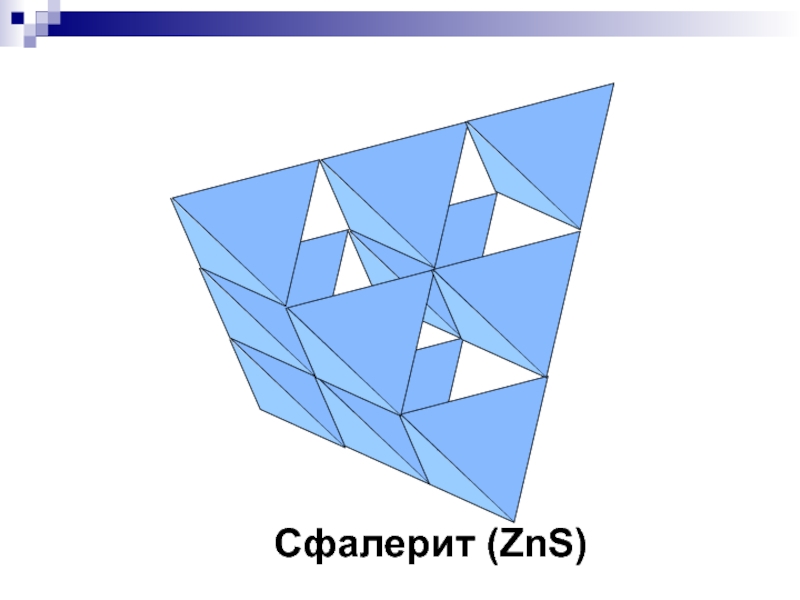
- 21. ZnS - сфалерит F43m, 2 экв. ПСТКЧZn=КЧS=4
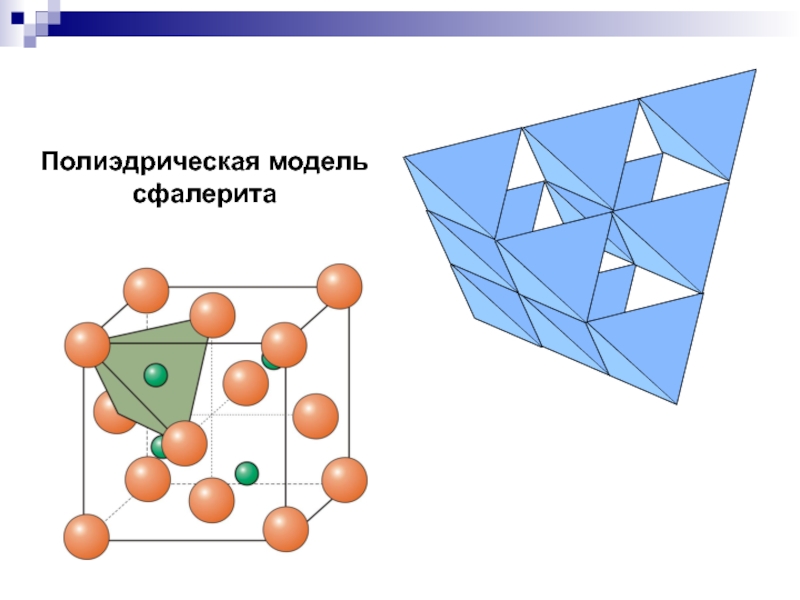
- 22. Полиэдрическая модель сфалерита
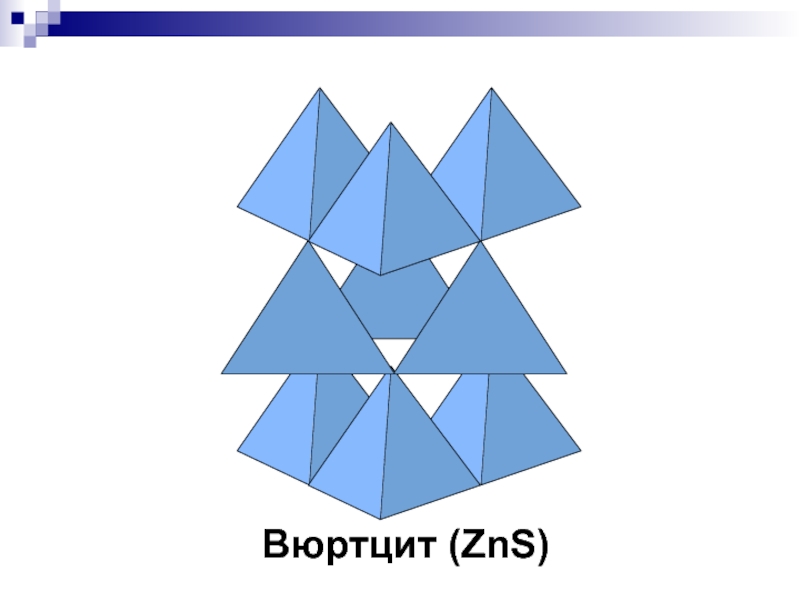
- 23. ZnS - вюртцит P63mc, 2 экв. ПСТ
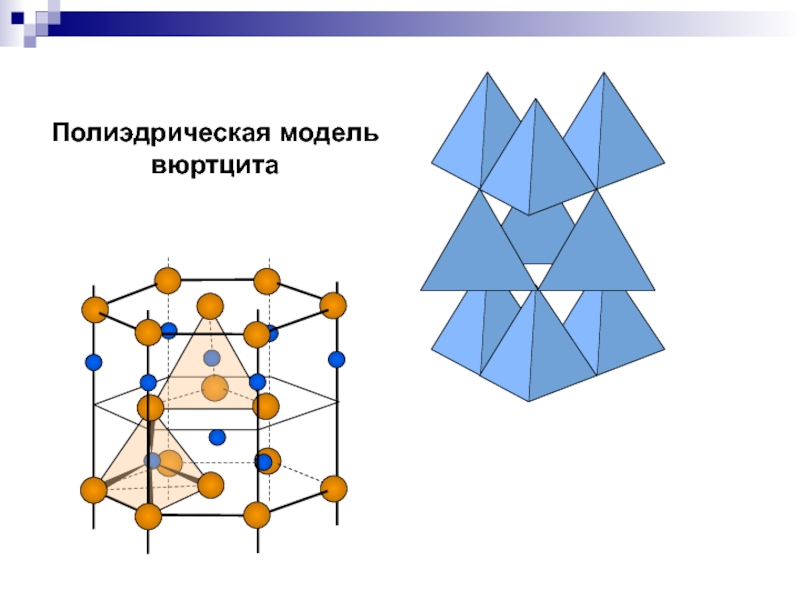
- 24. Полиэдрическая модель вюртцита
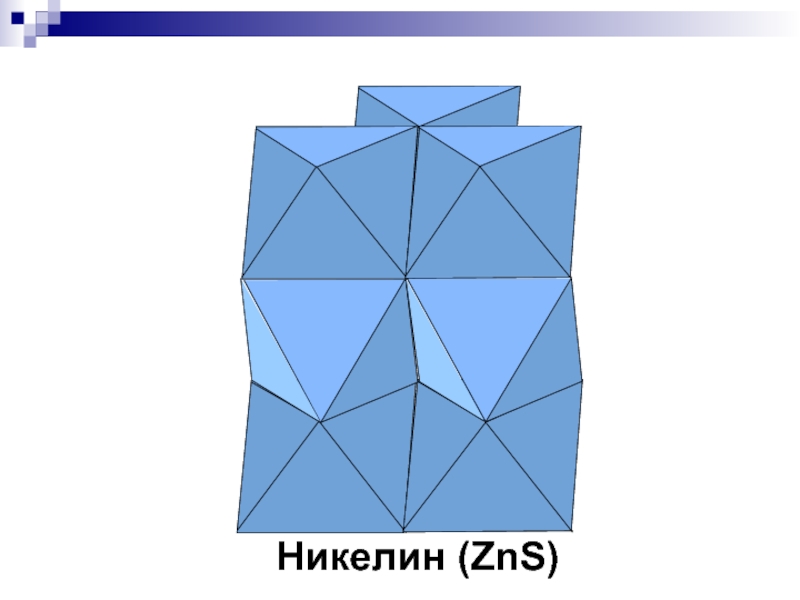
- 25. NiAs - никелин P63/mmc, 2 неэкв.
- 26. Обратите внимание!Две ПСТ, по которым располагаются Ni
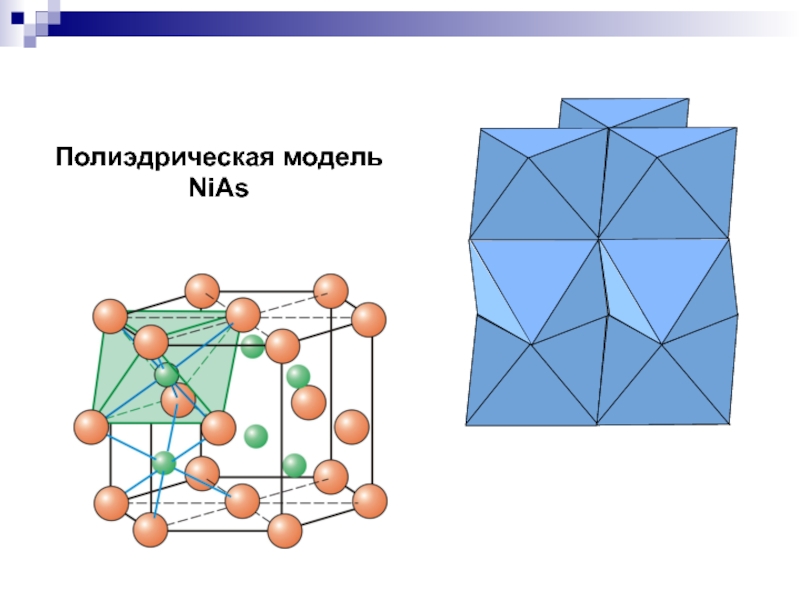
- 27. Полиэдрическая модель NiAs
- 28. Структуры веществ с хим. формулой АB2
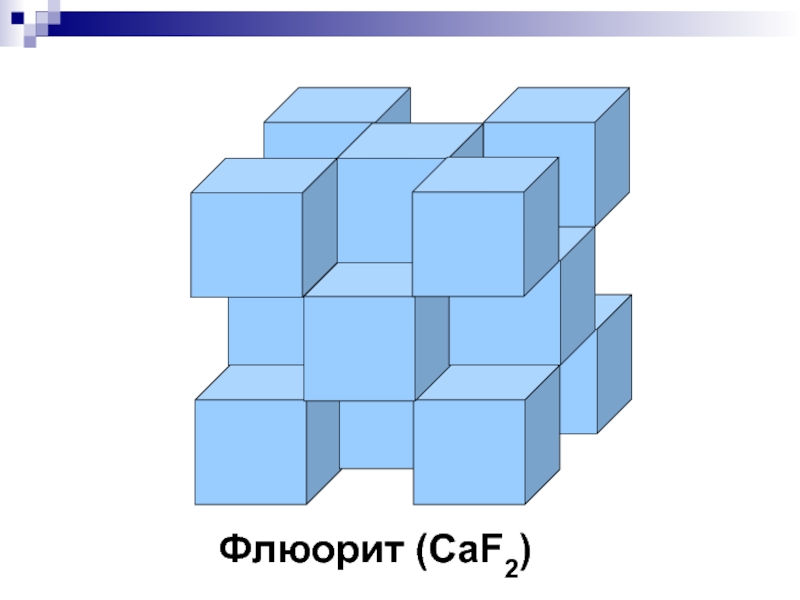
- 29. CaF2 - флюорит Fm3m, 2 неэкв.
- 30. Существует много химических соединений , кристаллы которых
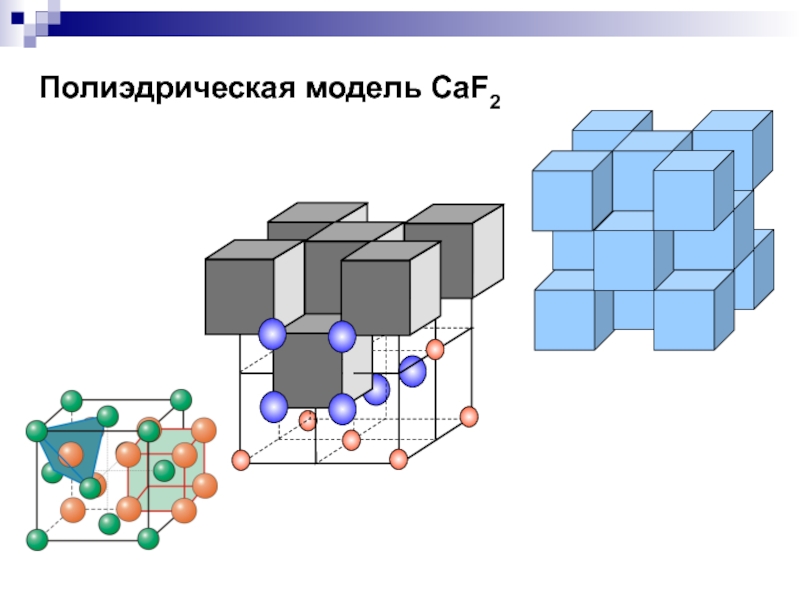
- 31. Полиэдрическая модель CaF2
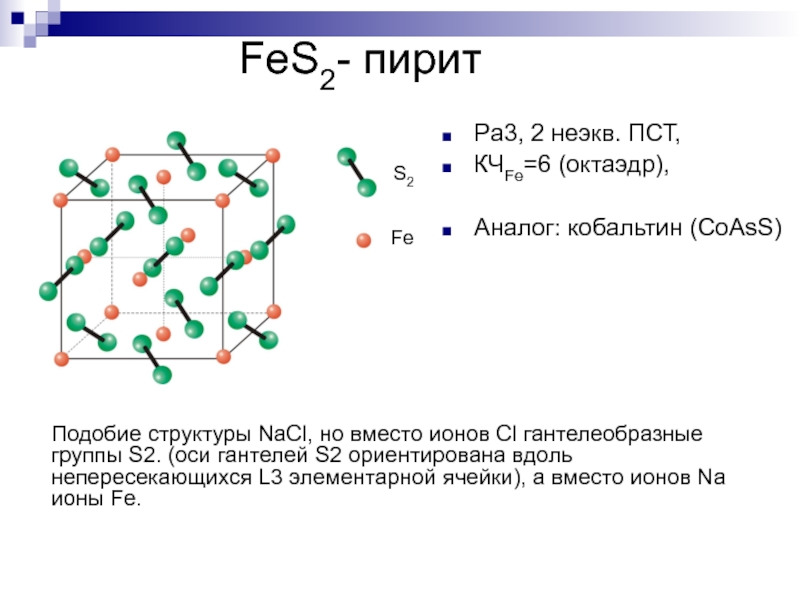
- 32. FeS2- пирит Pa3, 2 неэкв.
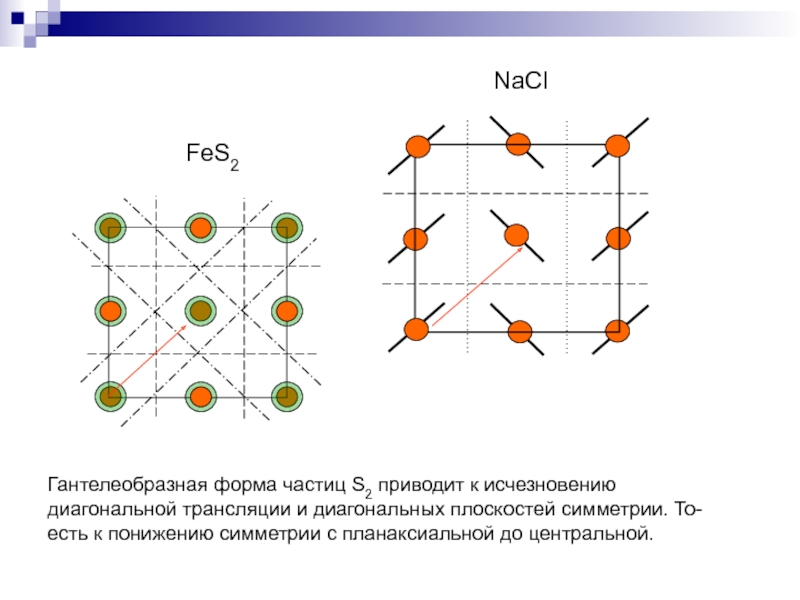
- 33. FeS2NaClГантелеобразная форма частиц S2 приводит к исчезновению
- 34. Немножко попрактикуемся в полиэдрических моделях
- 35. Флюорит (CaF2)
- 36. Галит (NaCl)
- 37. Вюртцит (ZnS)
- 38. Сфалерит (ZnS)
- 39. Никелин (ZnS)
- 40. Скачать презентанцию
Слайды и текст этой презентации
Слайд 4Структурный тип – совокупность соединений с геометрическим подобными структурами, которые
отличаются лишь параметрами элементарной ячейки.
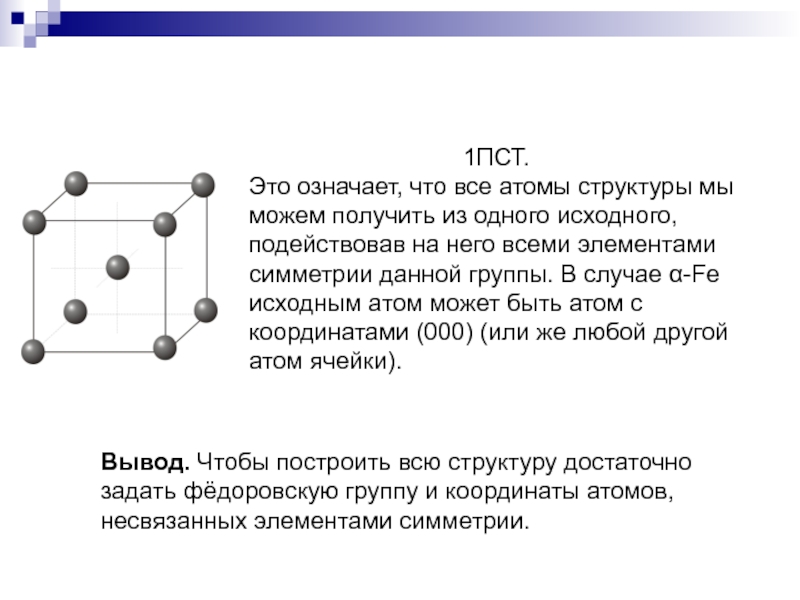
Слайд 71ПСТ.
Это означает, что все атомы структуры мы можем получить из
одного исходного, подействовав на него всеми элементами симметрии данной группы.
В случае α-Fe исходным атом может быть атом c координатами (000) (или же любой другой атом ячейки).Вывод. Чтобы построить всю структуру достаточно задать фёдоровскую группу и координаты атомов, несвязанных элементами симметрии.
Слайд 9 Mg - магний
P63/mmc, 1ПСТ
КЧ=12 (гексагональный кубоктаэдр)
ПГУ
Аналог: Co, Ni,
Ti, Zn, Be, Cd, Hf, TR
Слайд 10Алмаз
Fd3m, 1 ПСТ
КЧ =4 (тетраэдр)
ПУ отсутствует
Мотив ПУ: половина атомов С
расположена по мотиву ПКУ, вторая половина занимает половину тетраэдрических пустот.
Аналоги:
Si, Ge.Две F-решетки, вдвинутые друг в друга
Слайд 11У атома углерода в основном его состоянии во внешней оболочке
два неспаренных p-электрона: 1s22s22p2. В возбужденном состоянии один из внешних
s-электронов переходит в р-состояние (1s22s22p3), так что во внешней оболочке оказывается 4 валентных электрона. При возникновении химической связи одна s-орбиталь и три р-орбитали усредняются с образованием четырех смешанных или гибридных орбиталей (sp3-гибридизация). Образовавшиеся гибридные орбитали направлены от центра к вершинам тетраэдра (под углом 109.5о друг к другу). Направленностью связей и определяется тетраэдрическая координация углерода в структуре алмаза.sp3-гибридизация алмаза
Слайд 12αС - графит
P63/mmc, 2 неэкв. ПСТ: первая – атомы двух
слоёв, расположенные точно друг над другом, вторая – атомы над
центрами шестиугольников;КЧ=3 (треугольник)
ПУ отсутствует
Слайд 13В атомов углерода в структуре графите характерна sp2-гибридизация, получающаяся при
смешении одной s-орбитали и двух р-орбиталей. Гибридные sp2-орбитали располагаются в
одной плоскости под углом 1200 друг к другу. Именно так расположены атомы в структуре графите.sp2-гибридизация графита
Слайд 142 неэкв. ПСТ
Это означает, что для построения всей структуры необходимо
задать координаты двух атомов, несвязанных элементами симметрии. Подействовав на эти
атомы элементами симметрии группы получим расположение атомов в струкрутре. Получающиеся правильные системы точек неравноценны с геометрической точки зрения (неэквивалентны), т.е. если их поменять местами произойдет изменение структуры.Слайд 16 NaCl - галит
Fm3m, 2 экв ПСТ
КЧNa=КЧCl=6 (октаэдр)
Сl – ПКУ,
Na - все О-пустоты
Аналог: Сильвин (KCl), Галенит (PbS)
каждый атом
Na связан равноценными связями с шестью атомами Cl, а каждый атом Cl с шестью атомами Na, т.е. в структуре нет обособленных двухатомных групп NaCl, которые можно было бы назвать молекулами. Исследования показало отсутствие таких молекул у подавляющего большинства неорганических соединений. Слайд 172 экв. ПСТ
Всю структур можно получить из двух исходных атомов
действием элементов симметрии данной пространственной группы. Получающиеся системы точек абсолютно
идентичны с геометрической точки зрения. Если их поменять местами, структура не изменится. Можно с равным правом сказать, что «желты шарики соответствуют атомам натрия, а зеленые - хлора» и наоборот, что «желтые шарики соответствуют атомам хлора, а зеленые – натрия». Конечно, если на модели размеры шариков равны.Вывод. В случае эквивалентных ПСТ все атомы имеют одинаковые координационные полиэдры. В случае неэквивалентных, как правило, отличаются.
Слайд 19CsCl
Pm3m, 2 экв. ПСТ
КЧCs=КЧCl=8 (куб)
ПУ отсутствует
Подобна структуре α-Fe, но вершины
ячейки и её центр заняты различными атомами, что приводит к
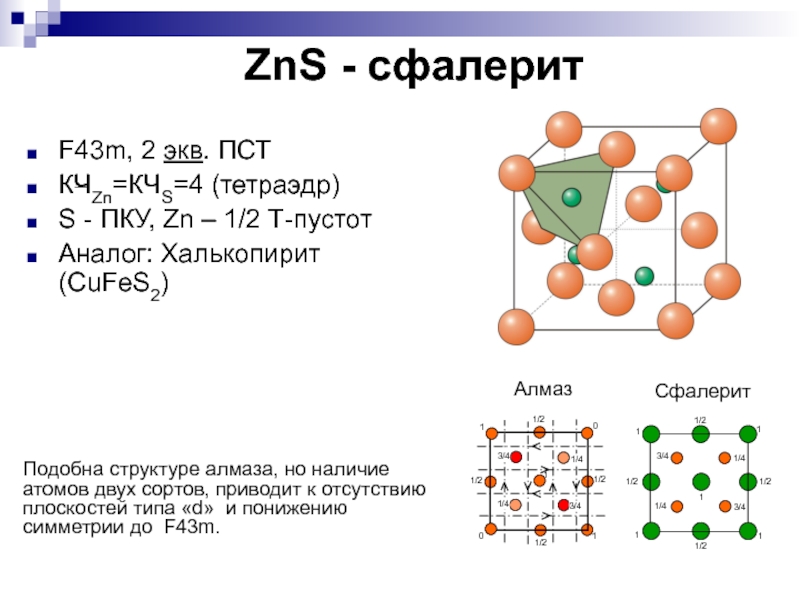
исчезновению центрирующей трансляции и изменению фёдоровской группыСлайд 21ZnS - сфалерит
F43m, 2 экв. ПСТ
КЧZn=КЧS=4 (тетраэдр)
S - ПКУ,
Zn – 1/2 Т-пустот
Аналог: Халькопирит (CuFeS2)
Алмаз
Сфалерит
0
1/2
1
1
1/2
1/2
1/2
0
1
3/4
1/4
3/4
1/4
3/4
3/4
1/4
1/4
1
1
1
1
1/2
1/2
1/2
1/2
1
Подобна структуре алмаза, но наличие
атомов двух сортов, приводит к отсутствию плоскостей типа «d» и понижению симметрии до F43m. Слайд 23ZnS - вюртцит
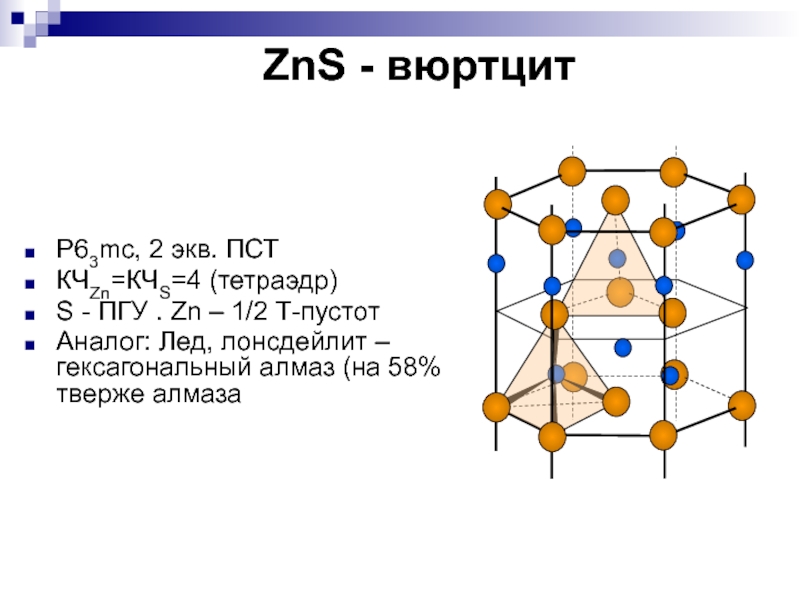
P63mc, 2 экв. ПСТ
КЧZn=КЧS=4 (тетраэдр)
S -
ПГУ . Zn – 1/2 Т-пустот
Аналог: Лед, лонсдейлит – гексагональный
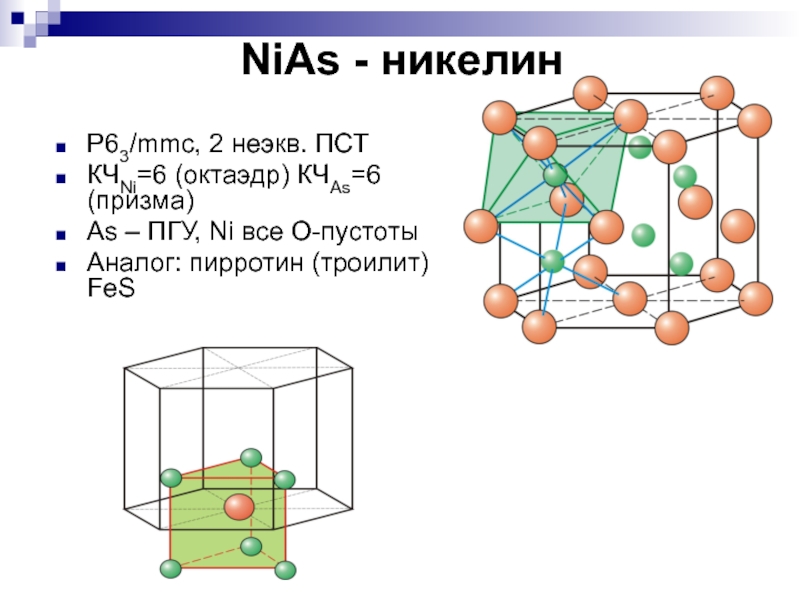
алмаз (на 58% тверже алмазаСлайд 25NiAs - никелин
P63/mmc, 2 неэкв. ПСТ
КЧNi=6 (октаэдр) КЧAs=6 (призма)
As
– ПГУ, Ni все О-пустоты
Аналог: пирротин (троилит) FeS
Слайд 26Обратите внимание!
Две ПСТ, по которым располагаются Ni и As не
являются эквивалентными: в отличие от ранее рассмотренных структур (кроме графита)
в струкрутре NiAs мы не можем заменить атомы Ni на атомы As и наоборот. Координационные числа и для Ni и для As равны 6, но координационные многогранники для них различны: для атома никеля это октаэдр (немножко искаженный), для атома мышьяка – тригональная призма!Слайд 29CaF2 - флюорит
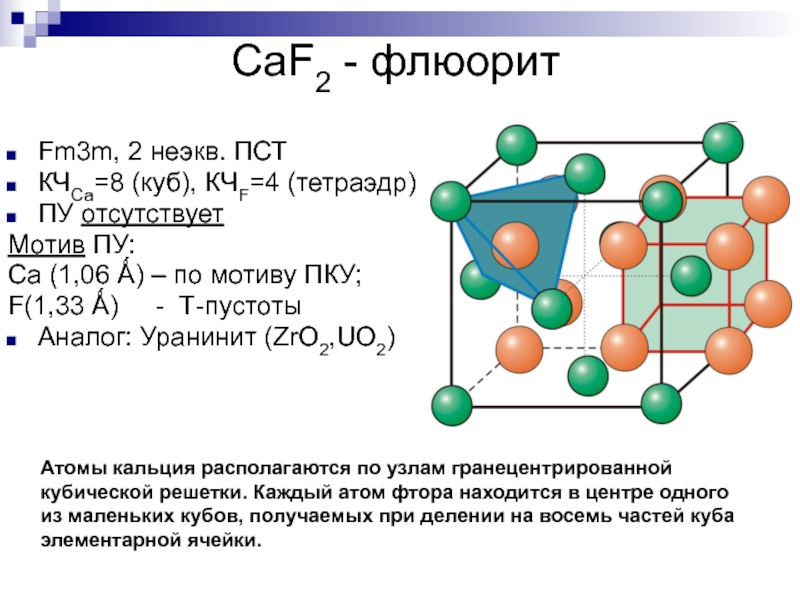
Fm3m, 2 неэкв. ПСТ
КЧСа=8 (куб), КЧF=4
(тетраэдр)
ПУ отсутствует
Мотив ПУ:
Ca (1,06 Ǻ) – по мотиву ПКУ;
F(1,33
Ǻ) - Т-пустотыАналог: Уранинит (ZrO2,UO2)
Атомы кальция располагаются по узлам гранецентрированной кубической решетки. Каждый атом фтора находится в центре одного из маленьких кубов, получаемых при делении на восемь частей куба элементарной ячейки.