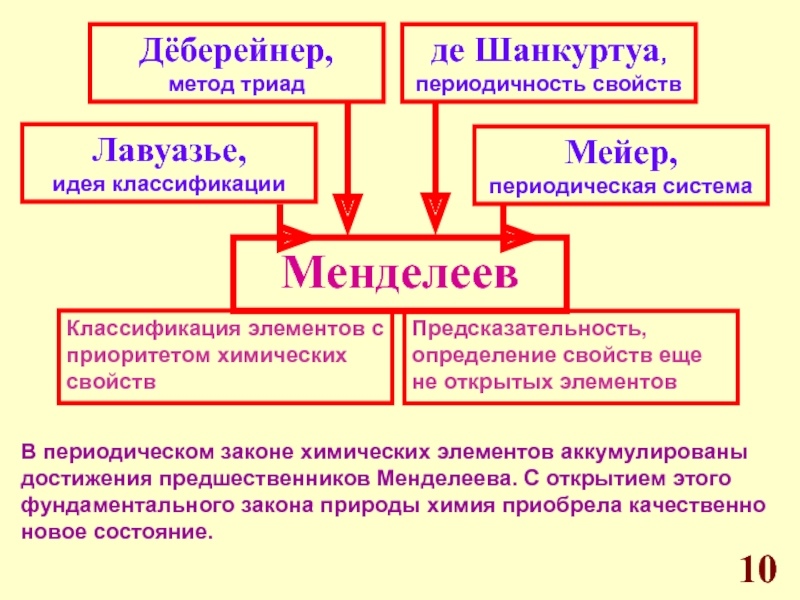
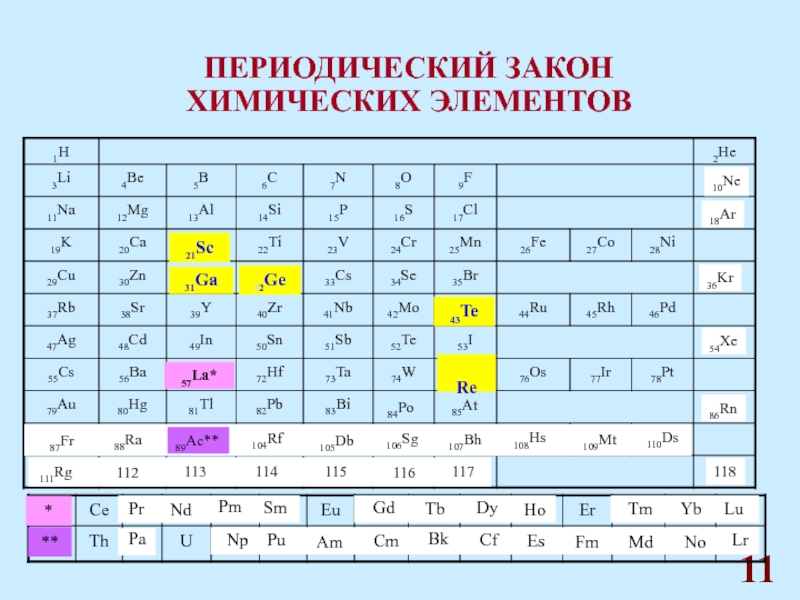
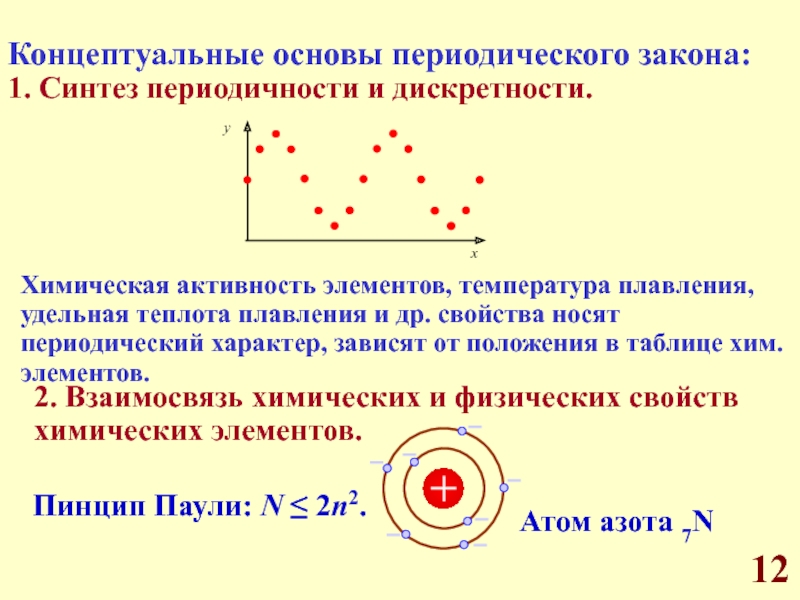
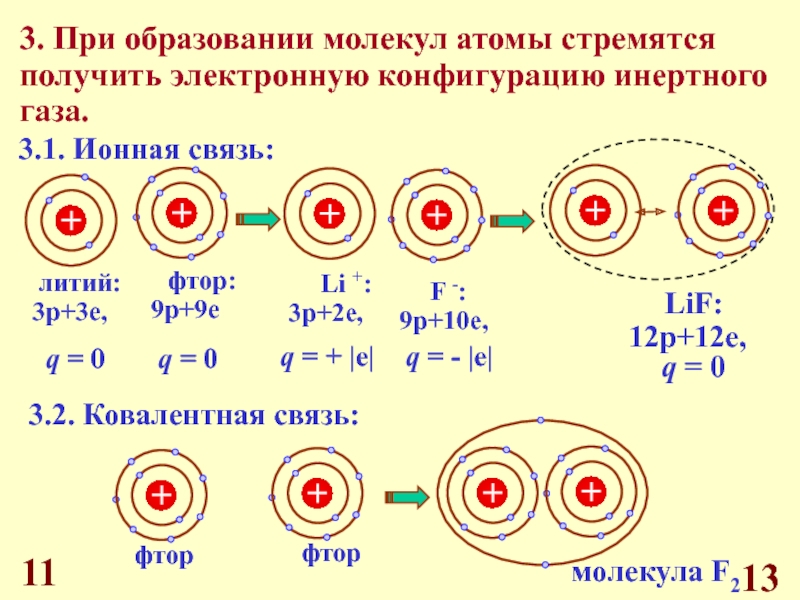
Д.И. Менделеева.
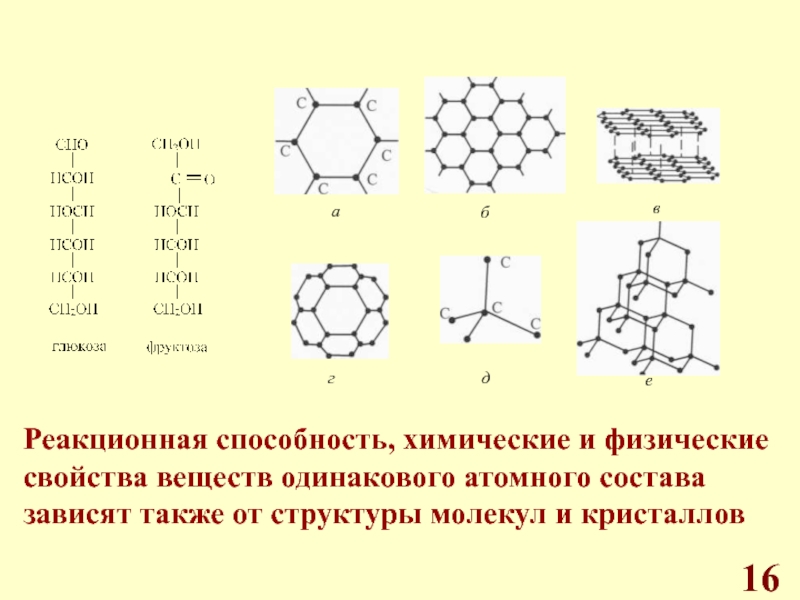
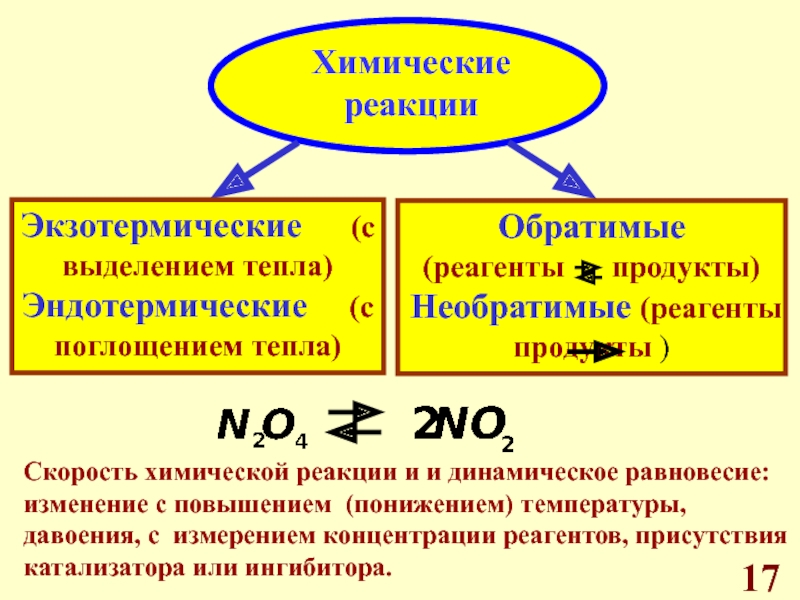
Химические реакции, валентность, реакционная способность веществ.
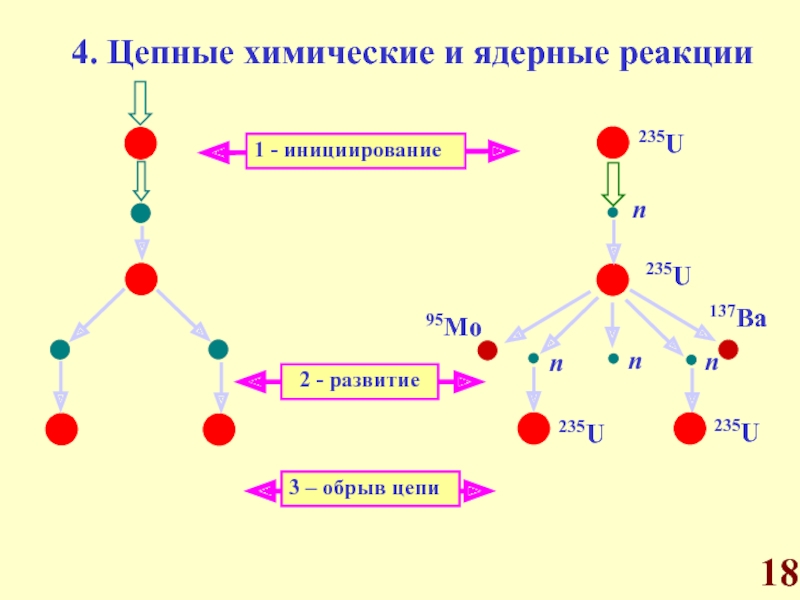
Цепные химические реакции.
Основные законы
химии.2