Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Природа химической связи
Содержание
- 1. Природа химической связи
- 2. Теоретические основы органической химииВыявление законов и закономерностей
- 3. Закон динамической эволюции волновойфункции во времени для
- 4. «Основная задача теоретической химииобеспечить концептуальную и терминологическую
- 5. 3.Молекула – бесконечно долгоживущая системаСтационарное уравнение ШредингераΨ
- 6. Адиабатическое уравнение Шредингера4.H = Ha + TяTя – оператор кинетической энергии ядер
- 7. Приближение Хартри-Фока (X-Ф)(ограниченный Х-Ф, замкнутая оболочка)5.E =
- 8. Метод ССП МО использует приближение ЛКАО, где
- 9. Fμν - матричные элементы матрицы Фока:Fμν =
- 10. Полная энергия Е:Орбитальные энергии получают решением:
- 11. Базисные АО9.Слейтеровского типа орбиталиχ(r,Θ,Φ) = rn-1 e-εr
- 12. 10.Гаусова типа орбиталиp,q,s – целые числавнутренняя 1s
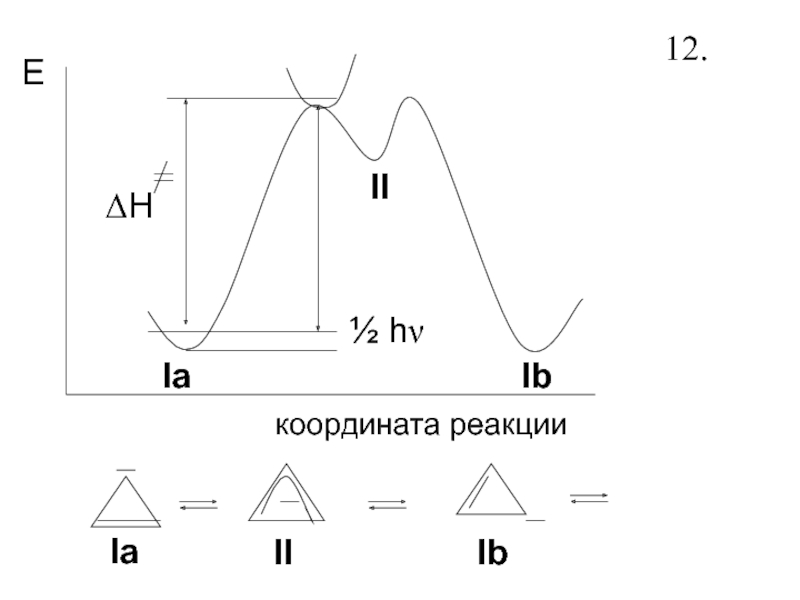
- 13. Поверхность потенциальной энергии - функция от ее
- 14. ½ hνΔHEкоордината реакцииIaIIIbIaIIIb12.
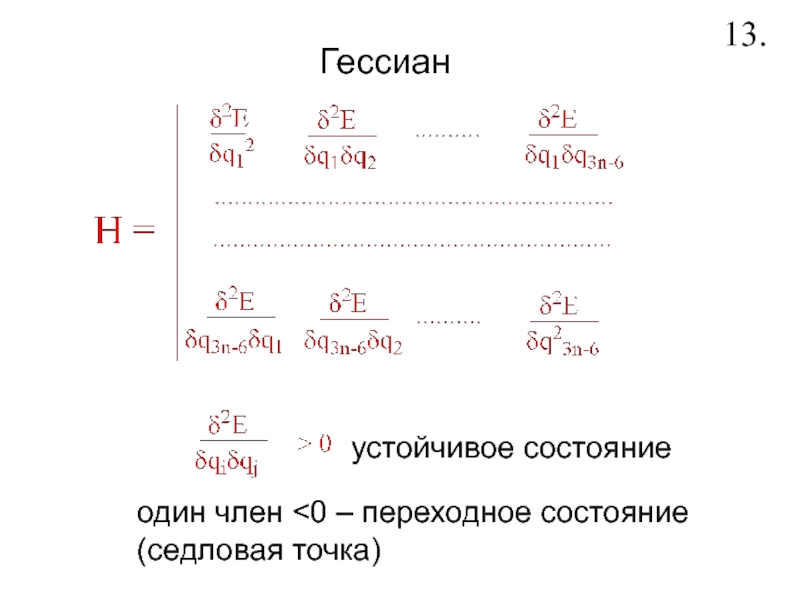
- 15. Гессиан13.устойчивое состояниеодин член
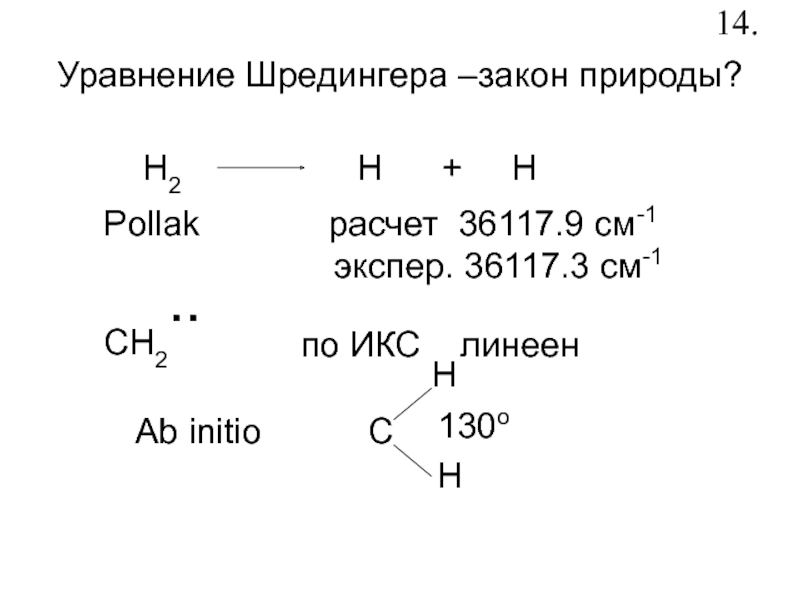
- 16. Уравнение Шредингера –закон природы?H2H +
- 17. Традиционные методы определения электронной структуры, в частности,
- 18. Методы основаны на анализе распределенияэлектронной плотности [ρ
- 19. Теоремы Хоэнберга — КонаПервая теорема: существует взаимно однозначное
- 20. P. Hohenberg, W. Kohn 1964 г.E
- 21. F[ρ] = T[ρ] + Vee [ρ]T[r]
- 22. = ν(r) + δF/δρ(r) = constтогда:[-1/2
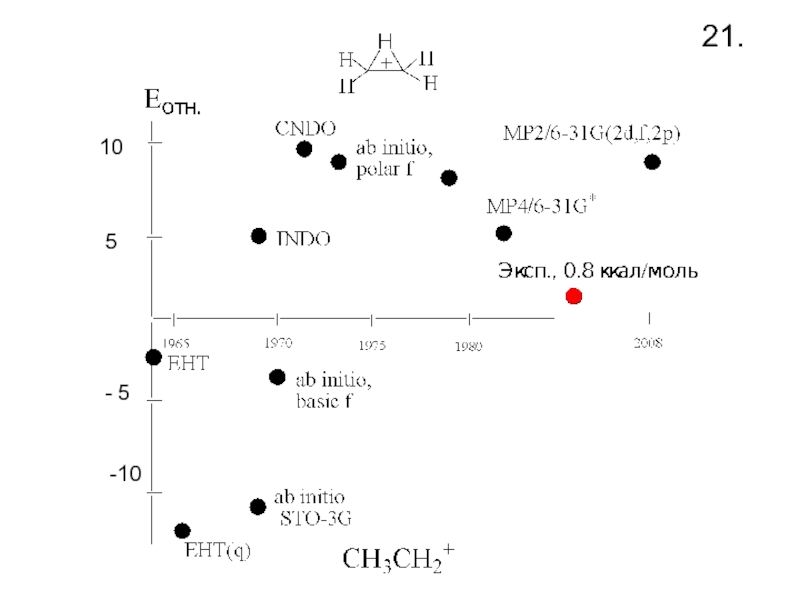
- 23. 21.-10-5510
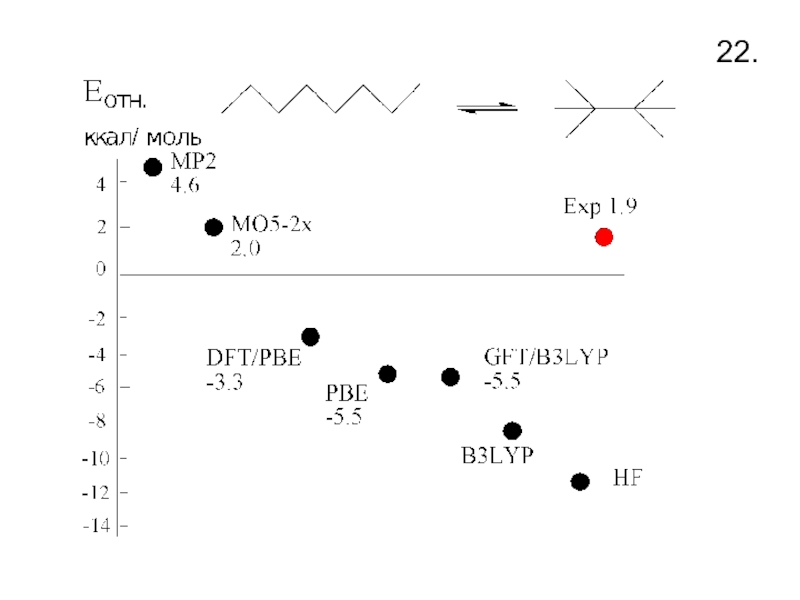
- 24. 22.
- 25. Квантово-химические расчетыJ. Phys. Chem. A, 2000, 2054
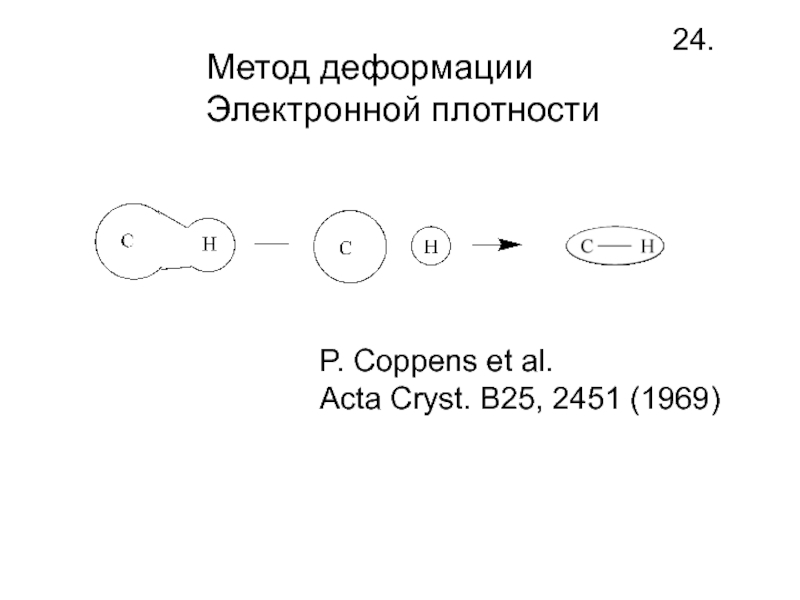
- 26. Метод деформацииЭлектронной плотности24.P. Coppens et al. Acta Cryst. B25, 2451 (1969)
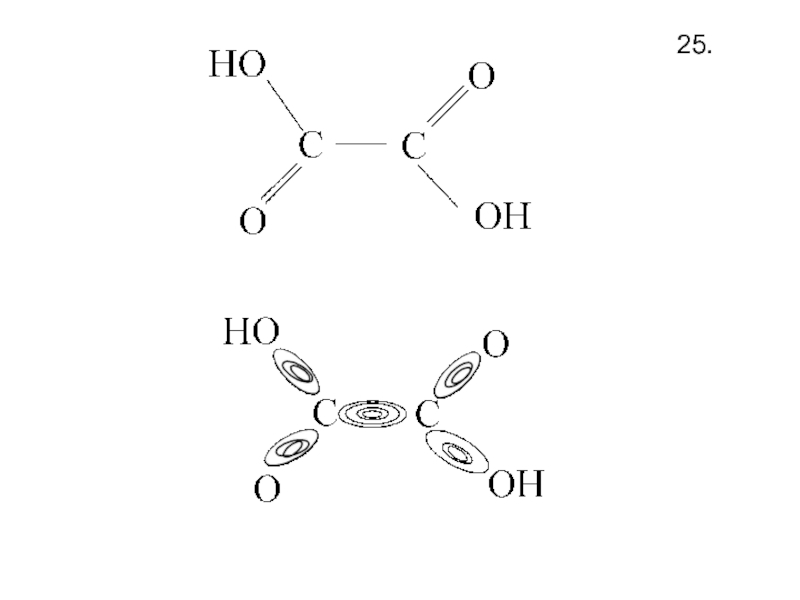
- 27. 25.
- 28. Теория резонанса26.Последовательность и расположение атомов
- 29. Слайд 29
- 30. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Теоретические основы органической
химии
Природа химической связи
Лекция 1
(электронно-лекционный курс)
Пособие разработано
в рамках реализации
Слайд 2Теоретические основы органической химии
Выявление законов и закономерностей
химической формы движения
материи
(превращений органических молекул).
Лекция 1
Число фундаментальных законов природы
бесконечно (теорема
Геделя).Тезис о не сводимости к квантовой механики высших форм движения материи.
Слайд 3Закон динамической эволюции волновой
функции во времени для изолированной
системы
H – оператор
Гамильтона
t -время
2.
Решение, если Н не зависит от времени:
х – совокупность
переменных (пространственныхи спиновых)
Е - энергия
Слайд 4«Основная задача теоретической химии
обеспечить концептуальную и терминологическую основу,
что необходимо
для понимания химии»
(Walter Thiel, Ang. Chem. Int. 2011, 9216)
“There
is nothing more practical than a good theory”(Kurt Lewin, psychogist, 1951)
Слайд 53.
Молекула – бесконечно долгоживущая система
Стационарное уравнение Шредингера
Ψ – собственные волновые
функции
E – собственные значения энергий
Адиабатической приближение – колебания
ядер в
молекуле происходят по сравнению сдвижением электронов (Борн, Оппенгеймер)
Еэл. : Екол. : Евращ. = 1 : (me/M)1/2 : me/M
(для Н2, 1 : 1/30 : 1/900)
Слайд 7Приближение Хартри-Фока (X-Ф)
(ограниченный Х-Ф, замкнутая оболочка)
5.
E = ∫ …
∫
φ(1,2...2n) H φ(1,2…2n)dτ1dτ2…dτn
Функции ψ выбираются так, чтобы
минимизировать полную энергию системы
Слайд 8Метод ССП МО использует приближение
ЛКАО, где в качестве базиса
разложения
применяют базис атомных орбиталей
φi = Σ cμi χμ i = 1,2…n N
Коэффициенты Сμi получают решением
уравнения Рутана:
Σcμi (Fμν − εi Sμν) = 0 (1)
μ = 1
N
6.
Слайд 9Fμν - матричные элементы матрицы Фока:
Fμν = Hμν + ΣΣPλσ[μνIλσ]
- ½ (μνIνσ] (2)
Интеграл перекрывания АО:
Sμν = ∫ χμ(1)χν(1) dτ1
(3)Hμν = ∫χμ(1)(-1/2Δ2) χν(1) dτ1 +
+ ∫χμ(1)(ΣzA/r1A) χν(1) dτ1 (4)
Pλσ − матрица порядков связей:
Pλσ = 2ΣCλiCσi (5)
λ σ
A
i
7.
Слайд 10Полная энергия Е:
Орбитальные энергии получают решением:
I Fμν - εi Sμν
I = 0 (6)E = 2 Σεi – ΣΣ(2Jij – Kij) + ΣΣ
ZAZB
RAB
i
i j
A B
Кулоновский (J) и обменный (К) интегралы:
Jij = ∫ ∫φi (1) φj (2) φi (1) φj (2) dτ1dτ2 (8)
1
r12
Kij = ∫ ∫φi (1) φj (2) φi (2) φj (1) dτ1dτ2 (9)
1
r12
(7)
8.
Слайд 11Базисные АО
9.
Слейтеровского типа орбитали
χ(r,Θ,Φ) = rn-1 e-εr Ylm(Θ,Φ)
ε − эффективный
заряд ядра (слейтеровская
экспонента)
n,l,m –
квантовые числаDZ – дубль дзета базис = каждой валентной
орбитали cоответствуют 2 функции с разными
слейтеровскими экспонентами
Н – 1s, 1s’
Слайд 1210.
Гаусова типа орбитали
p,q,s – целые числа
внутренняя 1s -
4-мя GTO
валентная 2S
-
3-мя GTO
валентная р-АО -
одной GTO
к каждой р-АО + d-GTO
к 1s-АО
(Н) + р-АОСлайд 13Поверхность потенциальной энергии -
функция от ее полной энергии (за
вычетом
кинетической энергии ядер).
Если система состоит из N ядер,
то число независимых
степеней свободы,определяющих ППЭ, равно (3N-6)
E(q) = E(q1, q2, q3…q3N-6)
[Для линейной молекулы (3N-5)].
11.
Слайд 16Уравнение Шредингера –закон природы?
H2
H + H
Pollak
расчет 36117.9 см-1
экспер. 36117.3 см-1СH2..
по ИКС линеен
Ab initio
C
H
H
130o
14.
Слайд 17Традиционные методы определения электронной структуры, в частности, метод Хартри —
Фока описывают систему с помощью
многоэлектронной волновой функции.
Основная цель
теории функционала плотности — при описании электронной подсистемы
заменить многоэлектронную волновую функцию электронной плотностью.
Методы Density functional theory (DFT)
15.
Слайд 18
Методы основаны на анализе распределения
электронной плотности [ρ = f(координат)]:
E = f (r)
E = Et + Ev + Ej + Exc (1)
где Et – кинетическая энергия электронов,
Ev – потенциальная энергия (ядро-электрон)
Ej – кулоновский член (е-е отталкивание),
Exc – обменно-корреляционный член
Exc = Ex (ρ) + Ec (ρ)
обменный корреляционный
функционал функционал
(Becke, 1988 г.) (Perdew, Wang, Lee)
16.
Слайд 19Теоремы Хоэнберга — Кона
Первая теорема: существует
взаимно однозначное соответствие
между плотностью
основного состояния
электронной подсистемы, находящейся
во внешнем потенциале атомных ядер,
и самим потенциалом ядер.Вторая теорема: (вариационный принцип)
энергия электронной подсистемы, записанная
как функционал электронной плотности,
имеет минимум, равный энергии основного
состояния.
17.
Слайд 20P. Hohenberg, W. Kohn 1964 г.
E = E[ρ]
Полная энергия
(Е) – функция распределения
электронной плотности, определяемой
функционалом [ρ].
E[ρ] = F[ρ]
+ ∫ ν(r) ρ(r)dr F[ρ] − Hohenberg-Kohn функционал
ν[r] - внешний функционал (действие
поля ядер и др. полей на электрон)
18.
Слайд 21F[ρ] = T[ρ] + Vee [ρ]
T[r] - функционал кинетической
энергии
электронов
Vee [r] – функционал
отталкиванияэлектронов
В соответствии с теоремой Kohn и Sham:
электронная плотность в основном соcтоянии
распределена так, что имеется минимум
по энергии:
δ(E[ρ] - μ ∫ ρ(r)dr) = o
19.
Слайд 22 = ν(r) + δF/δρ(r) = const
тогда:
[-1/2 Δ2 + ν(r)
+ νxc(r) + ∫ρ(r) / r-r’ φi] = εiφi
νxc(r)
- обменно-корреляционныйпотенциал
νxc(r) = δExc / δρ(r)
φi - Kohn-Sham орбитали,
ρ(r) = Σ φi 2
20.
Слайд 28Теория резонанса
26.
Последовательность и расположение атомов
в резонансных структурах
должна быть такой
же как и в реальной структуре.
2.
Число не спаренных электронов в резонансныхструктурах должно быть одинаковым.
3. Энергия электронов, соответствующая
волновой функции, составленной из функций
предельных структур, всегда меньше энергии,
отвечающей любой из предельных структур.








![Природа химической связи Fμν - матричные элементы матрицы Фока:Fμν = Hμν + ΣΣPλσ[μνIλσ] - Fμν - матричные элементы матрицы Фока:Fμν = Hμν + ΣΣPλσ[μνIλσ] - ½ (μνIνσ] (2)Интеграл перекрывания АО:Sμν =](/img/thumbs/e39e6cba28d069ac6984866ac00517ee-800x.jpg)





![Природа химической связи Методы основаны на анализе распределенияэлектронной плотности [ρ = f(координат)]: Методы основаны на анализе распределенияэлектронной плотности [ρ = f(координат)]:](/img/thumbs/28077705c246458f1f4b6a56bea6ce93-800x.jpg)

![Природа химической связи P. Hohenberg, W. Kohn 1964 г.E = E[ρ]Полная энергия (Е) – P. Hohenberg, W. Kohn 1964 г.E = E[ρ]Полная энергия (Е) – функция распределенияэлектронной плотности, определяемойфункционалом [ρ].](/img/thumbs/ebddfdf98439ecb09ccd3f29174997a4-800x.jpg)
![Природа химической связи F[ρ] = T[ρ] + Vee [ρ]T[r] - функционал кинетической энергии F[ρ] = T[ρ] + Vee [ρ]T[r] - функционал кинетической энергии электроновVee](/img/tmb/2/156560/37692624df45a15e9033d20109cf171a-800x.jpg)
![Природа химической связи = ν(r) + δF/δρ(r) = constтогда:[-1/2 Δ2 + ν(r) + = ν(r) + δF/δρ(r) = constтогда:[-1/2 Δ2 + ν(r) + νxc(r) + ∫ρ(r) / r-r’ φi]](/img/thumbs/5ea1ac65d0097c780b68e766bdfaf91a-800x.jpg)