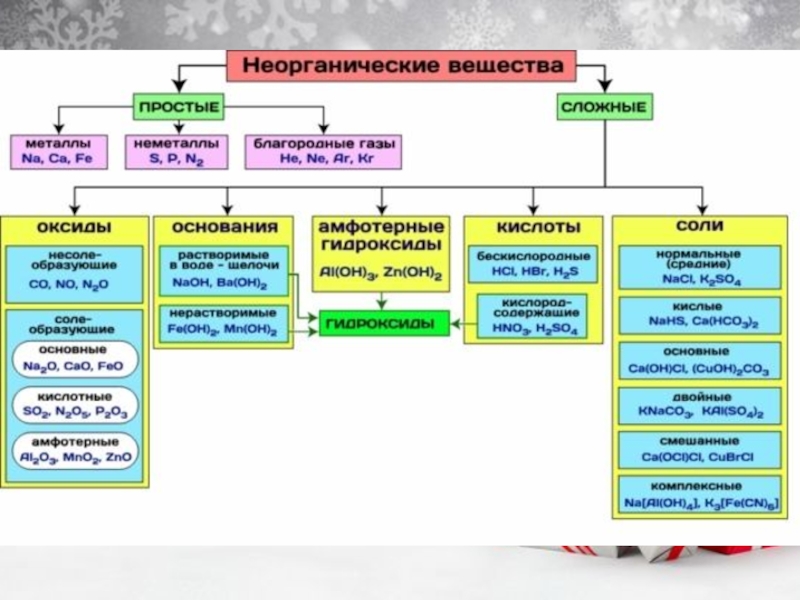
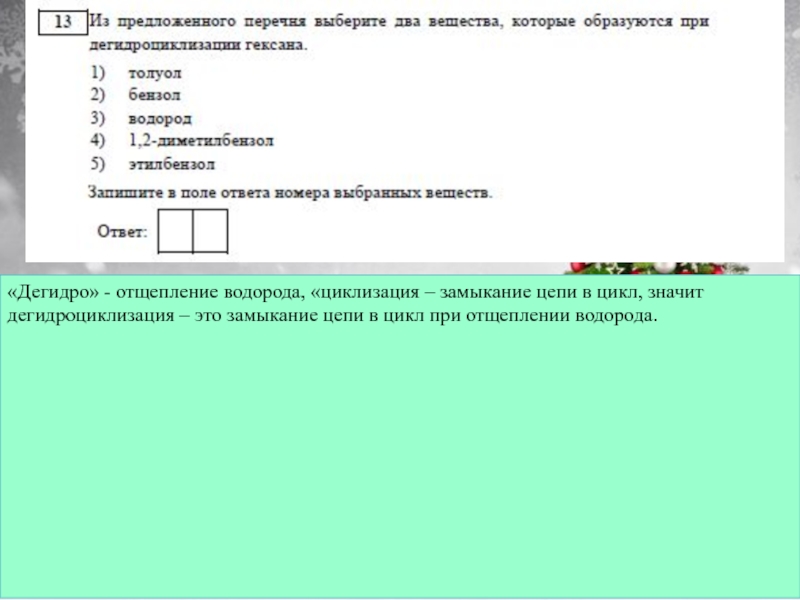
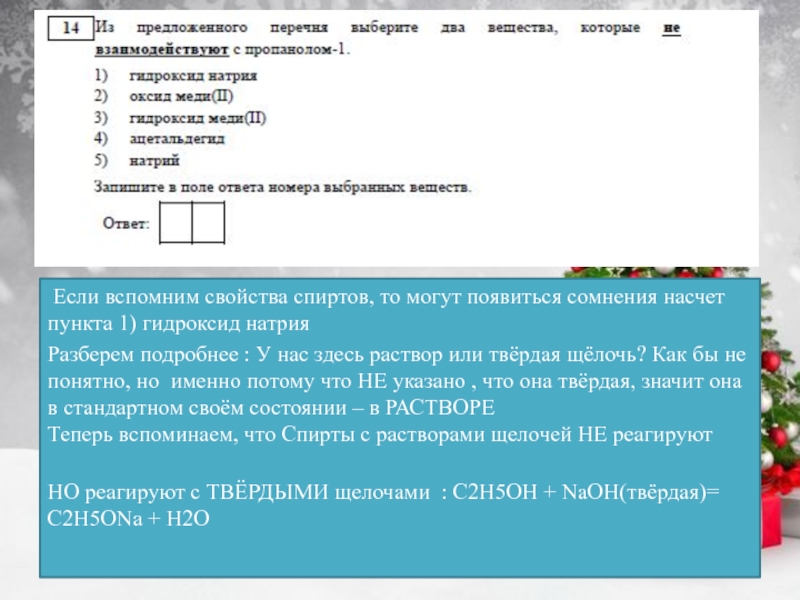
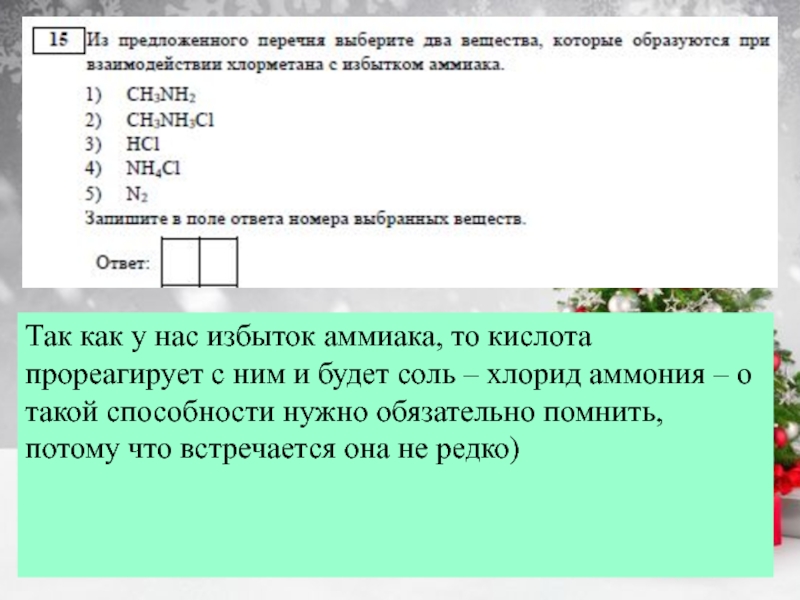
примеры запоминаем наизусть: С (алмаз, графит), В (бор), Si (кремний),
SiO2 (кварц, речной песок), Al2O3 (корунд, боксит, глинозем, рубин, сапфир); Ионная - В ионной кристаллической решетке в узлах есть КАТИОНЫ (положительно заряженные ионы) и АНИОНЫ (отрицательно заряженные ионы) (например, в солях, в гидридах металлов, оксиды металлов); Металлическая (металлы); Молекулярная (все кроме предыдущих 3 , встречается чаще всего, чаще всего газы или жидкости, простые двухатомные вещества – галогены, кислород, азот и.д.)
Смотрим задание – Na2O – ионная, I2 – молекулярная; KCl – ионная; SiO2 - атомная; H2O – молекулярная.
Задание 5 - вспоминаем типы веществ – картинка на сл.слайде (напоминание). Рассмотрим пункт В) H2SO4 – двухосновная кислота( два атома водорода), тогда по такой логике H3PO4 – трёхосновная КАК и полагается (структура дальше), тогда если бы у нас был в задании ГИДРОфосфат натрия – это была бы также КИСЛАЯ соль, а Дигидрофосфат – КИСЛАЯ соль.
Но есть две кислоты фосфора, у которых что-то пошло не так и у них , когда в составе есть один атом водорода , то это не кислая, а Средняя соль – всё покажу дальше)