Слайд 1Процесинг і презентація антигенів
Слайд 2Функція молекул МНС
Основна функція даного комплексу – презентація екзогенного
антигену. Тобто такого, що не синтезується в самій клітині (для
цього є МНС І). Отримання антигену таким чином відбувається з зовнішнього середовища шляхом піноцитозу або фагоцитозу.
Нормальна активація лімфоциту можлива лише за наявності костимуляторних молекул.
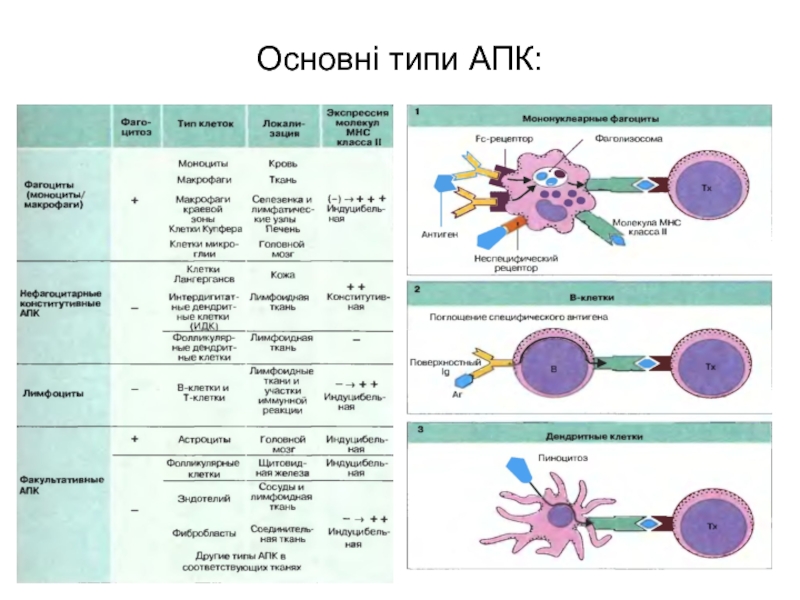
При цьому важлива роль належить макрофагам, що власне й фагоцитують зовнішньоклітинні антигени і в розщепленому виді презентують їх на своїй поверхні для взаємодії з Т-хелперною ланкою (СD4+).
Не менш важлива роль належить В-клітинам, що зв'язують антиген на своїй поверхні завдяки наявності ВCR (молекула імуноглобуліну), що потім шляхом піноцитозу спрямовується до клітини
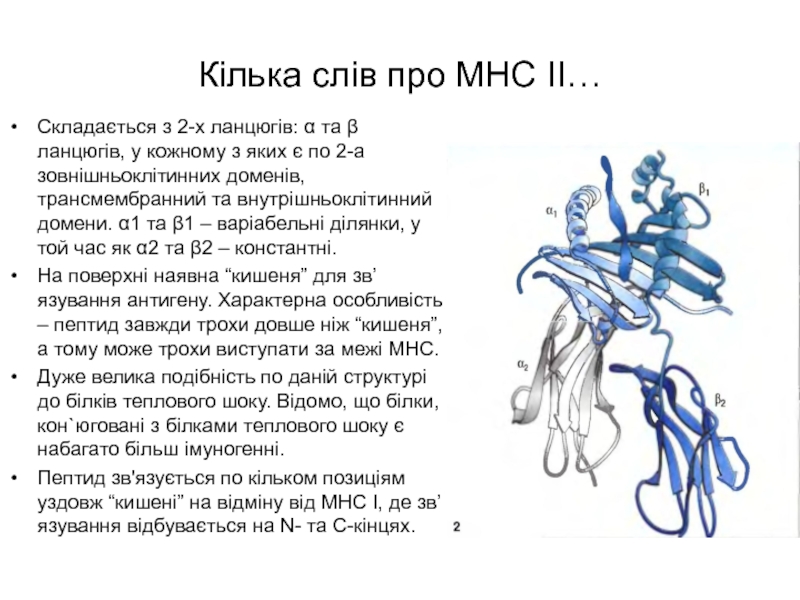
Слайд 3Кілька слів про МНС ІІ…
Складається з 2-х ланцюгів: α та
β ланцюгів, у кожному з яких є по 2-а зовнішньоклітинних
доменів, трансмембранний та внутрішньоклітинний домени. α1 та β1 – варіабельні ділянки, у той час як α2 та β2 – константні.
На поверхні наявна “кишеня” для зв’язування антигену. Характерна особливість – пептид завжди трохи довше ніж “кишеня”, а тому може трохи виступати за межі МНС.
Дуже велика подібність по даній структурі до білків теплового шоку. Відомо, що білки, кон`юговані з білками теплового шоку є набагато більш імуногенні.
Пептид зв'язується по кільком позиціям уздовж “кишені” на відміну від МНС І, де зв’язування відбувається на N- та С-кінцях.
Слайд 4Різниця між молекулами МНС І (зліва) та МНС ІІ (справа)
у зв'язуванні пептидів, що презентуються
МНС І
МНС ІІ
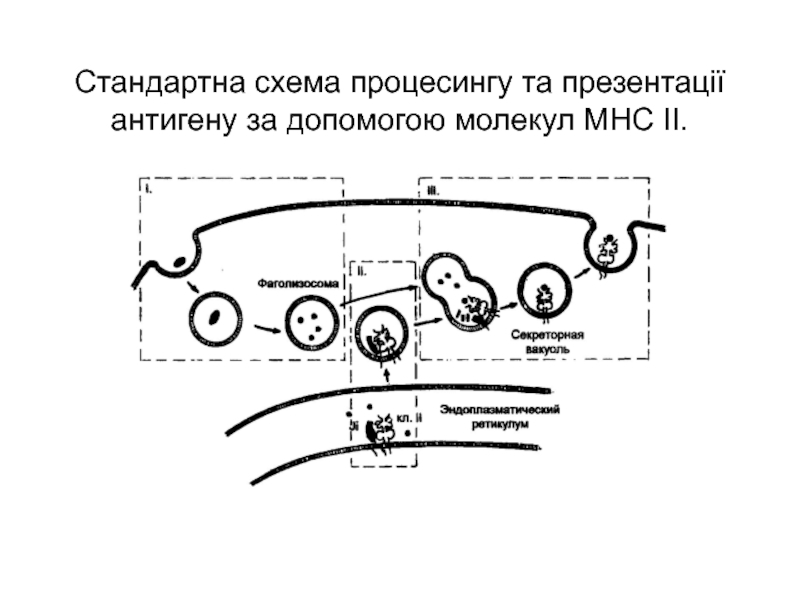
Слайд 5Стандартна схема процесингу та презентації антигену за допомогою молекул МНС
ІІ.
Слайд 6Стадії процесингу і презентації антигенів
І стадія: фагоцитоз антигену, перетравлювання його
у фаголізосомі. Маємо утворення маленьких і дуже маленьких фрагментів даного
білку.
ІІ стадія: підготовка комплексу МНС ІІ у ендоплазматичному ретикулюмі. Зв’язування його з інваріантним ланцюгом (Іі) для утворення тимчасово неактивного комплексу.
ІІІ стадія: зв’язування фаголізосоми з везикулою комплексу Гольджі, де знаходяться МНС, “вибивання” СLIP-протеїну з МНС ІІ за допомогою DM-білку і зв’язування з утвореними при лізисі пептидами, від’єднання від них білків теплового шоку. Утворюється структура під назвою МІІС (МНС ІІ – вмісний компартмент).
Злиття МІІС з плазмалемою і виведення МНС ІІ-пептид на поверхню клітини.
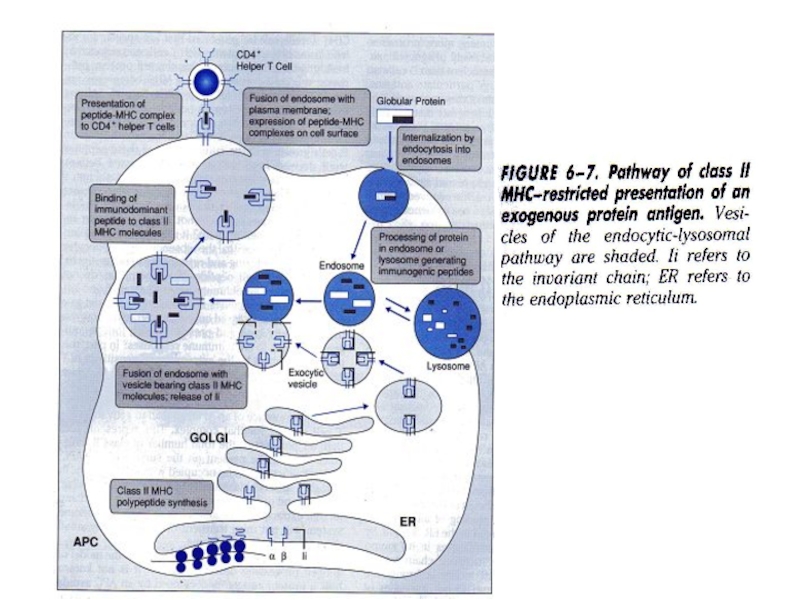
Слайд 7Більш точна ілюстрація МНС ІІ шляху
Основні моменти наведено раніше, тому
будуть розглянуті лише деталі. Вже вказувалося утворення фаголізосом. При цьому
з мембраною тут є зв'язані білки LAMP, але яка їх тут роль, поки що не зовсім зрозуміло. Можливо, зв’язування новоутворених пептидів?
Іі слугує тут свого роду перепусткою для везикули з МНС ІІ молекулою.
Вже вказувалася роль DM (складається з α та β субодиниць) у завантаженні антигену до МНС ІІ.
Велика роль на даному етапі належить Hsps, котрі зв'язують розщеплені пептиди.
Зв’язування йде у залежності від афінності до МНС ІІ.
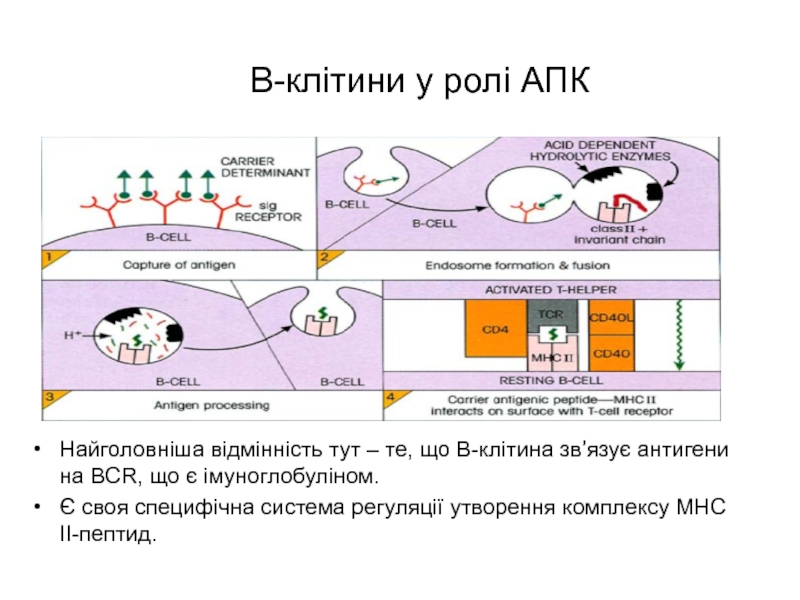
Слайд 8 В-клітини у ролі АПК
Найголовніша відмінність тут – те, що В-клітина
зв’язує антигени на BCR, що є імуноглобуліном.
Є своя специфічна система
регуляції утворення комплексу МНС ІІ-пептид.
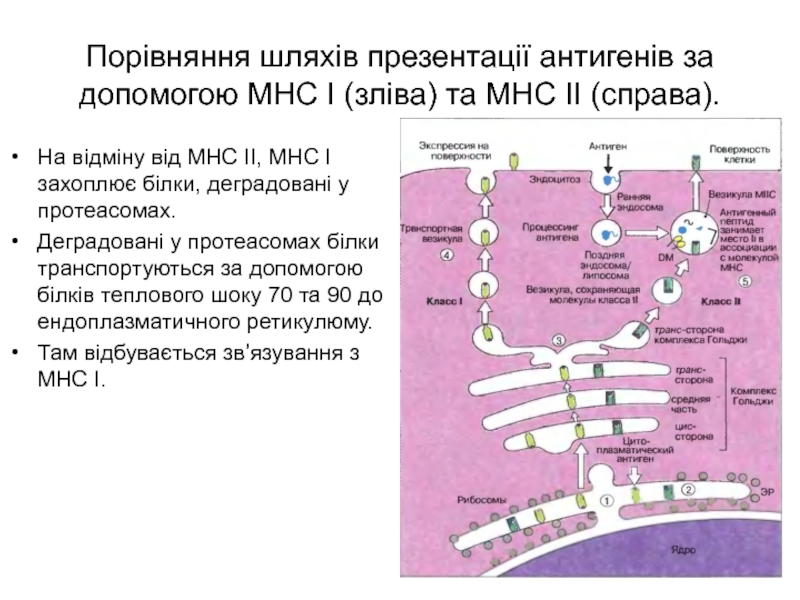
Слайд 11Порівняння шляхів презентації антигенів за допомогою МНС І (зліва) та
МНС ІІ (справа).
На відміну від МНС ІІ, МНС І захоплює
білки, деградовані у протеасомах.
Деградовані у протеасомах білки транспортуються за допомогою білків теплового шоку 70 та 90 до ендоплазматичного ретикулюму.
Там відбувається зв’язування з МНС І.
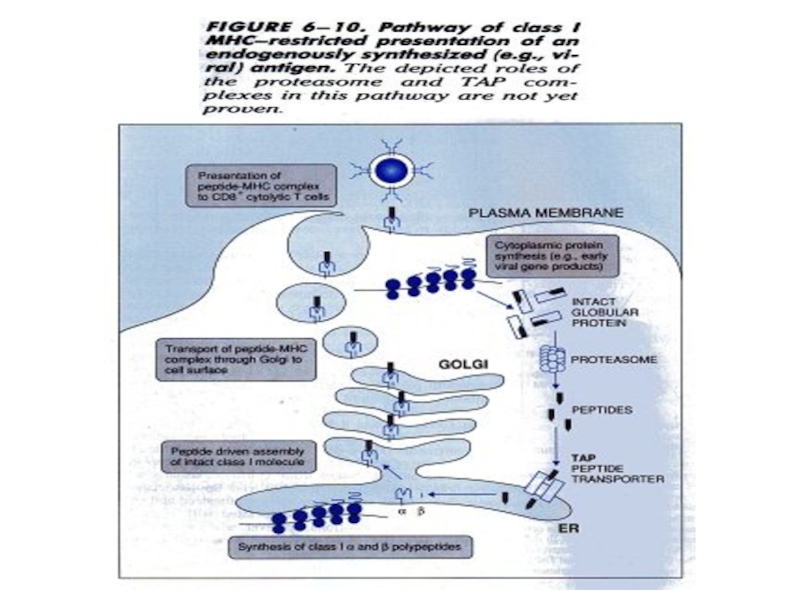
Слайд 12Формування пулу антигенних пептидів, які походять з ендогенних антигенів.
Убіквітинування –
перший етап процесінгу антигену
Після убіквітинуванні білки потрапляють до спеціалізованої
клітинної структури - протеосоми, де відбувається їх розщеплення на амінокислоти.
3. Біохімічний аналіз фрагментів деградації білків протеосомами різного типу виявив два різні механізми, що лежать в основі підсилення процесінгу антигенів імунопротеосомою. По-перше, імунопротеосома більш активно вирізає епітопи з деяких білків, ніж це робить стандартна протеосома, тобто володіє більшою каталітичною активністю. По-друге, для ряду білків, особливо вірусного походження, було помічено, що стандартна протеосома, на відміну від імунопротеосоми, розщеплює додаткові пептидні зв’язки всередині пептидів, які могли б стати готовими Т-епітопами.
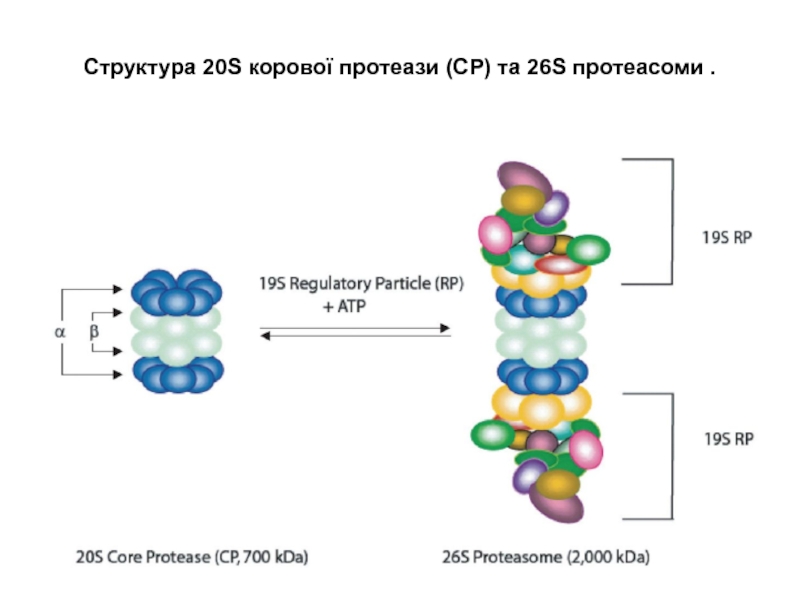
Слайд 13Структура 20S корової протеази (CP) та 26S протеасоми .
Слайд 14Убіквітин має глобулярну структуру, стабільний за високої температури та екстремально
кислотних умов.
C-термінальний Leu-Arg-Gly-Gly мотив, розташований в коровому домені, рухливий і
дуже гідрофобний: основний гідрофобний залишок – це Ile44, важливий для взваємодії з убіквітин-зв’язуючим доменом і з деубіквітиназами.
Важливо, що всі залишки лізину убіквітину, які розташовані в різних доменах молекули, направлені в різні боки ( за виключенням N-термінальної аміногрупи Met1, який розташлваний близько до Lys63)
Слайд 15Убіквітин та його лізинові залишки
Слайд 16Moделі формування ланцюгів убіквітину
Убіквітин має 7 залишків лізину Lys
(K),через які формує убіквітинові ланцюги.
(A) “Канонічне” убіквітування необхідне для
UPS-залоежної деградації білків-мішеней.(B)“Не-канонічне” використовується при репаації ДНК та активації протеїн-кіназ.(C) Моноубіквітування будь-якого залишку K призводить до змін в локалізації, регуляції транскрипції та ендоцитозі білків.
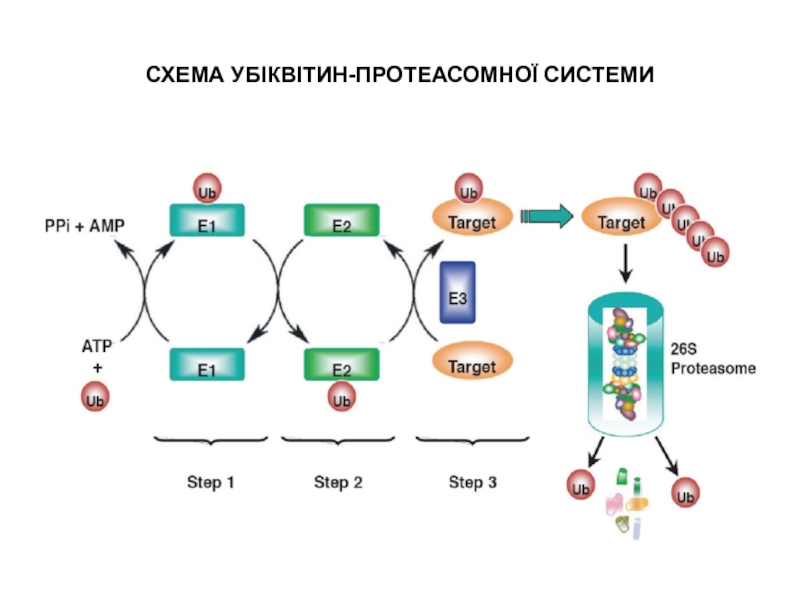
Слайд 17СХЕМА УБІКВІТИН-ПРОТЕАСОМНОЇ СИСТЕМИ
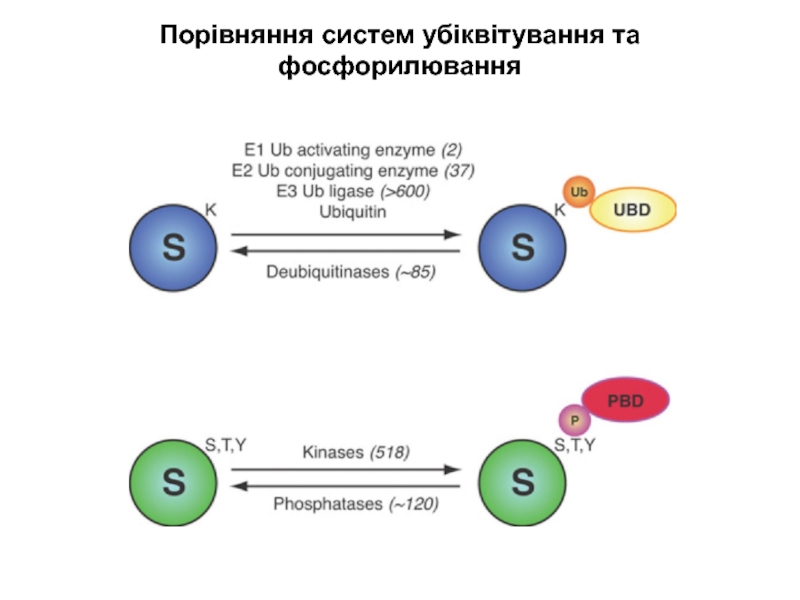
Слайд 18Порівняння систем убіквітування та фосфорилювання
Слайд 19Dysregulation of the UPS has been linked to the pathogenesis
of a variety of inherited and acquired diseases such as
cancer, diabetes, stroke, graft injection, Alzheimer’s disease, amyotropic lateral sclerosis, multiple sclerosis, asthma, inflammatory bowl disease, autoimmune thyroiditis, inflammatory arthritis and SLE. The involvement of the UPS in the pathogenesis of inflammatory and autoimmune diseases is mediated through various mechanisms.
Multiple lines of evidence have indicated UPS has the potential to be an exciting novel therapeutic target for the treatment of inflammatory and autoimmune diseases.
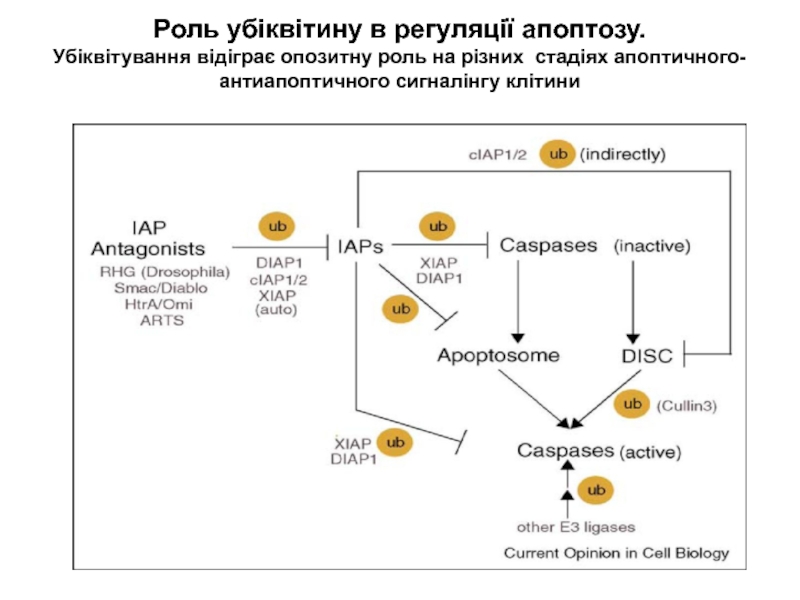
Слайд 20Роль убіквітину в регуляції апоптозу.
Убіквітування відіграє опозитну роль на
різних стадіях апоптичного-антиапоптичного сигналінгу клітини
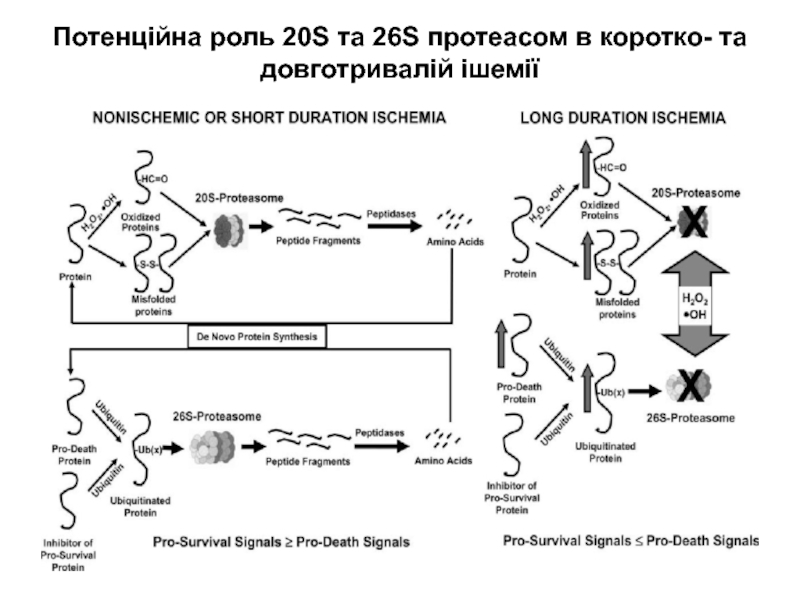
Слайд 21Потенційна роль 20S та 26S протеасом в коротко- та довготривалій
ішемії
Слайд 22
Протеасомні інгібітори як новітні терапевтичні агенти
Убіквітин-протеасомна система (UPS) залучена до
розвитку запальних та аутоімунних патологій через множинні шляхи, включаючи MHC-опосередковану
презентацію антигенів, цитокінів, регуляцію клітинного циклу і апоптозу.
1) Запальний артрит.
2) Псоріаз.
3) Алергія та астма.
4) Інші запальні та аутоімунні хвороби (серонегативні спондилоартропатії, анкілозний спондиліт, системний червоний вовчак та ін.)
Протеасомні інгібітори – це новий клас протипухлинних препаратів, а також речовин, які прямо впливають на сигнальні шляхи запалення через регуляцію катаболізма прозапальних білків.
Слайд 23А ось де відбувається сама презентація в організмі.
Слайд 25Костимуляторні молекули та модулятори імунної відповіді.
Схематично показано й наведено основні
костимуляторні та адгезивні молекули, що відповідають за утворення зв'язків між
МНС ІІ та ТCR.
Також вказано утворення сигнальних молекул, що можуть вплинути на ступінь активації клітини, синтез МНС ІІ тощо.
Слайд 26Аксесорні молекули CD4 та CD8
CD4 та CD8
зв’язуються з неполіморфними ділянками МНС (CD4 зв’язуються з β2 доменом
класу ІІ МНС, а CD8 - з α3 доменом МНС І), Обидві молекули підсилюють сигналінг, що є критичним для ініціації Т-клітинної відповіді. CD4 – рецептор для ВІЛ.
Слайд 27Розгорнута схема взаємодії Т-клітинного рецептора з антиген-презентуючою клітиною.
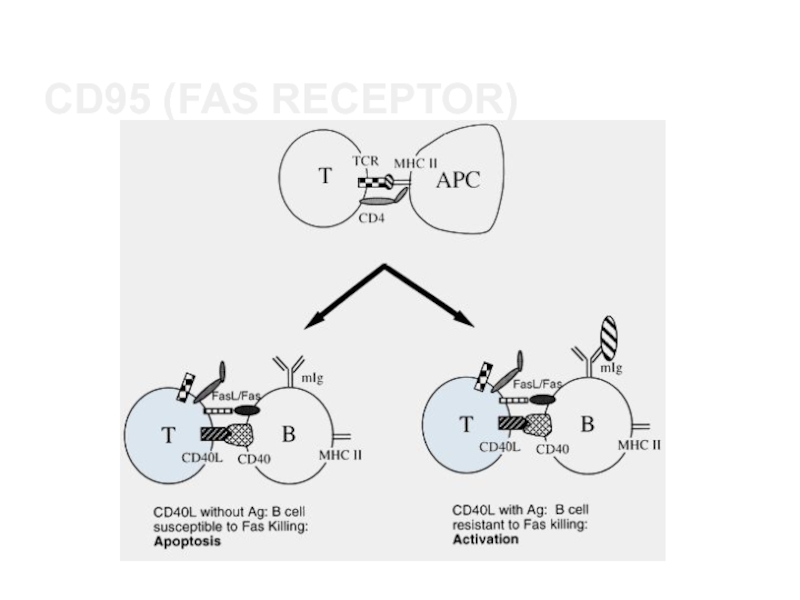
Слайд 29CD95 (Fas receptor)
Активированные Т-клетки также экспрессируют лиганд для рецептора смерти
Fas (CD95). Участие Fas приводит к апоптозу и имеет важное
значение для устранения Т-клеток.
FasL также проводит один из механизмов которыми CTL убивают мишени.
Слайд 31В И С Н О В К И
Для процесінгу антигенів
клітини використовують протеолітичний апарат, що спеціалізується на деградації білків.
Екзогенні,
або поглинуті антигени деградують в ендосомах, а синтезовані клітиною – в протеосомах, відповідно відрізняються і механізми процесінгу екзогенних та ендогенних антигенів.
Молекули МНС І зв’язують антигенні пептиди в ЕПР, а МНС ІІ повинні транспортуватися до ендосомального апарату.
Велика кількість допоміжних молекул бере участь в регуляції процесінгу антигенів, серед яких найголовнішими є протеолітичні ферменти і молекулярні шаперони.
В деяких випадках виникає потреба перехресної презентації антигенів. Особливо така презентація важлива для того, щоб з молекулами МНС І і МНС ІІ могли бути представлені епітопи спільного антигену. Це надає можливість дендритним клітинам вступати в контакт з Т-хелперами та Т-кілерами, які несуть рецептори, специфічні до одного антигену, тобто виконувати роль “містку” між цими клітинами.