Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Проверка изученного материала:
Содержание
- 1. Проверка изученного материала:
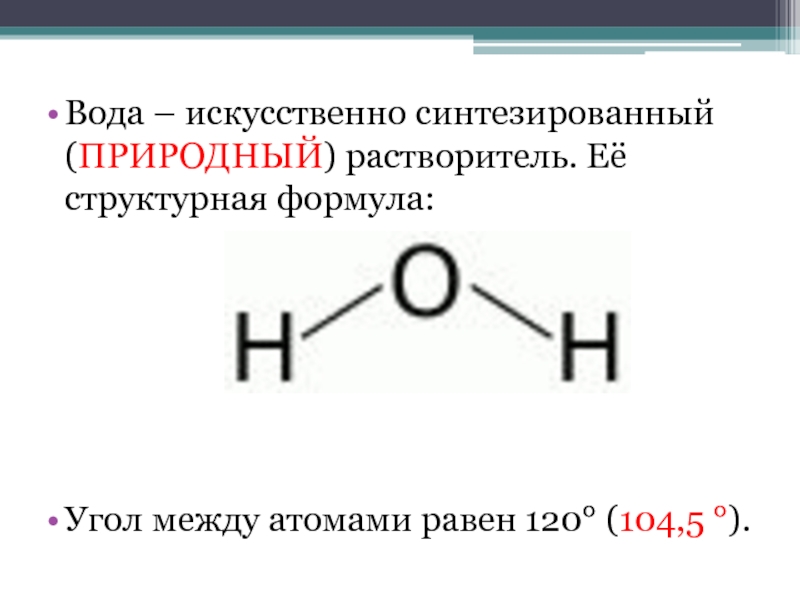
- 2. Вода – искусственно синтезированный (ПРИРОДНЫЙ) растворитель. Её структурная формула: Угол между атомами равен 120° (104,5 °).
- 3. Для воды характерна ковалентная неполярная (ПОЛЯРНАЯ) химическая
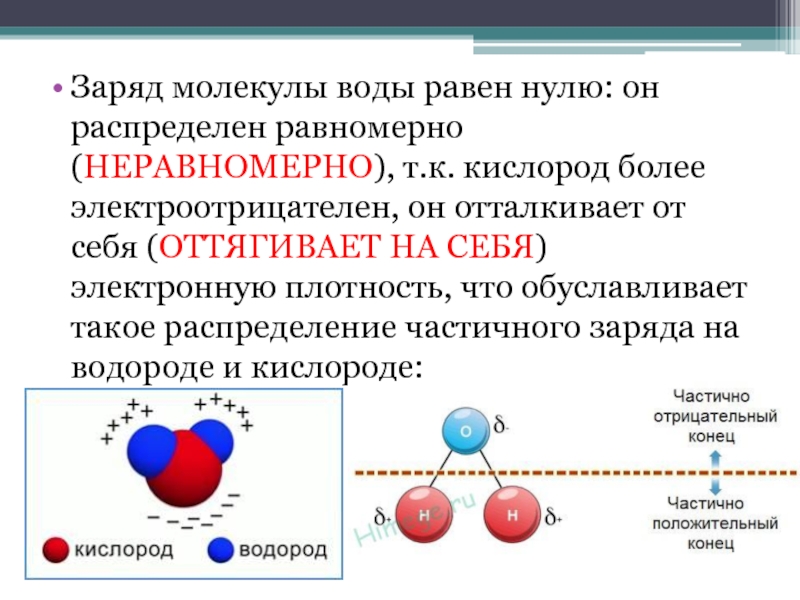
- 4. Заряд молекулы воды равен нулю: он распределен
- 5. Вода – неполярный (ПОЛЯРНЫЙ) растворитель, она хорошо
- 6. Стоит также отметить, что при растворении веществ
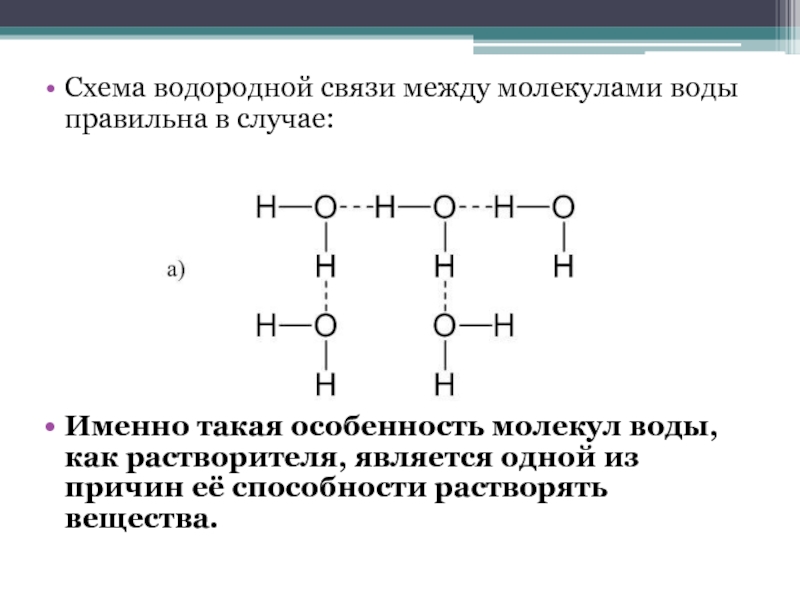
- 7. Схема водородной связи между молекулами воды правильна
- 8. Растворимость, её зависимость от разных факторов. Насыщенные и ненасыщенные растворы.
- 9. Не все вещества одинаково растворяются в воде:
- 10. Количественно способность растворяться в воде определяется физической
- 11. По растворимости вещества делятся:
- 12. Абсолютно нерастворимых веществ не существует
- 13. Таблица растворимости кислот, солей, оснований в воде:
- 14. Эмпирическое правило для определения качественной растворимости:
- 15. Факторы, влияющие на растворимость:
- 16. Факторы, влияющие на растворимость:Механическое воздействие на компоненты раствора– измельчение, перемешивание.
- 17. Факторы, влияющие на растворимость:Растворимость веществ зависит от природы растворенного вещества.
- 18. Факторы, влияющие на растворимость:Растворимость веществ зависит от
- 19. Факторы, влияющие на растворимость:Растворимость веществ зависит от температуры.
- 20. Факторы, влияющие на растворимость:Растворимость веществ зависит от давления.
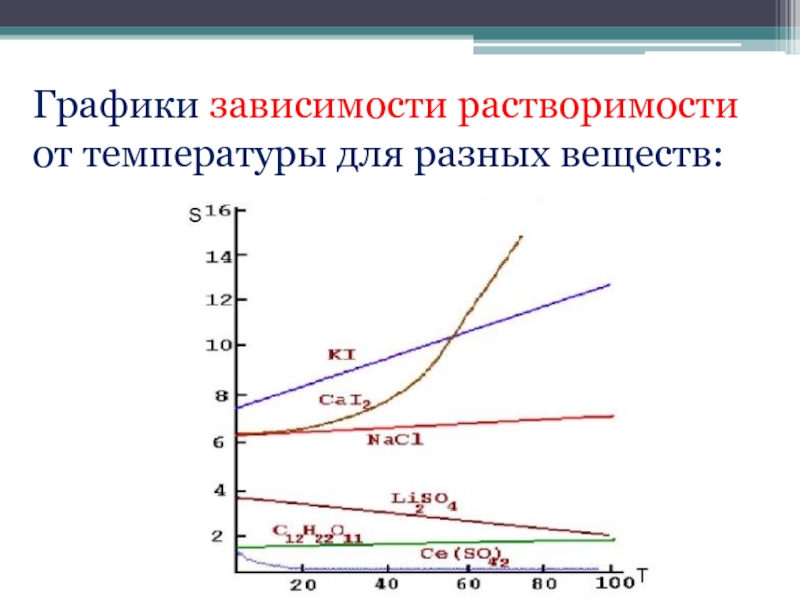
- 21. Графики зависимости растворимости от температуры для разных веществ:
- 22. Слайд 22
- 23. Слайд 23
- 24. Слайд 24
- 25. Кристаллизация пересыщенного раствора:
- 26. Правильны ли утверждения:Количественная способность растворяться в воде
- 27. Как называется раствор если:при данной t° вещество
- 28. Выводы:Растворимость – способность вещества образовывать с другими
- 29. Скачать презентанцию
Вода – искусственно синтезированный (ПРИРОДНЫЙ) растворитель. Её структурная формула: Угол между атомами равен 120° (104,5 °).
Слайды и текст этой презентации
Слайд 1Проверка изученного материала:
Прочитайте внимательно полученный текст.
Найдите ошибки в тексте и
исправьте их.
Слайд 2Вода – искусственно синтезированный (ПРИРОДНЫЙ) растворитель. Её структурная формула:
Угол
между атомами равен 120° (104,5 °).
Слайд 3Для воды характерна ковалентная неполярная (ПОЛЯРНАЯ) химическая связь, что обусловлено
наличием на внешнем валентном уровне восьми (ШЕСТИ) электронов у кислорода,
два из которых образуют электронную пару (связь) с водородом.Слайд 4Заряд молекулы воды равен нулю: он распределен равномерно (НЕРАВНОМЕРНО), т.к.
кислород более электроотрицателен, он отталкивает от себя (ОТТЯГИВАЕТ НА СЕБЯ)
электронную плотность, что обуславливает такое распределение частичного заряда на водороде и кислороде:Слайд 5Вода – неполярный (ПОЛЯРНЫЙ) растворитель, она хорошо растворяет неполярные (ПОЛЯРНЫЕ)
соединения по принципу «подобное растворяется в подобном», т.е. эти вещества
являются гидрофильными соединениями. Наряду с гидрофильными соединениями существуют также ГИДРОФОБНЫЕ соединения, например:углеводороды (бензин, керосин, парафин), животный жир, растительное масло.
Слайд 6Стоит также отметить, что при растворении веществ в воде происходит
распад на составляющие части исходного соединения (разрушение первичной структуры), при
этом происходит химическое превращение вещества (НЕ происходит хим. превращение).Аномальные свойства воды (значения ТЕМПЕРАТУРЫ и ПЛОТНОСТИ) обусловлены сильным (СЛАБЫМ) межмолекулярным взаимодействием – водородной связью между молекулами воды.
Слайд 7Схема водородной связи между молекулами воды правильна в случае:
Именно такая
особенность молекул воды, как растворителя, является одной из причин её
способности растворять вещества.Слайд 10Количественно способность растворяться в воде определяется физической величиной – растворимостью.
Растворимость
– это физическая величина, которая показывает, какую массу данного вещества
можно растворить в 1 л растворителя при данных температуре и давлении.Слайд 16Факторы, влияющие на растворимость:
Механическое воздействие на компоненты раствора– измельчение, перемешивание.
Слайд 17Факторы, влияющие на растворимость:
Растворимость веществ зависит от природы растворенного вещества.
Слайд 18Факторы, влияющие на растворимость:
Растворимость веществ зависит от природы растворителя.
Растворение медного
купороса в спирте
Растворение медного купороса в воде
Слайд 26Правильны ли утверждения:
Количественная способность растворяться в воде определяется растворимостью.
Растворимость всех
веществ почти одинакова.
Абсолютно нерастворимые вещества распространены больше, чем растворимые.
Перемешивание никак
не влияет на растворимость.В спирте можно растворить любое вещество, вне зависимости от его природы.
При повышении температуры растворимость газов повышается (при повышении давления?).
Слайд 27Как называется раствор если:
при данной t° вещество больше не растворяется?
при
данной t° вещество ещё растворяется?
раствор содержит избыток растворённого вещества?
Слайд 28Выводы:
Растворимость – способность вещества образовывать с другими веществами однородные системы
– растворы;
растворимость веществ может быть различной и зависит от природы
растворенного вещества, природы растворителя, температуры;растворы могут быть ненасыщенными, насыщенными, пересыщенными.