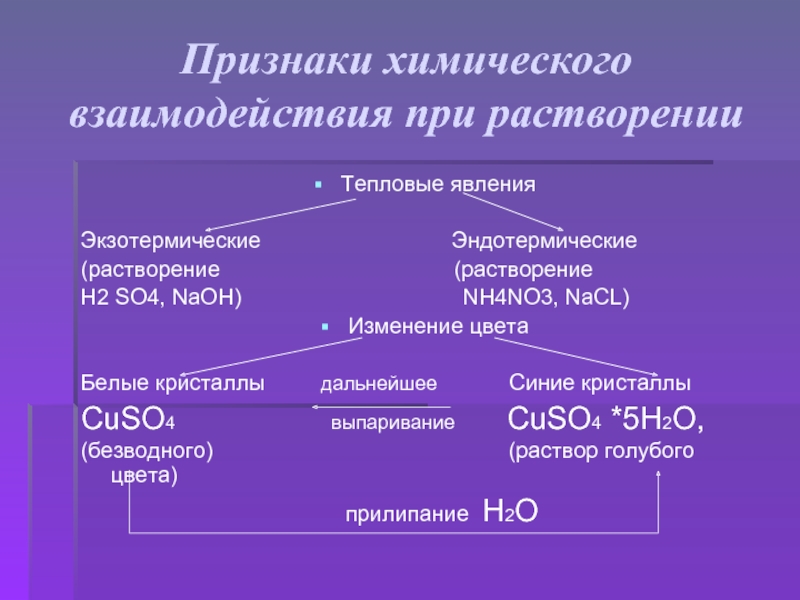
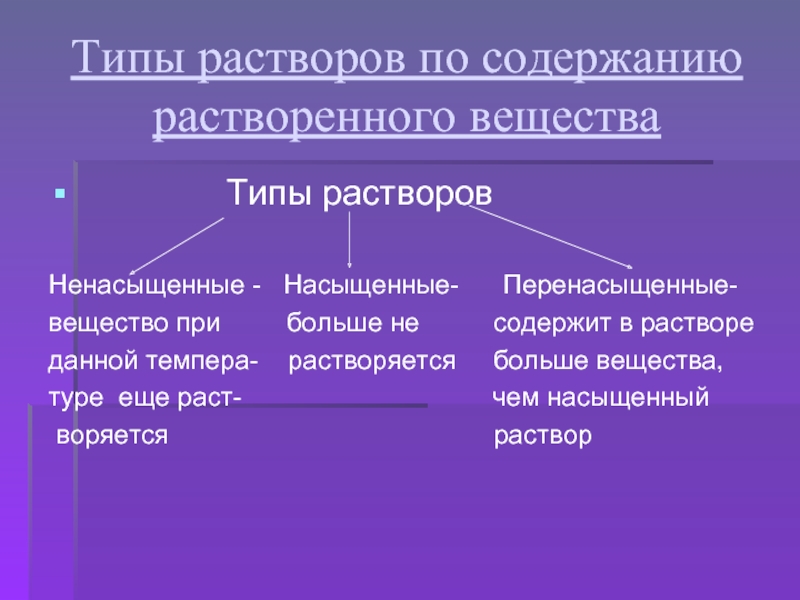
Знания составляются
из мелких крупинокежедневного опыта
(Д.И. Писарев)
Цели урока: Познакомится с растворением как физико-химическим процессом и с растворами как физико-химическими системами. Познакомится классификацией растворов по признаку растворимости.