Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Регуляция метаболических процессов
Содержание
- 1. Регуляция метаболических процессов
- 2. Организация химических реакций в метаболические путиПространственная локализация
- 3. В ряде случаев пространственная организация ферментов настолько
- 4. Слайд 4
- 5. ОрганоспецифичностьФерментный состав различных клеток неодинаков. Ферменты, выполняющие
- 6. КомпартментализацияСубклеточная локализация ферментов способствует упорядоченности биохимических процессов
- 7. Слайд 7
- 8. 2. Структура метаболических путей
- 9. Принципы регуляции метаболических путейВсе химические реакции в
- 10. Регуляция скорости ферментативных реакций осуществляется на 3
- 11. 1. Регуляция количества молекул фермента в клеткеБелки
- 12. 2. Регуляция скорости ферментативной реакции доступностью молекул
- 13. 3. Регуляция каталитической активности ферментовОсновные способы регуляции
- 14. Изостерическая регуляцияЕсли метаболит или ксенобиотик имеет структурное
- 15. Изостерическим ингибитором СДГ является также оксалоацетат, который
- 16. Слайд 16
- 17. Аллостерическая регуляцияАллостерическими ферментами называют ферменты, активность которых
- 18. Роль аллостерических ферментов в метаболизме клетки. Аллостерические
- 19. - при катаболических процессах. В случае накопления
- 20. Аллостерические эффекторы. Эффектор, вызывающий снижение (ингибирование) активности
- 21. Более редкий случай аллостерической регуляции, когда сам
- 22. Выявить ферменты с аллостерической регуляцией можно, изучая
- 23. S-образная кривая зависимости скорости реакции от концентрации
- 24. Работа регуляторных субъединиц АКТ-азыПротекание реакции во времени
- 25. Кооперативное связывание Аллостерические ферменты обладают свойством кооперативности:
- 26. Коэффициент Хилла h – безразмерная величина, характеризующая
- 27. Графическое определение коэффициента Хилла lg(v/( Vmax-v)) = h lg[S0] – h lg[S]0,5
- 28. Для изостерических ферментов, у которых кооперативного взаимодействия
- 29. Особенности строения и функционирования аллостерических ферментов:- обычно
- 30. - аллостерические ферменты обладают свойством кооперативности: взаимодействие
- 31. Слайд 31
- 32. Локализация аллостерических ферментов в метаболическом пути. Скорость
- 33. Фермент, катализирующий превращение субстрата А в продукт
- 34. В центральных метаболических путях исходные вещества могут
- 35. В качестве примера можно рассмотреть принципы регуляции
- 36. Слайд 36
- 37. Регуляция каталитической активности ферментов белок-белковыми взаимодействиями. Некоторые
- 38. Активация ферментов в результате присоединения регуляторных белков.
- 39. В мембране аденилатциклаза функционирует в комплексе с
- 40. Регуляция каталитической активности ферментов ассоциацией/диссоциацией протомеров Протеинкиназы
- 41. Протеинкиназа А (цАМФ-зависимая) состоит из 4 субъединиц
- 42. Слайд 42
- 43. Регуляция каталитической активности ферментов путём фосфорилирования/дефосфорилированияВ биологических
- 44. Слайд 44
- 45. Регуляция каталитической активности ферментов частичным (ограниченным) протеолизомНекоторые
- 46. Частичный протеолиз - пример регуляции, когда активность
- 47. Рассмотрим механизм частичного протеолиза на примере активации
- 48. Слайд 48
- 49. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Организация химических реакций в метаболические пути
Пространственная локализация ферментов
Все ферменты одного
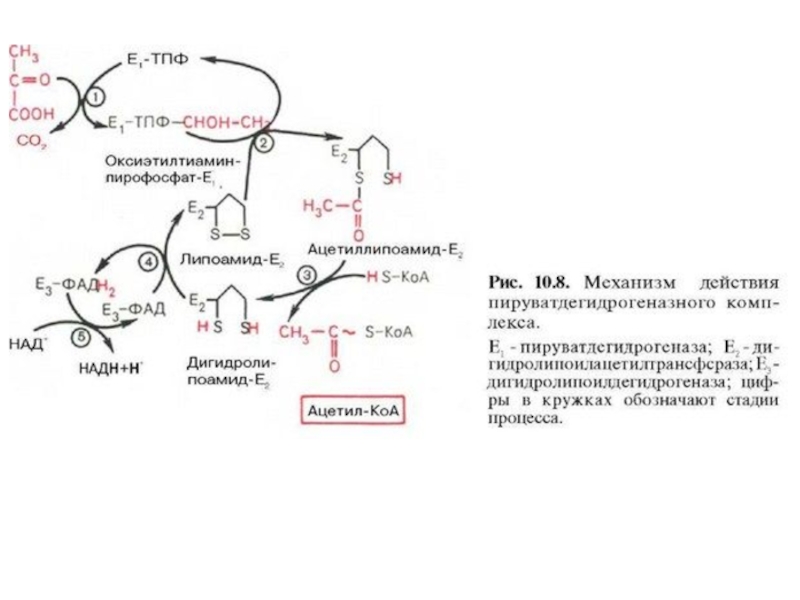
Слайд 3В ряде случаев пространственная организация ферментов настолько сильно выражена, что
продукт реакции ни при каких условиях не может быть вычленен
из метаболического пути и обязательно служит субстратом следующей реакции.Такая организация метаболического пути носит название мультиферментного комплекса и возникает в результате структурно-функциональной организации ферментов. Обычно такие комплексы связаны с мембранами.
Пример - пируватдегидрогеназный комплекс, под действием которого происходит окислительное декарбоксилирование пировиноградной кислоты
Слайд 5Органоспецифичность
Ферментный состав различных клеток неодинаков. Ферменты, выполняющие функцию жизнеобеспечения клетки,
находятся во всех клетках организма. В процессе дифференцировки клеток происходит
изменение ферментного состава клеток.Например, в клетках сердечной мышцы имеется повышенное количество ферментов креатинкиназы и аспартатаминотрансферазы, в клетках печени - аланинаминотрансферазы и аспартатаминотрансферазы.
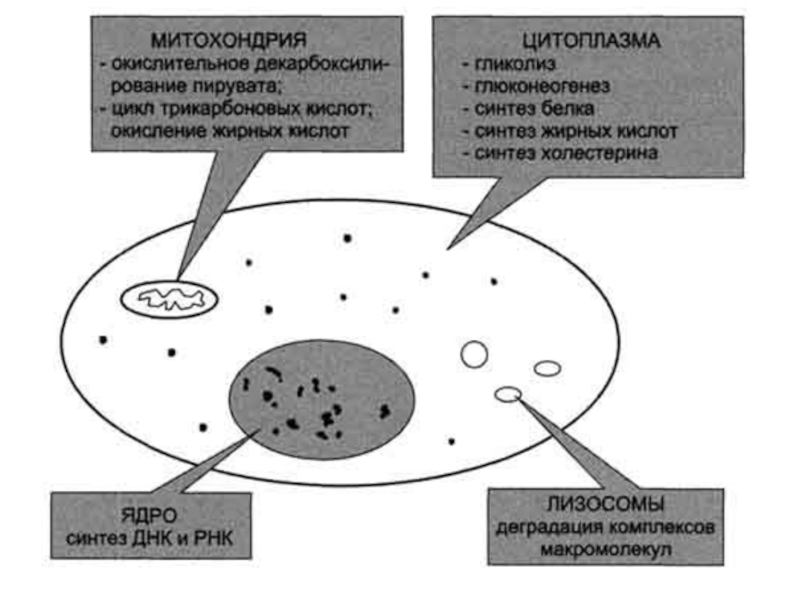
Слайд 6Компартментализация
Субклеточная локализация ферментов способствует упорядоченности биохимических процессов и увеличивает скорость
обмена веществ
В ядре находятся ферменты, связанные с синтезом молекул ДНК
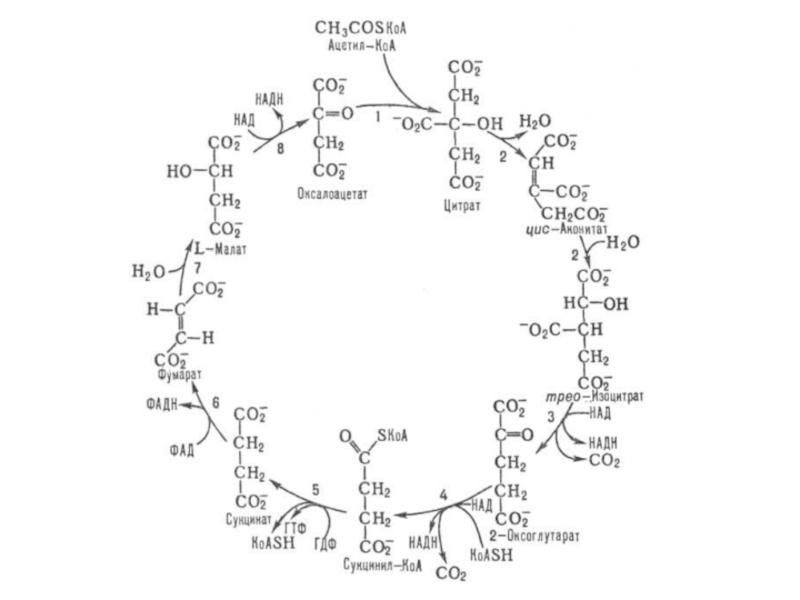
и РНК, в цитоплазме - ферменты гликолиза, в лизосомах - гидролитические ферменты, в матриксе митохондрий - ферменты ЦТК, во внутренней мембране митохондрий - ферменты цепи переноса электронов и т.д. .
Слайд 9Принципы регуляции метаболических путей
Все химические реакции в клетке протекают при
участии ферментов. Поэтому, чтобы воздействовать на скорость протекания метаболического пути,
достаточно регулировать количество или активность ферментов.Обычно в метаболических путях есть ключевые ферменты, благодаря которым происходит регуляция скорости всего пути. Эти ферменты (один или несколько в метаболическом пути) называются регуляторными ферментами; они катализируют, как правило, начальные реакции метаболического пути, необратимые реакции, скорость-лимитирующие реакции (самые медленные) или реакции в месте переключения метаболического пути (точки ветвления).
Слайд 10Регуляция скорости ферментативных реакций осуществляется на 3 независимых уровнях:
1) изменением
количества молекул фермента;
2) доступностью молекул субстрата и кофермента;
3) изменением каталитической
активности молекулы фермента.Слайд 111. Регуляция количества молекул фермента в клетке
Белки в клетке постоянно
обновляются. Количество молекул фермента в клетке определяется соотношением 2 процессов
- синтеза и распада белковой молекулы фермента.Синтез и фолдинг белка - многостадийный процесс. Регуляция синтеза белка может происходить на любой стадии формирования белковой молекулы. Наиболее изучен механизм регуляции синтеза белковой молекулы на уровне транскрипции.
Что касается распада ферментов, то регуляция этого процесса менее изучена. Можно только предполагать, что это не просто процесс протеолиза (разрушения белковой молекулы), а сложный механизм, возможно, определяемый на генетическом уровне.
Слайд 122. Регуляция скорости ферментативной реакции доступностью молекул субстрата и коферментов
Важный
параметр, контролирующий протекание метаболического пути, - наличие субстратов, и главным
образом - наличие первого субстрата. Чем больше концентрация исходного субстрата, тем выше скорость метаболического пути.Другой параметр, лимитирующий протекание метаболического пути, - наличие регенерированных коферментов. Например, в реакциях дегидрирования коферментом дегидрогеназ служат окисленные формы NAD+, FAD, FMN, которые восстанавливаются в ходе реакции. Чтобы коферменты вновь участвовали в реакции, необходима их регенерация, т.е. превращение в окисленную форму.
Слайд 133. Регуляция каталитической активности ферментов
Основные способы регуляции активности ферментов:
- изостерическая
регуляция;
- аллостерическая регуляция;
- регуляция с помощью белок-белковых взаимодействий;
- регуляция путём
фосфорилирования/дефосфорилирования молекулы фермента;- регуляция частичным (ограниченным) протеолизом.
Слайд 14Изостерическая регуляция
Если метаболит или ксенобиотик имеет структурное сходство с субстратом,
то он может связываться с субстратным активным центром фермента, подавляя
его каталитическую активность. Такие ингибиторы называютквазисубстратами. Сродство субстрата к ферменту больше, чем сродство квазисубстрата, и в присутствии субстрата и квазисубстрата между ними наблюдается конкуренция за активный центр фермента.
Ингибирующее действие зависит от соотношения«субстрат– квазисубстрат».
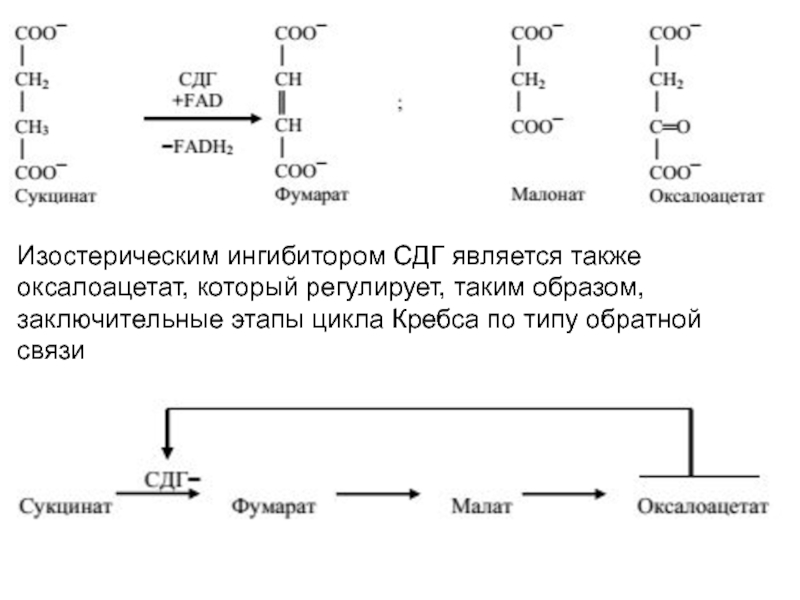
Классическим примером изостерического ингибирования является действие малоната на активность сукцинатдегидрогеназы. Для50%-го угнетения СДГ соотношение сукцинат/малонат должно составлять1:50
Слайд 15Изостерическим ингибитором СДГ является также оксалоацетат, который регулирует, таким образом,
заключительные этапы цикла Кребса по типу обратной связи
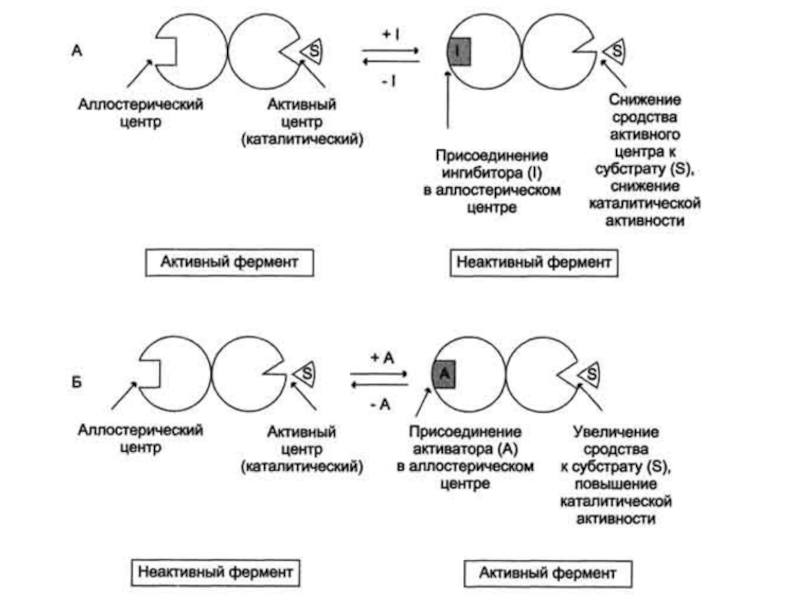
Слайд 17Аллостерическая регуляция
Аллостерическими ферментами называют ферменты, активность которых регулируется не только
количеством молекул субстрата, но и другими веществами, называемыми эффекторами.
Участвующие
в аллостерической регуляции эффекторы - клеточные метаболиты (например, продукты реакции) часто именно того пути, регуляцию которого они осуществляют.Аллостерический центр представляет собой участок молекулы фермента, в результате присоединения к которому определенного низкомолекулярного (а иногда - и высокомолекулярного) вещества изменяется третичная структура белковой молекулы. Вследствие этого изменяется конфигурация активного центра, сопровождающаяся либо увеличением, либо понижением каталитической активности фермента.
Слайд 18Роль аллостерических ферментов в метаболизме клетки.
Аллостерические ферменты играют важную
роль в метаболизме, так как они чрезвычайно быстро реагируют на
малейшие изменения внутреннего состояния клетки.Аллостерическая регуляция имеет большое значение в следующих ситуациях:
- при анаболических процессах. Ингибирование конечным продуктом метаболического пути и активация начальными метаболитами позволяют осуществлять регуляцию синтеза этих соединений;
Слайд 19- при катаболических процессах.
В случае накопления АТФ в клетке
происходит ингибирование метаболических путей, обеспечивающих синтез энергии.
- для координации анаболических
и катаболических путей. АТФ и АДФ - аллостерические эффекторы, действующие как антагонисты;- для координации параллельно протекающих и взаимосвязанных метаболических путей (например, синтез пуриновых и пиримидиновых нуклеотидов, используемых для синтеза нуклеиновых кислот).
Слайд 20Аллостерические эффекторы.
Эффектор, вызывающий снижение (ингибирование) активности фермента, называют отрицательным
эффектором, или ингибитором.
Эффектор, вызывавший повышение (активацию) активности ферментов, называют
положительным эффектором, или активатором.Аллостерическими эффекторами часто служат различные метаболиты.
Конечные продукты метаболического пути - часто ингибиторы аллостерических ферментов, а исходные вещества - активаторы.
Это так называемая гетеротропная регуляция.
Такой вид аллостерической регуляции очень распространён в биологических системах.
Слайд 21Более редкий случай аллостерической регуляции, когда сам субстрат может выступать
в качестве положительного эффектора. Такая регуляция называется гомотропной (эффектор и
субстрат - одно и то же вещество).Эти ферменты имеют несколько центров связывания для субстрата, которые могут выполнять двойную функцию: каталитическую и регуляторную.
Аллостерические ферменты такого типа используются в ситуации, когда субстрат накапливается в избытке и должен быстро преобразоваться в продукт.
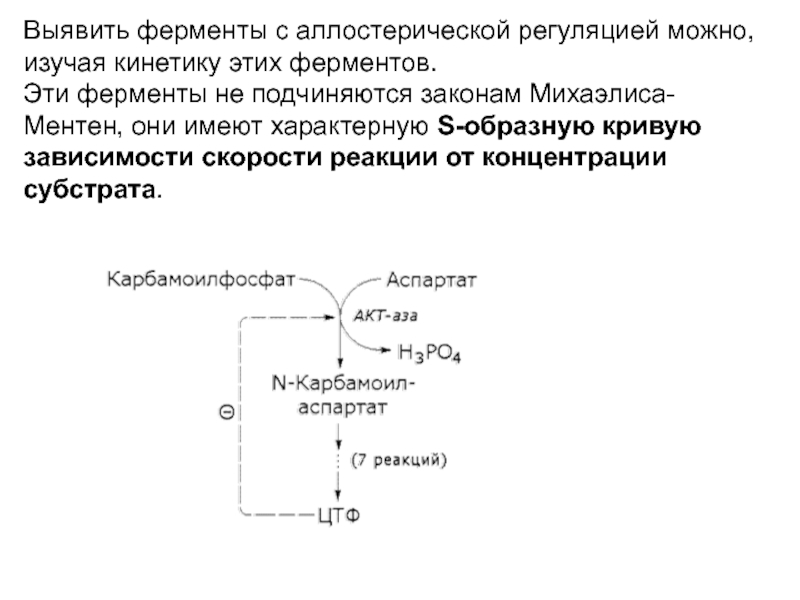
Слайд 22Выявить ферменты с аллостерической регуляцией можно, изучая кинетику этих ферментов.
Эти ферменты не подчиняются законам Михаэлиса-Ментен, они имеют характерную S-образную
кривую зависимости скорости реакции от концентрации субстрата.Слайд 23
S-образная кривая зависимости скорости реакции от концентрации субстрата
Арчибальд Хилл
1886-1977
Английский физиолог
Нобелевская
премия по
физиологии и медицине
1922 г.
График зависимости скорости реакции от
концентрации субстрата в виде S-образной
кривой на примере АКТ-азы: без эффектора, с АТР, с СTP. Субстрат – аспартат.
Впервые S-образные функции для насыщения были
получены в 1909 году (А. Хилл)
Слайд 24
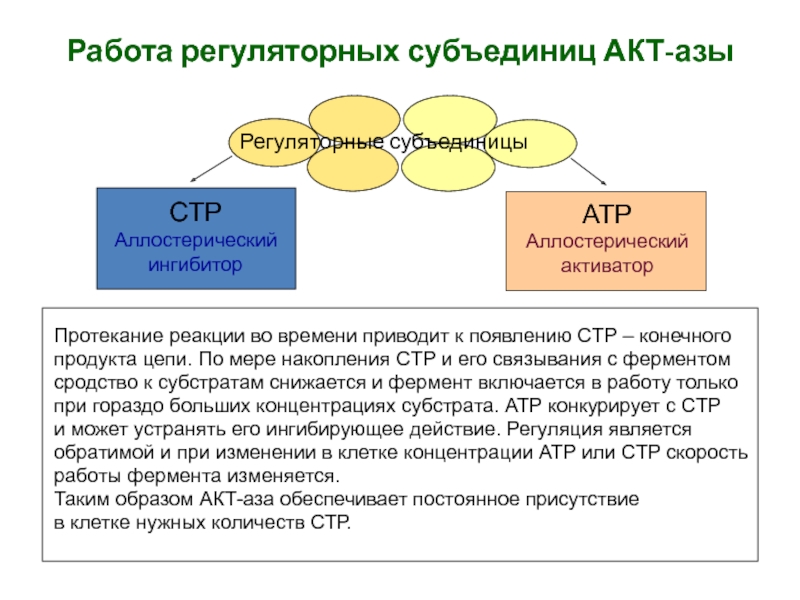
Работа регуляторных субъединиц АКТ-азы
Протекание реакции во времени приводит к появлению
СTP – конечного
продукта цепи. По мере накопления СTP и
его связывания с ферментом сродство к субстратам снижается и фермент включается в работу только
при гораздо больших концентрациях субстрата. АТР конкурирует с СTP
и может устранять его ингибирующее действие. Регуляция является
обратимой и при изменении в клетке концентрации АТР или СTP скорость
работы фермента изменяется.
Таким образом АКТ-аза обеспечивает постоянное присутствие
в клетке нужных количеств СТР.
Регуляторные субъединицы
СTP
Аллостерический
ингибитор
АТР
Аллостерический
активатор
Слайд 25
Кооперативное связывание
Аллостерические ферменты обладают
свойством кооперативности: взаимодействие эффектора с
аллостерическим центром вызывает последовательное кооперативное изменение конформации всех субъединиц, приводящее
к изменению конформации активного центра и к изменению сродства фермента к субстрату, что снижает или увеличивает каталитическую активность фермента.Слайд 26
Коэффициент Хилла h – безразмерная величина, характеризующая кооперативность связывания лиганда
ферментом
Y – степень насыщения, [L] – равновесная концентрация
лиганда и
[L]0,5 – равновесная концентрация лиганда, при которой Y=0,5 от максимального насыщения.
Vmax – максимальная скорость при S0→∞, [S]0,5 – концентрация
субстрата при половине максимальной скорости, которая
входит в уравнение вместо константы Михаэлиса KМ.
Слайд 28Для изостерических ферментов, у которых кооперативного взаимодействия между активными центрами
нет, то есть сродство фермента к субстрату не зависит от
уже присоединенных молекул субстрата, h=1.Положительная кооперативность (h>1) характеризуется тем, что присоединение одной молекулы субстрата к активному центру фермента увеличивает сродство к субстрату остальных активных центров.
S-образные кривые зависимости скорости реакции от концентрации субстрата характерны для положительной кооперативности. Связывание кислорода с гемоглобином, имеющим 4 центра связи, характеризуется параметром Хилла h=2,9.
Отрицательная кооперативность (h<1) характеризуется тем, что присоединение одной молекулы лиганда к активному центру фермента уменьшает сродство к лиганду остальных активных центров.
Слайд 29Особенности строения и функционирования аллостерических ферментов:
- обычно это олигомерные белки,
состоящие из нескольких протомеров (субъединиц);
- они имеют аллостерический центр, пространственно
удалённый от каталитического активного центра;- эффекторы присоединяются к ферменту нековалентно в аллостерических (регуляторных) центрах;
- аллостерические центры, так же, как и каталитические, могут проявлять различную специфичность по отношению к лигандам: она может быть абсолютной и групповой. Некоторые ферменты имеют несколько аллостерических центров, одни из которых специфичны к активаторам, другие - к ингибиторам.
Слайд 30- аллостерические ферменты обладают свойством кооперативности: взаимодействие аллостерического эффектора с
аллостерическим центром вызывает последовательное кооперативное изменение конформации всех субъединиц, приводящее
к изменению конформации активного центра и изменению сродства фермента к субстрату, что снижает или увеличивает каталитическую активность фермента;- регуляция аллостерических ферментов обратима: отсоединение эффектора от регуляторной субъединицы восстанавливает исходную каталитическую активность фермента;
- аллостерические ферменты катализируют ключевые реакции данного метаболического пути.
Слайд 32Локализация аллостерических ферментов в метаболическом пути.
Скорость метаболических процессов зависит
от концентрации веществ, использующихся и образующихся в данной цепи реакций.
Такая регуляция представляется логичной, так как при накоплении конечного продукта он (конечный продукт) может действовать как аллостерический ингибитор фермента, катализирующего чаще всего начальный этап данного метаболического пути
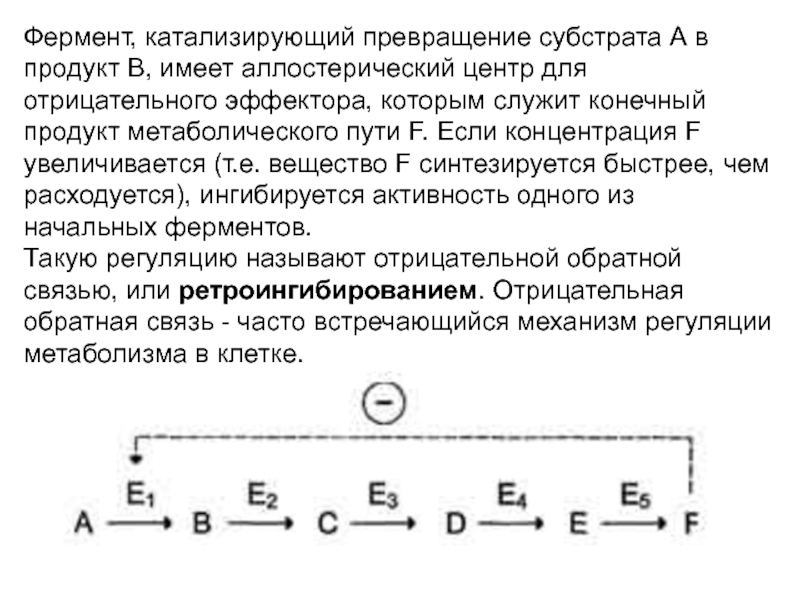
Слайд 33Фермент, катализирующий превращение субстрата А в продукт В, имеет аллостерический
центр для отрицательного эффектора, которым служит конечный продукт метаболического пути
F. Если концентрация F увеличивается (т.е. вещество F синтезируется быстрее, чем расходуется), ингибируется активность одного из начальных ферментов.Такую регуляцию называют отрицательной обратной связью, или ретроингибированием. Отрицательная обратная связь - часто встречающийся механизм регуляции метаболизма в клетке.
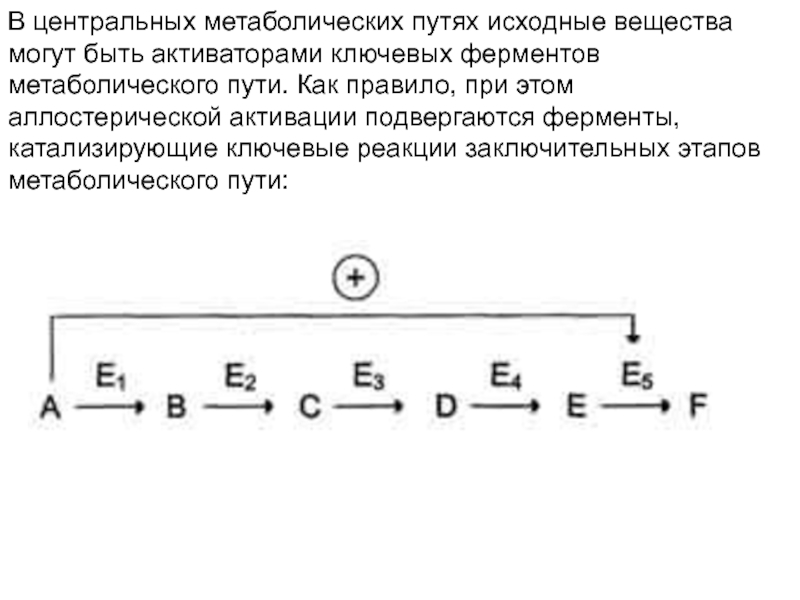
Слайд 34В центральных метаболических путях исходные вещества могут быть активаторами ключевых
ферментов метаболического пути. Как правило, при этом аллостерической активации подвергаются
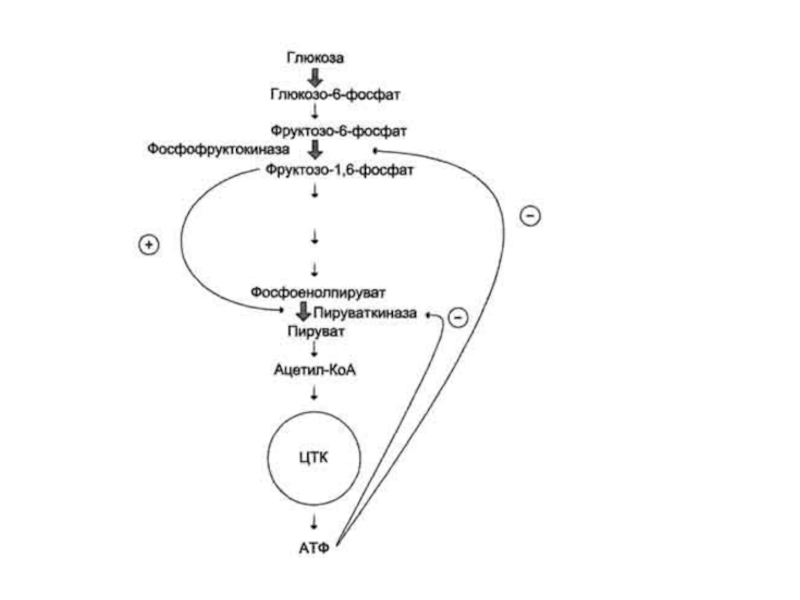
ферменты, катализирующие ключевые реакции заключительных этапов метаболического пути:Слайд 35В качестве примера можно рассмотреть принципы регуляции гликолиза - специфического
(начального) пути распада глюкозы.
Один из конечных продуктов распада глюкозы
- молекула АТФ. При избытке в клетке АТФ происходит ретро-ингибирование аллостерических ферментов фосфофруктокиназы и пируваткиназы. При образовании большого количества фруктозо-1,6-бисфосфата наблюдают аллостерическую активацию фермента пируваткиназы.
Слайд 37Регуляция каталитической активности ферментов белок-белковыми взаимодействиями.
Некоторые ферменты изменяют свою
каталитическую активность в результате белок-белковых взаимодействий.
2 механизма активации ферментов
с помощью белок-белковых взаимодействий:- активация ферментов в результате присоединения регуляторных белков;
- изменение каталитической активности ферментов вследствие ассоциации или диссоциации протомеров фермента.
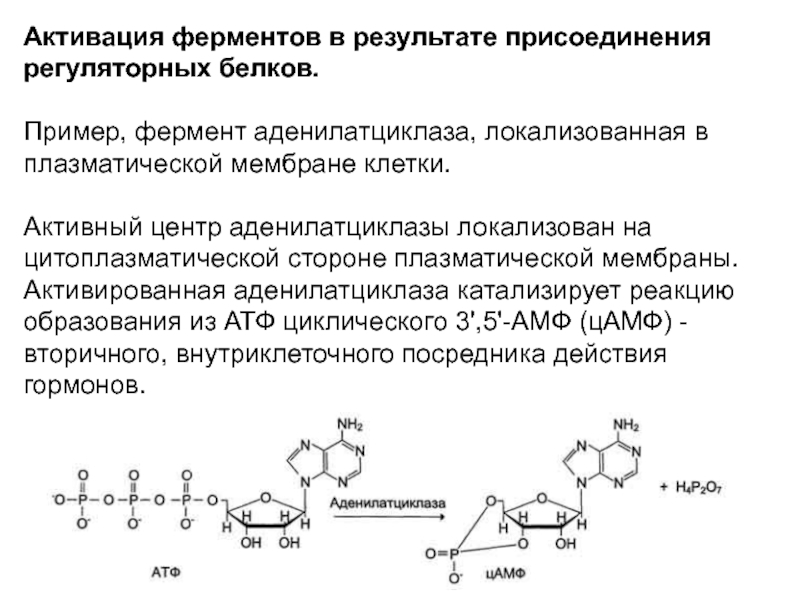
Слайд 38Активация ферментов в результате присоединения регуляторных белков.
Пример, фермент аденилатциклаза,
локализованная в плазматической мембране клетки.
Активный центр аденилатциклазы локализован на цитоплазматической
стороне плазматической мембраны. Активированная аденилатциклаза катализирует реакцию образования из АТФ циклического 3',5'-АМФ (цАМФ) - вторичного, внутриклеточного посредника действия гормонов.Слайд 39В мембране аденилатциклаза функционирует в комплексе с другими белками:
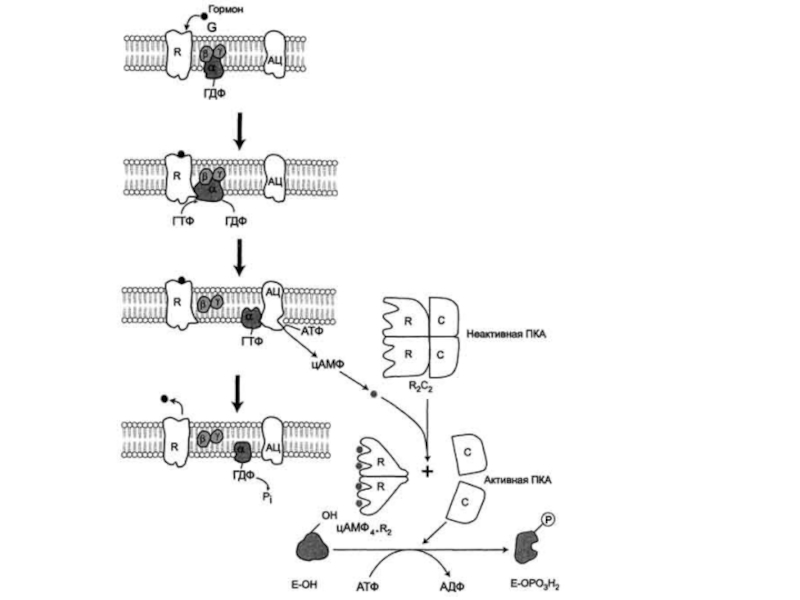
1) рецептором
гормона, выступающего во внеклеточную среду и взаимодействующего с гормонами;
2) с
G-белком, занимающим промежуточное положение между рецептором и ферментом аденилатциклазой. G-белок - олигомерный белок, состоящий из 3 субъединиц - α, β, γ. α-Субъединица имеет центр связывания и расщепления ГТФ. Поэтому этот белок называется ГТФ-связывающим белком, или G-белком;3) в результате связывания гормона с рецептором происходит изменение конформации G-белка, уменьшение его сродства к молекуле ГДФ, с которой он связан в отсутствие гормонального сигнала, и увеличение сродства к ГТФ. Присоединение ГТФ вызывает конформационные изменения в G-белке и диссоциацию его на субъединицы: субъединицу α, связанную с ГТФ (α-ГТФ), димер βγ;
4) α-ГТФ имеет высокое сродство к аденилатциклазе, его присоединение приводит к активации последней, поэтому α-ГТФ - регуляторный белок, а данный механизм активации аденилатциклазы называют активацией ферментов в результате присоединения регуляторных белков.
Слайд 40Регуляция каталитической активности ферментов ассоциацией/диссоциацией протомеров
Протеинкиназы - группа ферментов,
катализирующих перенос остатка фосфорной кислоты с АТФ на специфические ОН-группы
аминокислотных остатков белков (вызывают фосфорилирование белков). Механизмы активации различных протеинкиназ неодинаковы. В качестве примера регуляции каталитической активности ферментов ассоциацией или диссоциацией протомеров можно привести регуляцию активности фермента Протеинкиназы А.Слайд 41Протеинкиназа А (цАМФ-зависимая) состоит из 4 субъединиц 2 типов: 2
регуляторных (R) и 2 каталитических (С).
Такой тетрамер не обладает
каталитической активностью. Регуляторные субъединицы имеют участки связывания для циклического 3',5'-АМФ (цАМФ), по 2 на каждую субъединицу. Присоединение 4 молекул цАМФ к 2 регуляторным субъединицам приводит к изменению конформации регуляторных протомеров и к диссоциации тетрамерного комплекса, при этом высвобождаются 2 активные каталитические субъединицы.
Такой механизм регуляции обратим. Отщепление молекул цАМФ от регуляторных субъединиц приведёт к ассоциации регуляторных и каталитических субъединиц Протеинкиназы А с образованием неактивного комплекса.
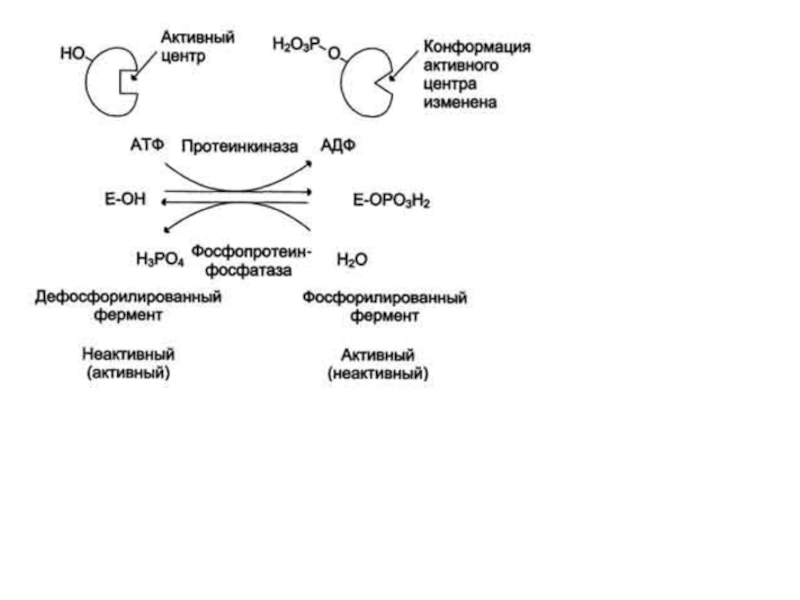
Слайд 43Регуляция каталитической активности ферментов путём фосфорилирования/дефосфорилирования
В биологических системах часто встречается
механизм регуляции активности ферментов с помощью ковалентной модификации аминокислотных остатков.
Быстрый и широко распространённый способ химической модификации ферментов - фосфорилирование/дефосфорилирование.Модификации подвергаются ОН-группы фермента.
Фосфорилирование осуществляется ферментами протеинкиназами, а дефосфорилирование - фосфопротеинфосфатазами.
Присоединение остатка фосфорной кислоты приводит к изменению конформации активного центра и его каталитической активности. При этом результат может быть двояким: одни ферменты при фосфорилировании активируются, другие, напротив, становятся менее активными.
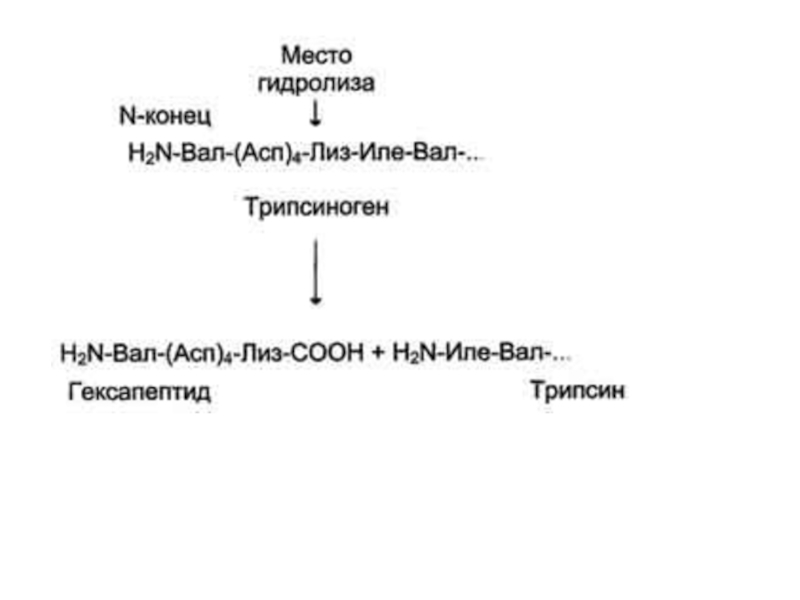
Слайд 45Регуляция каталитической активности ферментов частичным (ограниченным) протеолизом
Некоторые ферменты, функционирующие вне
клеток (в ЖКТ или в плазме крови), синтезируются в виде
неактивных предшественников и активируются только в результате гидролиза одной или нескольких определённых пептидных связей, что приводит к отщеплению части белковой молекулы предшественника.В результате в оставшейся части белковой молекулы происходит конформационная перестройка и формируется активный центр фермента.
Слайд 46Частичный протеолиз - пример регуляции, когда активность фермента изменяется необратимо.
Такие ферменты функционируют, как правило, в течение короткого времени, определяемого
временем жизни белковой молекулы. Частичный протеолиз лежит в основе активации протеолитических ферментов, белков свёртывающей системы крови и фибринолиза.



















![Регуляция метаболических процессов Коэффициент Хилла h – безразмерная величина, характеризующая кооперативность связывания лиганда ферментомY Коэффициент Хилла h – безразмерная величина, характеризующая кооперативность связывания лиганда ферментомY – степень насыщения, [L] – равновесная](/img/thumbs/c26d912a7501aea01a9cdb01692b0241-800x.jpg)
![Регуляция метаболических процессов Графическое определение коэффициента Хилла lg(v/( Vmax-v)) = h lg[S0] – h lg[S]0,5 Графическое определение коэффициента Хилла lg(v/( Vmax-v)) = h lg[S0] – h lg[S]0,5](/img/thumbs/17e166468a8b2cdb3f2adf882e9aabea-800x.jpg)