Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
регуляция.ppt
Содержание
- 1. регуляция.ppt
- 2. СПОСОБЫ РЕГУЛЯЦИИ КЛЕТОЧНОЙ АКТИВНОСТИI.ВЗАИМОДЕЙСТВИЕ МЕТАБОЛИТОВ И КОФАКТОРОВ
- 3. I. ВЗАИМОДЕЙСТВИЕ МЕТАБОЛИТОВ И КОФАКТОРОВ С ФЕРМЕНТАМИРЕГУЛЯЦИЯ
- 4. ВЗАИМОДЕЙСТВИЕ МЕТАБОЛИТОВ И КОФАКТОРОВ С ФЕРМЕНТАМИ2. РЕГУЛЯЦИЯ
- 5. СИНТЕЗ БЕЛКА НА РИБОСОМЕВ клетках животных многие
- 6. II. ХИМИЧЕСКАЯ МОДИФИКАЦИЯ БЕЛКОВ(ПОСТТРАНСЛЯЦИОННАЯ МОДИФИКАЦИЯ БЕЛКОВ)ковалентные модификации белкаГИДРОКСИЛИРОВАНИЕ ГЛИКОЗИЛИРОВАНИЕАЦЕТИЛИРОВАНИЕМЕТИЛИРОВАНИЕФОСФОРИЛИРОВАНИЕ ОГРАНИЧЕННЫЙ ПРОТЕОЛИЗ
- 7. ГИДРОКСИЛИРОВАНИЕ - присоединение ОН- к определенным остаткам
- 8. ГЛИКОЗИЛИРОВАНИЕ - присоединение углеводных остатков, образование гликопротеиновПроисходит в ЭПС и комплексе ГольджиПеренос олигосахаридовУкорачивание олигосахаридов
- 9. АЦЕТИЛИРОВАНИЕ и МЕТИЛИРОВАНИЕПрисоединение ацильной или метильной группыПРИМЕР:
- 10. ПОСТТРАНСЛЯЦИОННАЯ МОДИФИКАЦИЯ ГИСТОНОВ ОКАЗЫВАЕТ ВЛИЯНИЕ НА ТРАНСКРИПЦИОННУЮ
- 11. ФОСФОРИЛИРОВАНИЕ Присоединение фосфатной группы.Обратимый процесс.Фосфорилируется
- 12. ФОСФОРИЛИРОВАНИЕКИНАЗА ФОСФОРИЛИРУЕТФОСФАТАЗА ДЕФОСФОРИЛИРУЕТ
- 13. Слайд 13
- 14. ОГРАНИЧЕННЫЙ ПРОТЕОЛИЗ – избирательное расщепление белка на
- 15. ПРИМЕР: АКТИВАЦИЯ ТРИПСИНОГЕНА
- 16. Инсулин синтезируется в виде проинсулина и представляет
- 17. ВНУТРИКЛЕТОЧНАЯ Са 2+ -ЗАВИСИМАЯ ПРОТЕАЗА КАЛЬПАИННарушение
- 18. III. ИЗМЕНЕНИЕ КОМПАРТМЕНТАЛИЗАЦИИ ВЕЩЕСТВ В КЛЕТКЕФерменты и
- 19. IV.ТОПОДИНАМИЧЕСКАЯ РЕГУЛЯЦИЯОснована на динамической неоднородности распределения белков в мембране, их способности образовывать ассоциации.
- 20. I, III, IV – белковые комплексыII – сукцинатдегид-рогеназаV – АТФ-синтазаПРИМЕР: дыхательная цепь в митохондрии
- 21. V.ЭКСПРЕССИЯ ГЕНОМАРЕГУЛЯЦИЯ СОДЕРЖАНИЯ БЕЛКА В КЛЕТКЕ ПОСРЕДСТВОМ ИНДУКЦИИ И РЕПРЕССИИ СИНТЕЗА, Т.Е. ИЗМЕНЕНИЕМ СКОРОСТИ ТРАНСКРИПЦИИ
- 22. РЕГУЛЯЦИЯ СИНТЕЗА БЕЛКА У ПРОКАРИОТИНДУКТОРОМ СИНТЕЗА СЛУЖИТ СУБСТРАТ
- 23. Во всех эукариотических клетках экспрессия генов контролируется
- 24. КОНТРОЛЬ НА УРОВНЕ ТРАНСКРИПЦИИРЕГУЛЯЦИЯ СИНТЕЗА БЕЛКА У ЭУКАРИОТИНДУКТОРЫ СИНТЕЗА – СТЕРОИДНЫЕ ГОРМОНЫ
- 25. VI. РЕГУЛЯТОРНЫЕ СИСТЕМЫ С УЧАСТИЕМ ВТОРИЧНЫХ ПОСРЕДНИКОВКОМПОНЕНТЫ
- 26. СПОСОБЫ МЕЖКЛЕТОЧНОЙ КОММУНИКАЦИИСПОСОБЫ ДОСТАВКИ СИГНАЛЬНЫХ МОЛЕКУЛ К КЛЕТКАМ
- 27. МЕЖКЛЕТОЧНЫЕ СИГНАЛЬНЫЕ МОЛЕКУЛЫ (ПЕРВИЧНЫЕ ПОСРЕДНИКИ)НЕБОЛЬШИЕ ЛИПОФИЛЬНЫЕ МОЛЕКУЛЫДИФФУНДИРУЮТ
- 28. 1. НЕБОЛЬШИЕ ЛИПОФИЛЬНЫЕ МОЛЕКУЛЫСтероидные гормоны, вырабатываемые половыми железами и корой надпочечников Тиреоидные гормоны Первичные посредники
- 29. СХЕМА ДЕЙСТВИЯ СТЕРОИДНЫХ И ТИРЕОИДНЫХ ГОРМОНОВвнутриклеточные рецепторы имеют гормон-связывающий домен ДНК-связывающий домен
- 30. Слайд 30
- 31. МЕХАНИЗМ ДЕЙСТВИЯ ЛИПОФИЛЬНЫХ ГОРМОНОВ, ПРОНИКАЮЩИХ ВНУТРЬ КЛЕТКИ
- 32. 2. ЛИПОФИЛЬНЫЕ МОЛЕКУЛЫПроизводные арахидоновой кислоты – ЭЙКОЗАНОИДЫ:ПРОСТАГЛАНДИНЫЛЕЙКОТРИЕНЫПРОСТАЦИКЛИНЫТРОМБОКСАНЫ Первичные посредники
- 33. ЭЙКОЗАНОИДЫ ОБРАЗУЮТСЯ ПРАКТИЧЕСКИ ВО ВСЕХ КЛЕТКАХ, ИХ
- 34. 3. ГИДРОФИЛЬНЫЕ МОЛЕКУЛЫПервичные посредникиГИДРОФИЛЬНЫЕ ГОРМОНЫНЕЙРОТРАНСМИТТЕРЫФАКТОРЫ РОСТА (эпидермальный
- 35. СХЕМА ДЕЙСТВИЯ НЕЙРОМЕДИАТОРОВПервичные посредники
- 36. СХЕМА ДЕЙСТВИЯ ГИДРОФИЛЬНЫХ АГОНИСТОВПервичные посредникиГидрофильные гормоныИнсулин, факторы роста
- 37. РЕЦЕПТОРЫ И МЕХАНИЗМЫ ИХ ДЕЙСТВИЯ
- 38. РЕЦЕПТОР –СПЕЦИФИЧЕСКИЙ БЕЛОК, КОТОРЫЙ СВЯЗЫВАЕТ СИГНАЛЬНОЕ ВЕЩЕСТВО,
- 39. ХАРАКТЕРИСТИКИ РЕЦЕПТОРОВ
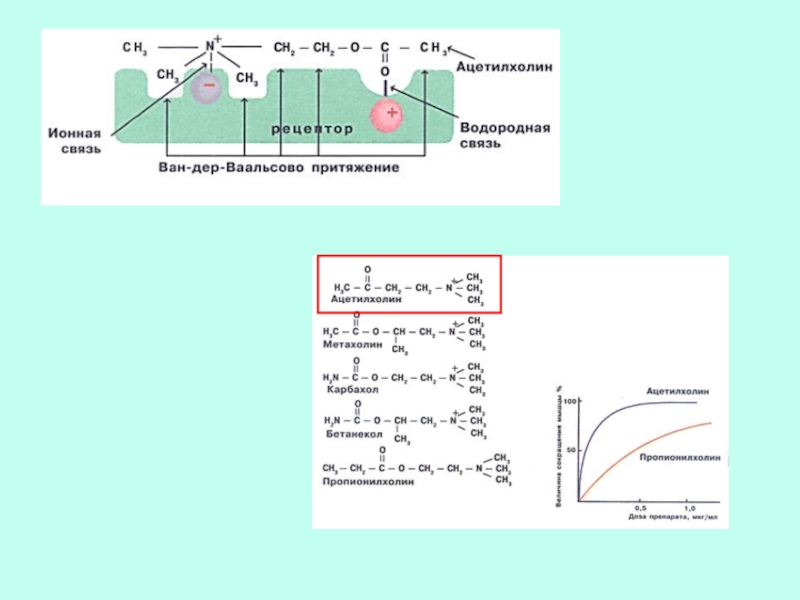
- 40. СЕЛЕКТИВНОСТЬ СВОЙСТВО, ОСНОВАННОЕ НА СТРОГОЙ СТРУКТУРНОЙ СПЕЦИФИЧНОСТИ.
- 41. Слайд 41
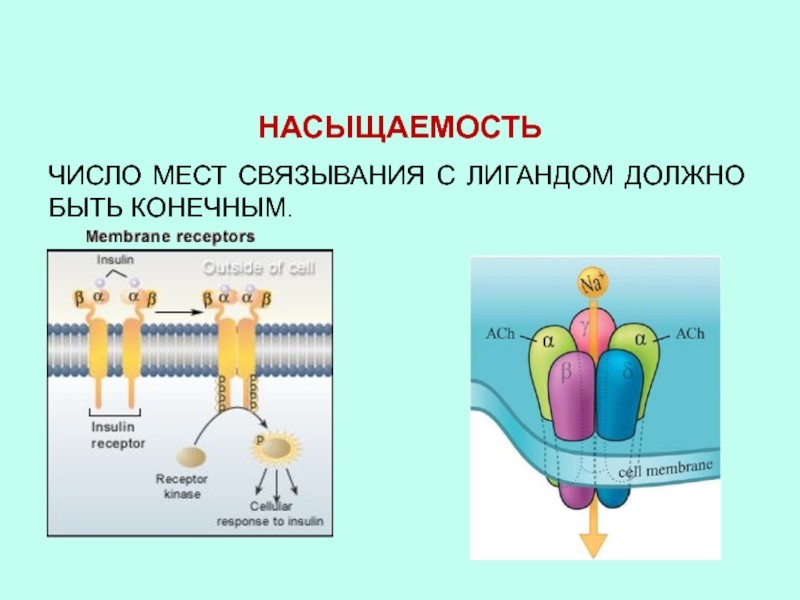
- 42. НАСЫЩАЕМОСТЬЧИСЛО МЕСТ СВЯЗЫВАНИЯ С ЛИГАНДОМ ДОЛЖНО БЫТЬ КОНЕЧНЫМ.
- 43. СРОДСТВО К ЛИГАНДУНАСЫЩЕНИЕ РЕЦЕПТОРА ПРОИСХОДИТ ПРИ ФИЗИОЛОГИЧЕСКИХ
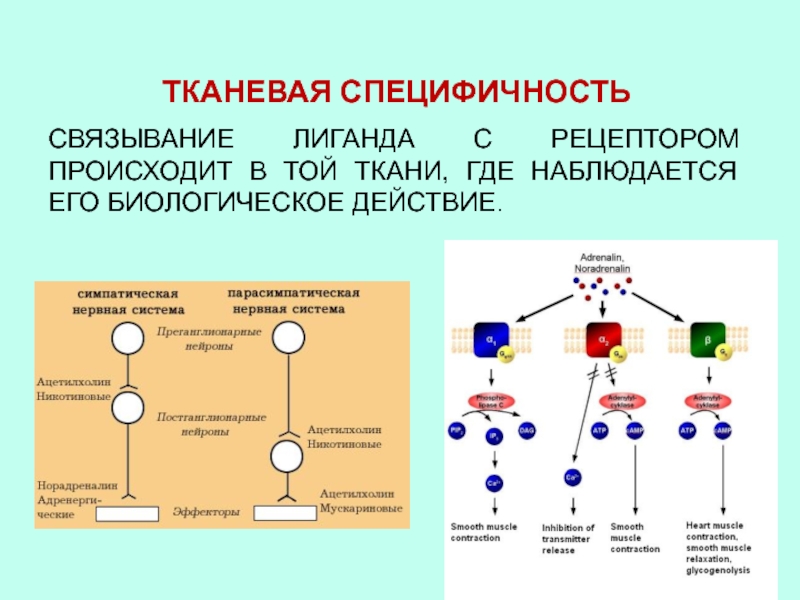
- 44. ТКАНЕВАЯ СПЕЦИФИЧНОСТЬСВЯЗЫВАНИЕ ЛИГАНДА С РЕЦЕПТОРОМ ПРОИСХОДИТ В ТОЙ ТКАНИ, ГДЕ НАБЛЮДАЕТСЯ ЕГО БИОЛОГИЧЕСКОЕ ДЕЙСТВИЕ.
- 45. Скачать презентанцию
СПОСОБЫ РЕГУЛЯЦИИ КЛЕТОЧНОЙ АКТИВНОСТИI.ВЗАИМОДЕЙСТВИЕ МЕТАБОЛИТОВ И КОФАКТОРОВ С ФЕРМЕНТАМИII.ХИМИЧЕСКАЯ МОДИФИКАЦИЯ БЕЛКОВIII.ИЗМЕНЕНИЕ КОМПАРТМЕНТАЛИЗАЦИИ ВЕЩЕСТВ В КЛЕТКЕIV.ТОПОДИНАМИЧЕСКАЯ РЕГУЛЯЦИЯV. ЭКСПРЕССИЯ ГЕНОМАVI.РЕГУЛЯТОРНЫЕ СИСТЕМЫ С УЧАСТИЕМ ВТОРИЧНЫХ ПОСРЕДНИКОВ
Слайды и текст этой презентации
Слайд 2СПОСОБЫ РЕГУЛЯЦИИ КЛЕТОЧНОЙ АКТИВНОСТИ
I.ВЗАИМОДЕЙСТВИЕ МЕТАБОЛИТОВ И КОФАКТОРОВ С ФЕРМЕНТАМИ
II.ХИМИЧЕСКАЯ МОДИФИКАЦИЯ
БЕЛКОВ
УЧАСТИЕМ ВТОРИЧНЫХ ПОСРЕДНИКОВСлайд 3I. ВЗАИМОДЕЙСТВИЕ МЕТАБОЛИТОВ И КОФАКТОРОВ С ФЕРМЕНТАМИ
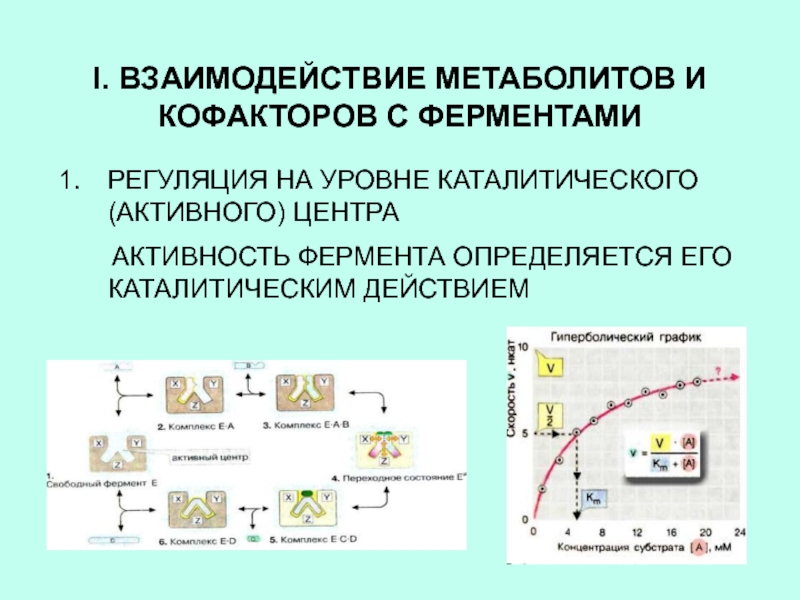
РЕГУЛЯЦИЯ НА УРОВНЕ КАТАЛИТИЧЕСКОГО
(АКТИВНОГО) ЦЕНТРА
АКТИВНОСТЬ ФЕРМЕНТА ОПРЕДЕЛЯЕТСЯ ЕГО КАТАЛИТИЧЕСКИМ ДЕЙСТВИЕМ
Слайд 4ВЗАИМОДЕЙСТВИЕ МЕТАБОЛИТОВ И КОФАКТОРОВ С ФЕРМЕНТАМИ
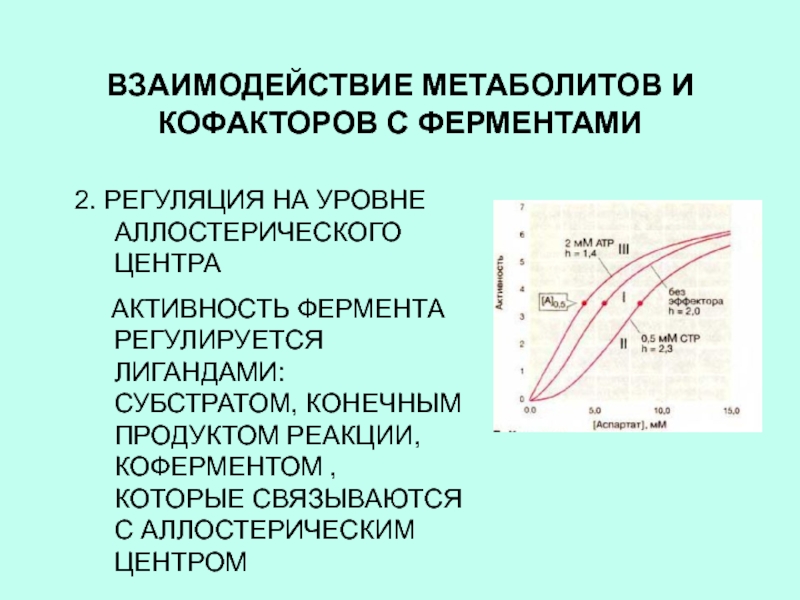
2. РЕГУЛЯЦИЯ НА УРОВНЕ АЛЛОСТЕРИЧЕСКОГО
ЦЕНТРА
АКТИВНОСТЬ ФЕРМЕНТА РЕГУЛИРУЕТСЯ ЛИГАНДАМИ: СУБСТРАТОМ, КОНЕЧНЫМ ПРОДУКТОМ
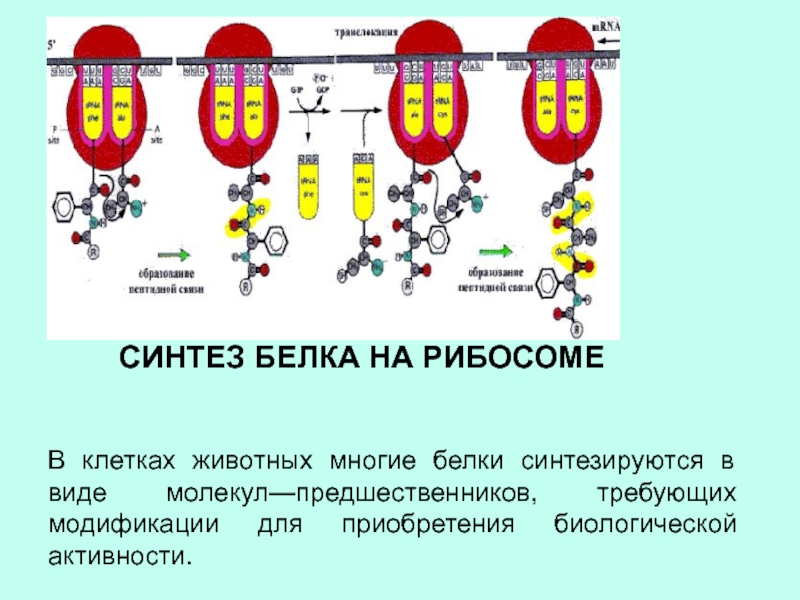
РЕАКЦИИ, КОФЕРМЕНТОМ , КОТОРЫЕ СВЯЗЫВАЮТСЯ С АЛЛОСТЕРИЧЕСКИМ ЦЕНТРОМСлайд 5СИНТЕЗ БЕЛКА НА РИБОСОМЕ
В клетках животных многие белки синтезируются в
виде молекул—предшественников, требующих модификации для приобретения биологической активности.
Слайд 6II. ХИМИЧЕСКАЯ МОДИФИКАЦИЯ БЕЛКОВ
(ПОСТТРАНСЛЯЦИОННАЯ МОДИФИКАЦИЯ БЕЛКОВ)
ковалентные модификации белка
ГИДРОКСИЛИРОВАНИЕ
ГЛИКОЗИЛИРОВАНИЕ
АЦЕТИЛИРОВАНИЕ
МЕТИЛИРОВАНИЕ
ФОСФОРИЛИРОВАНИЕ
ОГРАНИЧЕННЫЙ
ПРОТЕОЛИЗ
Слайд 7ГИДРОКСИЛИРОВАНИЕ - присоединение ОН- к определенным остаткам аминокислот
ПРИМЕР: коллаген
синтезируется в виде проколлагена. Гидроксилирование остатков пролина и лизина проколлагеновых
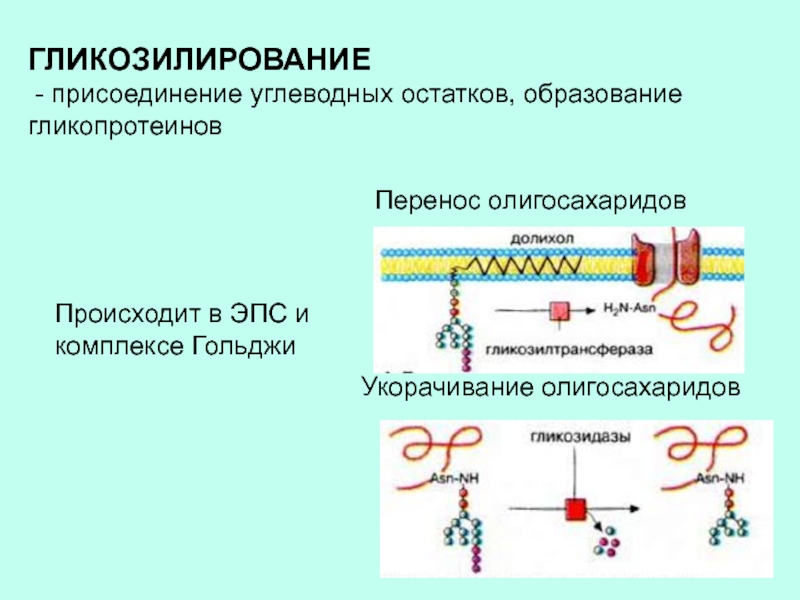
цепей приводит к образованию стабилизирующих перекрестных сшивок. Затем – отщепление концевых пептидов и образование конечного продукта – прочной нерастворимой молекулы коллагена.Слайд 8ГЛИКОЗИЛИРОВАНИЕ
- присоединение углеводных остатков, образование гликопротеинов
Происходит в ЭПС и
комплексе Гольджи
Перенос олигосахаридов
Укорачивание олигосахаридов
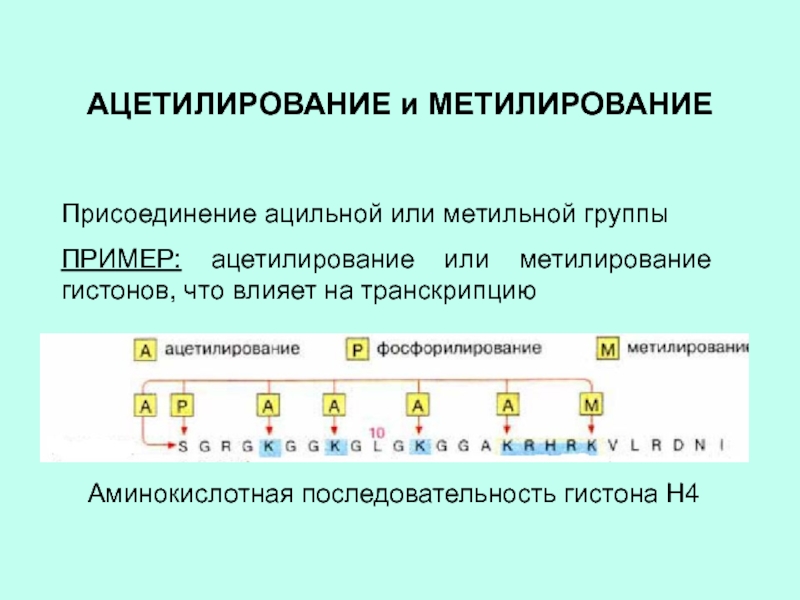
Слайд 9АЦЕТИЛИРОВАНИЕ и МЕТИЛИРОВАНИЕ
Присоединение ацильной или метильной группы
ПРИМЕР: ацетилирование или метилирование
гистонов, что влияет на транскрипцию
Аминокислотная последовательность гистона Н4
Слайд 10
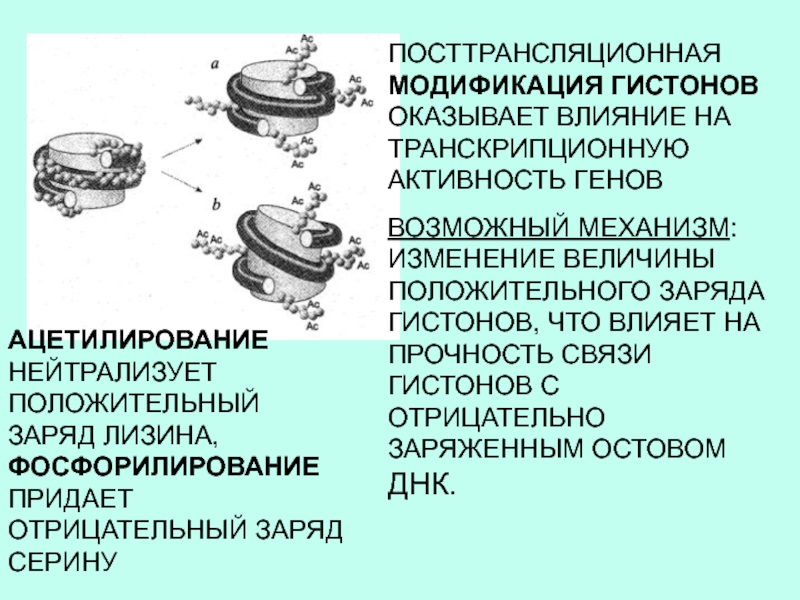
ПОСТТРАНСЛЯЦИОННАЯ МОДИФИКАЦИЯ ГИСТОНОВ ОКАЗЫВАЕТ ВЛИЯНИЕ НА ТРАНСКРИПЦИОННУЮ АКТИВНОСТЬ ГЕНОВ
ВОЗМОЖНЫЙ МЕХАНИЗМ:
ИЗМЕНЕНИЕ ВЕЛИЧИНЫ ПОЛОЖИТЕЛЬНОГО ЗАРЯДА ГИСТОНОВ, ЧТО ВЛИЯЕТ НА ПРОЧНОСТЬ СВЯЗИ
ГИСТОНОВ С ОТРИЦАТЕЛЬНО ЗАРЯЖЕННЫМ ОСТОВОМ ДНК.АЦЕТИЛИРОВАНИЕ НЕЙТРАЛИЗУЕТ ПОЛОЖИТЕЛЬНЫЙ ЗАРЯД ЛИЗИНА, ФОСФОРИЛИРОВАНИЕ ПРИДАЕТ ОТРИЦАТЕЛЬНЫЙ ЗАРЯД СЕРИНУ
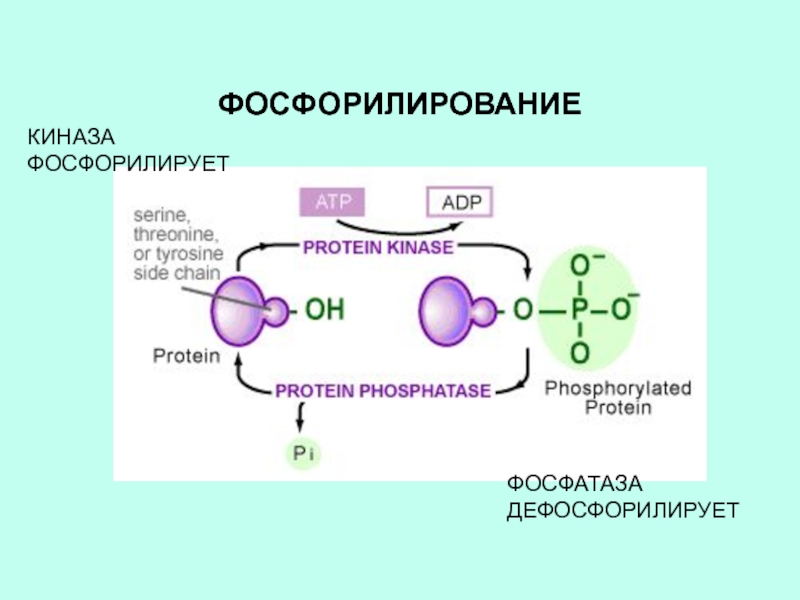
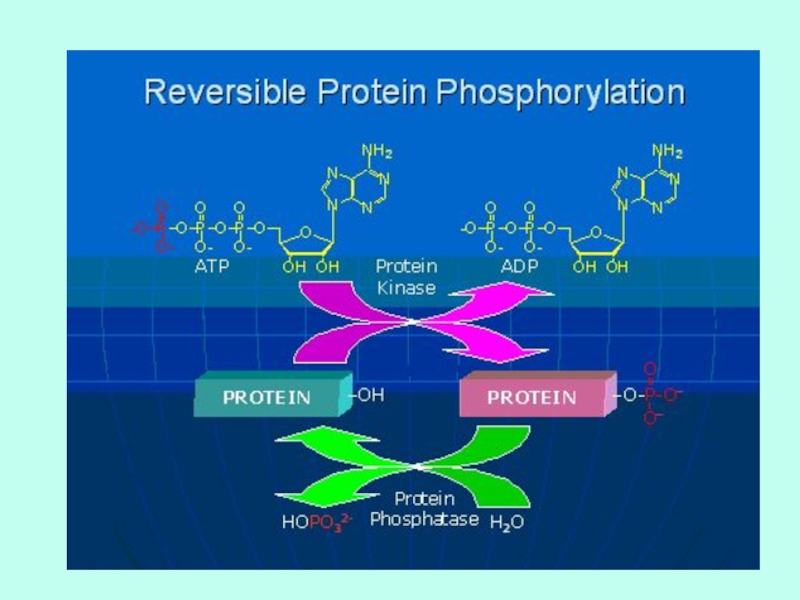
Слайд 11ФОСФОРИЛИРОВАНИЕ
Присоединение фосфатной группы.
Обратимый процесс.
Фосфорилируется остаток серина (треонина) или тирозина.
Несмотря
на большое количество остатков серина (треонина) или тирозина, фосфорилированию избирательно
подвергается их малое (1 – 3) число.В зависимости от конкретного случая более активным может быть либо фосфо- либо дефосфофермент.
Фосфорилированию подвергаются, кроме ферментов, белки транспортных систем, цитоскелета и др.
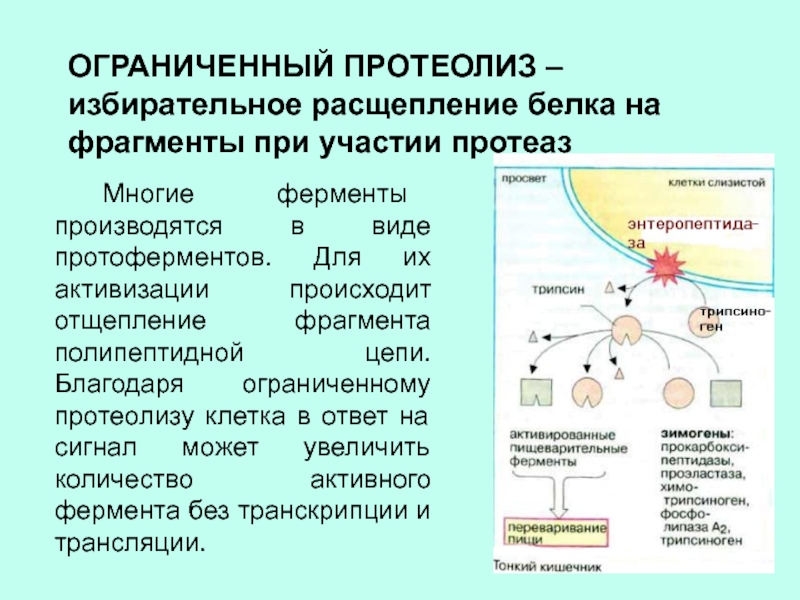
Слайд 14ОГРАНИЧЕННЫЙ ПРОТЕОЛИЗ – избирательное расщепление белка на фрагменты при участии
протеаз
Многие ферменты производятся в виде протоферментов. Для их активизации
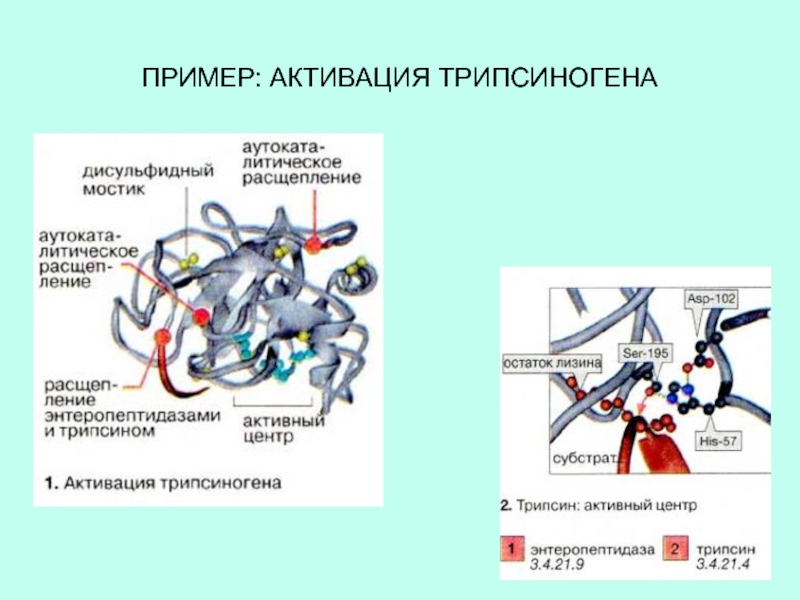
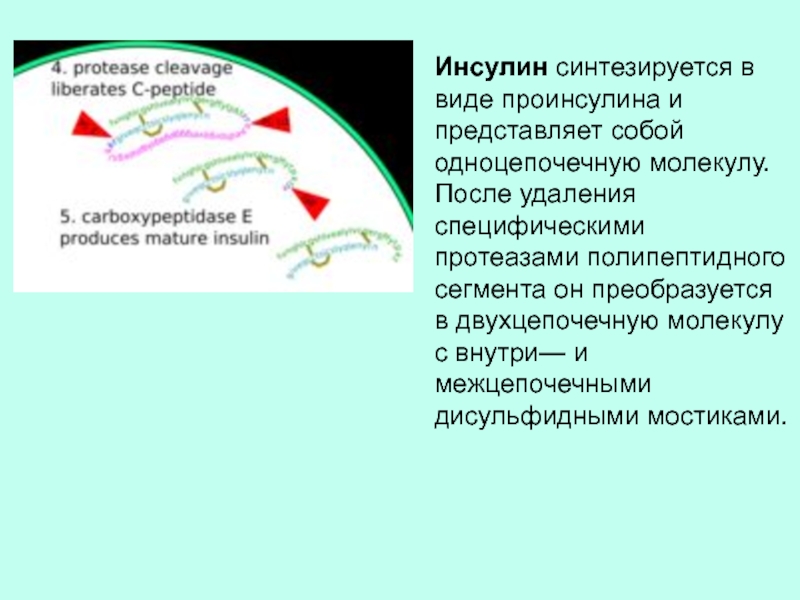
происходит отщепление фрагмента полипептидной цепи. Благодаря ограниченному протеолизу клетка в ответ на сигнал может увеличить количество активного фермента без транскрипции и трансляции.Слайд 16Инсулин синтезируется в виде проинсулина и представляет собой одноцепочечную молекулу.
После удаления специфическими протеазами полипептидного сегмента он преобразуется в двухцепочечную
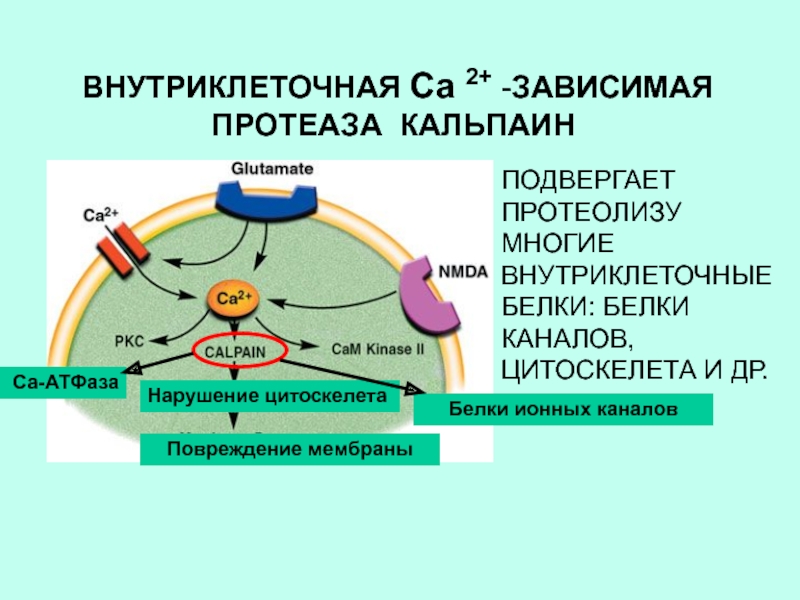
молекулу с внутри— и межцепочечными дисульфидными мостиками.Слайд 17 ВНУТРИКЛЕТОЧНАЯ Са 2+ -ЗАВИСИМАЯ ПРОТЕАЗА КАЛЬПАИН
Нарушение цитоскелета
Повреждение мембраны
ПОДВЕРГАЕТ ПРОТЕОЛИЗУ
МНОГИЕ ВНУТРИКЛЕТОЧНЫЕ БЕЛКИ: БЕЛКИ КАНАЛОВ, ЦИТОСКЕЛЕТА И ДР.
Белки ионных каналов
Са-АТФаза
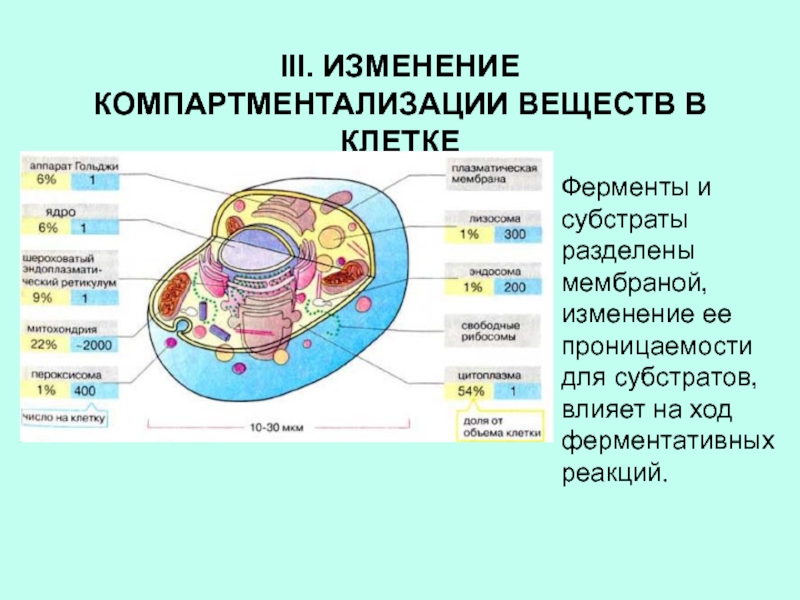
Слайд 18III. ИЗМЕНЕНИЕ КОМПАРТМЕНТАЛИЗАЦИИ ВЕЩЕСТВ В КЛЕТКЕ
Ферменты и субстраты разделены мембраной,
изменение ее проницаемости для субстратов, влияет на ход ферментативных реакций.
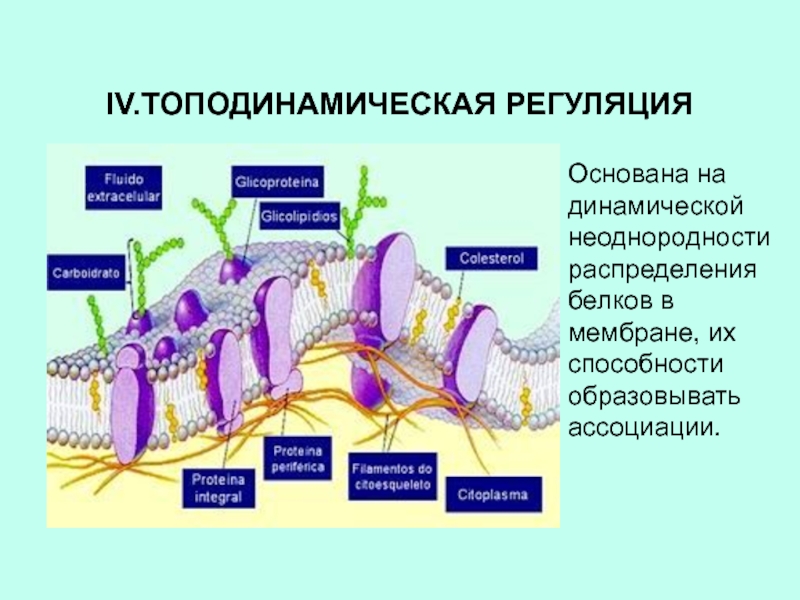
Слайд 19IV.ТОПОДИНАМИЧЕСКАЯ РЕГУЛЯЦИЯ
Основана на динамической неоднородности распределения белков в мембране, их
способности образовывать ассоциации.
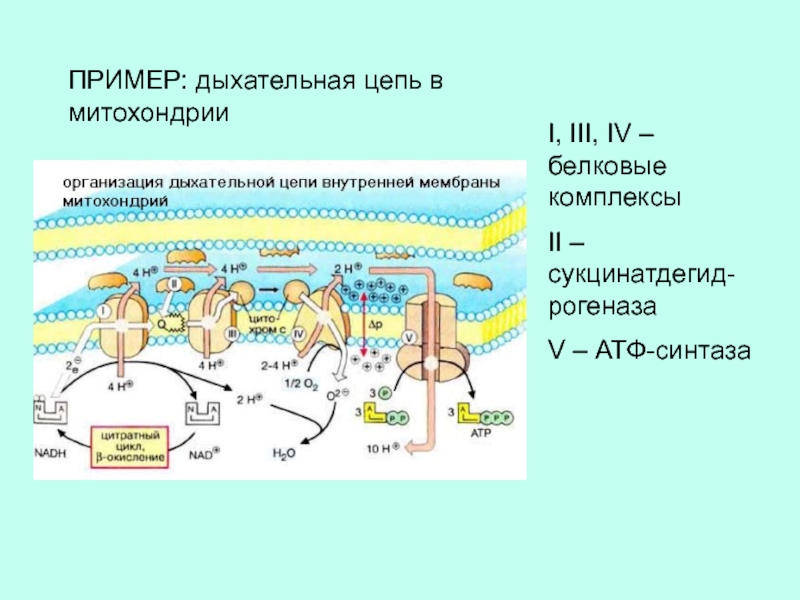
Слайд 20I, III, IV – белковые комплексы
II – сукцинатдегид-рогеназа
V – АТФ-синтаза
ПРИМЕР:
дыхательная цепь в митохондрии
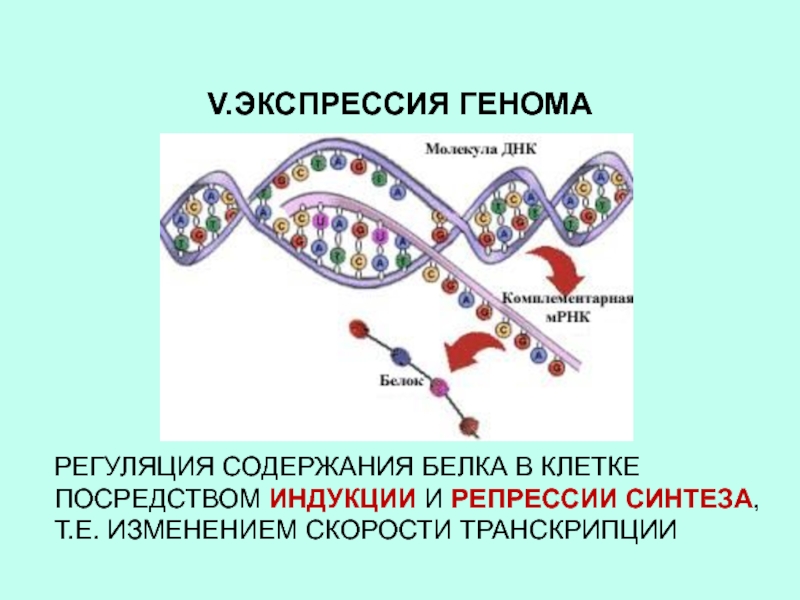
Слайд 21V.ЭКСПРЕССИЯ ГЕНОМА
РЕГУЛЯЦИЯ СОДЕРЖАНИЯ БЕЛКА В КЛЕТКЕ ПОСРЕДСТВОМ ИНДУКЦИИ И РЕПРЕССИИ
СИНТЕЗА, Т.Е. ИЗМЕНЕНИЕМ СКОРОСТИ ТРАНСКРИПЦИИ
Слайд 23Во всех эукариотических клетках экспрессия генов контролируется регуляторными белками, которые
связываются с определенными участками ДНК и стимулируют или подавляют транскрипцию.
Регуляторные
элементы, стимулирующие транскрипцию, называют ЭНХАНСЕРАМИ (от англ. enchance – усиливать ).Белки, подавляющие транскрипцию, называют САЙЛЕНСЕРАМИ (от англ. silence – заглушать)
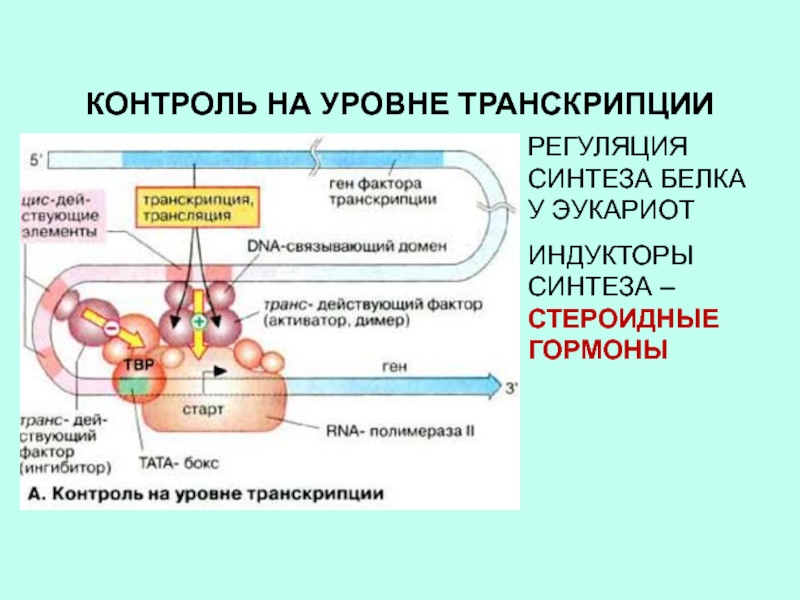
Слайд 24КОНТРОЛЬ НА УРОВНЕ ТРАНСКРИПЦИИ
РЕГУЛЯЦИЯ СИНТЕЗА БЕЛКА У ЭУКАРИОТ
ИНДУКТОРЫ СИНТЕЗА –
СТЕРОИДНЫЕ ГОРМОНЫ
Слайд 25VI. РЕГУЛЯТОРНЫЕ СИСТЕМЫ С УЧАСТИЕМ ВТОРИЧНЫХ ПОСРЕДНИКОВ
КОМПОНЕНТЫ СИСТЕМЫ
ПОСЛЕДОВАТЕЛЬНОСТЬ СОБЫТИЙ
РЕЦЕПТОР
ПРЕОБРАЗОВАТЕЛЬ СИГНАЛА
– G БЕЛОК
ФЕРМЕНТ – УСИЛИТЕЛЬ СИГНАЛА, ОБРАЗУЮЩИЙ ВТОРИЧНЫЕ ПОСРЕДНИКИ
БЕЛОК-ЭФФЕКТОР
ПРОТЕИНКИНАЗА
Слайд 27МЕЖКЛЕТОЧНЫЕ СИГНАЛЬНЫЕ МОЛЕКУЛЫ (ПЕРВИЧНЫЕ ПОСРЕДНИКИ)
НЕБОЛЬШИЕ ЛИПОФИЛЬНЫЕ МОЛЕКУЛЫ
ДИФФУНДИРУЮТ ЧЕРЕЗ МЕМБРАНУ И
СВЯЗЫВАЮТСЯ С ВНУТРИКЛЕТОЧНЫМИ РЕЦЕПТОРАМИ
ЛИПОФИЛЬНЫЕ МОЛЕКУЛЫ
ВЗАИМОДЕЙСТВУЮТ С МЕМБРАННЫМИ РЕЦЕПТОРАМИ
ГИДРОФИЛЬНЫЕ МОЛЕКУЛЫ
ВЗАИМОДЕЙСТВУЮТ С
МЕМБРАННЫМИ РЕЦЕПТОРАМИ1
2
3
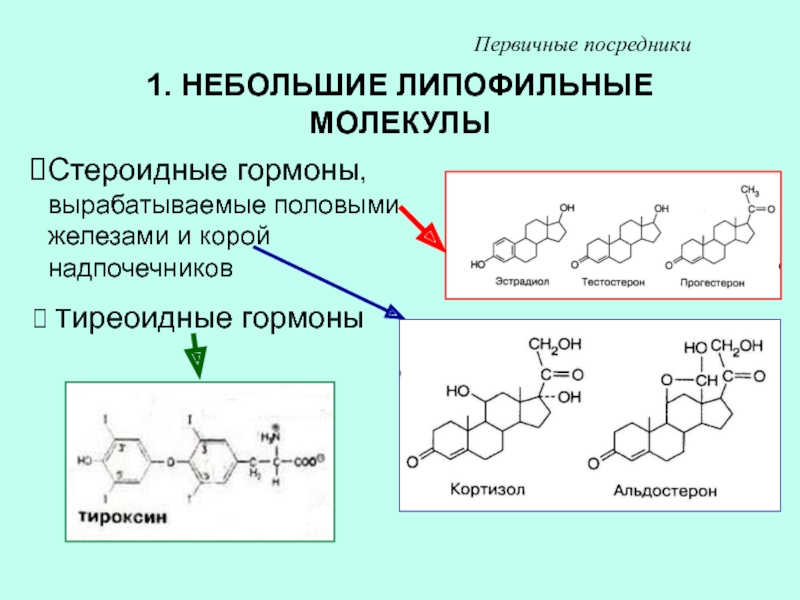
Слайд 281. НЕБОЛЬШИЕ ЛИПОФИЛЬНЫЕ МОЛЕКУЛЫ
Стероидные гормоны, вырабатываемые половыми железами и корой
надпочечников
Тиреоидные гормоны
Первичные посредники
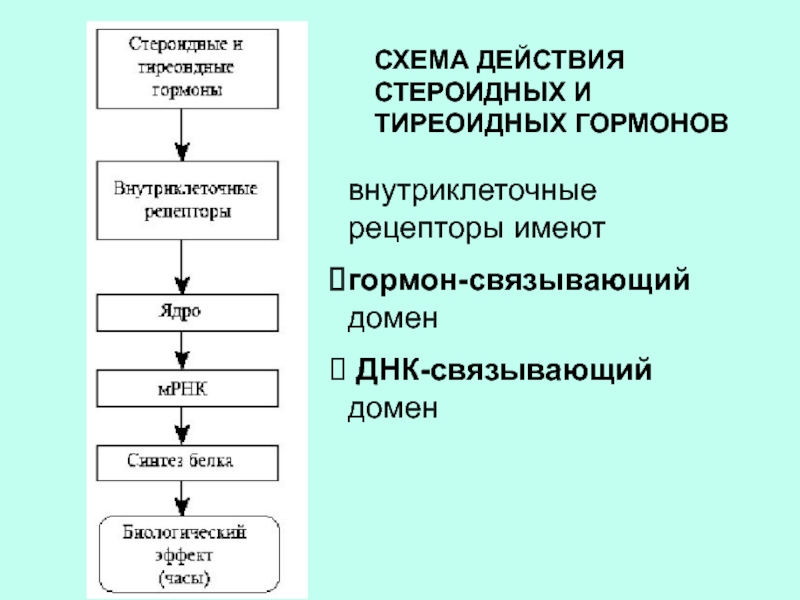
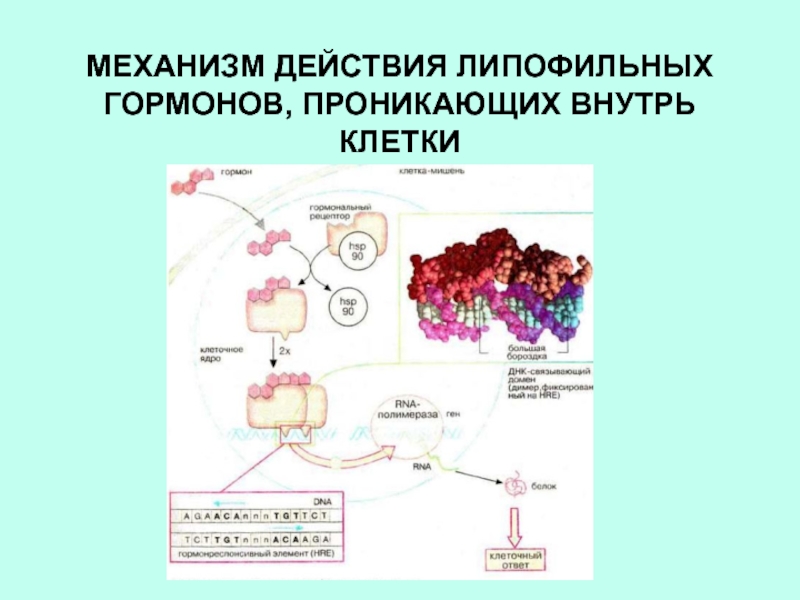
Слайд 29СХЕМА ДЕЙСТВИЯ СТЕРОИДНЫХ И ТИРЕОИДНЫХ ГОРМОНОВ
внутриклеточные рецепторы имеют
гормон-связывающий домен
ДНК-связывающий домен
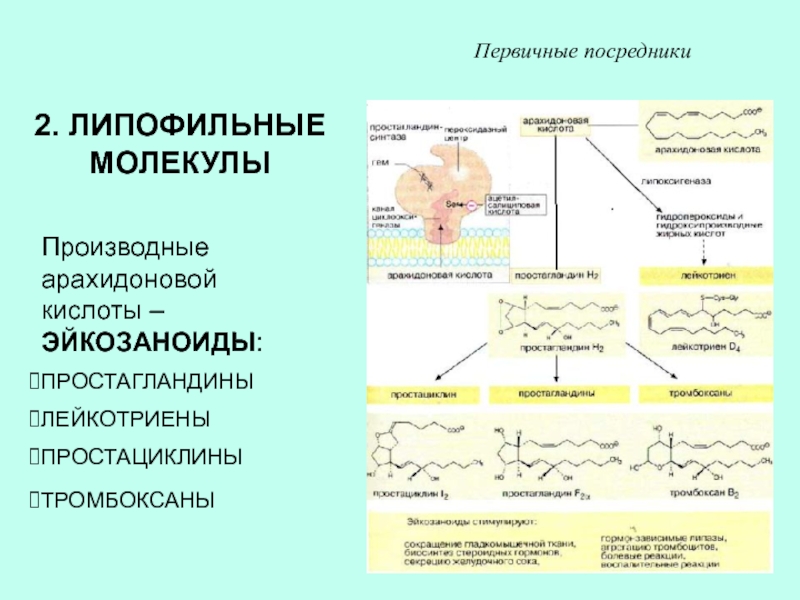
Слайд 322. ЛИПОФИЛЬНЫЕ МОЛЕКУЛЫ
Производные арахидоновой кислоты – ЭЙКОЗАНОИДЫ:
ПРОСТАГЛАНДИНЫ
ЛЕЙКОТРИЕНЫ
ПРОСТАЦИКЛИНЫ
ТРОМБОКСАНЫ
Первичные посредники
Слайд 33ЭЙКОЗАНОИДЫ ОБРАЗУЮТСЯ ПРАКТИЧЕСКИ ВО ВСЕХ КЛЕТКАХ, ИХ БИОСИНТЕЗ ИНИЦИИРУЕТСЯ ФОСФОЛИПАЗОЙ
А2
ДЕЙСТВУЮТ ЧЕРЕЗ МЕМБРАННЫЕ РЕЦЕПТОРЫ, ОСУЩЕСТВЛЯЮТ ПАРАКРИННОЕ И АУТОКРИННОЕ ДЕЙСТВИЕ
ЭЙКОЗАНОИДЫ
РЕГУЛИРУЮТ СОКРАЩЕНИЕ ГЛАДКОМЫШЕЧНЫХ КЛЕТОК
БОЛЕВЫЕ И ВОСПАЛИТЕЛЬНЫЕ РЕАКЦИИ
СЕКРЕЦИЮ ЖЕЛУДОЧНОГО СОКА
АГРЕГАЦИЮ ТРОМБОЦИТОВ И ДР.
Первичные посредники
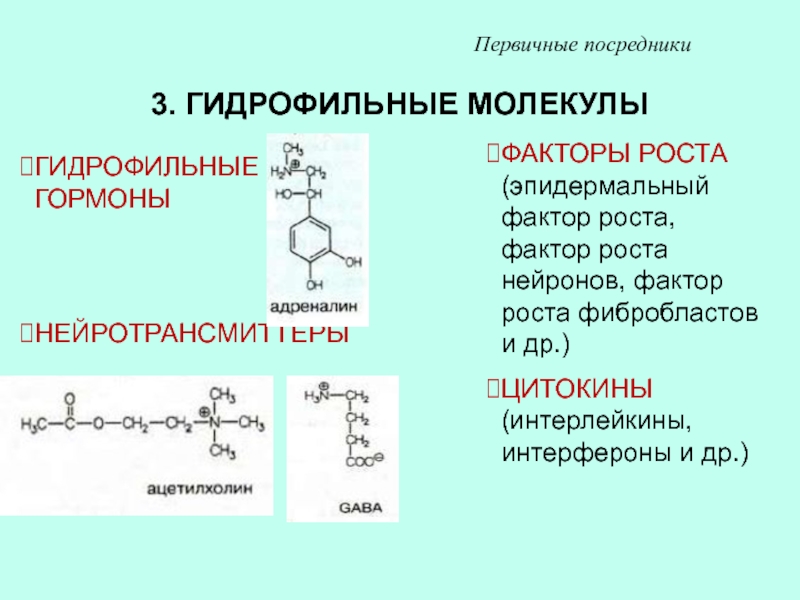
Слайд 343. ГИДРОФИЛЬНЫЕ МОЛЕКУЛЫ
Первичные посредники
ГИДРОФИЛЬНЫЕ ГОРМОНЫ
НЕЙРОТРАНСМИТТЕРЫ
ФАКТОРЫ РОСТА (эпидермальный фактор роста, фактор
роста нейронов, фактор роста фибробластов и др.)
ЦИТОКИНЫ (интерлейкины, интерфероны и
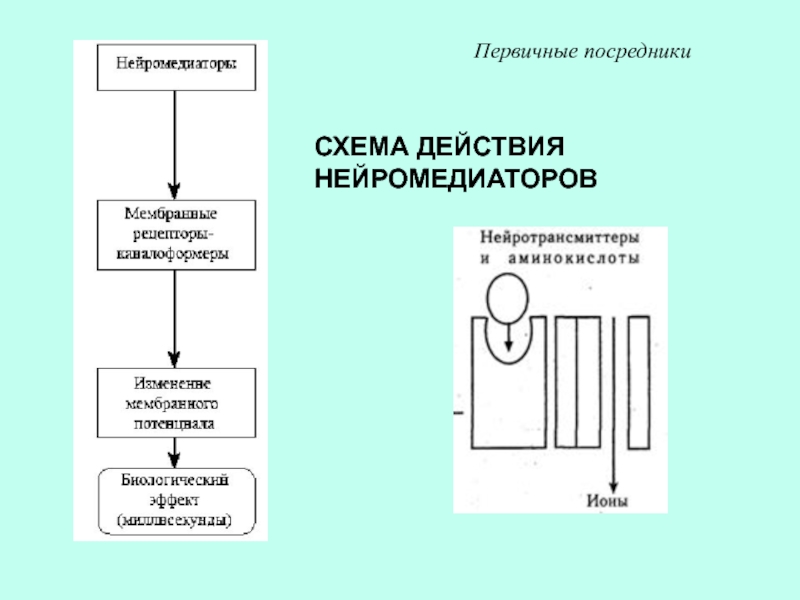
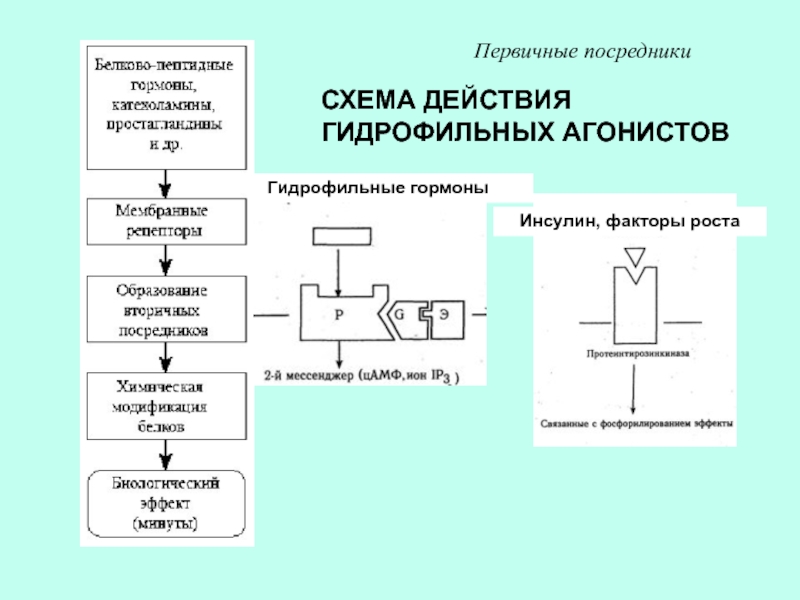
др.)Слайд 36СХЕМА ДЕЙСТВИЯ ГИДРОФИЛЬНЫХ АГОНИСТОВ
Первичные посредники
Гидрофильные гормоны
Инсулин, факторы роста
Слайд 38РЕЦЕПТОР –СПЕЦИФИЧЕСКИЙ БЕЛОК, КОТОРЫЙ СВЯЗЫВАЕТ СИГНАЛЬНОЕ ВЕЩЕСТВО, ЧТО ПРИВОДИТ В
КОНЕЧНОМ ИТОГЕ К РАЗВИТИЮ КЛЕТОЧНОЙ РЕАКЦИИ.
АГОНИСТ ПЕРЕВОДИТ РЕЦЕПТОР В
АКТИВНОЕ СОСТОЯНИЕ, АНТАГОНИСТ – В НЕАКТИВНОЕ.Слайд 40СЕЛЕКТИВНОСТЬ
СВОЙСТВО, ОСНОВАННОЕ НА СТРОГОЙ СТРУКТУРНОЙ СПЕЦИФИЧНОСТИ. ДАННЫЙ ЛИГАНД ДОЛЖЕН
БЫТЬ ЛИБО ЕДИНСТВЕННЫМ ВЕЩЕСТВОМ, СВЯЗЫВАЮЩИМСЯ С РЕЦЕПТОРОМ, ЛИБО ЭФФЕКТИВНО КОНКУРИРОВАТЬ
С ДРУГИМИ.Слайд 43СРОДСТВО К ЛИГАНДУ
НАСЫЩЕНИЕ РЕЦЕПТОРА ПРОИСХОДИТ ПРИ ФИЗИОЛОГИЧЕСКИХ КОНЦЕНТРАЦИЯХ ЛИГАНДА
АКТГ
— 0-50 пг/мл
Тироксин общий (Т4) —62-141 нмоль/л
Кальцитонин — 5,5-28 пмоль/л.
Данные приведены для плазмы крови