Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Регуляція ферментативної активності
Содержание
- 1. Регуляція ферментативної активності
- 2. Негативна кооперативністьЗменшення спорідненості - антикооперативністьСиметричні субодиниці –
- 3. Реакційна здатність половини зв’язуючих центрів
- 4. Кількісний аналіз кооперативності рівняння ХіллаН – коефіцієнт Хілла – нахил кривої в області напівнасичення (Y=0,5)
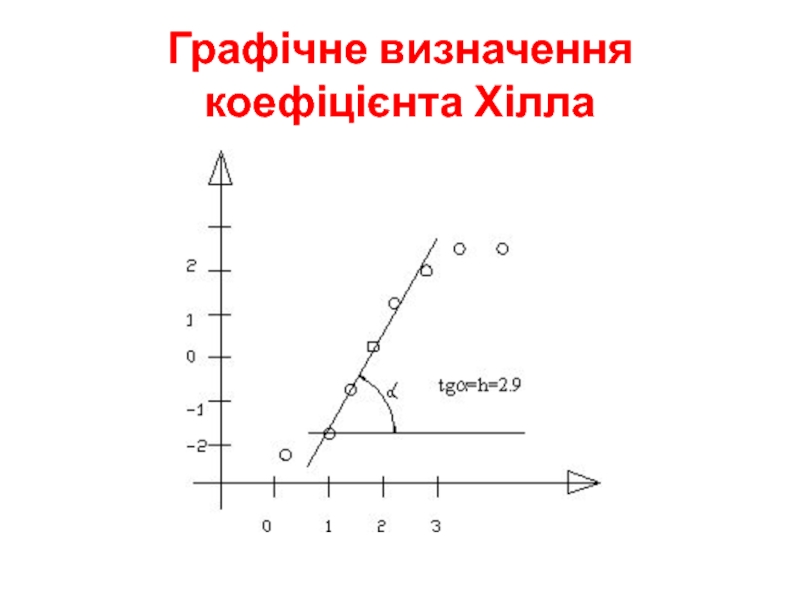
- 5. Графічне визначення коефіцієнта Хілла
- 6. Крива зв’язування для моделі узгодженої взаємодії (
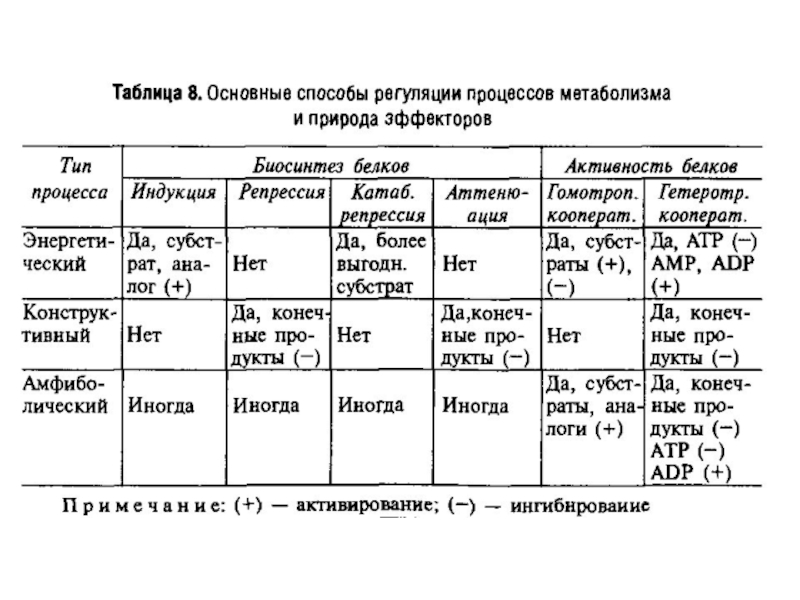
- 7. Алостеричні константи для деяких білків
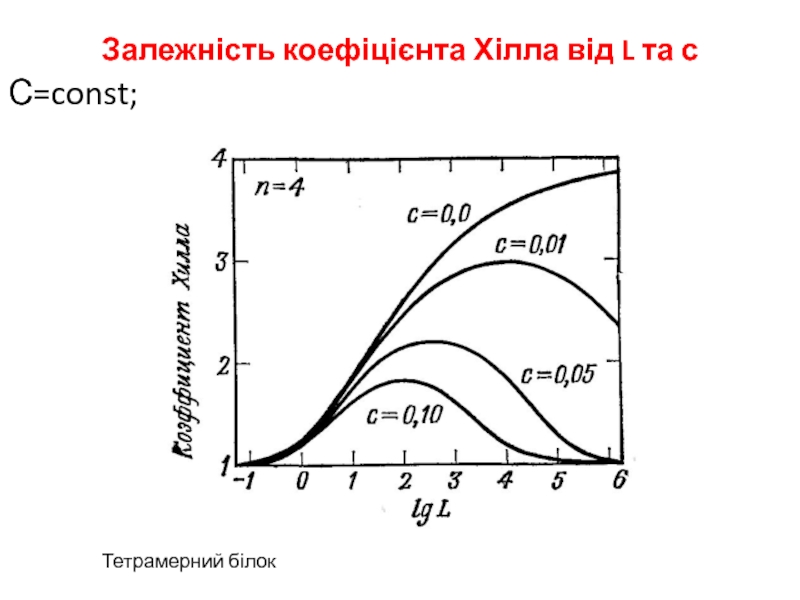
- 8. Залежність коефіцієнта Хілла від L та сС=const; Тетрамерний білок
- 9. Крива зв’язування для моделі послідовної взаємодії (
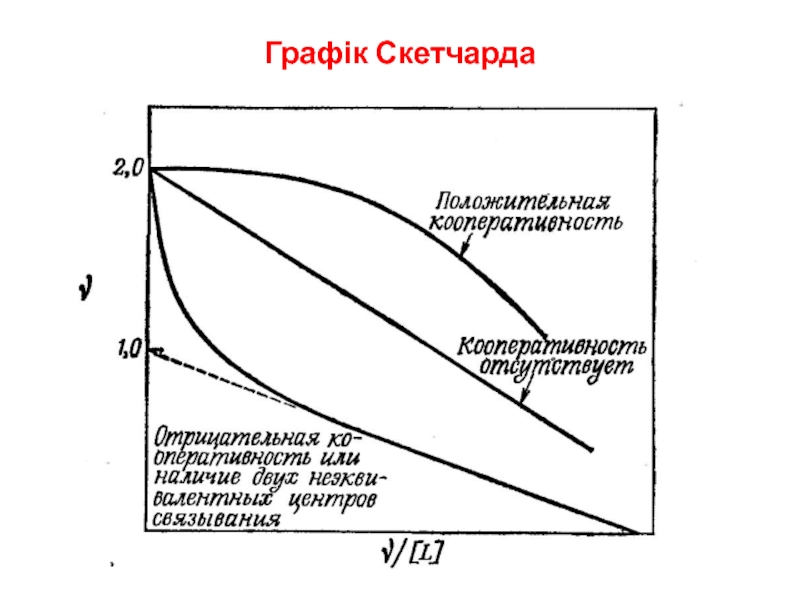
- 10. Графік Скетчарда
- 11. Регуляція ферментативної активності шляхом нековалентного зв’язування з ефекторамиРегуляція субстратомГомотропна кооперативність:ПозитивнаНегативна Регуляція ефекторами, відмінними від субстратуГетеротропна кооперативністьПозитивнанегативна
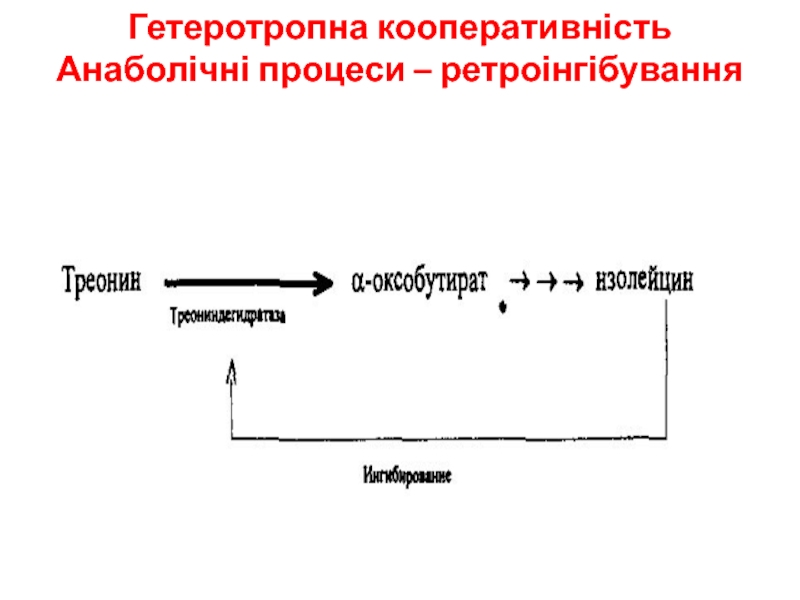
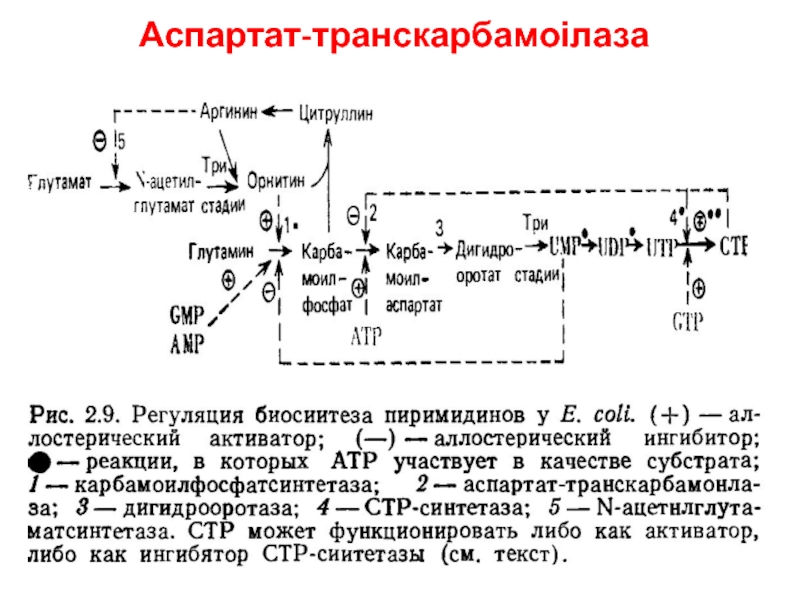
- 12. Гетеротропна кооперативність Анаболічні процеси – ретроінгібування
- 13. Аспартат-транскарбамоілаза
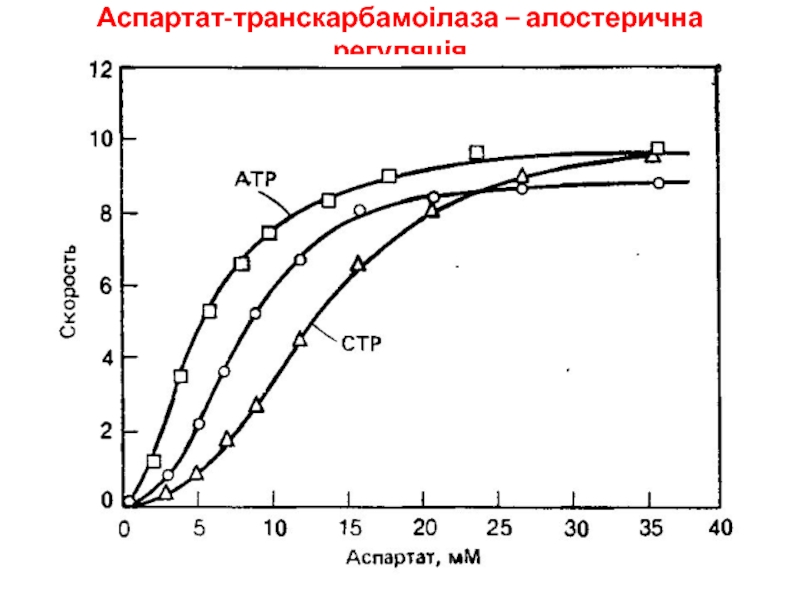
- 14. Аспартат-транскарбамоілаза – алостерична регуляція
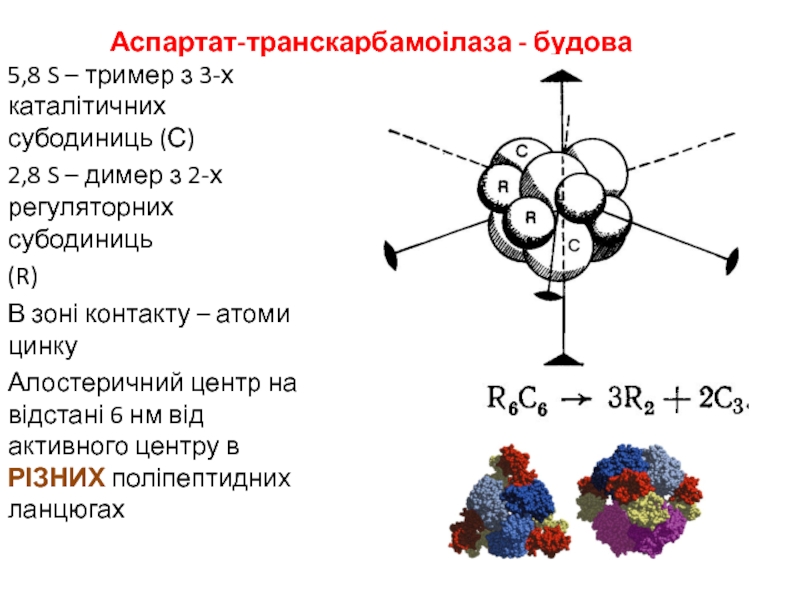
- 15. Аспартат-транскарбамоілаза - будова5,8 S – тример з
- 16. Аспартат-транскарбамоілаза
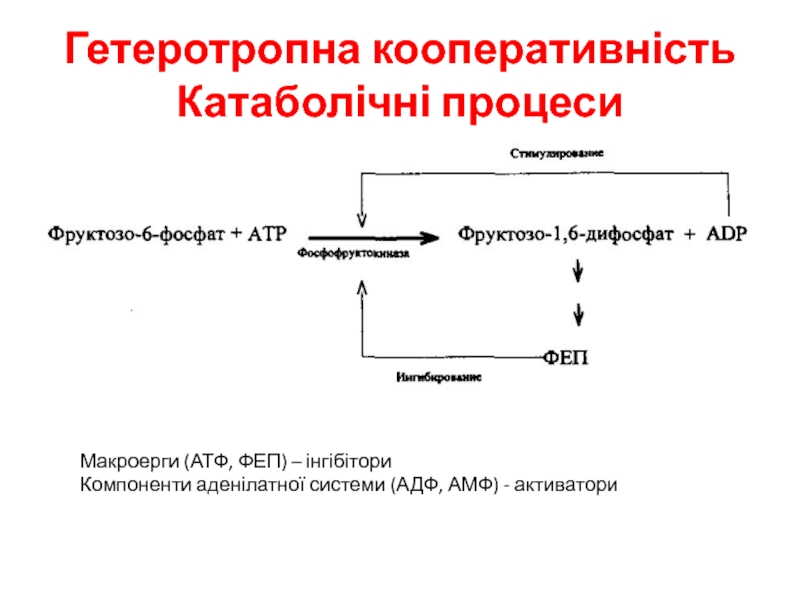
- 17. Гетеротропна кооперативність Катаболічні процесиМакроерги (АТФ, ФЕП) – інгібіториКомпоненти аденілатної системи (АДФ, АМФ) - активатори
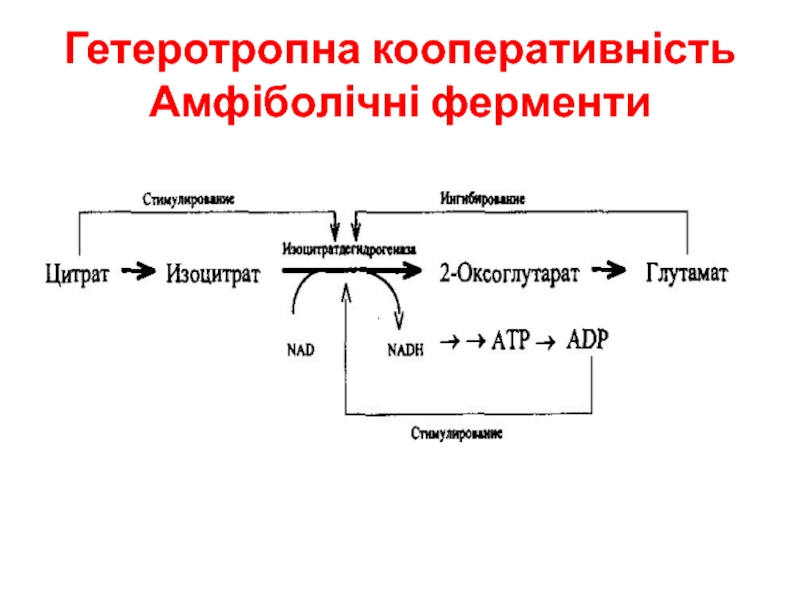
- 18. Гетеротропна кооперативність Амфіболічні ферменти
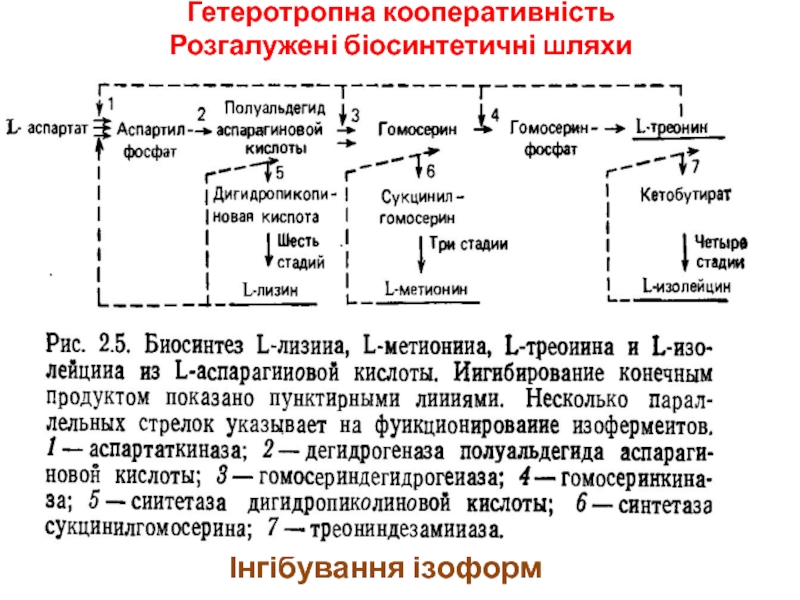
- 19. Гетеротропна кооперативність Розгалужені біосинтетичні шляхиІнгібування ізоформ
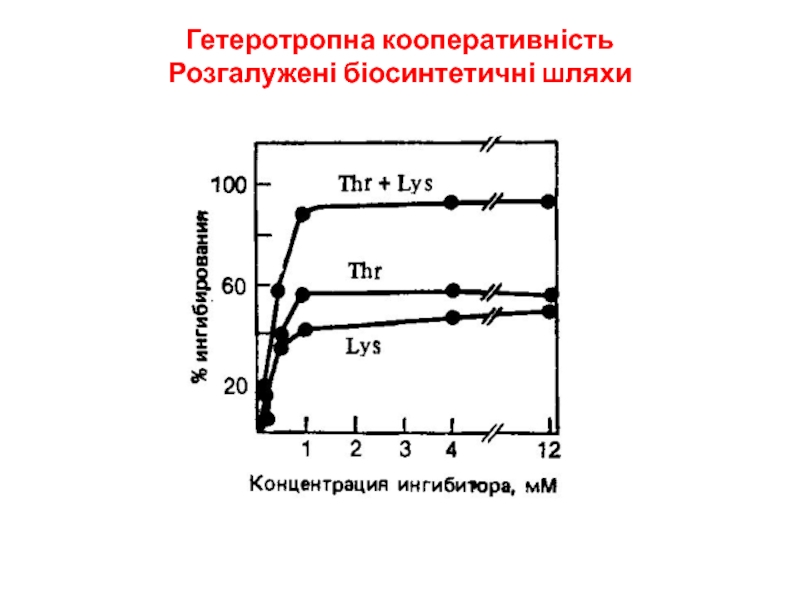
- 20. Гетеротропна кооперативність Розгалужені біосинтетичні шляхи
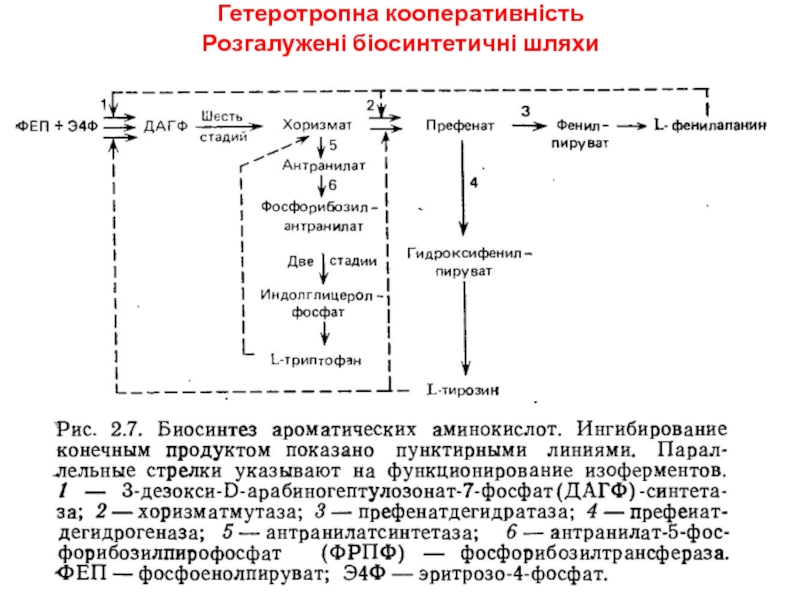
- 21. Гетеротропна кооперативність Розгалужені біосинтетичні шляхи
- 22. Гетеротропна кооперативність Розгалужені біосинтетичні шляхиаспартаткіназа В. polymyxa, B.subtilis - мультивалентне інгібування (лише треонін+лізин)
- 23. Слайд 23
- 24. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Регуляція ферментативної активності
Негативна кооперативність.
Кількісний аналіз кооперативності:
Рівняння Хіла
Використання гетеротропної кооперативності у
внутрішьоклітинних метаболічних шляхах.
Слайд 2Негативна кооперативність
Зменшення спорідненості - антикооперативність
Симетричні субодиниці – лише модель Кошланда
Н.:
Гліцеральдегід-3-фосфат-дегідрогеназа
(костанта
дисоціації зв’язування 4 молей НАД+: 10-11→ 10-9 → 3*10-9 →
3*10-9 )Реакційна здатність половини зв’язуючих центрів
Передіснуюча асиметрія – ідентичні субодиниці не займають рівноцінні позиції
тирозил-тРНК-синтетаза (зв’язування 1 моля тирозину з 2-х теоретично можливих)
Слайд 4Кількісний аналіз кооперативності
рівняння Хілла
Н – коефіцієнт Хілла – нахил кривої
в області напівнасичення (Y=0,5)
Слайд 6Крива зв’язування для моделі узгодженої взаємодії ( модель Моно)
KR -
константа дисоціації для ліганду з R-формою ферменту
KT - константа
дисоціації для ліганду з Т-формою ферменту L – алостерична константа;
Rx ,Tx - R та,T стан з x приєднаними молекулами ліганду
безрозмірна концентрація субстрату
Слайд 9Крива зв’язування для моделі послідовної взаємодії ( модель Кошланда)
Численні константи
дисоціації для ліганду з різними формами ферменту – не обчислюється
!!!Слайд 11Регуляція ферментативної активності шляхом нековалентного зв’язування з ефекторами
Регуляція субстратом
Гомотропна кооперативність:
Позитивна
Негативна
Регуляція ефекторами, відмінними від субстрату
Гетеротропна кооперативність
Позитивна
негативна
Слайд 15Аспартат-транскарбамоілаза - будова
5,8 S – тример з 3-х каталітичних субодиниць
(С)
2,8 S – димер з 2-х регуляторних субодиниць
(R)
В зоні контакту
– атоми цинкуАлостеричний центр на відстані 6 нм від активного центру в РІЗНИХ поліпептидних ланцюгах