Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Рекомендации по оформлению развёрнутых ответов на задания ЕГЭ по химии
Содержание
- 1. Рекомендации по оформлению развёрнутых ответов на задания ЕГЭ по химии
- 2. Задания с развернутым ответом в структуре контрольных
- 3. Задания 30Задания 30 ориентированы на проверку следующих
- 4. Задание 30
- 5. Составление электронного баланса:правильно указаны степени окисления элемента-окислителя
- 6. Задание выполнено полностью правильно.Оценка: 3 балла.Пример 1KNO2
- 7. K2Cr2O7
- 8. 2. Указаны окислитель и восстановитель (1 балл):-
- 9. В качестве окислителя выбран не дихромат, а
- 10. В качестве окислителя выбран оксид хрома(IV). Электронный
- 11. Электронный баланс не составлен. Окислитель и восстановитель
- 12. При составлении электронного баланса допущена ошибка (запись
- 13. Выбрана щелочная среда и Cr2O3 в качестве
- 14. Указаны окислитель и восстановитель. Определены недостающие веществаи
- 15. Единых требований к оформлению ответа на это
- 16. Неверно составлен электронный баланс; указание окислителя и
- 17. Удвоены коэффициенты в уравнении реакции. Однако оснований для снижения оценки нет.Оценка: 3 балла
- 18. Задание 31Выполнение этих заданий предполагает запись четырёх
- 19. ЗаданиЗЗЗЗЗе
- 20. Опираемся на знания:кислотно-основное взаимодействие;реакции ионного обмена;окислительно-восстановительные реакции;комплексообразование
- 21. Каждый из четырёх элементов ответа считать верным
- 22. Задание 31Хлорид алюминия нагрели с калием. Полученный
- 23. Верно записаны 4 уравнения реакций.Оценка: 4 балла.
- 24. Верно записаны 4 уравнения реакций.Оценка: 4 балла.
- 25. При электролизе водного раствора нитрата меди(II) получили
- 26. Верно написаны 2, 3 и 4 уравнения реакций.Оценка: 3 балла
- 27. Уравнение 1- пропущен коэффициент перед формулой нитрата
- 28. характерные химические свойства органических веществ различных классовгенетическая
- 29. В ответе экзаменуемого допустимо использование структурных формул
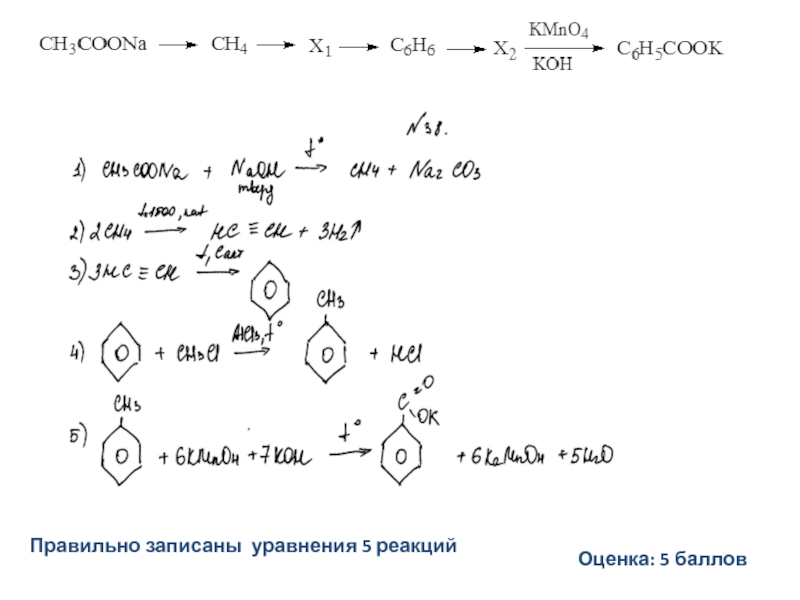
- 30. Напишите уравнения реакций, с помощью которых можно
- 31. Допускается запись уравненияC6H5COONa + NaOH → C6H6 + Na2CO3Допускается запись(без указания условий реакции) Не допускается запись:
- 32. Не допускается отсутствие одного из продуктов (HCl)Допускается
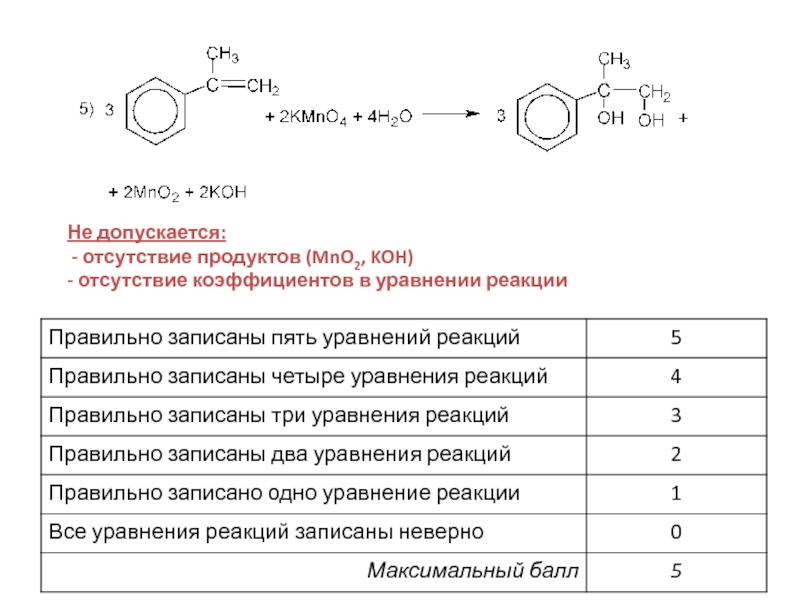
- 33. Не допускается: - отсутствие продуктов (MnO2, KOH)- отсутствие коэффициентов в уравнении реакции
- 34. Слайд 34
- 35. Правильно записаны уравнения 5 реакцийПример 1Оценка: 5 баллов
- 36. Пример 4Оценка: 0 балловЗадание 32-1
- 37. Задание 33 Критерии оценивания
- 38. Задание 33
- 39. Слайд 39
- 40. Работа 1Уравнения р-ций – 1 б.Не использованы
- 41. Работа 2Уравнения р-ций – 1 б.Данные условия
- 42. Задание 34
- 43. Задание 34
- 44. Задание 34
- 45. Работа 8Вычисления проведены неверно – 0 б.Молекулярная
- 46. Задание 34
- 47. Задание 34
- 48. Работа 10Вычисления проведены верно – 1 б.Молекулярная
- 49. Работа 11Вычисления проведены неверно – 0 б.Молекулярная
- 50. Благодарю за внимание! Успеха в работе! gadzhibekova.selfinaz@bk.ru
- 51. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Рекомендации по оформлению развёрнутых ответов на задания
ЕГЭ по химии
Учитель
МБОУ Школа № 17
Слайд 2Задания с развернутым ответом в структуре контрольных измерительных материалов для
единого государственного экзамена 2017 года по химии
Задания с развернутым
ответом:предусматривают комплексную проверку усвоения на высоком уровне сложности нескольких (двух и более) элементов содержания из различных содержательных блоков курса по общей, неорганической и органической химии;
ориентированы на проверку умений, отвечающих требованиям образовательного стандарта углубленного уровня:
объяснять обусловленность свойств и применения веществ их составом и строением; характер взаимного влияния атомов в молекулах органических соединений; взаимосвязь неорганических и органических веществ; сущность и закономерность протекания изученных типов реакций;
проводить комбинированные расчеты по химическим уравнениям
Слайд 3Задания 30
Задания 30 ориентированы на проверку следующих умений:
определять степень
окисления химических элементов, окислитель и восстановитель;
прогнозировать продукты окислительно-восстановительных реакций,
в том числе с учетом характера среды (кислой, щелочной, нейтральной)составлять уравнения окислительно-восстановительных реакций;
составлять электронный баланс, на его основе расставлять коэффициенты в уравнениях реакций.
Слайд 5Составление электронного баланса:
правильно указаны степени окисления элемента-окислителя и элемента-восстановителя;
указаны (знаками
+ и –) процессы принятия и отдачи электронов;
определены соотношения количеств
элементов (коэффициенты); Примечание:
- степень окисления 0 может быть не указана экзаменуемым;
- если с.о. не указана, то считать её равной 0;
- наличие в ответе экзаменуемого взаимоисключающих суждений или обозначений следует рассматривать как факт несформированности умения применять данные знания (например, знаки «+» и «–» в записи электронного баланса не соответствуют природе окислителя или восстановителя).
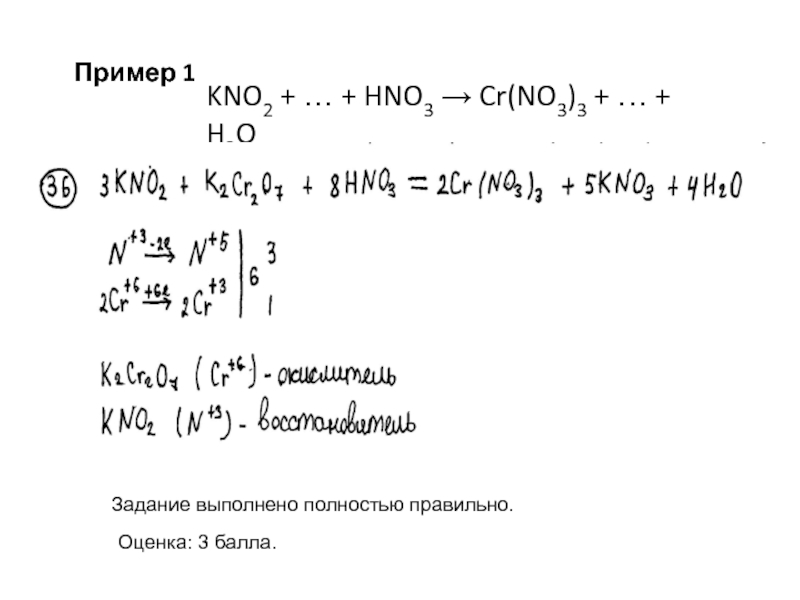
Слайд 6Задание выполнено полностью правильно.
Оценка: 3 балла.
Пример 1
KNO2 + … +
HNO3 Cr(NO3)3 + … + H2O
Слайд 7 K2Cr2O7 + KBr +
H2SO4 → Cr2(SO4)3 + Br2 + …
2Cr+6 + 6ē →
2Cr+32Br-1 - 2ē → Br2
или
Cr+6 + 3ē → Cr+3
Br- - ē → Br0
или
2Cr+6 + 6ē → 2Cr+3
2Br- - 2ē → 2Br
3
1
3
1
Допустимы записи:
Недопустима запись:
Cr2
+3
+ 6ē → 2Cr+3
3
1
Количество принятых и отданных электронов может быть указано над стрелкой.
Слайд 82. Указаны окислитель и восстановитель (1 балл):
- окислитель и восстановитель
могут быть обозначены даже одной буквой («В» или «О»), поскольку
согласно условию задания не требуется указание процессов окисления и восстановления.Примечание. В качестве окислителя и восстановителя допустимо указывать как элементы в соответствующей строчке электронного баланса, так и формулы веществ.
3. Составлено уравнение реакции (1 балл):
- правильно определены формулы недостающих в схеме реакции веществ;
- расставлены все коэффициенты (допустимо использование дробных и удвоенных коэффициентов)
Слайд 9В качестве окислителя выбран не дихромат, а хромат калия. Задание
выполнено полностью правильно.
Оценка: 3 балла.
KNO2 + … + HNO3
Cr(NO3)3 + … + H2OСлайд 10В качестве окислителя выбран оксид хрома(IV). Электронный баланс составлен; определены
окислитель и восствновитель. Не расставлены стехиометрические коэффициенты в уравнении реакции.
Оценка:
2 балла.KNO2 + … + HNO3 Cr(NO3)3 + … + H2O
Слайд 11Электронный баланс не составлен. Окислитель и восстановитель определены. Не расставлены
стехиометрические коэффициенты в уравнении реакции.
Оценка: 1 балл.
KNO2 + … +
HNO3 Cr(NO3)3 + … + H2OСлайд 12При составлении электронного баланса допущена ошибка (запись Cr2+3). Окислитель и
восствновитель определены. Коэффициенты в уравнении реакции расставлены.
Оценка: 2 балла.
KNO2 +
CrSO4 + … → N2 + … + K2SO4 + H2OСлайд 13Выбрана щелочная среда и Cr2O3 в качестве продукта реакции (при
определении продукта не учтен характер среды). Окислитель и восствновитель определены.
Составлен электронно-ионный баланс.
Оценка: 2 балла.
KNO2 + CrSO4 + … → N2 + … + K2SO4 + H2O
2KNO2 + 6CrSO4 + 4H2SO4 = N2 + 3Cr2(SO4)3 + K2SO4 + 4H2O
Слайд 14Указаны окислитель и восстановитель. Определены недостающие веществаи расставлены коэффициенты в
уравнении реакции. Электронный баланс составлен неверно.
Оценка: 2 балла.
NH3 + …
+ H2SO4 N2 + MnSO4 + … + H2O10NH3 + 6KMnO4 + 9H2SO4 = 5N2 + 6MnSO4 + 3K2SO4 + 24H2O
Слайд 15Единых требований к оформлению ответа на это задание не предъявляется.
Оценка:
3 балла.
PCl3 + HNO3 + ... → NO + HCl
+ ...3PCl3 + 2HNO3 + 8H2O = 3H3PO4 + 9HCl + 2NO
Слайд 16Неверно составлен электронный баланс;
указание окислителя и восстановителя записано неграмотно,
но это не может быть основанием к снижению оценки.
Оценка: 2
балла.K2MnO4 + … → MnBr2 + Br2 + … + H2O
Слайд 17Удвоены коэффициенты в уравнении реакции. Однако оснований для снижения оценки
нет.
Оценка: 3 балла
Слайд 18Задание 31
Выполнение этих заданий предполагает запись четырёх уравнений реакций, описание
которых представлено в условии задания.
Обрашаем внимание на то, что
наличие в ответе большего количества уравнений будет считаться ошибкой. Рассмотрим примеры заданий и прокомментируем их выполнение. Слайд 20Опираемся на знания:
кислотно-основное взаимодействие;
реакции ионного обмена;
окислительно-восстановительные реакции;
комплексообразование (на примере гидроксокомплексов
цинка и алюминия);
гидролиз (бинарных соединений, совместный гидролиз);
электролиз расплавов и растворов
солей, оксида алюминия.Слайд 21Каждый из четырёх элементов ответа считать верным если:
правильно записаны все
формулы веществ − участников реакции;
указаны все коэффициенты (допустимо использование дробных
и удвоенных коэффициентов);Примечание.
При составлении уравнения реакции экзаменуемый может:
не указывать условие ее проведения (прокаливание, катализатор), так как они указаны в условии задания;
- не использовать обозначения осадка «↓» или газа «↑»
Слайд 22Задание 31
Хлорид алюминия нагрели с калием. Полученный в результате металл
поместили в раствор гидроксида калия. Через получившийся при этом раствор
пропустили углекислый газ, в результате наблюдали выпадение белого осадка. К оставшемуся после отделения осадка раствору добавили раствор сульфата железа(III). Напишите уравнения четырёх описанных реакций.1) AlCl3 + 3K = 3KCl + Al
2) 2Al + 2KOH + 3H2O = 2K[Al(OH)4] + 3H2 (возможно образование K3[Al(OH)6])
3) 2K[Al(OH)4] + CO2 = 2Al(OH)3 + K2CO3 + H2O (допустимо образование KHCO3)
4) 3K2CO3 + Fe2(SO4)3 + 3H2O = 2Fe(OH)3 + 3CO2 + 3K2SO4 (допустимо написание уравнения реакции с KHCO3)
Слайд 25При электролизе водного раствора нитрата меди(II) получили металл. Металл обработали
концентрированной серной кислотой при нагревании. Выделившийся в результате газ прореагировал
с сероводородом с образованием простого вещества. Это вещество нагрели с концентрированным раствором гидроксида калия. Напишите уравнения четырёх описанных реакций.1) 2Cu(NO3)2 + 2H2O = 2Cu + 4HNO3 + O2 (электролиз)
2) Cu + 2H2SO4(конц.) = CuSO4 + SO2↑ + 2H2O
3) SO2 + 2H2S = 3S + 2H2O
4) 3S + 6KOH = 2K2S + K2SO3 + 3H2O
(возможно образование K2S2O3)
Слайд 27Уравнение 1- пропущен коэффициент перед формулой нитрата меди;
Уравнение 2 –
неверный коэффициент перед формулой диоксида серы;
Уравнение 3 записано верно;
Уравнение 4
записано неверно (вместо сульфита калия приведена формула сульфата калия)Пример 20
Оценка: 1 балл
Слайд 28характерные химические свойства органических веществ различных классов
генетическая взаимосвязь органических веществ
Задание
32
Проверяемые ведущие элементы содержания
Подтверждать существование генетической взаимосвязи между веществами различных
классов путём составления уравнений соответствующих реакций с учётом заданных условий их проведенияПроверяемые умения (виды деятельности)
Слайд 29В ответе экзаменуемого допустимо использование структурных формул
разного вида (развёрнутой,
сокращённой, скелетной),
однозначно отражающих порядок связи и взаимное расположение
заместителей
и функциональных групп в молекуле органического вещества.Оценивание правильности записи каждого из пяти уравнений реакций производится в рамках единых требований к сформированности умения «составлять уравнение реакции».
Если при расстановке коэффициентов допущена хотя бы одна ошибка, то элемент ответа оценивается в 0 баллов.
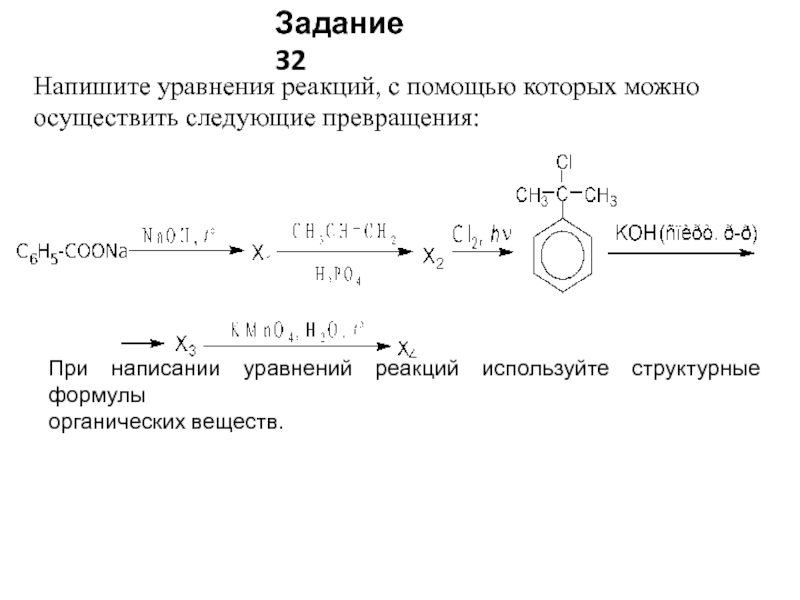
Слайд 30Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При
написании уравнений реакций используйте структурные формулы
органических веществ.
Задание 32
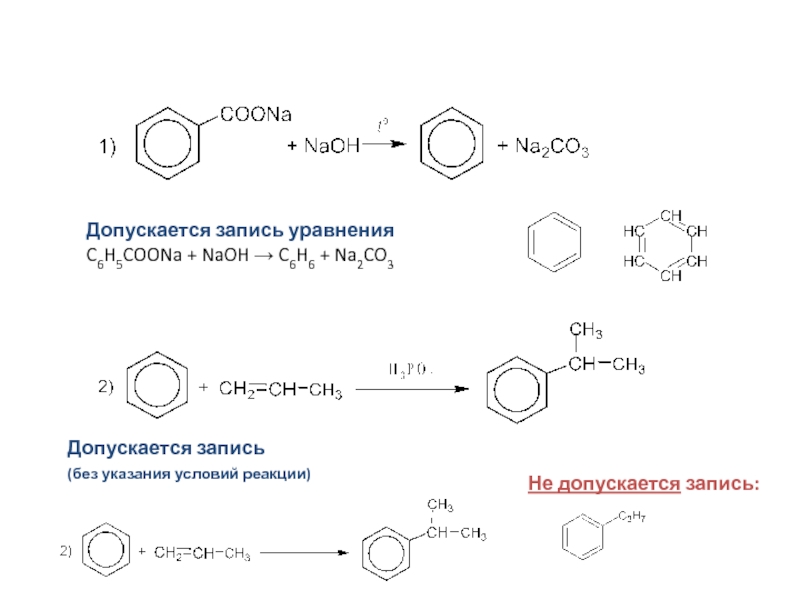
Слайд 31Допускается запись уравнения
C6H5COONa + NaOH → C6H6 + Na2CO3
Допускается запись
(без
указания условий реакции)
Не допускается запись:
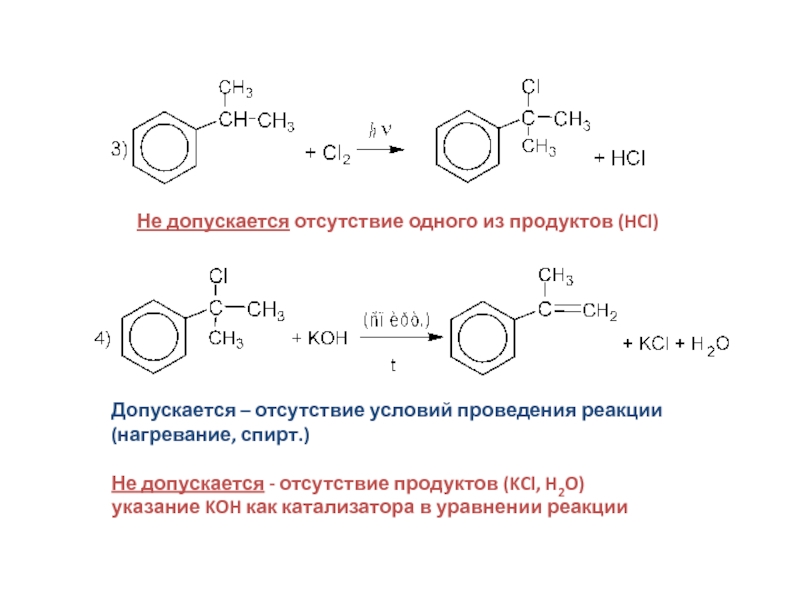
Слайд 32Не допускается отсутствие одного из продуктов (HCl)
Допускается – отсутствие условий
проведения реакции
(нагревание, спирт.)
Не допускается - отсутствие продуктов (KCl, H2O)
указание
KOH как катализатора в уравнении реакцииСлайд 33Не допускается:
- отсутствие продуктов (MnO2, KOH)
- отсутствие коэффициентов в
уравнении реакции
Слайд 40Работа 1
Уравнения р-ций – 1 б.
Не использованы данные: 44,4 г
Mg(NO3)2
Как найдено 0,68 моль HCl ?
Логика нарушена – твердый остаток
не проанализирован;Масса раствора найдена неверно (только оксид магния попал в раствор);
Искомая величина найдена неверно.
Всего 1 балл.
Слайд 41Работа 2
Уравнения р-ций – 1 б.
Данные условия все использованы -
1 б.
Логика понятная: в раствор попадает остаток после выделившихся газов
(44,4 – 22,08 – 3,84 ) – 1 б.Масса раствора найдена верно;
Искомая величина найдена неверно: взята масса прореагировавшей, а не оставшейся соляной кислоты – 0 б.
Всего 3 балла.
Слайд 45Работа 8
Вычисления проведены неверно – 0 б.
Молекулярная формула не соответствует
условию задания – 0 б.
Структурная формула не соответствует условию задания
– 0 б.Уравнение реакции записано неверно (структ ф-ла) – 0 б.
Всего 0 баллов.
Слайд 48Работа 10
Вычисления проведены верно – 1 б.
Молекулярная формула соответствует условию
задания – 1 б.
Структурная формула не соответствует условию задания –
0 б.Уравнение реакции записано неверно (формула не соотв структурной форм.) – 0 б.
Всего 2 балла.
Слайд 49Работа 11
Вычисления проведены неверно – 0 б.
Молекулярная формула соответствует условию
и результату вычислений
– 1 б.
Структурная формула соответствует условию и
полученной МФ – 1 б.Уравнение реакции записано верно – 1 б.
Всего 3 балла.