Слайд 1Роль океанской воды в формировании
химического состава природных вод
С.М.Судариков
Гидрогеохимия
Слайд 2Геологическая роль водной толщи современного Океана
Слайд 3Данные о составе, объеме и геохимической структуре водной толщи Мирового
океана
Общая площадь всех вод Мирового океана, межматериковых, внутриматериковых и внутренних
морей – 361.26 х 1012 м2 (70.91% от всей поверхности планеты). Площадь суши – 148.21 х 1012 м2 (29.09%).
Т.е. водная поверхность в 2.44 раза более поверхности суши.
объем водной толщи Мирового океана более, чем в 11 раз, т.е. на порядок, превосходит объем суши, расположенной выше его уровня
Слайд 4Океанская водная толща является основным компонентом гидросферы планеты.
Общая масса
всех типов вод в ее составе гидросферы – 2.3 х
1021 кг .
Масса водной толщи океана –
1.37 х 1021 кг (почти 60%).
Слайд 5Грандиозный объем водной толщи создает среду для протекания специфичных рудообразующих
процессов в пределах современного океана. В ходе этих процессов возникают
особые по составу и условиям залегания продукты океанского рудогенеза, не имеющие аналогов на суше.
В их числе железомарганцевые конкреции, кобальтоносные марганцевые корки и др. Решение вопросов, связанных с их образованием невозможно без учета всего многообразия факторов воздействия со стороны водной толщи океана
Слайд 6морская вода представлена мономинеральным жидким соединением , в котором растворенные
солевые компоненты составляют, в среднем, 34.71 ‰ (3.47%).
Солевой состав включает
11 макроэлементов с концентрацией выше 1-2 мг/л: Cl-, Na+, Mg2+, SO42-, Ca2+, K+, Br-, -HCO3, Sr2+, F- и B;
13 микроэлементов с концентрацией от 1-2 мг/л до 1 мкг/л: Li, Rb, P, J, Ba, Mo, Fe, Zn, As, V, Cu, Al, Ti
свыше 50 микроэлементов с концентрацией <1 мкг/л _ Mn, Ni, Co, Cd, Y, La, Ce и Au.
Слайд 7Основу океанской водной толщи составляет достаточно концентрированный раствор солей галогенов
(Cl, Br и F), сернокислых соединений и соединений гидрокарбонат-иона со
щелочными и щелочноземельными металлами.
Формирующая этот раствор группа макроэлементов на 3-4 порядка превосходит суммарную массу микроэлементов.
Слайд 8В рудах океана, обычно содержатся десятые доли (кобальт), а иногда
до 1% других металлов (медь, никель),
Из чего следует, что
формирование океанских рудных месторождений возможно в условиях, требующих исключительно высокой мобилизации полезных компонентов
Она оценивается, по сравнению с исходной матрицей, коэффициентом концентрирования порядка 107-109.
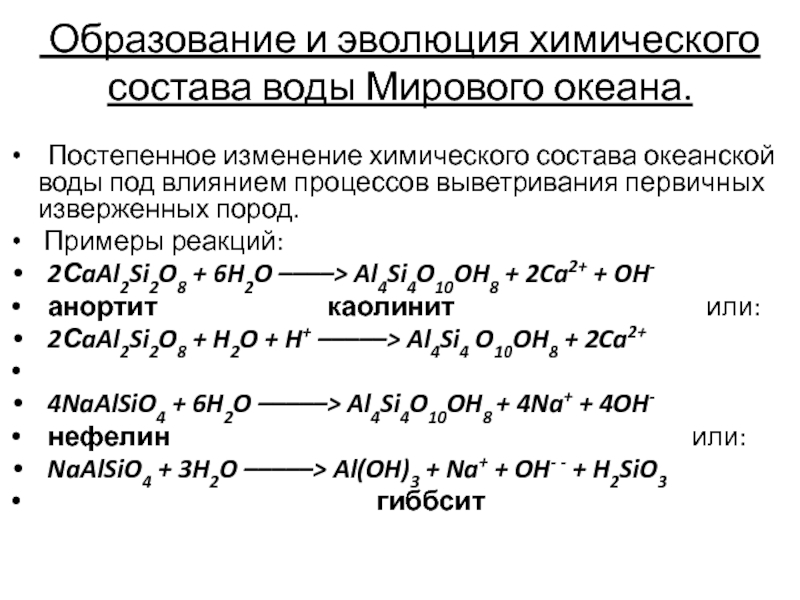
Слайд 9 Образование и эволюция химического состава воды Мирового океана.
Постепенное
изменение химического состава океанской воды под влиянием процессов выветривания первичных
изверженных пород.
Примеры реакций:
2СaAl2Si2O8 + 6H2O ––––> Al4Si4O10OH8 + 2Ca2+ + OH-
анортит каолинит или:
2СaAl2Si2O8 + H2O + H+ –––––> Al4Si4 O10OH8 + 2Ca2+
4NaAlSiO4 + 6H2O –––––> Al4Si4O10OH8 + 4Na+ + 4OH-
нефелин или:
NaAlSiO4 + 3H2O –––––> Al(OH)3 + Na+ + OH- - + H2SiO3
гиббсит
Слайд 10В результате происходило поглощение кислотности первичной океанской воды (увеличение щелочности)
и формирование катионного состава.
К началу фанерозоя состав воды Мирового
океана стал близким к современному. Сформировались условия, благоприятные для развития карбонатных раковин и скелетов, остатки которых сохранялись в илах и становились частью осадочных толщ.
Последующие изменения в составе океанской воды, судя по палеонтологическим, геохимическим, изотопным данным были незначительными.
Сформировалась одна из главных планетарных констант – химический состав воды Океана.
Слайд 112.Состав океанской воды:
г/кг %-экв
г/кг %-экв
Cl 19,35 90,20 Na 10,76 77,32
SO4 2,70 9,28 K 0,39 1,64
HCO3 0,14 0,38 Mg 1,29 17,62
Br 0,07 0,14 Ca 0,41 3,36
Sr 0,01 0,06
rNa/rCl = 0,86; Cl/Br = 300; pH= 8,2;
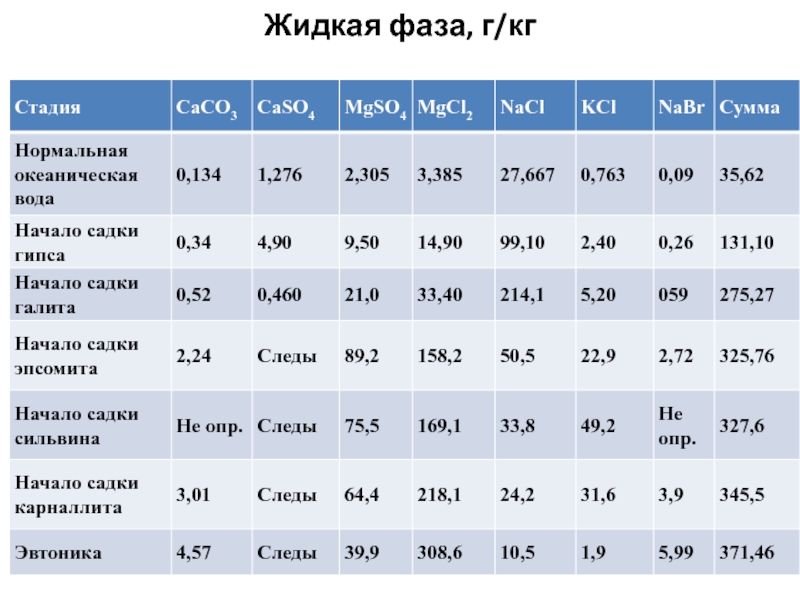
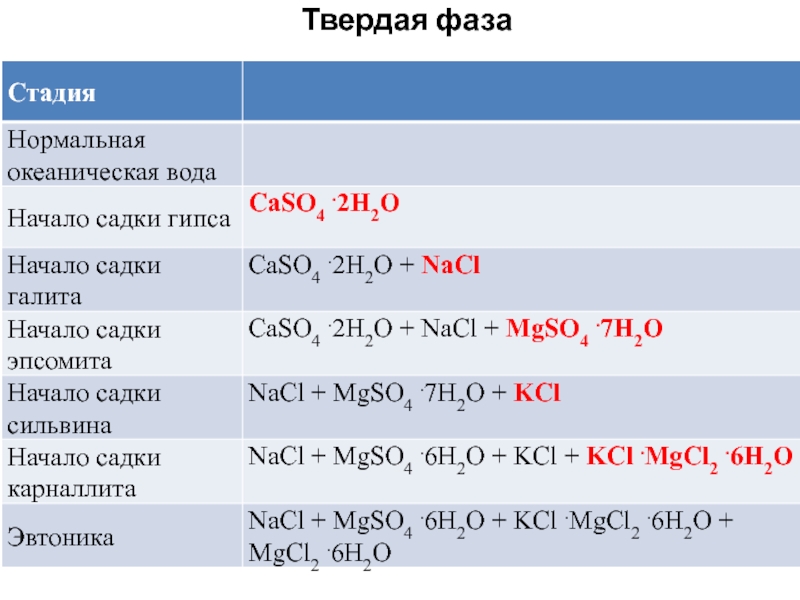
Слайд 123. Изменение состава океанской воды при упаривании
Состав океанской воды различной
степени сгущения (по М. Г. Валяшко)
Слайд 15130 г/кг; начало садки гипса, в результате которой в твердую
фазу уходит весь кальций; объем оставшейся воды 19,6 % от
исходной; оставшееся к-во сульфатов 7 %-экв;
280 г/кг; начало садки галита; выпадает с тв. фазой натрий; объем оставшейся воды 9,3 % от исходной; после осаждения галита сульфатов 25%-экв;
325 г/кг; начало садки эпсомита
(MgSO4. 7H2O); осталось 6 % воды; 5 %-экв калия;
Слайд 16350 г/кг; начало садки сильвина и карналлита (KCl.MgCl2. 6H2O); осталось
3,1 (сильвин) -3,9 (карналлит) % от исходной воды; 6 %-экв.
калия;
около 370 г/кг; начало садки бишофита (MgCl2.6H2O); осталось 2,7 % воды;
если исходная вода была обогащена кальцием (седиментогенные рассолы), обособляется стадия садки тахгидрита (2MgCl2.CaCl2.12H2O), 1,9 % от исходного количества воды;
420 г/кг; эвтоника.
Слайд 17Особенности испарительного концентрирования в других водоемах
Мертвое море (г/кг)
(абс.отм. зеркала воды
-392 м, гл. 400 м) – выделяется стадия садки тахгидрита
Слайд 18Каспийское море (г/кг)
(абс. отм. зеркала -28,5 м,гл. 6-8
м на севере, до 1025 м на юге) – выделяется
стадия садки мирабилита (Na2SO4.10H2O).
Слайд 19Ситуация с бромом
После начала садки галита соотношение хлора и брома
меняется
ф-ла В.И.Гуревича (1963):
Слайд 20Если принять максимальное содержание хлора около 300-320 г/л, максимальное содержание
брома составит ≈ 10 г/л.
Прогнозы В.И.Гуревича подтвердились данными по рассолам
усольской свиты н. кембрия в Ангаро-Ленском артезианском бассейне.
Слайд 21Метаморфизация химического состава морской воды и продуктов ее упаривания
Прямое направление
¤
Сульфатредукция:
SO4 2- + 2H2O + 2Cорг –––> H2S + 2HCO3-;
SO4 2- + 2H + + 2Cорг –––> H2S + 2CO2;
Протекание процесса на стадиях диагенеза (в илах) и катагенеза (в осадочных толщах, обогащенных органическим веществом).
Роль температурного фактора: повышение Т до 80-90о усиливает процесс, выше – ослабляет (смерть сульфатредуцирующих бактерий).
Слайд 22¤ Вторичная доломитизация
Процессы вторичной доломитизации протекают при aСа/aMg >
0,7. Увеличение пористости может достигать 12 % от первоначальной пористости
кальцита. Кольматация пор образующимся гипсом начинается при (rSO4 -rCa) > 14 мг-экв.
Слайд 23¤ Альбитизация плагиоклазов
Оптимальные условия протекания – кислая среда и повышенные
температуры
¤ Катионный обмен:
2Na + + Ca кол Ca 2+
+ Na кол
Mg 2+ + Ca кол <––> Ca 2+ + Mg кол
Протекание на стадиях диагенеза (Гломар Челленджер); катагенеза (данные по Волго-Камскому артезианскому бассейну).
Слайд 24Обратное направление
Протекание реакций катионного обмена в обратном направлении. Возвращение в
жидкую фазу поглощенного "морского" натрия. В солевой форме это:
СaSO4 +
Na кол ––> Na2SO4 + Ca кол
Сa(HCO3)2 + Na кол ––> Na2SO4 + Ca(HCO3)2
При этом, пока из породы не выщелочен весь гипс, протекает процесс
2NaHCO3 + CaSO4 ––> Na2SO4 + Ca(HCO3)2 ,
т.е. происходит стадийное накопление сначала сульфатных натриевых вод, а потом – гидрокарбонатных натриевых.
Слайд 25Общая схема метаморфизации морской воды и продуктов ее упаривания
В гидрогеохимических
типах Курнакова-Валяшко:
хлоридный ← сульфатный → карбонатный
Слайд 26Геоисторически сложившееся геологическое тело
Урез воды Океана пространственно коррелируется с разделом,
отделяющим кору океанического и переходного типов от коры континентального типа,
что автоматически увязывает контуры океанской водной толщи с гравитационным полем, с изостатической картиной распределения силы тяжести на поверхности планеты, отражающей ее глубинное строение.
Слайд 27Этот факт свидетельствует о том, что океанская водная толща имеет
не просто грандиозный объем H2O, заполнивший природный бассейн под названием
Мировой океан, а представляет геоисторически сложившееся геологическое тело, залегающее среди других геологических тел Земли, подчиняясь общим геодинамическим законам, регулирующим его местоположение, объем и состав.
Слайд 28При этом оно соединяет в себе качества противоположного свойства. С
одной стороны, то, о чем сказано выше – стабильность объема,
состава и внутренней структуры. С другой – необычайная физическая мобильность и ответная реакционная агрессивность по отношению к окружающей среде, которые способствуют, как средства самозащиты, сохранению океанской водной толщи в рамках своих консервативно стабильных параметров.