Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Se Te Po
Содержание
- 1. Se Te Po
- 2. Se,
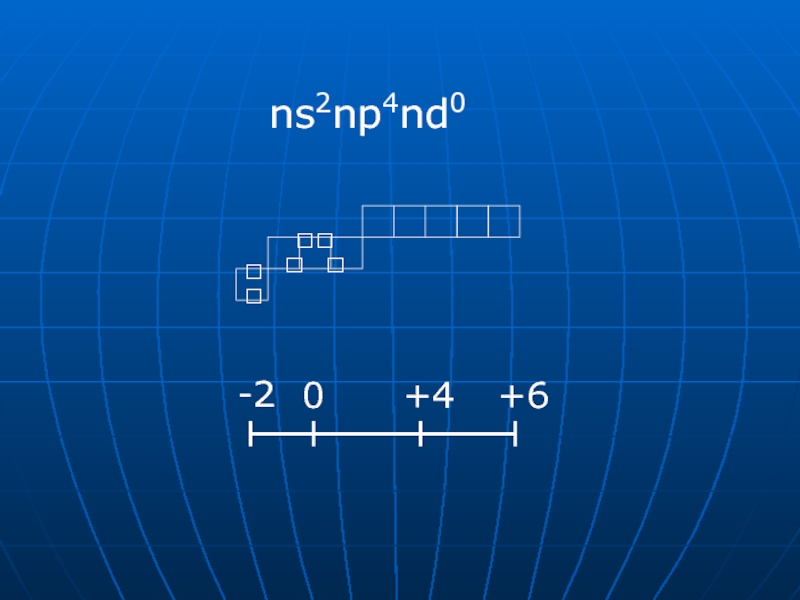
- 3. ns2np4nd0
- 4. Se і Te супроводжують S в природних
- 5. ЕO2 + SO2 + H2O → Е
- 6. Ро – радіоактивний елемент
- 7. 210Ро у кількості декілька кг добувають
- 8. Капіляр з фільтром для фільтрування
- 9. Хімічні властивості Окисні властивості 2Al
- 10. d-метали утворюють селеніди і телуриди МеЕ, Ме2Е3,
- 11. H2 + S H2S
- 12. Відновні властивості. Se + O2 →
- 13. Слайд 13
- 14. Властивості сполук С. О. -2 K2Se
- 15. H2S
- 16. H2S H2Se
- 17. Слайд 17
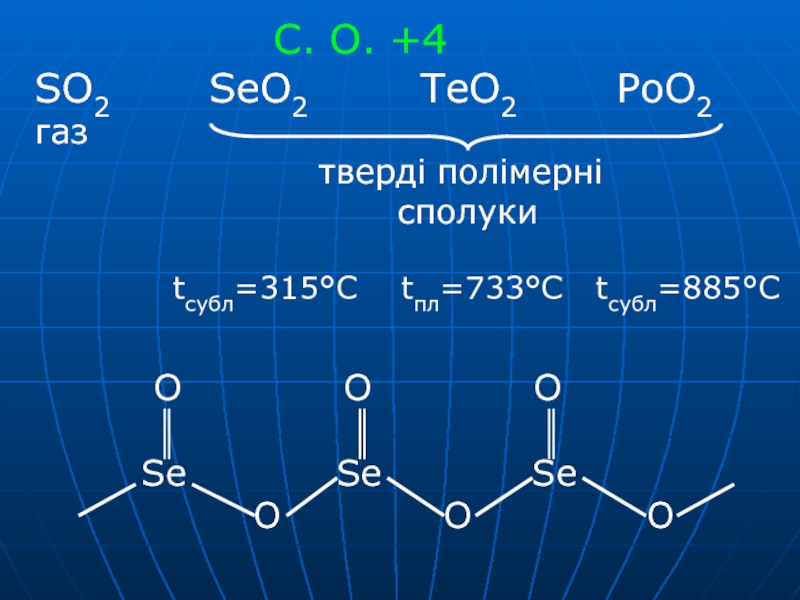
- 18. Добування: E + O2 → EO2
- 19. SO2 SeO2
- 20. SO2, SeO2 – кислотні оксиди SeO2
- 21. С. О.
- 22. H2SeO3 + 4HJ → 2J2 + Se
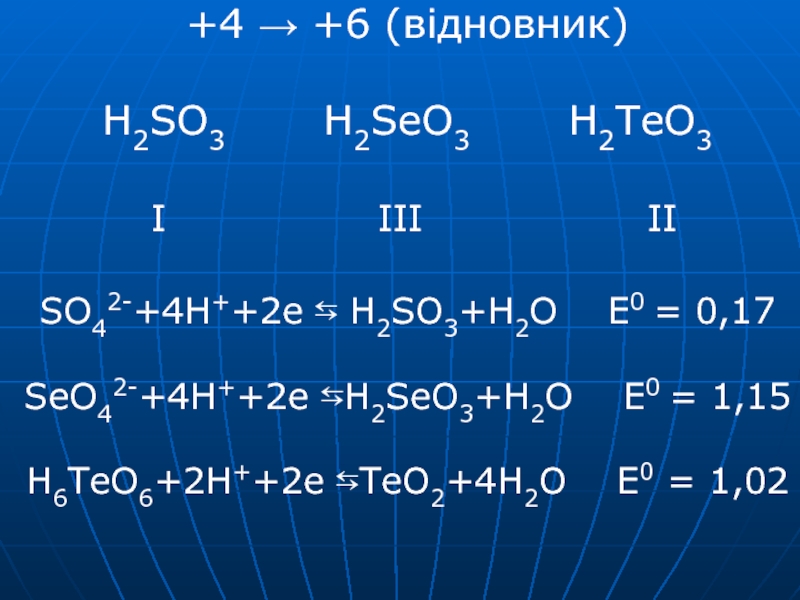
- 23. +4 → +6 (відновник) H2SO3
- 24. +6 для S найбільш стійкий для Se
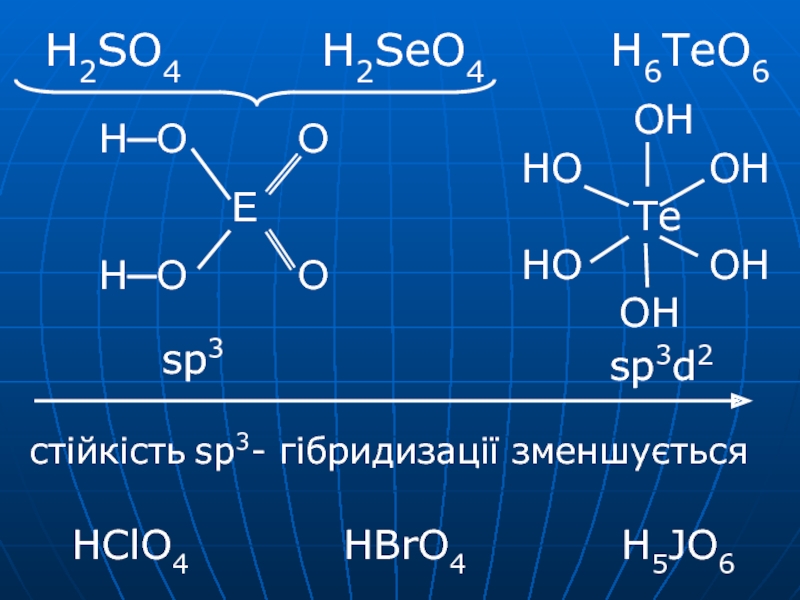
- 25. H2SO4 H2SeO4
- 26. SeO3 + H2O → H2SeO4
- 27. H2SO4 H2SeO4
- 28. Окисні властивості H2SO4
- 29. H2SO4 + HCl → H2SeO4
- 30. Слайд 30
- 31. Кислотні властивості:
- 32. Солі: сульфати, селенати, телурати. Ортотелурати можна отримати
- 33. Скачать презентанцию
Se, Te, Po ат.% 6·10-5 1·10-6 2·10-14 Se8 – червоний, Se∞ – сірий, Te∞ –сріблясто-сірий Se
Слайды и текст этой презентации
Слайд 4Se і Te супроводжують S в природних сполуках (PbS, FeS2,
ZnS, самородна S) Se і Te – розсіяні елементи Ро –
рідкісний елемент Добувають Se і Te з відходів виробництва сірчаної кислоти та анодних шламів(відходів) очистки (електролітичного рафінування) Cu, NiСлайд 5ЕO2 + SO2 + H2O → Е + H2SO4 (Е –
Se, Te) Спочатку виділяється Se, а потім, після сильного розведення
розчину, невелика кількість TeСлайд 6 Ро – радіоактивний елемент 1870 р. – Д.
І. Менделєєв передбачив існування Ро 1898р. – М. Склодовська-Кюрі та П.
Кюрі відкрили Ро Вони помітили, що природна руда набагато радіоактивніша за очищений препарат (оксид U) Новий дуже радіоактивний елемент названо полонієм на честь Польщі – батьківщини МаріїСлайд 7 210Ро у кількості декілька кг добувають в атомних реакторах, а
також з відходів переробки уранових руд 210Ро як α-випромінювач використовують в
якості джерела енергії в ядерних елементах живлення на супутникахСлайд 8 Капіляр з фільтром для фільтрування осадів полонія.
Для порівняння розмірів, нитка з голкою і сірник
Слайд 9Хімічні властивості Окисні властивості 2Al + 3Se → Al2Se3 селенід Fe + Tе
→ FeTe телурид Активні метали утворюють селеніди та телуриди нормальної стехіометрії
Al2Se3 + 6HCl → 3H2Se + 2AlCl3 Al2Te3 + 6H2O → 3H2Te + 2Al(OH)3Слайд 10d-метали утворюють селеніди і телуриди МеЕ, Ме2Е3, Ме3Е4, МеЕ2 нестехіометричного
складу. За підвищеного вмісту Se і Te ці сполуки мають
напівпровідникові властивості.Слайд 11H2 + S H2S H2 + Se
H2Se H2 + Te →
S Se Te окисні властивості зменшуються Е0, В 0,14 -0,40 -0,74 H2Se + S → Se + H2SE + 2e + 2H+⇆H2E
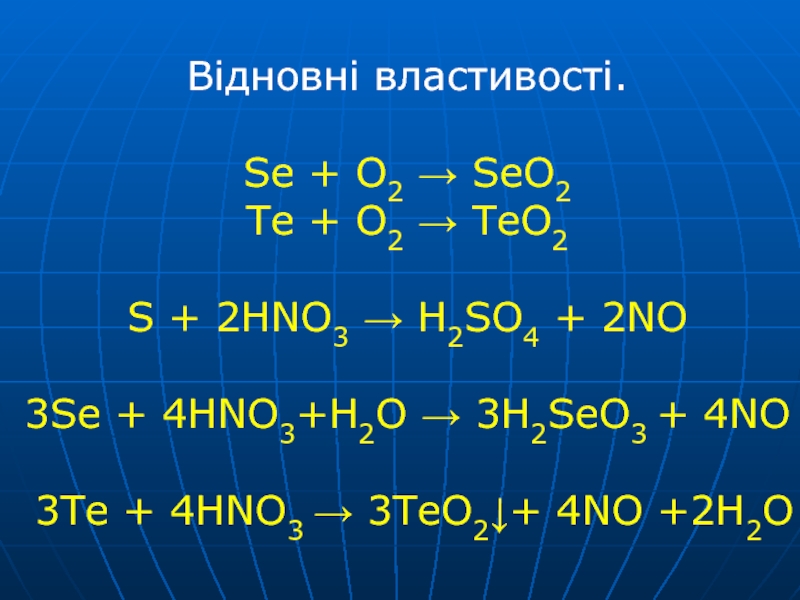
Слайд 12Відновні властивості. Se + O2 → SeO2 Te + O2 → TeO2 S
+ 2HNO3 → H2SO4 + 2NO 3Se + 4HNO3+H2O → 3H2SeO3
+ 4NO 3Te + 4HNO3 → 3TeO2↓+ 4NO +2H2OСлайд 13
нагр. 3Se + 6KOH K2SeO3
+ 2K2Se +H2O охол. Te + 2H2O → TeO2 + 2H2↑ Te + 3H2O2 → H6TeO6 Po + 2HCl → PoCl2 + H2↑Слайд 14Властивості сполук С. О. -2 K2Se + H2SO4(p.)→ K2SO4 + H2Se FeTe +
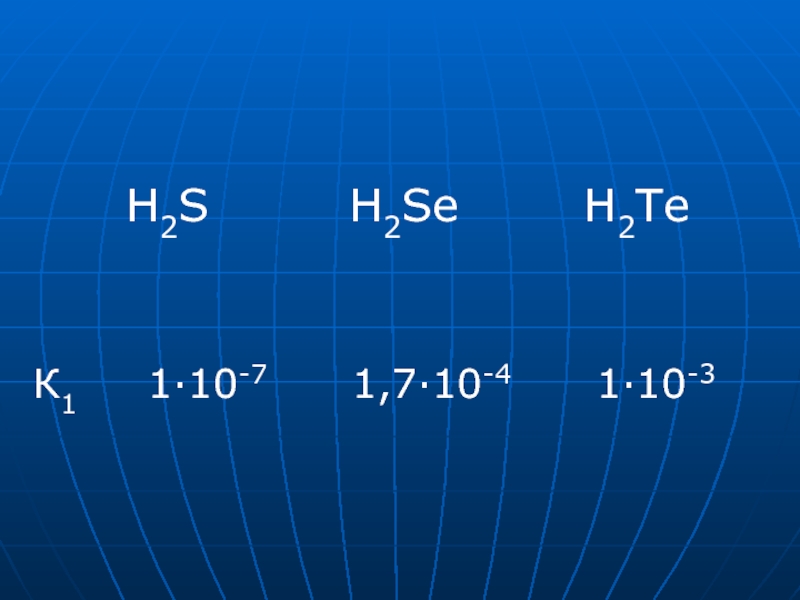
H2SO4(p.)→ FeSO4 + H2Te H2S H2Se
H2Te довжина зв'язку енергія зв'язку стійкість H2Te → H2 + TeСлайд 18Добування: E + O2 → EO2 H2Е + O2 → ЕO2
+ H2O SeO2 + H2O → H2SeO3 TeO2 + H2O
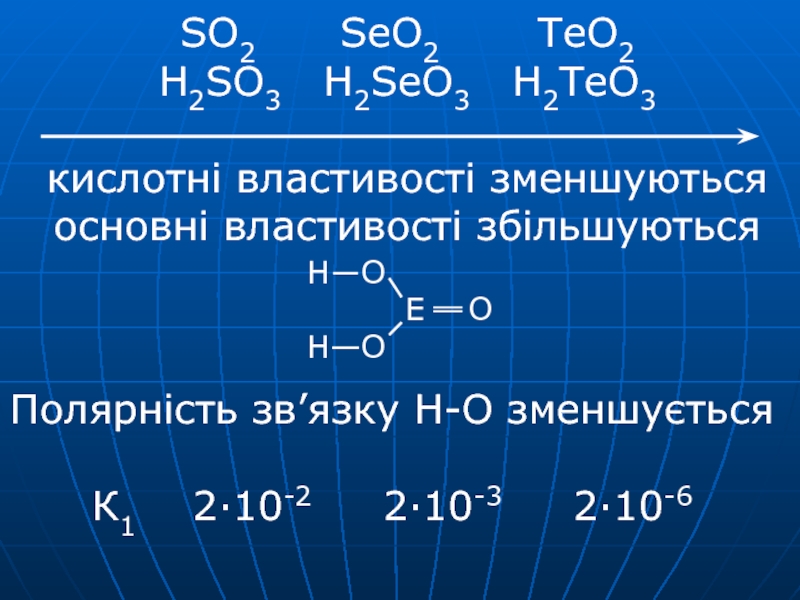
→ TeO2 + 2NaOH → Na2TeO3 + H2O Na2TeO3 + 2HCl → H2TeO3 + 2NaCl H2SeO3 – селениста, H2TeO3 –телуриста виділені у вільному станіСлайд 19SO2 SeO2 TeO2 H2SO3 H2SeO3
H2TeO3
кислотні властивості зменшуються
основні властивості збільшуються
Полярність зв’язку Н-О зменшується
К1
2·10-2 2·10-3 2·10-6Слайд 20SO2, SeO2 – кислотні оксиди SeO2 + HCl →
SeO2 + HBr → TeO2 – амфотерний оксид H2TeO3
+ 2KOH → K2TeO3 + 2H2O H2TeO3 + 4HCl → TeCl4 + 3H2O H2TeO3 + 6HCl → H2TeCl6 + 3H2O TeO2 + 4HJ → TeJ4 + 2H2O PoO2 – переважно основний оксид PoO2 + 2H2SO4 → Po(SO4)2 + 2H2O PoO2 + NaOH →Слайд 21 С. О. +4 – проміжний
+4 → 0 (окисник)
H2SO3 H2SeO3 H3TeO3 ІІІ І ІІ Е0,В 0,45 0,74 0,59 Для процесу H2EO3 + 4e + 4H+ ⇆ E + 3H2O H2SeO3 і H2TeO3 являються більш сильними окисниками, ніж H2SO3Слайд 22H2SeO3 + 4HJ → 2J2 + Se + 3H2O H2TeO3 +
4HJ → TeJ4 + 3H2O H2SeO3+ 2H2SO3→2H2SO4+ Se + H2O TeO2 +
2SO2 + 2H2O → Te + 2H2SO4Слайд 23+4 → +6 (відновник) H2SO3 H2SeO3
H2TeO3 I
III II SO42-+4H++2e ⇆ H2SO3+H2O E0 = 0,17 SeO42-+4H++2e ⇆H2SeO3+H2O E0 = 1,15 H6TeO6+2H++2e ⇆TeO2+4H2O E0 = 1,02Слайд 24+6 для S найбільш стійкий для Se найменш H2SeO3 + O2 →
5H2SeO3+ 2HClO3→5H2SeO4+ Cl2+ H2O t 3K2SeO3 + KClO3 → 3K2SeO4
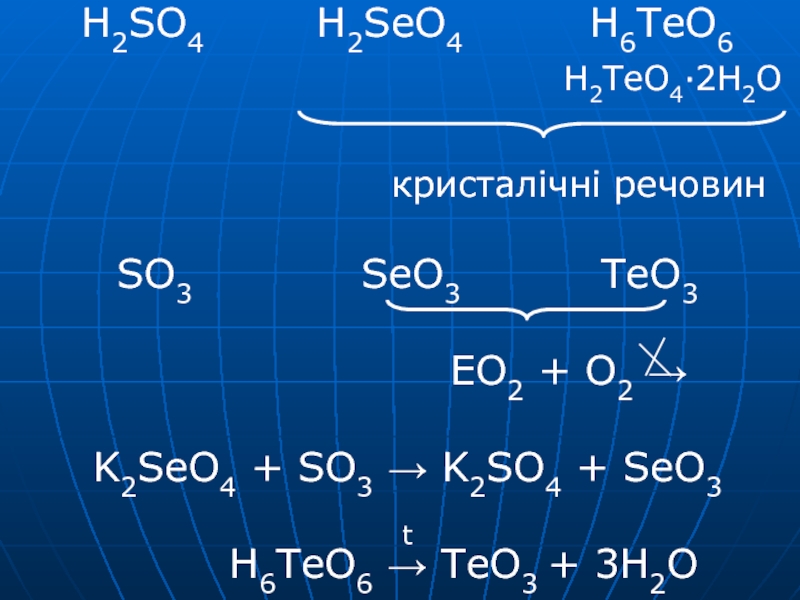
+ KCl K2SeO3 + Cl2 + H2O → K2SeO4 + 2HCl TeO2 + H2O2 + 2H2O → H6TeO6Слайд 25H2SO4 H2SeO4 H6TeO6
H2TeO4·2H2O кристалічні речовин SO3 SeO3 TeO3 EO2 + O2 → K2SeO4 + SO3 → K2SO4 + SeO3 t H6TeO6 → TeO3 + 3H2O
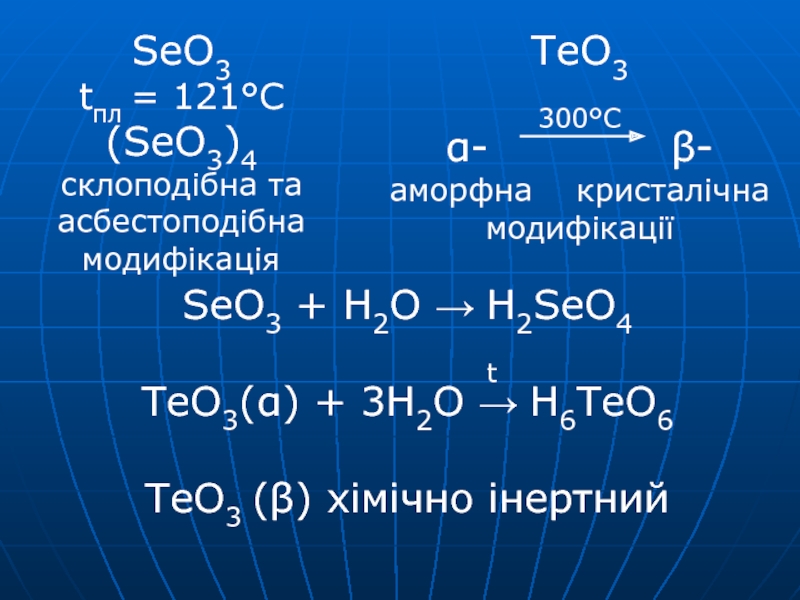
Слайд 26SeO3 + H2O → H2SeO4
t TeO3(α) + 3H2O → H6TeO6 TeO3
(β) хімічно інертнийSeO3
tпл = 121°С
(SeO3)4
склоподібна та
асбестоподібна
модифікація
Слайд 28Окисні властивості H2SO4 H2SeO4
H6TeO6 III I
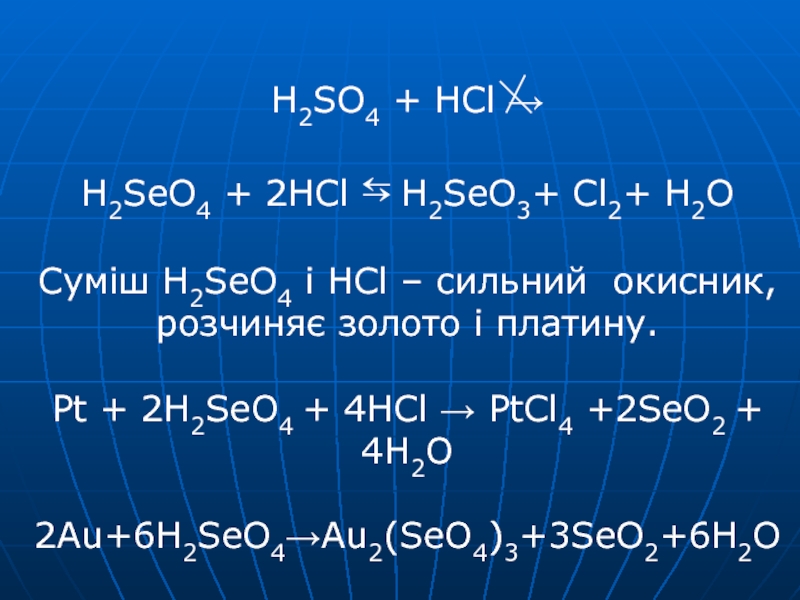
II SO42-+4H++2e ⇆ H2SO3+H2O E0 = 0,17 SeO42-+4H++2e ⇆H2SeO3+H2O E0 = 1,15 H6TeO6+2H++2e ⇆TeO2+4H2O E0 = 1,02Слайд 29 H2SO4 + HCl → H2SeO4 + 2HCl ⇆ H2SeO3+ Cl2+ H2O
Суміш H2SeO4 і HCl – сильний окисник, розчиняє золото і
платину. Pt + 2H2SeO4 + 4HCl → PtCl4 +2SeO2 + 4H2O 2Au+6H2SeO4→Au2(SeO4)3+3SeO2+6H2OСлайд 31 Кислотні властивості: H2SO4
H2SeO4 H6TeO6 сильна сильна
слабка K1 = 103 K2 = 1,2·10-2 K2 = 1·10-2K1=2·10-8
K2=9·10-12
K3=3·10-15