Слайд 1Сера и её соединения
Кислородсодержащие соединения серы
Слайд 3Распространение в земной коре
Сера - распространенный химический элемент: ее земной
кларк составляет 0,05%.
Она в больших количествах встречается в самородном
виде и в соединениях- сульфатах Na2SO4.10H2O - мирабилит, СаSO4.2H2O - гипс, сульфидах PbS - галенит, ZnS - сфалерит, CuS - ковелин, Сu2S - халькозин и др., а также в виде газообразного сероводорода в природном газе некоторых месторождений и в некоторых минеральных источниках.
Мирабилит (глауберова соль)
сфалерит
халькозин
Слайд 4Модификации серы
При обычных условиях сера образует хрупкие кристаллы желтого цвета,
плавящиеся при 112,8ºС; плотность её 2,07г/см3. Она нерастворима в воде,
но довольно хорошо растворяется в сероуглероде, бензоле и некоторых других жидкостях. При испарении этих жидкостей сера выделяется из раствора в виде прозрачных жёлтых кристаллов ромбической системы, имеющих форму октаэдров, у которых обычно часть углов или рёбер как бы срезана. Эта модификация серы называется ромбической.
Кристаллы ромбической серы
Структура молекулы S8
Слайд 5Модификации серы
Моноклинная сера
Иной формы кристаллы получаются, если медленно охлаждать расплавленную
серу.
При этих условиях стенки сосуда оказываются покрытыми изнутри длинными
тёмно-жёлтыми игольчатыми кристаллами моноклинной серы.
Она имеет плотность 1,96г/см3, плавится при 119,3ºС и устойчива только при температуре выше 96ºС. При более низкой температуре кристаллы моноклинной серы светлеют, превращаясь в октаэдры ромбической серы.
Кристаллические модификации серы:
Слева – ромбическая. Справа – моноклинная
Слайд 6Пластическая сера
Если нагреть серу до 445 °С, она закипает.
Выливая
кипящую серу тонкой струйкой в холодную воду, можно получить пластическую
серу — резиноподобную модификацию, состоящую из полимерных цепочек.
Пластическая сера эластична, как резина.
Слайд 7Физические свойства серы
При нагревании серы в интервале от 160 до
250 0С вязкость расплавленной серы возрастает, это связано с переходом
циклических молекул состава S8 в линейные цепочки S∞.
При температуре 444,6 0С сера кипит, при этом в парах серы выделены цепи состава S8, S6, S4 и S2.
Молекулы S2 по строению сходны с молекулами кислорода и обладают парамагнитными свойствами, тогда как все остальные модификации серы диамагнитны.
Слайд 8Химические свойства серы
Сера при взаимодействии с металлами является окислителем:
Zn +
S = ZnS
2Al + 3S = Al2S3
При взаимодействии
с сильными окислителями - восстановителем:
S + 6HNO3 = H2SO4+ NO2 + 2H2O
С водой сера не взаимодействует, в щелочах при нагревании диспропорционирует по уравнению:
3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O
Слайд 10Сероводород строение
Сероводород – газ, тяжелее воздуха, на открытом воздухе может
скапливаться в малопроветриваемых низинах в больших концентрациях.
Сероводород - термически неустойчив
(при температурах более 400°С разлагается на простые элементы).
Слайд 11
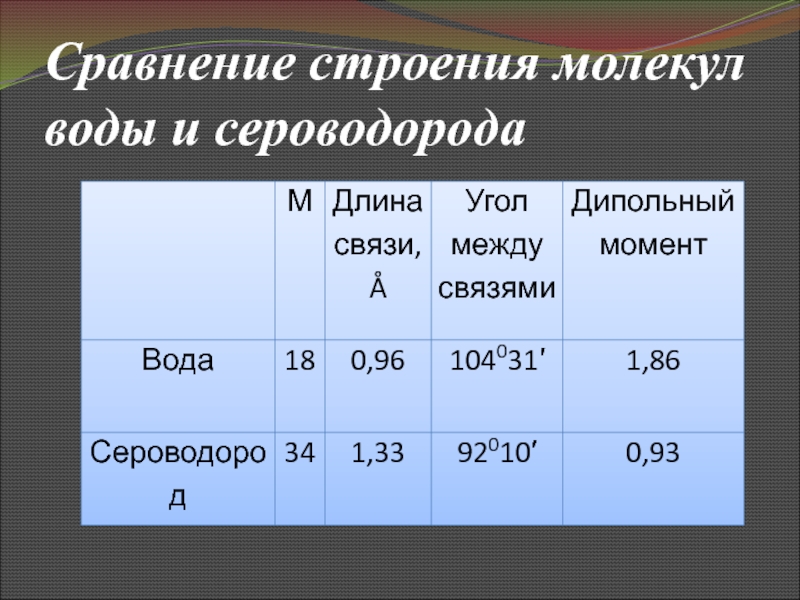
Сравнение строения молекул воды и сероводорода
Слайд 12Получение сероводорода
Сероводород Н2S - сильно ядовитый газ с неприятным запахом.
Он образуется при взаимодействии водорода с серой при 150оС, при
обработке сульфида железа (II) соляной кислотой, при гидролизе сульфида алюминия:
H2 + S = H2S
FeS + 2HCl = FeCl2 + H2S
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
Слайд 13Физические свойства сероводорода
Молекулы сероводорода, подобно молекулам воды, полярны, однако, водородные
связи, в отличие от Н2О, между ними практически не возникают,
поэтому сероводород при н.у. газообразное вещество и малорастворим в воде.
Концентрация его насыщенного водного раствора, называемого сероводородной водой, составляет при 20оС около 0,4%.
Слайд 14Химические свойства сероводорода
В растворе сероводород - слабая кислота, диссоциирующая в
две ступени:
H2S
H+ + HS- ; Ка1 = 1,0.10-7
HS- H+ + S2-; Ка2 = 2,5.10-13
Слайд 15Восстановитель
Сероводород является восстановителем. В зависимости от условий он может окисляться
по следующим полуреакциям:
H2S - 2e = S + 2H+
jo = 0,14 В
HS- - 2e = S + H+ jo = -0,06 В
H2S + 4H2O - 8e = SO42- + 10H+ jo = 0,30 В
Из сравнения стандартных окислительно-восстановительных потенциалов видно, что наиболее вероятно окисление сероводорода до серы, хотя не исключено и более глубокое окисление до серной кислоты:
3H2S + K2Cr2O7 + 4H2SO4 = 3S + Cr2(SO4)3 + K2SO4 + 7H2O
3H2S + 4HClO3 = 3H2SO4 + 4НСl
Слайд 21Сульфид марганца
Сульфид цинка
Сульфид кадмия
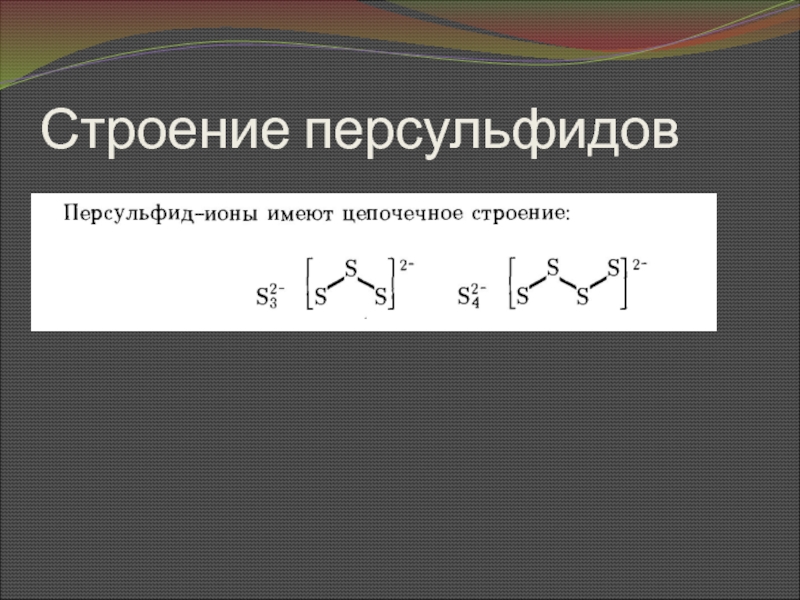
Слайд 23Что такое персульфиды?
Соединения, в состав которых входят группы из ковалентно
связанных друг с другом атомов окислительных элементов, называют персоединениями.
Способность серы
образовывать устойчивые гомоцепи реализуется в персульфидах (полисульфидах) типа M2+1Sn.
Их получают при взаимодействии серы с концентрированными растворами основного сульфида.
Na2S + (n-1)S = Na2Sn.
Слайд 25Сравнение персульфида и пероксида водорода
Персульфид водорода — неорганическое бинарное химическое
соединение водорода и серы. Химическая формула H2S2.
Персульфид водорода
Пероксид водорода
1 пм
= 10 -12 м
1 Å = 10-10 м
Слайд 26Персульфиды в природе
Пирит, от греческого "пир" – «огонь». Не затронутый
процессами окисления, пирит имеет бронзово-жёлтую, золотистую окраску. Пирит ещё в
древности использовали для украшений. В захоронениях находили отполированные кристаллы пирита, вероятно, служившие зеркалами. Золотистый цвет пирита нередко вводил в заблуждение - его принимали за золото. Пирит так снисходительно и называют - "кошачье золото".
Слайд 27Химические свойства персульфидов
Персульфид водорода при комнатной температуре распадается на серу
и сероводород (диспропорционирование):
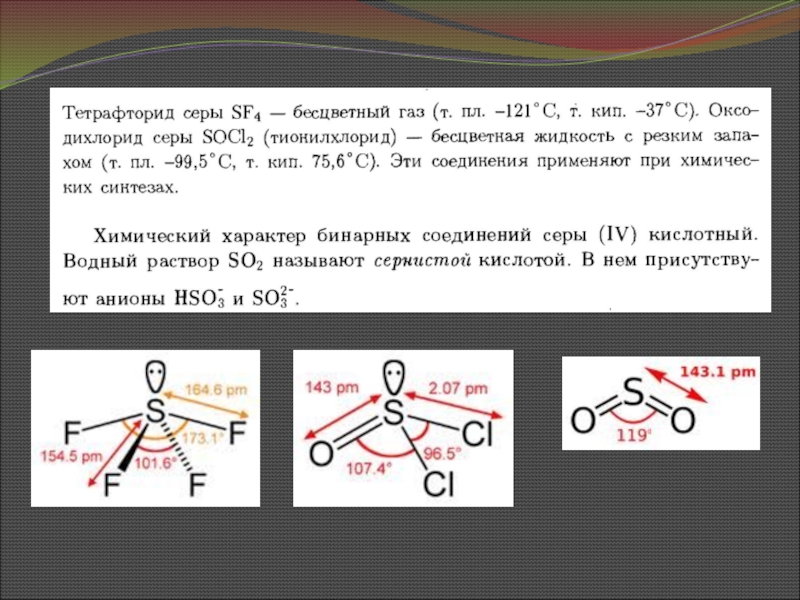
Слайд 28Соединения серы (IV)
Тетрагалогениды, оксодигалогениды, диоксид серы
Слайд 31Сернистый газ
Молекула диоксида серы
Молекула озона
Слайд 35Восстановительные свойства сульфит-аниона
Слайд 36Окислительные свойства сульфит-аниона
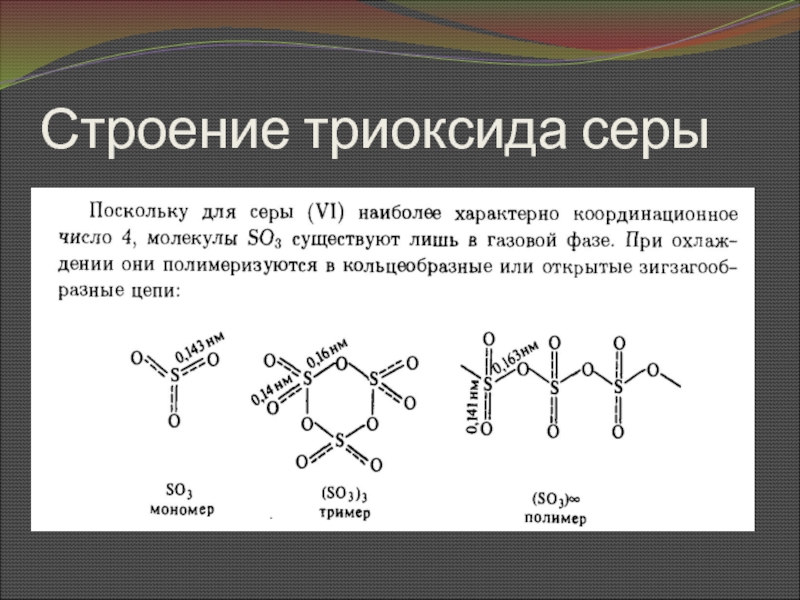
Слайд 37Соединения серы (VI)
Гексафторид, триоксид, оксо- и диоксодигалогениды
Слайд 44Сульфаты
Железный купорос
Медный купорос
Слайд 54Селен – простое вещество
Лучше всего изучен термодинамически
устойчивый серый селен. Это полимер с винтообразными макромолекулами, уложенными параллельно.
В цепях атомы связаны ковалентно, а молекулы-цепи объединены молекулярными силами и частично - металлической связью.
Даже расплавленный или растворенный селен не "делится" на отдельные атомы. При плавлении селена образуется жидкость, состоящая из цепей и замкнутых колец. Есть восьмичленные Se8 кольца, есть и более многочисленные "объединения".
Газообразный селен существует в виде разрозненных атомов только при температуре выше 1500°С, а при более низких температурах селеновые пары состоят из двух-, шести- и восьмичленных "содружеств". До 900°С преобладают молекулы состава Sе6, после 1000°С - Sе2.
Слайд 55Красный аморфный селен - тоже полимер цепного строения, но малоупорядоченной
структуры. В температурном интервале 70-90°С он приобретает каучукоподобные свойства, переходя
в высокоэластичное состояние.
Иенc Якоб Берцелиус (1779-1848) - выдающийся шведский химик. Он открыл селен и окись церия, выделил элементарные торий, цирконий и литий. Берцелиус был главой крупной химической школы, среди его учеников - Вёлер, Сёфстрем, Арфведсон и другие видные химики.
Селен открыт в 1817 году.
Слайд 56История открытия теллура
Впервые был найден в 1782 году в золотоносных
рудах Трансильвании горным инспектором Францом Иозефом Мюллером (впоследствии барон фон
Рейхенштейн), на территории Австро-Венгрии.
"Аурум парадоксум" - парадоксальное золото, так называли теллур, после того как в конце XVIII столетия он был открыт Рейхенштейном в соединении с серебром и желтым металлом в минерале сильваните. Неожиданным явлением казался факт, когда золото, обычно всегда встречающееся в самородном состоянии, было обнаружено в соединении с теллуром.
сильванит AgAuTe4
Слайд 57Калаверит AuTe2
Теллурсодержащие руды
Тетрадимит Bi2Te2S
Слайд 58Теллур – простое вещество
Устойчивая гексагональная структура теллура подобна селену.
Это серебристо-белое
металлоподобное кристаллическое вещество.
Теллур хрупок – легко растирается в порошок.
Является полупроводником
(электропроводность увеличивается при облучении светом).
Аморфный теллур коричневого цвета.
Слайд 59Минерал, содержащий полоний.
Полоний содержится в урановых и ториевых минералах, как
продукт распада радиоактивного ряда урана.
Полоний – простое вещество
Металлическая кристаллическая решетка
полония.
Полоний – мягкий металл, серебристо-белого цвета. По физическим свойствам напоминает висмут и свинец.
Слайд 61Физические свойства простых веществ
Слайд 62Химические свойства простых веществ
Слайд 63Химические свойства простых веществ
Слайд 65Соединения со степенью окисления -2
Слайд 66Соединения со степенью окисления -2
Слайд 70Соединения со степенью окисления +4
Степень окисления +4 селена, теллура и
полония проявляется в диоксидах ЭО2, тетрагалогенидах ЭHal4, оксодигалогенидах ЭОHal2, в
анионных комплексах ЭО32-, ЭHal62-.
Для полония (IV) характерны солеподобные соединения Po(SO4)2, Po(NO3)4
Слайд 74Соединения со степенью окисления +6
Слайд 79Химические свойства селеновой кислоты