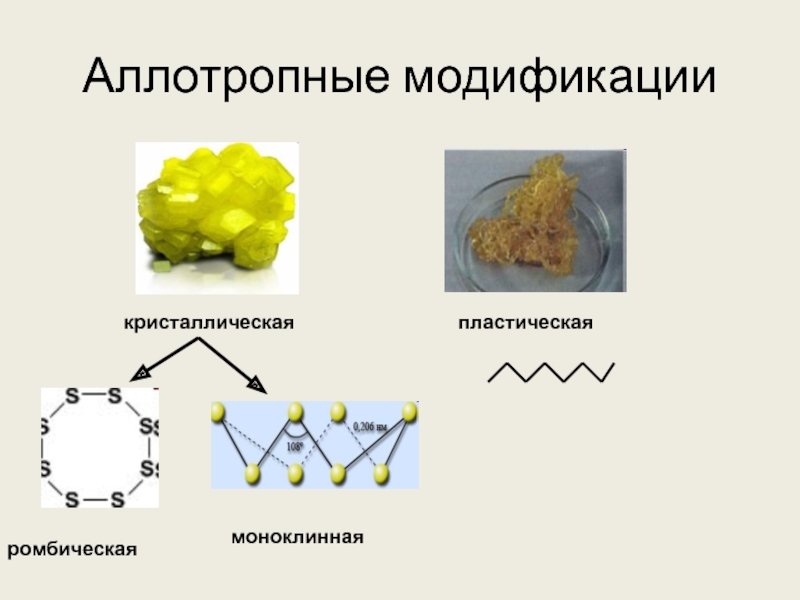
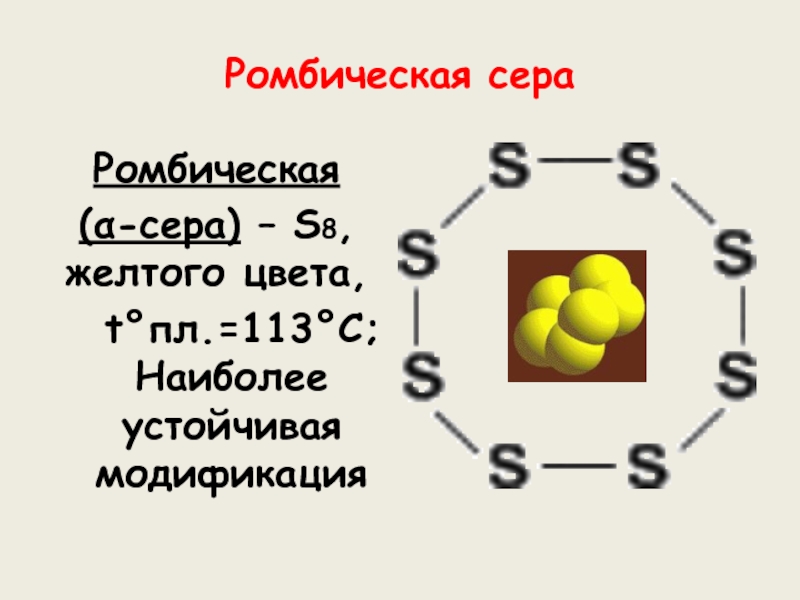
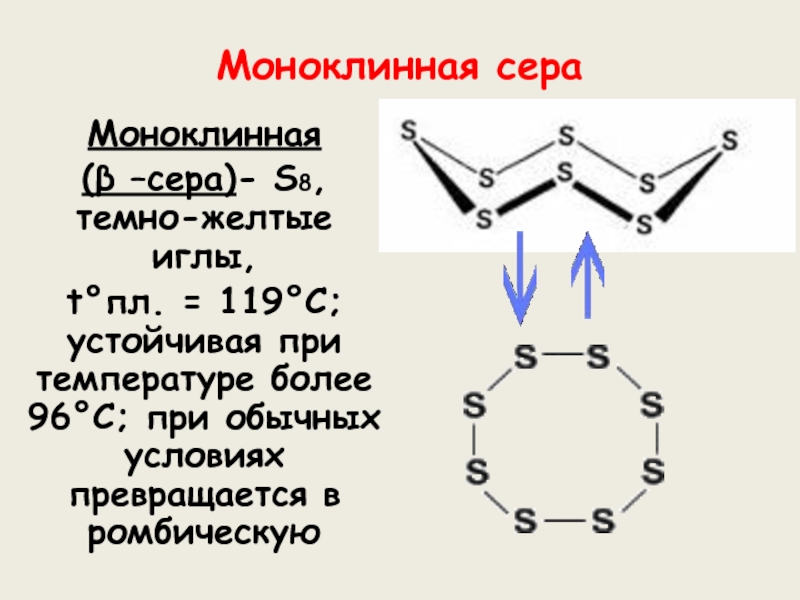
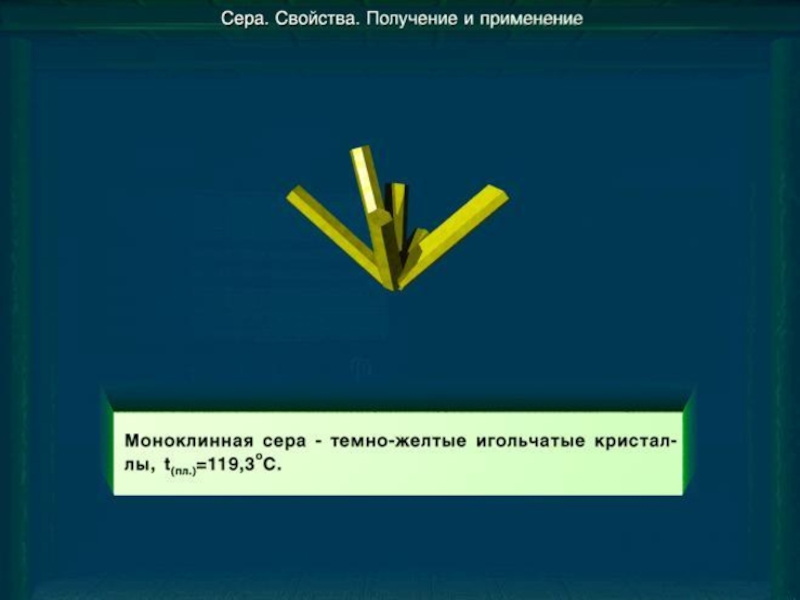
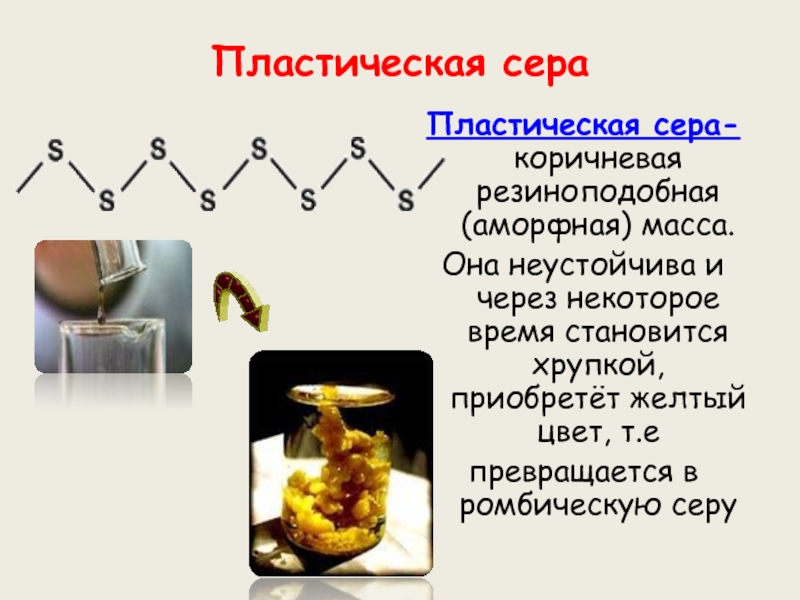
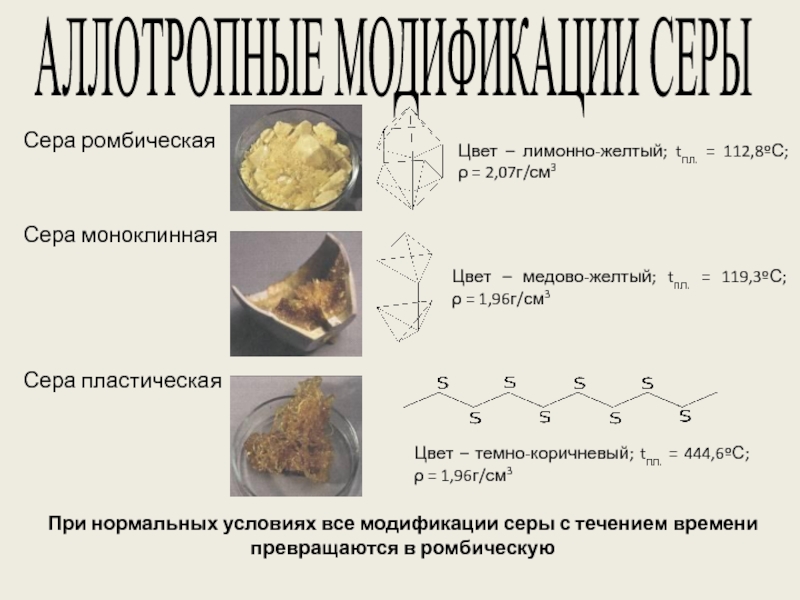
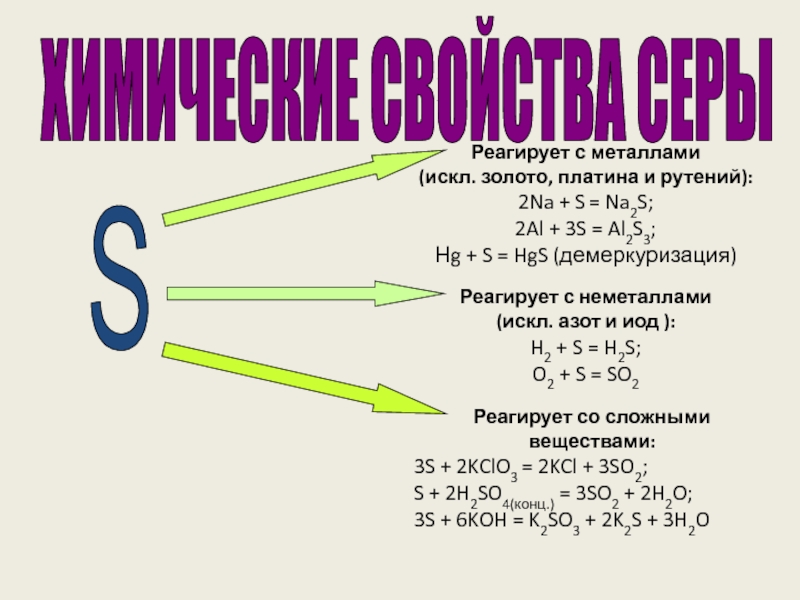
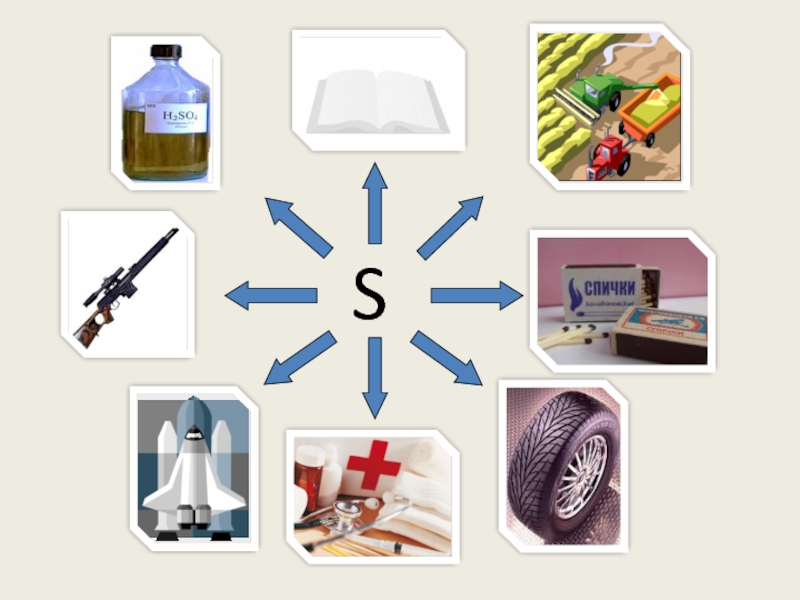
веков. Ещё древние греки и римляне нашли ей разнообразное практическое
применение. Куски самородной серы использовались для совершения обряда изгнания злых духов. Так, по легенде, Одиссей, возвратившись, в родной дом после долгих странствий, первым делом велел окурить его серой. Много упоминаний об этом веществе встречается в Библии.В Средние века сера занимала важное место в арсенале алхимиков. Как они считали, все металлы состоят из ртути и серы: чем меньше серы, тем благороднее металл. Практический интерес к этому веществу в Европе возрос в XIII—XIV вв., после появления пороха и огнестрельного оружия.
Сера – от санскритского слова сира – «светло-желтый».
ОТКРЫТИЕ СЕРЫ