Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Система
Содержание
- 1. Система
- 2. Функции состояния системыфункция состояния системы – такой
- 3. Процессыизотермический (T = const)изобарический (p = const)изохорный
- 4. Внутренняя энергия (U)Кинетическая энергия движения частицПотенциальная энергия
- 5. Работа (А)Работа – "макрофизический" способ передачи энергии
- 6. Первый закон термодинамикиКоличество теплоты, полученное системой, идет
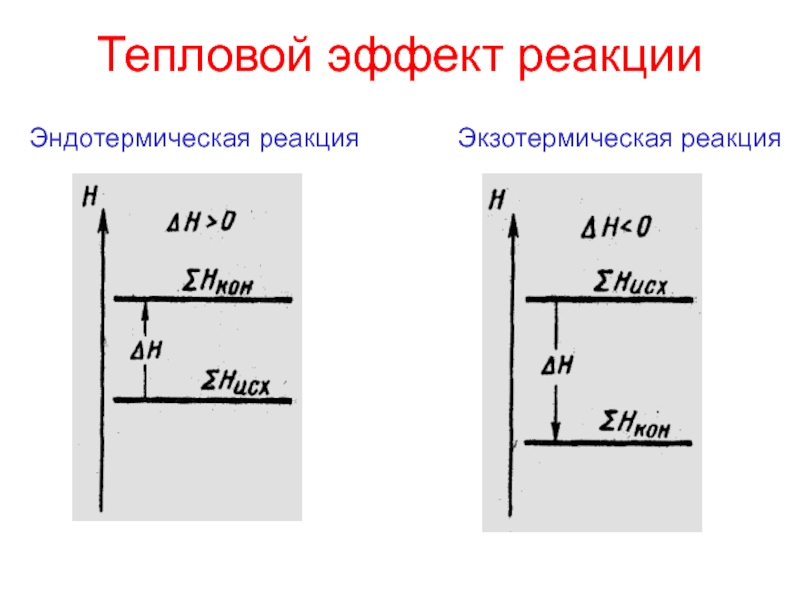
- 7. Тепловой эффект реакциитеплота, выделяющаяся или поглощающаяся при химической реакции
- 8. Тепловой эффект реакцииЭндотермическая реакцияЭкзотермическая реакция
- 9. Стандартная энтальпия образованияТеплота образования (formation) – тепловой
- 10. Термохимические уравненияхимические уравнения, в которых указан тепловой
- 11. Закон ГессаТепловой эффект реакции зависит только от
- 12. Применение закона Гесса(1) С(графит) + О2(г) =
- 13. Следствие из закона ГессаИзменение энтальпии (тепловой эффект)
- 14. Термохимические расчетыОпределим, какая из реакций – прямая
- 15. ЭнтропияПараметры системымакропараметры системы(Т, р, V)микропараметры отдельных частиц
- 16. Изменение энтропии в химических реакциях ПримерОпределить изменение
- 17. Третье начало термодинамикиПри абсолютном нуле температур энтропия любого совершенного кристалла равна нулю.Зависимость энтропии свинца от температуры:
- 18. Самопроизвольные процессыПринцип Бертло-Томсена. Самопроизвольный химический процесс должен сопровождаться выделением тепла. H
- 19. Второй закон термодинамикиВ изолированной системе самопроизвольный процесс
- 20. Энергия Гиббса (р, Т = const)Два фактораэнергия
- 21. II закон т.д. для химических процессовΔH <
- 22. Изменение энергии ГиббсаПримерВычислить стандартное изменение энергии Гиббса
- 23. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Система
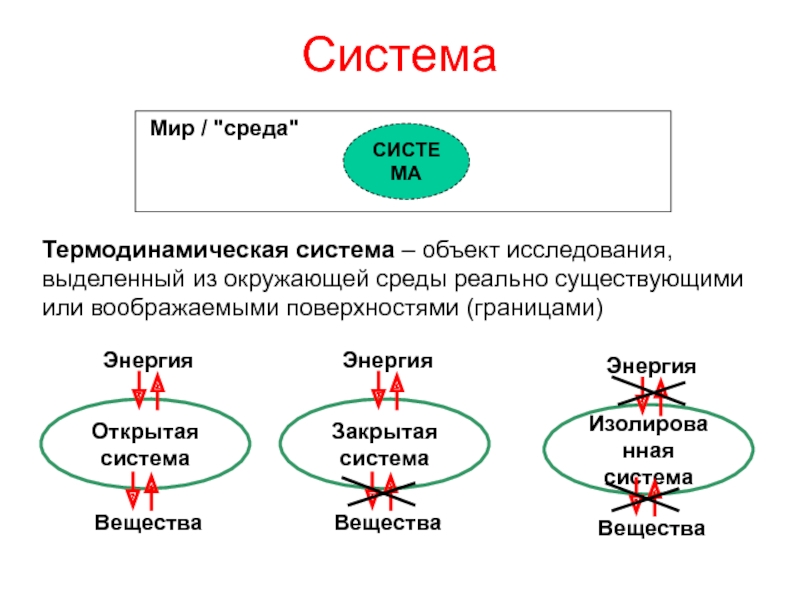
Термодинамическая система – объект исследования, выделенный из окружающей среды реально
существующими или воображаемыми поверхностями (границами)
Слайд 2Функции состояния системы
функция состояния системы – такой параметр, значение которого
зависит только от начального и конечного состояния системы, но не
зависит от пути процессаE – полная энергия системы
U – внутренняя энергия
H - энтальпия
S - энтропия
G – свободная энергия Гиббса (изобарно-изотермический потенциал)
F – свободная энергия Гельмгольца (изохорно-изотермический потенциал)
Слайд 3Процессы
изотермический (T = const)
изобарический (p = const)
изохорный (V = const)
изобарно-изотермический
(p, T = const)
изохорно-изотермический (V, T = const)
адиабатический (отсутствует теплообмен)
Процесс
– переход системы из одного состояния в другоеСлайд 4Внутренняя энергия (U)
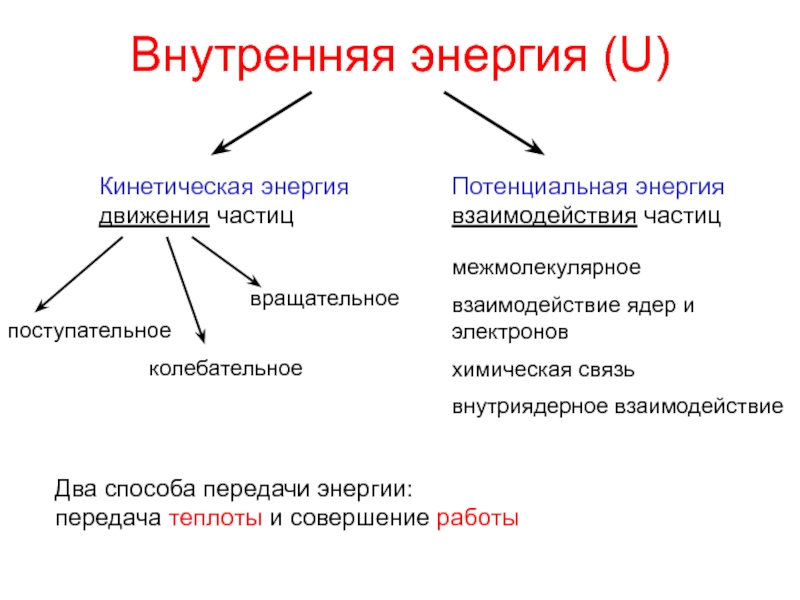
Кинетическая энергия движения частиц
Потенциальная энергия взаимодействия частиц
поступательное
колебательное
вращательное
межмолекулярное
взаимодействие
ядер и электронов
химическая связь
внутриядерное взаимодействие
Два способа передачи энергии:
передача теплоты и
совершение работыСлайд 5Работа (А)
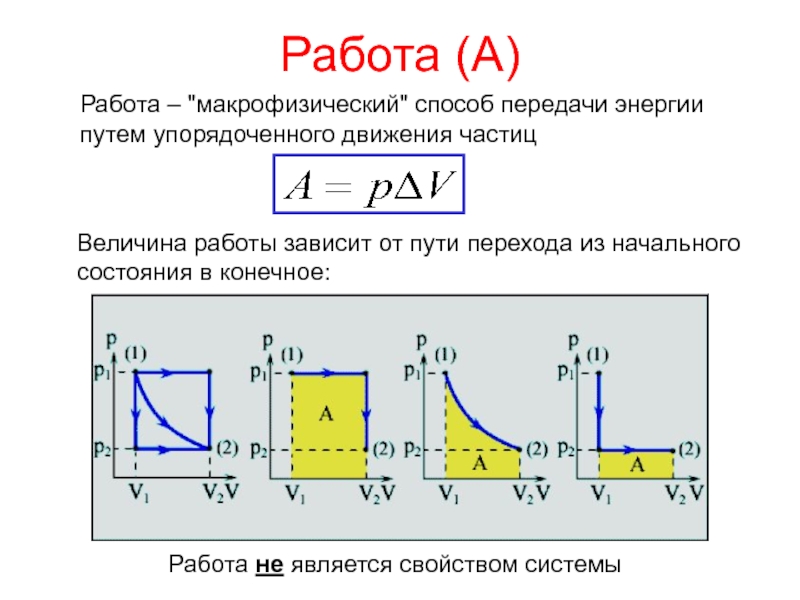
Работа – "макрофизический" способ передачи энергии путем упорядоченного движения
частиц
Работа не является свойством системы
Величина работы зависит от пути перехода
из начального состояния в конечное:Слайд 6Первый закон термодинамики
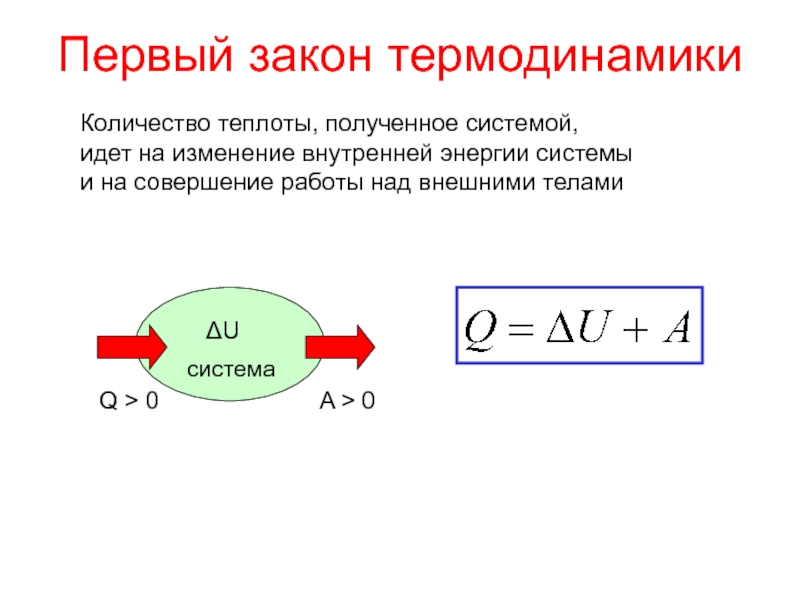
Количество теплоты, полученное системой,
идет на изменение внутренней энергии
системы
и на совершение работы над внешними телами
Слайд 9Стандартная энтальпия
образования
Теплота образования (formation) – тепловой эффект реакции образования 1
моля вещества из простых веществ, устойчивых в указанных условиях
Слайд 10Термохимические уравнения
химические уравнения, в которых указан тепловой эффект реакции
HT
– дельта аш стандартное при Т (К)
Стандартные условия:
устойчивая модификация вещ-ва
р
= 1атм. = 101325 ПаТ любая, обычно 298,15 К (25 С)
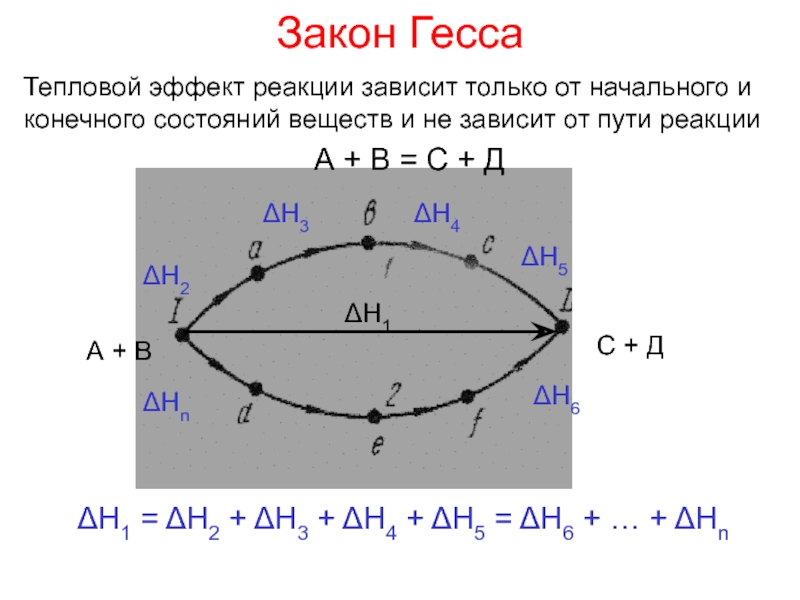
Слайд 11Закон Гесса
Тепловой эффект реакции зависит только от начального и конечного
состояний веществ и не зависит от пути реакции
А + В
= C + ДА + В
С + Д
ΔН1
ΔН2
ΔН3
ΔН4
ΔН5
ΔН6
ΔНn
ΔН1 = ΔН2 + ΔН3 + ΔН4 + ΔН5 = ΔН6 + … + ΔНn
Слайд 12Применение закона Гесса
(1) С(графит) + О2(г) = СО2(г); ΔН1 =
-393,5 кДж
(2) С(алмаз) + О2(г) = СО2(г); ΔН2 = -395,4
кДж(3) С(графит) = С (алмаз); ΔН3 = ?
(1)–(2): С(графит) + О2(г) - С(алмаз) - О2(г) = СО2(г) - СО2(г)
(1)–(2)=(3): С(графит) = С(алмаз)
ΔН3= ΔН1 - ΔН2 = -393,5 – ( -395,4) = 1,9 кДж
Термохимические уравнения можно складывать и вычитать как алгебраические
Слайд 13Следствие из закона Гесса
Изменение энтальпии (тепловой эффект) реакции ΔrH равно
разности между
суммой энтальпий образования конечных продуктов и суммой энтальпий
образования исходных веществ исх
f
прод
f
r
H
H
H
0
0
0
D
S
-
D
S
=
D
Слайд 14Термохимические расчеты
Определим, какая из реакций – прямая или обратная –
идет самопроизвольно с точки зрения энтальпии.
Al2(SO4)3(т) = Al2O3(т) + 3SO3(г)
ΔfН0
298, -3442,0 -1675,8 -395,8кДж/моль
Нр-ции = НобрSO3(г)3 + НобрAl2O3(т) - Нобр Al2(SO4)3(т)
Нр-ции = -1675,8 - 395,83 + 3442,0 = +578,8 кДж
Нр-ции > 0, следовательно, реакция по энтальпийному фактору идет в обратном направлении.
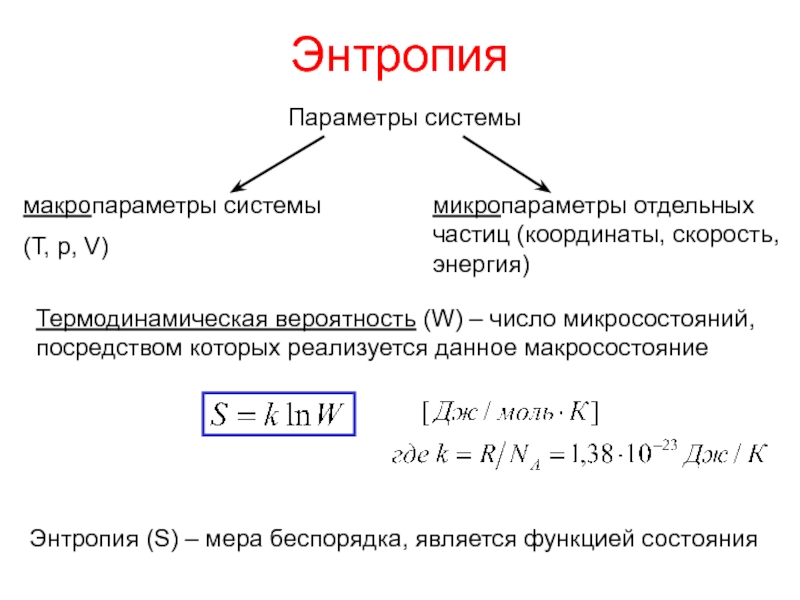
Слайд 15Энтропия
Параметры системы
макропараметры системы
(Т, р, V)
микропараметры отдельных частиц (координаты, скорость, энергия)
Термодинамическая
вероятность (W) – число микросостояний, посредством которых реализуется данное макросостояние
Энтропия
(S) – мера беспорядка, является функцией состоянияСлайд 16Изменение энтропии
в химических реакциях
Пример
Определить изменение энтропии в ходе реакции:
2С(тв.) + О2(г) = 2СО(г)
S0298 (C) = 5,74 Дж/моль·К
S0298 (O2)
= 205,04 Дж/моль·КS0298 (CO) = 197,54 Дж/моль·К
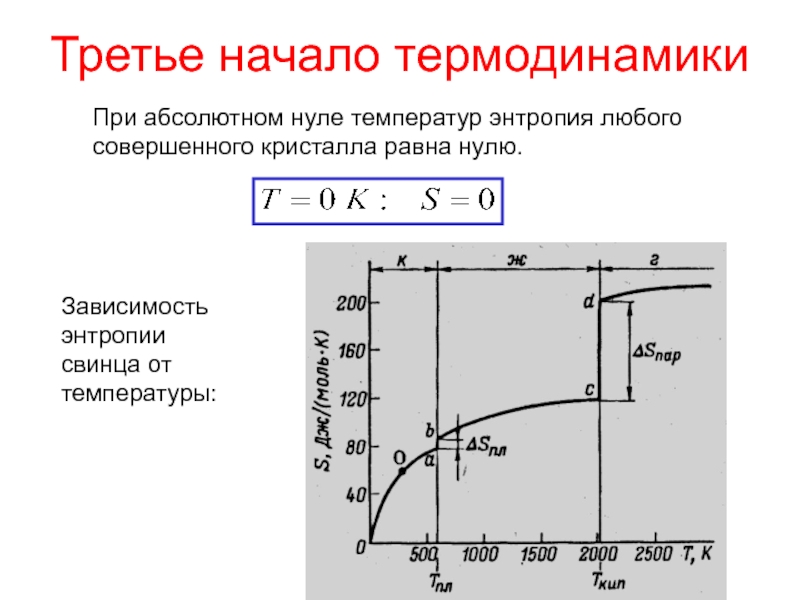
Слайд 17Третье начало термодинамики
При абсолютном нуле температур энтропия любого совершенного кристалла
равна нулю.
Зависимость энтропии свинца от температуры:
Слайд 18Самопроизвольные процессы
Принцип Бертло-Томсена. Самопроизвольный химический процесс должен сопровождаться выделением тепла.
H
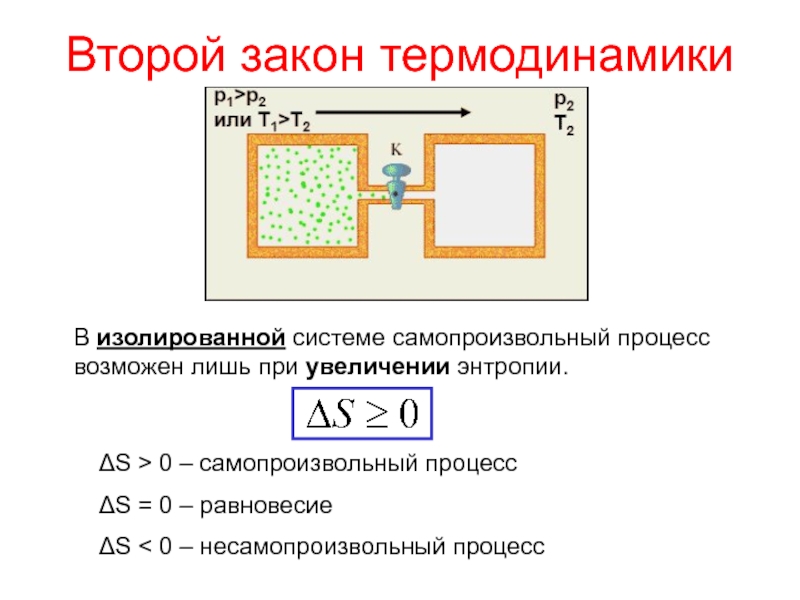
закон термодинамикиСлайд 19Второй закон термодинамики
В изолированной системе самопроизвольный процесс возможен лишь при
увеличении энтропии.
S > 0 – самопроизвольный процесс
S = 0 –
равновесиеS < 0 – несамопроизвольный процесс
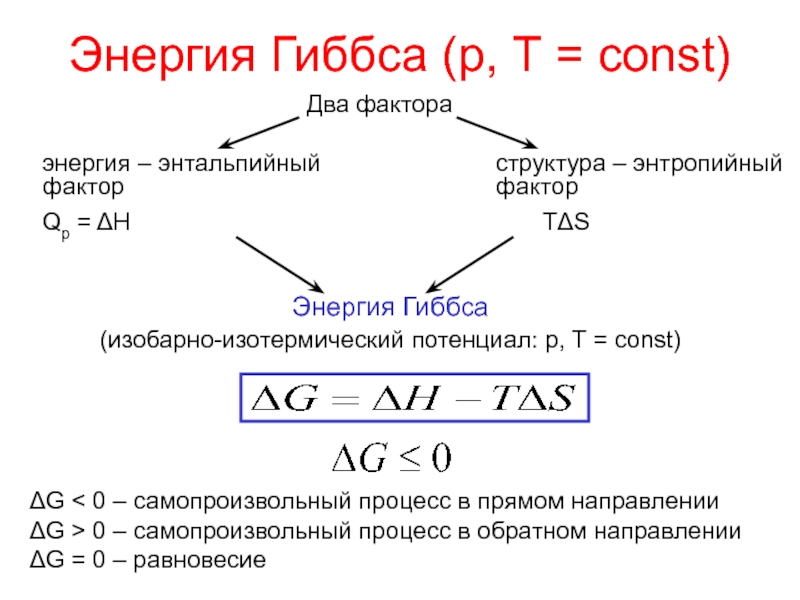
Слайд 20Энергия Гиббса (р, Т = const)
Два фактора
энергия – энтальпийный фактор
Qp
= H
структура – энтропийный фактор
TS
Энергия Гиббса
(изобарно-изотермический потенциал: р, Т = const)
G < 0 – самопроизвольный процесс в прямом направлении
G > 0 – самопроизвольный процесс в обратном направлении
G = 0 – равновесие
Слайд 21II закон т.д. для химических процессов
ΔH < 0, ΔS >
0 – самопроизвольный процесс.
2С(тв.) + О2(г) = 2СО(г)
ΔH >
0, ΔS < 0 – несамопроизвольный процесс.
3О2(г) = 2О3(г) (эл. разряд)ΔH > 0, ΔS > 0 – процесс протекает при |ΔH| < |TΔS| 2Сu2O(тв.) = 4Cu(тв) + O2(г)
ΔH < 0, ΔS < 0 – процесс протекает при |ΔH| > |TΔS| 2NO2(г) = N2O4(г)
Химическая реакция протекает самопроизвольно в том направлении, при котором происходит уменьшение энергии Гиббса:
Слайд 22Изменение энергии Гиббса
Пример
Вычислить стандартное изменение энергии Гиббса при 25 С
для термического разложения CaCO3, если ΔH0 = +178 кДж\моль, ΔS0
= +161 Дж\мольК.Может ли эта реакция протекать самопроизвольно при 25 С?
При какой температуре становится возможным самопроизвольное протекание реакции?