Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Соединения железа
Содержание
- 1. Соединения железа
- 2. Соединения железа1. Соединения железа (II)2. Железный купорос. Соль Мора3. Окисление гидроксида
- 3. Соединения железа1. Соединения железа (II)Оксид железа (II). Черное кристаллическое
- 4. Соединения железаFeO
- 5. Соединения железаГидроксид железа (II) – соединение белого
- 6. Соединения железаГидроксид железа (II) При длительном стоянии
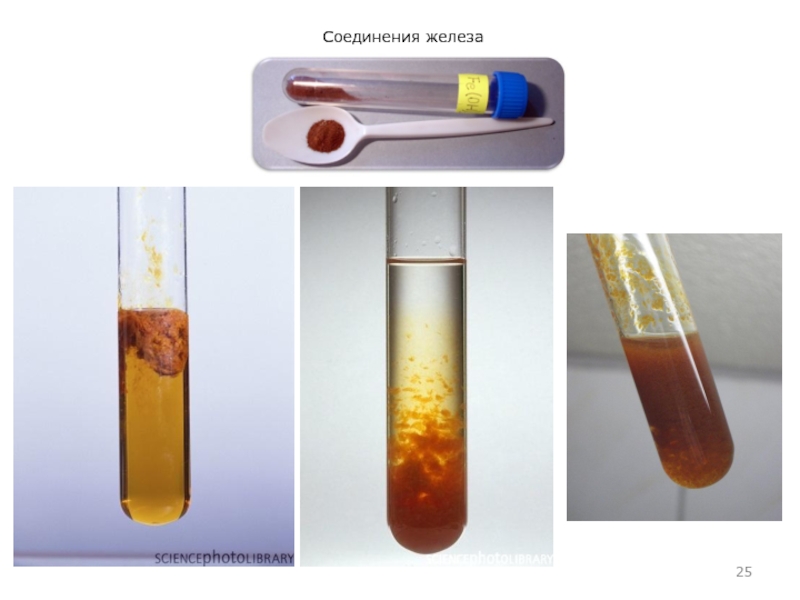
- 7. Соединения железаThe second tube from the left
- 8. Соединения железа
- 9. Соединения железаFe(OH)2
- 10. Соединения железаСоли железа(II) – сильные восстановители, хотя
- 11. Соединения железаКарбонат FeCO3, белое вещество, практически нерастворимо
- 12. Соединения железаDisplacement reaction in a test tube
- 13. Соединения железаМигрирующий в природных водах Fe(HCO3)2, попадая
- 14. Соединения железа2. Железный купорос. Соль МораСульфат FeSO4 –
- 15. Соединения железаFeSO47Н2О
- 16. Соединения железа2. Железный купорос. Соль МораХимическая формула: FeSO4·(NH4)2SO4·6H2O
- 17. Соединения железа(NH4)2Fe(SO4)2·6H2O
- 18. Соединения железа3. Окисление гидроксида железа (II) на воздухеСоединения железа (II)
- 19. Соединения железа4. Соединения железа (III)Оксид железа (IІI). Красно-коричневый или
- 20. Соединения железаОксид железа (IІI). В воде оксид
- 21. Соединения железаПри взаимодействии Fe2O3 с оксидами элементов-металлов
- 22. Соединения железаСмешанно-валентный оксид железа (II,III) Fe3O4 –
- 23. Соединения железаВзаимные переходы между оксидами железа различного
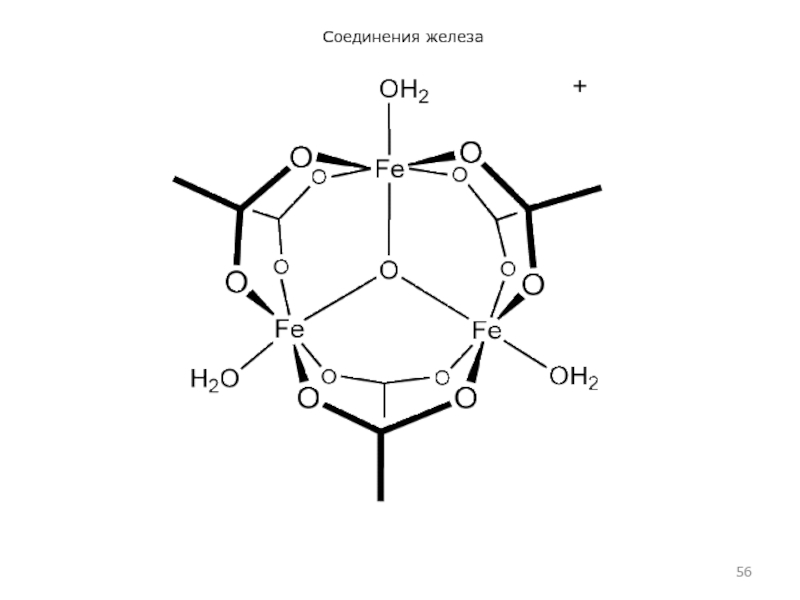
- 24. Соединения железаГидроксид железа (III) Fe(OH)3 – бурое
- 25. Соединения железа
- 26. Соединения железаОксид-гидроксид железа (III) FeO(OH) имеет несколько
- 27. Соединения железаСульфат железа (III) Fe2(SO4)3 – бесцветный
- 28. Соединения железаFeNH4(SO4)2·12H2O Fe2(SO4)3·3H2O
- 29. Соединения железаКарбонат железа (III) не существует: при
- 30. Соединения железаГИДРОЛИЗПоскольку гидроксиды Fe(ОН)2 и Fe(ОН)3 не
- 31. Соединения железаГидролиз солей железа(III) – сложный и
- 32. Соединения железаРастворы солей железа (II) имеют бледно-зеленую
- 33. Соединения железаВодный раствор солей железа (III) почти
- 34. Соединения железаВ среде с высокой концентрацией хлорид-ионов
- 35. Соединения железаНаиболее наглядно окраску ионов железа (+3)
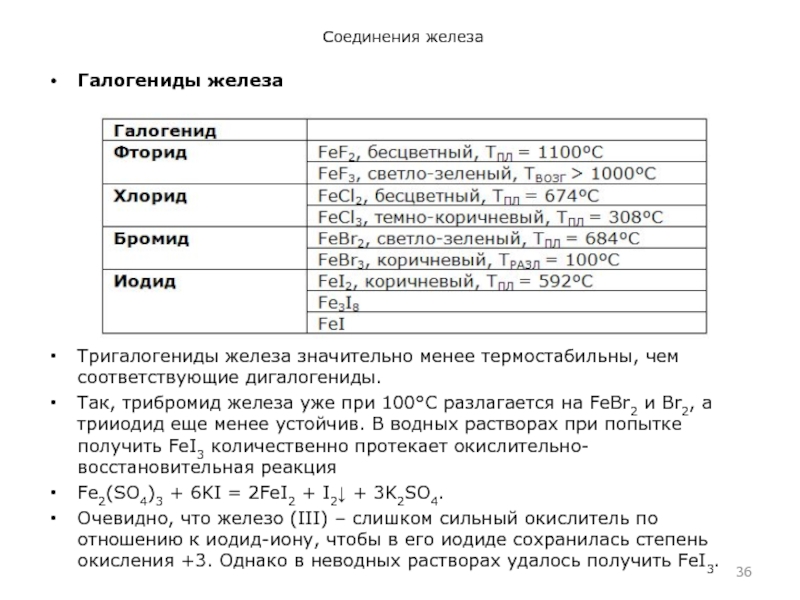
- 36. Соединения железаГалогениды железаТригалогениды железа значительно менее термостабильны,
- 37. Соединения железаFeCl2. Белый (кристаллогидрат – зеленый), плавится
- 38. Соединения железаFeСl3. Черно-коричневый (темно-красный в проходящем свете,
- 39. Соединения железа
- 40. Соединения железа
- 41. Соединения железаДигалогениды ЭХ2 – типичные солеобразные соединения
- 42. Соединения железаВзаимный гидролиз при взаимодействии с солями
- 43. Соединения железаЖелтая кровяная соль K4[Fe(CN)6] – хорошо
- 44. Соединения железаЖелтая кровяная соль K4[Fe(CN)6]
- 45. Соединения железаКрасная кровяная соль K4[Fe(CN)6] – хорошо
- 46. Соединения железаКрасная кровяная соль K4[Fe(CN)6]
- 47. Соединения железаДолгое время предполагалось, что синие осадки,
- 48. Соединения железа6. Качественные реакции на ионы железаКачественная реакция
- 49. Соединения железа
- 50. Соединения железа
- 51. Соединения железаКачественная реакция с роданидом на Fe3+
- 52. Соединения железа
- 53. Соединения железа
- 54. Соединения железа
- 55. Соединения железа6. Качественные реакции на ионы железаПри взаимодействии
- 56. Соединения железа
- 57. Соединения железа
- 58. Соединения железа
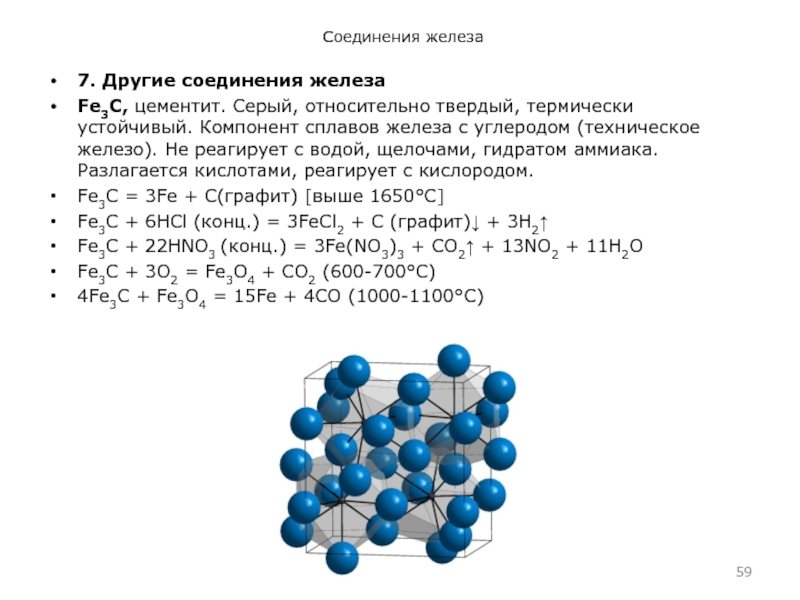
- 59. Соединения железа7. Другие соединения железаFe3C, цементит. Серый, относительно
- 60. Соединения железаФерраты (VI) Для железа характерна степень
- 61. Соединения железаПри анодном окислении железа в щелочном
- 62. Соединения железаРаствор феррата натрия (слева) в сравнении с перманганатом калия (справа)
- 63. Соединения железаВ последнее время удалось доказать существование
- 64. Соединения железаДомашнее задание1. Учить §442. Письменно выполнить тренировочные упражнения
- 65. Скачать презентанцию
Соединения железа1. Соединения железа (II)2. Железный купорос. Соль Мора3. Окисление гидроксида железа (II) на воздухе4. Соединения железа (III)5. Желтая и красная кровяные соли6. Качественные реакции на ионы железа7. Другие соединения железа
Слайды и текст этой презентации
Слайд 1
Соединения железа
Исследовать – значит видеть то, что видели все, и
думать так, как не думал никто.
А. Сент–ДьердиСлайд 2Соединения железа
1. Соединения железа (II)
2. Железный купорос. Соль Мора
3. Окисление гидроксида железа (II) на воздухе
4. Соединения
железа (III)
5. Желтая и красная кровяные соли
6. Качественные реакции на ионы железа
7. Другие соединения
железаСлайд 3Соединения железа
1. Соединения железа (II)
Оксид железа (II). Черное кристаллическое вещество. В воде
практически не растворим, хорошо растворим в кислотах, растворах щелочей. Легко
окисляется; пирофорeн. После прокаливания химическая активность и пирофорность FeO снижаются. Нестехиометрический, имеет область гомогенности Fe1−xO (0,05 х 0,11; вюстит).Проявляет амфотерные свойства (основные свойства преобладают); реагирует с кислотами, гидроксидом натрия (при сплавлении). Легко окисляется кислородом. Восстанавливается водородом, углеродом.
FeO + 2НСl (разб.) = FeCl2 + Н2O
FeO + 4HNO3 (конц.) = Fe(NO3)3 + NO2 + 2H2O
FeO + 4NaOH = Na4FeO3 (краcн.) + 2H2O (400-500°C)
4FeO + 2nH2O + O2 –() 2(Fe2O3∙nH2O)
6FeO + O2 = 2Fe3O4 (300-500°С)
FeO + H2 = Fe + H2O (350°C)
FeO + С (кокс) = Fe + CO (выше 1000°C)
Оксид железа (II) получают разложением оксалата FeC2O4 в вакууме:
FeC2O4 –(t°) FeO + СО + СО2.
Можно использовать и восстановление оксида железа (III), например, водородом, оксидом углерода (II) или металлом:
Fe2O3 + Н2 –(300°C) 2FeO + Н2О.
Слайд 5Соединения железа
Гидроксид железа (II) – соединение белого цвета, на воздухе
быстро изменяет окраску, превращаясь вследствие окисления сначала в сине-зеленый смешанно-валентный
гидратированный оксид примерного состава Fe3O4·хН2О, а затем в частично обезвоженный гидроксид FeIII бурого цвета:4Fe(OH)2 + О2 + 2Н2О = 4Fe(OH)3.
Для получения неокисленного гидроксида Fe(OH)2 необходима тщательная изоляция реагентов и прибора от кислорода воздуха.
Будучи основанием средней силы и средней растворимости, гидроксид железа (II) растворяется в кислотах. Считают вместе с тем, что у Fe(OH)2 проявляются признаки амфотерности, хотя их можно обнаружить лишь в жестких условиях. Так, обработкой 50%-ным раствором NaOH в присутствии мелкораздробленного металлического железа (для создания восстановительной среды) при кипячении можно растворить Fe(OH)2 и из полученного раствора выделить кристаллы гидроксокомплекса Na2[Fe(OH)4]·2Н2О. Известен также светло-зеленый Ba2[Fe(OH)6].
Таким образом, здесь мы имеем делo с амфотерностью – комплексообразованием: железо (II) входит в состав аниона за счет образования комплекса, где лигандами являются гидроксид-ионы.
Слайд 6Соединения железа
Гидроксид железа (II)
При длительном стоянии на воздухе осадок
становится бурым, такое изменение окраски соответствует полному окислению железа. Более
сильные окислители, например гипохлорит или бромная вода, сразу позволяют получить гидратированный оксид железа(III):2Fe(OH)2 + Br2 + 2NaOH + (х−3)Н2O = Fe2O3·xH2O + 2NaBr.
В качестве окислителя в щелочной среде можно также использовать пероксид водорода:
2Fe(OH)2 + Н2O2 + (х−3)Н2O = Fe2O3·хН2O.
Около 150°С гидроксид железа (II) разлагается:
3Fe(OH)2 –(t°) Fe3O4 + H2 + 2Н2О.
Слайд 7Соединения железа
The second tube from the left has almost pure
whitish iron(II) hydroxide
This container has a precipitate of dark greenish
iron(II) hydroxide in it.Слайд 10Соединения железа
Соли железа(II) – сильные восстановители, хотя и уступают гидроксиду.
Они обесцвечивают подкисленный раствор перманганата калия, хлорную и бромную воду,
восстанавливают дихромат до солей хрома(III). Для их окисления удобно использовать азотную кислоту:6FeSO4 + 3H2SO4 + 2HNO3 = 3Fe2(SO4)3 + 2NO + 4H2O.
Слайд 11Соединения железа
Карбонат FeCO3, белое вещество, практически нерастворимо в воде. При
нагревании до 400°С происходит термическое разложение:
3FeCO3 = Fe3O4 +
2CO2 + СО.FeCO3 выпадает в виде белого осадка при действии на растворы солей FeII карбонатов ЩЭ:
FeSO4 + Na2CO3 = FeCO3 + Na2SO4.
Во влажном состоянии осадок быстро зеленеет, а затем буреет на воздухе вследствие окисления и гидролиза с образованием Fe(OH)3. Получение индивидуального карбоната FeII требует тонкой техники эксперимента, хотя в природе он встречается в виде минерала сидерита. Карбонат железа (II) заметно растворяется в воде, содержащей СО2, с образованием существующего только в растворе гидрокарбоната: FeCO3 + CO2 + H2O ⇄ Fe(HCO3)2, который легко (особенно при концентрировании раствора и при нагревании) распадается с отщеплением углекислого газа и воды.
В присутствии О2 происходит быстрое окисление гидрокарбоната железа (II):
4Fe(HCO3)2 + О2 + 2Н2О = 4Fe(OH)3 + 8CO2.
Слайд 12Соединения железа
Displacement reaction in a test tube between iron (II)
chloride (FeCl2, in beaker at right) and sodium carbonate (Na2CO3,
left). These two salts swap ions during this reaction, forming iron (II) carbonateСлайд 13Соединения железа
Мигрирующий в природных водах Fe(HCO3)2, попадая из восстановительной среды
(в недрах Земли) в окислительную, превращается в Fe(OH)3.
В природе
это можно видеть, например, на Кавказе у источников нарзанов. Из недр земной коры (восстановительная среда) выходит практически бесцветный раствор, содержащий Fe(HCO3)2. Испаряясь и взаимодействуя с О2 воздуха, он образует на скалах буро-красные натеки, состоящие из гидроксида Fe(OH)3 и продуктов его дегидратации.Распад гидрокарбоната железа (II), сосуществующего в природных водах с гидрокарбонатами магния и кальция, при нагревании «жесткой» воды приводит к образованию накипи (например, в паровых котлах), имеющей тем более интенсивный бурый цвет, чем выше содержание Fe(HCO3)2 в воде.
Слайд 14Соединения железа
2. Железный купорос. Соль Мора
Сульфат FeSO4 – бесцветное вещество, хорошо
растворяется в воде, образует железный купорос – голубовато-зеленые кристаллы FeSO4·7H2O.
При хранении выветривается, превращаясь в белый порошок, а на воздухе постепенно желтеет вследствие окисления. Выветривание железного купороса объясняется тем, что в его структуре [Fe(H2O)6]SO4·Н2O присутствует одна молекула внешнесферной воды, которая легко покидает кристаллическую решетку.Его обезвоживание на воздухе сопровождается частичным гидролизом и окислением до основного сульфата Fe(OH)SO4 и завершается при температуре 700°С образованием оксида Fe2O3:
FeSO4·7Н2O –(100°C) FeSO4·Н2O + 6Н2O;
4FeSO4·Н2O + O2 –(150°C) 4Fe(OH)SO4+ 2Н2O;
6Fe(OH)SO4 –(450°C) 2Fe2(SO4)3 + Fe2O3 + 3H2O.
Некоторое количество FeSO4·Н2O теряет воду, не успев окислиться, и при температуре 650°С разлагается на Fe2(SO4)3, Fe2O3 и SO2.
Слайд 16Соединения железа
2. Железный купорос. Соль Мора
Химическая формула: FeSO4·(NH4)2SO4·6H2O (или Fe(NH4)2(SO4)2·6H2O). Представляет
собой неярко сине-зелёные моноклинные кристаллы. Растворяется в воде. Растворимость соли
Мора в воде равна 21,6 г безводного вещества в 100 г воды при 20°C. В кислоте растворимость несколько больше. Устойчива на воздухе. Парамагнетик. Соль Мора используется в медицине (добавляется в пищу, или в виде фармакопейного препарата, при нехватке в организме больного железа), для определения уробилина, в фармацевтике.Применение. Соль Мора применяется в научно-исследовательских работах и химических лабораториях как удобная форма препарата железа (II): для определения концентрации (титра) перманганата калия в растворах, при определении концентраций хрома и ванадия в растворах этилового спирта и эфира. В растворах ион Fe2+ даже слабыми окислителями легко окисляется до Fe3+.
10FeSO4 + 2KMnO4 + 8H2SO4 = 2MnSO4 + 5Fe2(SO4)3 + K2SO4 + 8H2O.
Также, в виде концентрированных растворов, применяется для пропитки древесины для защиты её от гниения. Имеет и другие применения.
Соль названа в честь немецкого химика Карла Фридриха Мора (1809-1879).
Слайд 18Соединения железа
3. Окисление гидроксида железа (II) на воздухе
Соединения железа (II) достаточно легко окисляются
кислородом воздуха до соединений железа (III). В кислой среде этот процесс
протекает медленнее, чем в щелочной:4Fe(ОН)2 + 2Н2О + О2 4Fe(ОН)3
В присутствии сильных окислителей этот процесс протекает очень быстро, например:
2FeSO4 + Н2О2 + H2SO4 Fe2(SO4)3 + 2Н2О
4FeSO4 + О2 + 2H2SO4 2Fe2(SO4)3 + 2Н2О
Соединения железа (III) более устойчивы к действию восстановителей. Их восстановление проводят с помощью достаточно сильных восстановителей. Например:
Fe2(SO4)3 + SO2 + 2Н2О 2FeSO4 + 2H2SO4
2FeCl3 + Cu CuCl2 + 2FeCl2
2FeCl3 + Fe 3FeCl2
2FeCl3 + H2S S + 2FeCl2 + 2HCl
Слайд 19Соединения железа
4. Соединения железа (III)
Оксид железа (IІI). Красно-коричневый или темно-коричневый Термически устойчивый
Fe2O3
– красно-коричневое кристаллическое вещество, существующее в нескольких полиморфных модификациях.
При атмосферном
давлении Fe2O3 устойчив до 1455°С, при более высокой температуре он теряет часть кислорода и переходит в Fe3O4:6Fe2O3 –(t°) 4Fe3O4 + О2.
Расплавить Fe2O3 без разложения (1562°С) можно только при повышенном давлении кислорода.
При нагревании Fe2O3 восстанавливается водородом или оксидом углерода (II):
Fe2O3 + Н2 –(t°) 2FeO + Н2О
Fe2O3 + СО –(t°) 2FeO + СО2
Fe2O3 + Fe = 3FeO (900°C)
Слайд 20Соединения железа
Оксид железа (IІI).
В воде оксид железа (III) нерастворим,
но растворяется в кислотах и проявляет амфотерные свойства, образуя при
сплавлении со щелочами или карбонатами ЩЭ ферраты (III) (по старому «ферриты»).Fe2O3 + 6HCl 2FeCl3 + 3H2O.
Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O,
Fe2O3 + 6HNO3 (разб.) 2Fe(NO3)3 + 3H2O.
Fe2O3 + Na2CO3 –(t°) 2NaFeO2 + CO2
Fe2O3 + 2NaOH –(t°) 2NaFeO2 + Н2О
Слайд 21Соединения железа
При взаимодействии Fe2O3 с оксидами элементов-металлов также получаются ферриты.
Это большая группа соединений: шпинели MFe2O4, где М = Fe,
Co, Ni, Mg, Mn, Cu; гранаты M3Fe5О12, где М – некоторые РЗЭ; ортоферриты MFeO3, где М = РЗЭ; гексаферриты, например, ВаО·6Fe2O3. Многие ферриты сочетают пространственную упорядоченность атомных магнитных моментов, ведущую к высоким значениям намагниченности, с низкой электрической проводимостью. Поэтому ферриты широко используют как магнитные материалы в радиотехнике, электронике, автоматике, вычислительной технике (ферритовые антенны, сердечники и др.) В промышленности ферриты получают спеканием при высокой температуре оксидов, карбонатов, сухих остатков совместно упаренных растворов двух солей (нитратов, сульфатов) или совместно осажденных гидроксидов, оксалатов или карбонатов.strontium ferrite
Ферриты - гранаты (Re3Fe5O12)
Слайд 22Соединения железа
Смешанно-валентный оксид железа (II,III) Fe3O4 – черное кристаллическое вещество.
Очень твердый, термически устойчивый. В прокаленном виде химически неактивен.
Fe3O4 не
растворяется в воде, взаимодействует с кислотами и щелочами. При нагревании может быть окислен до Fe2O3 и восстановлен до FeO:4Fe3O4 + O2 –(t°) 6Fe2O3
Fe3O4 + Н2 –(570°C) 3FeO + Н2О
Fe3O4 + Fe = 4FeO (900-1000°C)
Fe3O4 образуется при прокаливании Fe2O3 до t > 1400°С или выдерживании при 250°С в вакууме. Кроме этого, Fe3O4 получают действием водорода на Fe2O3 при 400°С. Для синтеза Fe3O4 предложено также нагревать железо в атмосфере углекислого газа.
Fe3O4 + 8НСl = FeCl2 + 2FeCl3 + 4Н2O.
Fe3O4 + 10HNO3 (конц.) = 3Fe(NO3)3 + NO2 + 5H2O.
Fe3O4 + 14NaOH = Na4FeO3 + 2Na5FeO4 + 7H2O (400-500°C).
Оксид железа (II,III) можно рассматривать и как двойной оксид, и как соль Fe(FeO2)2, т.е. феррит железа (II).
Слайд 23Соединения железа
Взаимные переходы между оксидами железа различного состава (по убыванию
содержания кислорода) можно представить следующей схемой:
Fe2O3 ⇄ Fe3O4 ⇄ FeO
⇄ Fe.Повышение температуры и действие восстановителей, связывающих кислород, смещает равновесие направо. Напротив, повышение содержания кислорода в системе и понижение температуры смещает равновесие влево.
Слайд 24Соединения железа
Гидроксид железа (III) Fe(OH)3 – бурое аморфное вещество; образуется
при действии щелочей на растворы солей железа(III) Fe3+ + 3ОН⎺
= Fe(OH)3, а также при гидролизе ферратов (III), полученных с помощью твердофазных реакций (ферритов). Например, реакция NaFeO2 + 2Н2О = Fe(OH)3 + NaOH раньше использовалась для получения едкого натра из Na2CO3 («способ Левига», первая стадия которого – сплавление Na2CO3 и Fe2O3, вторая – гидролиз полученного NaFeO2).Суждения о том, существуют ли гидроксид железа (III) в форме Fe(OH)3 или в виде Fe2O3·nН2О, противоречивы. По-видимому, чрезвычайно низкая растворимость рыхлого осадка, называемого гидроксидом железа (III), связана с быстро протекающей полимеризацией nFe(OH)3 [Fe(OH)3]n и с одновременным обезвоживанием из-за превращения оловых мостиков в оксоловые.
Гидроксид железа (III) – амфотерное вещество с преобладанием основных свойств, легко растворяющееся в кислотах с образованием солей FeIII и плохо растворимое даже в горячих концентрированных растворах щелочей с образованием гидроксоферратов (III) различного состава, например, Na4[Fe(OH)7], K3[Fe(OH)6] и Na5[Fe(OH)8].
Гидроксид железа(III) в водных растворах устойчив как к окислению, так и к восстановлению. Сильные окислители (бром, гипохлорит) способны перевести его в ферраты(VI).
Слайд 26Соединения железа
Оксид-гидроксид железа (III) FeO(OH) имеет несколько кристаллических полиморфных модификаций,
из которых главными являются встречающиеся в природе -FeO(OH) – гетит
и -FeO(OH) – лепидокрокит.Слайд 27Соединения железа
Сульфат железа (III) Fe2(SO4)3 – бесцветный (безводный), выделяемый при
обработке Fe2O3 концентрированной серной кислотой, хорошо растворим в воде и
образует несколько кристаллогидратов, например Fe2(SO4)3·10Н2О и Fe2(SO4)3·9Н2О (желтого цвета).При осторожном нагревании кристаллогидратов они обезвоживаются.
Безводная соль выше 600°С разлагается с выделением SO3 [Fe2(SO4)3 = Fe2O3 + 3SO3], что использовали в прежние времена для получения концентрированной серной кислоты («купоросное масло»).
Сульфат железа (III) проявляет окислительные свойства, например, по отношению к иодид- и сульфид-ионам:
Fe2(SO4)3 + 6KI = 2FeI2 + I2 + 3K2SO4
Fe2(SO4)3 + H2S = 2FeSO4 + S + H2SO4
Слайд 29Соединения железа
Карбонат железа (III) не существует: при попытке получить его
в водных растворах, например, действием соды на раствор Fe2(SO4)3, происходит
полный гидролиз как катиона Fe3+·aq (за счет щелочной среды, создаваемой содой), так и аниона СО32− (за счет кислой среды, возникающей при гидролизе Fe3+·aq):Fe2(SO4)3 + 3Na2CO3 + 3H2O = Fe(OH)3 + 3Na2SO4 + 3CO2
Слайд 30Соединения железа
ГИДРОЛИЗ
Поскольку гидроксиды Fe(ОН)2 и Fe(ОН)3 не являются сильными основаниями,
то соответствующие им соли подвергаются гидролизу. При этом соли FeIII
гидролизуются в гораздо большей степени, чем соли FeII в таких же условиях, что связано с более сильным поляризующим действием иона Fe3+ на окружающую его воду в Fe3+·aq.Вследствие гидролиза водные растворы солей FeIII имеют сильнокислую реакцию; в зависимости от концентрации их рН составляет 2-3.
Только добавление к растворам солей FeIII сильных кислот (до рН < 1) подавляет гидролиз. Напротив, под действием щелочи (или при кипячении и разбавлении) гидролиз солей FeIII усиливается, и его можно довести до конца – до образования осадка (геля) или коллоидного раствора (золя) гидроксида Fe(OH)3.
Ионы гексаакважелеза(III) входят в состав некоторых кристаллогидратов, однако в растворах в заметной концентрации присутствуют лишь в сильнокислой (рН < 0) среде. Ион [Fe(H2O)6]3+ практически бесцветен (имеет едва заметную бледно-фиолетовую окраску). Таким образом, соединения, в состав которых входит гексаакваион [Fe(H2O)6]3+ (например, Fe(ClO4)3·10Н2О, Fe(NO3)3·9Н2O), не имеют интенсивной окраски. В тоже время хорошо известно, что растворы, а зачастую и твердые препараты солей железа(III) окрашены в желтый или коричневый цвет. Это связано с протеканием гидролиза или вхождением аниона соли в координационную сферу металла.
Слайд 31Соединения железа
Гидролиз солей железа(III) – сложный и до конца не
изученный процесс. На первой стадии происходит депротонирование одной из молекул
воды:[Fe(H2O)6]3+ ⇄ [Fe(OH)(H2O)5]2+ + Н+.
Появление гидроксильной группы в координационной сфере атома железа приводит к появлению типичной для соединений железа(III) желтой окраски.
На второй стадии поликонденсации образовавшиеся гидроксокомплексы объединяются в димеры, содержащие оксомостик:
2[Fe(OH)(H2О)5]2+ ⇄ [(H2O)5Fe−O−Fe(OH2)5]4+ + Н2O.
На дальнейших стадиях частицы еще более усложняются
Слайд 32Соединения железа
Растворы солей железа (II) имеют бледно-зеленую окраску. Даже в
высокой концентрации эти растворы почти бесцветны.
На фотографиях показаны растворы
с содержанием соли железа примерно 2%.Слайд 33Соединения железа
Водный раствор солей железа (III) почти бесцветен.
Левая фотография
показывает раствор, содержащий железо (III) в разбавленной азотной кислоте (концентрация
HNO3 – 2 моль/л).На фотографии справа показан раствор с подобной концентрацией железа (III), но в дистиллированной воде.
На правой фотографии виден некоторый осадок внизу пробирки, образовавшийся благодаря гидролизу.
Слайд 34Соединения железа
В среде с высокой концентрацией хлорид-ионов (хлорида натрия или
соляной кислоты) кислые растворы, содержащие ионы железа (III) приобретают ярко-желтую
окраску.Фотография слева показывает раствор соли железа (III) в 2 М HNO3.
Фотография справа показывает такую же пробирку, но с добавкой концентрированного раствора NaCl. Цвет изменился от слабого зелено-коричневого до ярко-желтого. Желтая окраска появляется благодаря образованию в растворе иона FeCl4⎺.
Слайд 35Соединения железа
Наиболее наглядно окраску ионов железа (+3) можно продемонстрировать в
случае растворения в воде нитрата железа (III).
На фотографии слева –
концентрированный свежеприготовленный раствор нитрата железа (III). Этот раствор имеет желто-оранжевую окраску. Вероятно это происходит благодаря тому, что эта соль сильно гидролизована в водном растворе (раствор имеет острый запах азотной кислоты). На средней фотографии показан результат добавления небольшого количества разбавленной азотной кислоты (2 М) – образуется бесцветная жидкость.
На фотографии справа показан результат добавления небольшого количества разбавленной (10%-ной) соляной кислоты к бесцветной жидкости, показанной на средней фотографии.
Слайд 36Соединения железа
Галогениды железа
Тригалогениды железа значительно менее термостабильны, чем соответствующие дигалогениды.
Так, трибромид железа уже при 100°С разлагается на FeBr2 и
Вr2, а трииодид еще менее устойчив. В водных растворах при попытке получить FeI3 количественно протекает окислительно-восстановительная реакция Fe2(SO4)3 + 6KI = 2FeI2 + I2 + 3K2SO4.
Очевидно, что железо (III) – слишком сильный окислитель по отношению к иодид-иону, чтобы в его иодиде сохранилась степень окисления +3. Однако в неводных растворах удалось получить FeI3.
Слайд 37Соединения железа
FeCl2. Белый (кристаллогидрат – зеленый), плавится и кипит без
разложения. Летуч в потоке НСl при нагревании, в газе –
димер Fe2Cl4. На воздухе желтеет вследствие окисления. Хорошо растворяется в холодной воде (гидролиз по катиону) и хлороводородной кислоте. Разлагается кипящей водой, кислотами, щелочами, гидратом аммиака. Типичный восстановитель, при стоянии раствора окисляется растворенным в воде O2. Восстанавливается водородом. Вступает в реакции обмена и комплексообразования.FeCl2 + Н2O = FeCl(OH) + НСl (кип.)
FeCl2 (т) + H2SO4 (конц., гор.) = FeSO4 + 2HCl
FeCl2 + 4HNO3 (конц.) = Fe(NO3)3 + NO2 + 2HCl + H2O (кип.)
FeCl2 + 2NaOH (разб.) = Fe(OH)2 + 2NaCl (в атмосфере N2)
FeCl2 + 2(NH3∙Н2O) [конц.] = Fe(OH)2 + 2NH4Cl (80°С, в атмосфере N2)
4FeCl2 + 3O2 = 2Fe2O3 + 4Cl2 (450-480°C)
4FeCl2 + 6H2O + O2 = 4FeO(OH) + 8HCl (кип.)
FeCl2 + H2 = Fe + 2HCl (выше 500°С)
2FeCl2 (p) + Cl2 = 2FeCl3
Слайд 38Соединения железа
FeСl3. Черно-коричневый (темно-красный в проходящем свете, зеленый в отраженном
свете). При нагревании плавится (красная жидкость), кипит и разлагается; в
жидкости и паре – димер Fe2Cl6. Хорошо растворяется в воде (сильный гидролиз по катиону) и в хлороводородной кислоте. Кристаллогидрат FeCl3·6Н2O имеет строение [Fe(H2O)4Cl2]Cl·2Н2O. Реагирует с кипящей водой, щелочами. Слабый окислитель и восстановитель. Вступает в реакции обмена и комплексообразования.2FeCl3 ⇄ 2FeCl2 + Cl2 (500°С)
FeCl3 + 2H2O (гор.) = FeCl(OH)2 + 2HCl
2FeCl3 + 3H2O (пар) = Fe2O3 + 6HCl (350-500°C)
FeCl3 + НСl (конц.) + H2O = H[FeCl4] + H2O = [FeCl4]⎺ + H3O+
2FeCl3 (т) + 3H2SO4 (конц., гор.) = Fe2(SO4)3 + 6HCl
2FeCl3 + 6NаОН (разб., гор.) + (n−3)H2O = Fe2O3∙nH2O + 6NaCl
2FeCl3 + 6(NH3∙Н2O) [конц.] + (n−3)H2O = Fe2O3∙nH2O + 6NH4Cl
4FeCl3 + 3O2 (воздух) = 2Fe2O3 + 3Cl2 (350-500°C)
2FeCl3 + 3Na2S = 2FeS + S + 6NaCl
2FeCl3 + H2 = 2FeCl2 + 2HCl (250-300°C)
2FeCl3 + Fe = 3FeCl2 (кип. в тетрагидрофуране)
2FeCl3 + 2H2O + SO2 = 2FeCl2 + H2SO4 + 2HCl
Слайд 41Соединения железа
Дигалогениды ЭХ2 – типичные солеобразные соединения с ионным характером
химической связи. Об этом говорят сравнительно высокие ТПЛ, закономерно понижающиеся
от фторидов к иодидам. Дифториды мало растворимы в воде, остальные дигалогениды, напротив, растворяются хорошо.Для синтеза безводных дифторида и дихлорида железа сначала получают галогенированием металлического железа соответствующие тригалогениды, а затем их восстанавливают водородом при нагревании:
2FeX3 + Н2 –(t°) 2FeX2 + 2HX.
Нагревание иода с избытком железа в запаянной ампуле приводит к образованию дииодида FeI2, который можно синтезировать также нагреванием железа в токе паров иода и водорода или термическим разложением Fe(CO)4I2.
Безводные тригалогениды железа можно получить взаимодействием железа с галогенами: 2Fe + 3Х2 = 2FeX3. Исключение представляет иод, при растирании которого с порошком Fe или при нагревании железа с иодом в воде образуется соединение состава Fe3I8 (FeI2·2FeI3). Взаимодействие последнего с поташом может служить методом получения иодида калия из иода:
Fe3I8 + 4K2СО3 = 8KI + Fe3O4 + 4СО2.
Все безводные галогениды элементов триады железа гигроскопичны.
Из водных растворов галогениды элементов триады железа выделяются в виде кристаллогидратов различного состава, причем КЧ металла в них равно 6. В качестве примера можно привести FeF2·8Н2О, FeCl2·4Н2О, FeBr2·6Н2О, FeI2·4Н2О, FeF3·3Н2О, FeF3·4,5Н2О, FeCl3·6Н2О.
Слайд 42Соединения железа
Взаимный гидролиз при взаимодействии с солями железа. При барботировании
H2S через раствор солей железа (III) происходит окислительно-восстановительное взаимодействие
2FeCl3 +
H2S = 2FeCl2 + S + 2HCl.Сульфид аммония осаждает из растворов солей железа (III) сульфид FeS:
2FeCl3 + 3(NH4)2S = 2FeS + S + 6NH4Cl.
Взаимодействие ионов железа(III) с сульфид-ионами зависит от кислотности среды. В кислом и нейтральном растворах протекает окислительно-восстановительная реакция, сопровождающаяся помутнением раствора вследствие образования серы.
В щелочных растворах окислительная активность железа(III) понижается, поэтому реакция с сульфидами щелочных металлов, растворы которых имеют сильнощелочную среду вследствие гидролиза, протекает преимущественно с выпадением осадка гидроксида:
Fe2(SO4)3 + 3Na2S + (х+3)Н2O = Fe2O3·xH2O + 3Na2SO4 + 3H2S.
Считается, что при взаимодействии солей железа(III) с растворами карбонатов, сульфитов, сульфидов и силикатов происходит выпадение осадка гидроксида вследствие взаимно усиливающегося гидролиза:
Fe2(SO4)3 + 3Na2CO3 + xH2O = Fe2O3·xH2O + 3CO2 + 3Na2SO4.
Слайд 43Соединения железа
Желтая кровяная соль K4[Fe(CN)6] – хорошо растворимое в воде
желтое кристаллическое вещество, разлагающееся при прокаливании.
K4[Fe(CN)6] –(t°) 4KCN + FeC2
+ N2.В кислой среде гексацианоферрат (II)-анион не разрушается, а по обменной реакции превращается в кислоту H4[Fe(CN)6], образующую осадок, умеренно растворимый в воде и спирте, но не растворимый в эфире.
Анион [Fe(CN)6]4- с различными катионами образует малорастворимые соединения, например Ba2[Fe(CN)6], K2Ca[Fe(CN)6] и др. В растворах при взаимодействии с ионами Fe2+ выпадает белый осадок K2Fe[Fe(CN)6], с ионами Fe3+ – синий осадок «берлинской лазури». Под действием окислителей желтая кровяная соль превращается в красную кровяную соль K3[Fe(CN)6]:
2K4[Fe(CN)6] + Cl2 = 2K3[Fe(CN)6] + 2KCl.
В лаборатории желтую кровяную соль получают, добавляя к раствору соли FeII цианид калия, при этом наблюдают две стадии:
Fe2+ + 2CN⎺ = Fe(CN)2 (желто-бурый осадок)
Fe(CN)2 + 4KCN = K4[Fe(CN)6] (раствор)
На втором этапе происходит растворение первоначально выпавшего осадка Fe(CN)2, а при упаривании или охлаждении раствора кристаллизуется K4[Fe(CN)6]·3Н2О.
Слайд 45Соединения железа
Красная кровяная соль K4[Fe(CN)6] – хорошо растворимое в воде
красно-оранжевое кристаллическое вещество
K3[Fe(CN)6] является сильным окислителем, особенно активно действующим в
щелочной среде Например, металлический вольфрам красной кровяной солью легко окисляется, переходя в раствор:W + 6K3[Fe(CN)6] + 8KОН = 6K4[Fe(CN)6] + K2WO4 + 4Н2О.
Нагревание K3[Fe(CN)6] с раствором KОН (1:1) сопровождается выделением О2 и образованием K4[Fe(CN)6]:
4K3[Fe(CN)6] + 4KОН = 4K4[Fe(CN)6] + O2 + 2H2O.
При взаимодействии красной кровяной соли с растворами солей Fe3+ возникает зеленовато-коричневое окрашивание, а с Fe2+ – синий осадок (или синее окрашивание при малых концентрациях). Поэтому гексацианоферраты (II) и (III) издавна использовали как реактивы для определения соединений FeIII и FeII соответственно.
Слайд 47Соединения железа
Долгое время предполагалось, что синие осадки, образующиеся в ходе
качественного химического анализа при взаимодействии желтой и красной кровяной соли
с солями железа (III и II), имеют разный состав: при определении FeIII получается так называемая берлинская лазурь Fe4III[FeII(CN)6]3, а при определении FeII – турнбулева синь Fe3II[FeIII(CN)6]2:4Fe3+ + 3[FeII(CN)6]4− = Fe4III[FeII(CN)6]3
3Fe2+ + 2[FeIII(CN)6]3− = Fe3II[FeIII(CN)6]2
Из данных -резонансной спектроскопии следует, однако, что оба эти соединения представляют собой одно и то же вещество – гидратированный комплекс Fe4III[FeII(CN)6]3·nH2O.
Образование синих осадков, которые использовались как красители, стало основанием для еще одного названия желтой и красной кровяной соли – «железосинеродистый» и «железистосинеродистый» калий.
Известна, кроме того, «растворимая берлинская лазурь» состава KFeIIIFeII(CN)6, образование которой можно описать уравнениями реакций
K4[Fe(CN)6] + FeCl3 = KFeIIIFeII(CN)6 + 3KCl
K3[Fe(CN)6] + FeCl2 = KFeIIIFeII(CN)6 + 2KCl
Слайд 48Соединения железа
6. Качественные реакции на ионы железа
Качественная реакция с красной кровяной
солью K3[Fe(CN)6] на Fe2+
K3[Fe(CN)6] + FeCl2 = KFeIIIFeII(CN)6 + 2KCl
(синий осадок «турнбулевой сини»)Качественная реакция с желтой кровяной солью K4[Fe(CN)6] на Fe3+
K4[Fe(CN)6] + FeCl3 = KFeIIIFeII(CN)6 + 3KCl (синий осадок «берлинской лазури»)
Слайд 51Соединения железа
Качественная реакция с роданидом на Fe3+
Роданиды (тиоцианаты) калия
или аммония образуют с солями железа (III) красный роданид железа,
который по виду напоминает кровь. Обычно эту реакцию записывают так:3KSCN + FeCl3 ⇄ [Fe(SCN)3] + 3KCl
В действительности образуется одновременно несколько комплексов железа, которые находятся в динамическом равновесии: [Fe(SCN)]2+, [Fe(SCN)2]+, [Fe(SCN)3], [Fe(SCN)4]⎺.
Данную реакцию используют в аналитической химии для обнаружения трехвалентного железа в растворе.
Реакция очень чувствительна, с ее помощью можно обнаружить примесь Fe(III) в солях Fe(II) или других реактивах, например – в азотной кислоте.
Образование роданида железа используют для имитации крови во время химических опытов.
Слайд 55Соединения железа
6. Качественные реакции на ионы железа
При взаимодействии соединений железа (III)
с ацетатом натрия образуются основные ацетаты железа (III) темно-красного цвета.
Качественная
реакция на ацетат-ионы При добавлении FeCl3 к ацетат-ионам появляется красная окраска, обусловленная образованием основного ацетата железа:
8CH3COO⎺ + 3Fe3+ + 2H2O [Fe3(OH)2(CH3COO)6]+ + 2CH3COOH.
Упрощенный состав – Fe(CH3COO)3.
Выполнение реакции. 2-3 мл раствора уксусной кислоты вносят в пробирку и добавляют 1 каплю 5%-го свежеприготовленного раствора FeCl3. Появление красной окраски указывает на наличие ацетат-ионов в растворе. При нагревании окрашенного раствора происходит гидролиз, в результате которого выпадает бурый осадок.
Основный ацетат железа имеет довольно сложное строение. Координационная сфера этого вещества содержит не один, а три атома металла (в данном случае – железа), которые расположены по вершинам правильного треугольника вокруг центрального атома кислорода. Такие комплексы называются трехъядерными (в общем случае – полиядерными). Аналогичный комплекс с ацетатом образует и трехвалентный хром.
Слайд 59Соединения железа
7. Другие соединения железа
Fe3C, цементит. Серый, относительно твердый, термически устойчивый.
Компонент сплавов железа с углеродом (техническое железо). Не реагирует с
водой, щелочами, гидратом аммиака. Разлагается кислотами, реагирует с кислородом.Fe3C = 3Fe + С(графит) [выше 1650°С]
Fe3C + 6НСl (конц.) = 3FeCl2 + С (графит) + 3H2
Fe3C + 22НNО3 (конц.) = 3Fe(NO3)3 + CO2 + 13NO2 + 11H2O
Fe3C + 3O2 = Fe3O4 + CO2 (600-700°C)
4Fe3C + Fe3O4 = 15Fe + 4CO (1000-1100°C)
Слайд 60Соединения железа
Ферраты (VI)
Для железа характерна степень окисления +6, которую
оно проявляет в ферратах (VI) состава (ЩЭ)2FeO4 и (ЩЗЭ)FеО4. Существует
несколько способов получения ферратов (VI), например, прокаливанием твердых реагентов:Fe2O3 + 3KNO3 + 4KОН –(t°) 2K2FeO4 + 3KNO2 + 2H2O
Феррат калия придает образующемуся расплаву красно-фиолетовую окраску.
Ферраты ЩЭ и ЩЗЭ можно получить и в растворе, окисляя соединения FeII или FeIII хлором или бромом. Как и в других случаях, для стабилизации высокой степени окисления элементов-металлов необходима щелочная среда:
1) FeCl3 + 3KОН = Fe(OH)3 + 3KCl
2) 2Fe(OH)3 + 3Сl2 + 10KОН = 2K2FeO4 + 6KСl + 8Н2О
Для синтеза феррата калия можно использовать и окисление металлического железа щелочным раствором нитрата калия или пероксидом калия:
Fe + 3KNO3 + 2KOH = K2FeO4 + 3KNO2 + Н2О
Fe + 3K2O2 + 2H2O = K2FeO4 + 4KОН.
Слайд 61Соединения железа
При анодном окислении железа в щелочном электролите также образуется
феррат (VI):
Fe + 2KOH + 2Н2О –(электролиз) K2FeO4 + 3Н2.
Лучше
всего изучены и сравнительно легко получаются ферраты (VI) калия и бария, но даже они термически неустойчивы. Так, при нагревании малиново-красного раствора K2FeO4 происходит разложение:4K2FeO4 + 10Н2О = 4Fe(OH)3 + 3О2 + 8KОН.
Кристаллический K2FeO4 разлагается с отщеплением кислорода при ~200°С, BaFeO4 – при 120°С. Феррат бария (из раствора выпадает красный BaFeO4·Н2О) практически нерастворим и в этом отношении подобен BaSO4. Строение феррат-иона тетраэдрическое, связи железо–кислород преимущественно ковалентные.
Ферраты (VI) проявляют свойства сильных окислителей. Соединения железа (VI) особенно неустойчивы в кислой среде:
4K2FeO4 + 10H2SO4 = 2Fe2(SO4)3 + 3O2 + 4K2SO4 + 10H2O
2K2FeO4 + 16HCl = 2FeCl3 + 3Cl2 + 4KCl + 8H2O
2K2FeO4 + 2NH3 + 2H2O = 2Fe(OH)3 + N2 + 4KOH
2K2FeO4 + 3H2S + 2H2O = 2Fe(OH)3 + 3S + 4KOH
Из-за сильного поляризующего действия протона на феррат-анион кислота H2FeO4 и соответствующий ангидрид FeO3 до настоящего времени в индивидуальном состоянии не выделены.








































![Соединения железа Соединения железаЖелтая кровяная соль K4[Fe(CN)6] – хорошо растворимое в воде желтое Соединения железаЖелтая кровяная соль K4[Fe(CN)6] – хорошо растворимое в воде желтое кристаллическое вещество, разлагающееся при прокаливании.K4[Fe(CN)6] –(t°)](/img/tmb/4/307161/f91cf9bda39e716962044a6b09edb05a-800x.jpg)
![Соединения железа Соединения железаЖелтая кровяная соль K4[Fe(CN)6] Соединения железаЖелтая кровяная соль K4[Fe(CN)6]](/img/thumbs/06f5529b99fba04c8c30ee8959f61e59-800x.jpg)
![Соединения железа Соединения железаКрасная кровяная соль K4[Fe(CN)6] – хорошо растворимое в воде красно-оранжевое Соединения железаКрасная кровяная соль K4[Fe(CN)6] – хорошо растворимое в воде красно-оранжевое кристаллическое веществоK3[Fe(CN)6] является сильным окислителем, особенно](/img/thumbs/3c238499772bf2ada0fceaefc4c8870b-800x.jpg)
![Соединения железа Соединения железаКрасная кровяная соль K4[Fe(CN)6] Соединения железаКрасная кровяная соль K4[Fe(CN)6]](/img/thumbs/7ec857a0d0757877fd997b1157e59337-800x.jpg)

![Соединения железа Соединения железа6. Качественные реакции на ионы железаКачественная реакция с красной кровяной солью Соединения железа6. Качественные реакции на ионы железаКачественная реакция с красной кровяной солью K3[Fe(CN)6] на Fe2+K3[Fe(CN)6] + FeCl2 =](/img/thumbs/0efcb12f00f1335498aa58fbaf99063a-800x.jpg)