Слайд 1СОСТАВ ЗЕМНОЙ КОРЫ И ЛИТОСФЕРЫ
Слайд 2По данной теме - минералогии
выполняются лабораторные работы:
«Физико-диагностические свойства
минералов»
«Важнейшие породообразующие минералы»
Ход этих работ описан в файле
«Текст практикума, часть 1-ая». Дома Вы можете проверить свойства соли и тех минералов, которые имеются в вашей местности.
Приглашаем посетить также Учебный геологический музей ЮУрГУ,
кор. 1А(хим. факультет), ауд. 101
Скачать базу данных можно по ссылке:
https://cloud.mail.ru/public/LpTt/7JVTkkPnF
Student --studentassusu
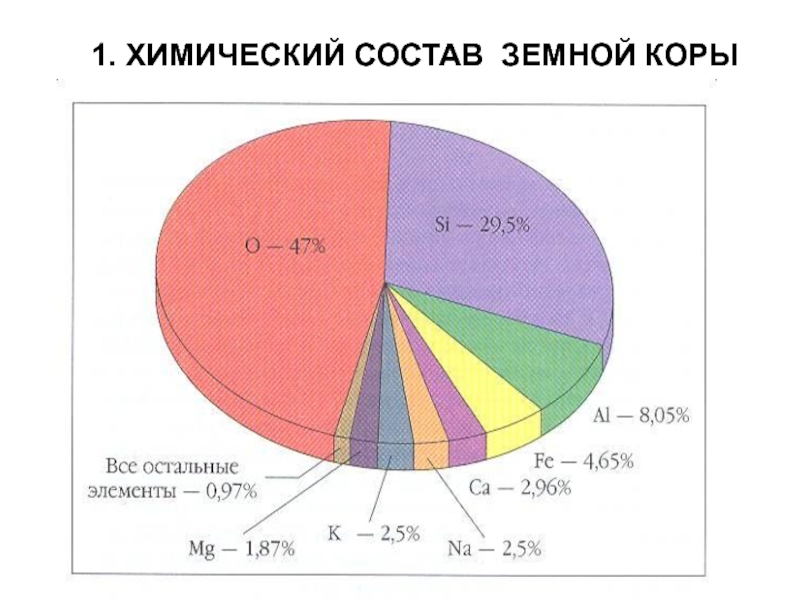
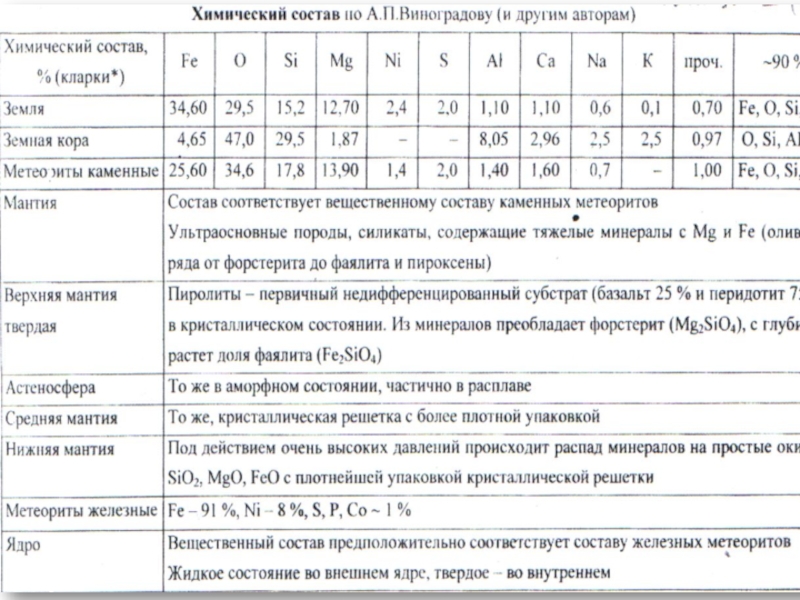
Слайд 31. ХИМИЧЕСКИЙ СОСТАВ ЗЕМНОЙ КОРЫ
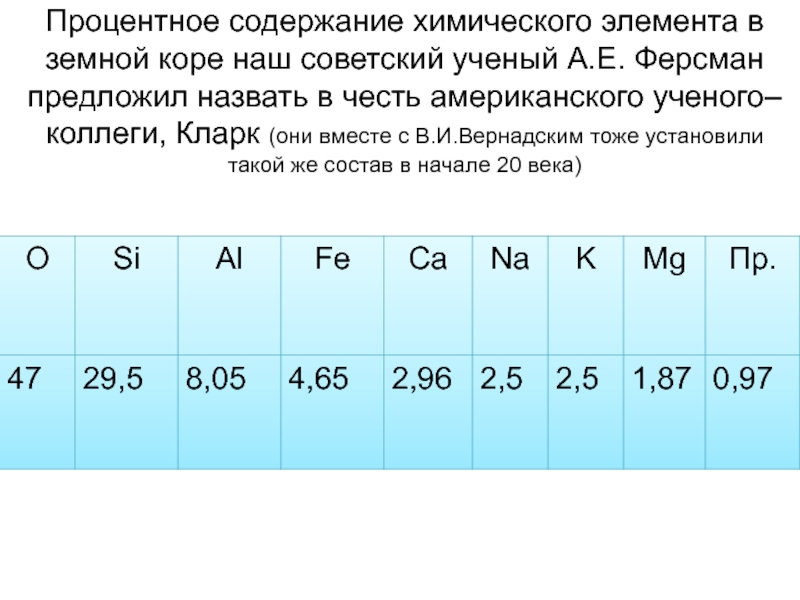
Слайд 4Процентное содержание химического элемента в земной коре наш советский ученый
А.Е. Ферсман предложил назвать в честь американского ученого–коллеги, Кларк (они
вместе с В.И.Вернадским тоже установили такой же состав в начале 20 века)
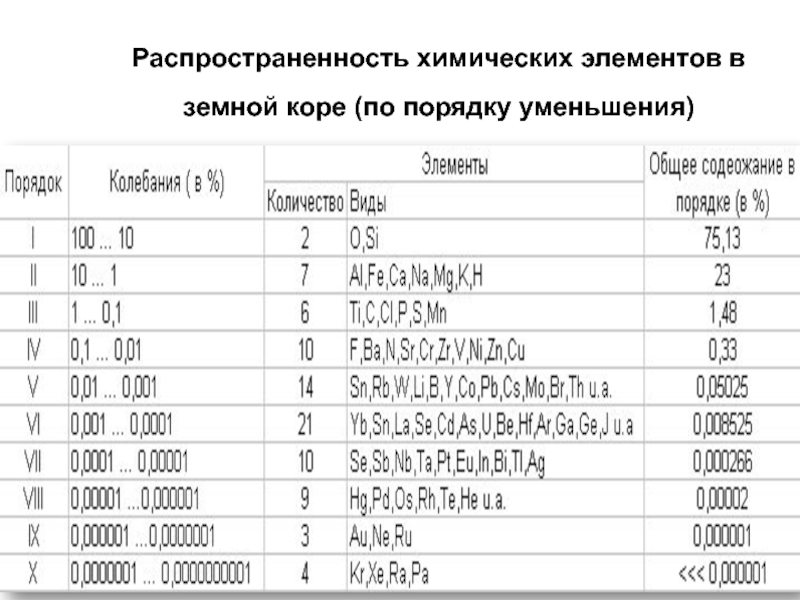
Слайд 6Распространенность химических элементов в земной коре (по порядку уменьшения)
Слайд 7В целом, мы видим:
В земной коре установлено
около 85 химических элементов таблицы Менделеева.
Химические элементы (ХЭ) распределены
крайне неравномерно:
на долю 8 приходится около 99 %, из которых на долю 2 – более 75%;
Все другие ХЭ встречаются в малом количестве – менее тысячных – миллионных %, поэтому и месторождения других металлов кроме алюминия и железа очень трудно найти и содержание металлов в них будет первые или десятые доли %.
ХЭ в земной коре в свободном виде не встречаются, а образуют твердые химические соединения – минералы.
Слайд 8Химические элементы
Встречаются в земной коре и недрах Земли в виде
природных химических соединения: SiO2, FeS2 и другие – минералов (примитивное
понятие).
Псевдосталактиты халцедона до 4 см длиной. Старая Ситня,
Московская область.
Слайд 92. Основы минералогии
Минералы - составные части горных пород
в виде твердых
- природных индивидов (кристаллов или зерен )
- определенного химического состава,
- упорядоченной (кристаллической) внутренней структуры,
с характерными химическими и физическими
свойствами.
Кристаллами принято называть индивиды относительно правильной геометрической формы, напоминающие многогранники, видимые на глаз.
Зерны – индивиды мелкие (менее 1 мм) или (и) произвольной неправильной формы.
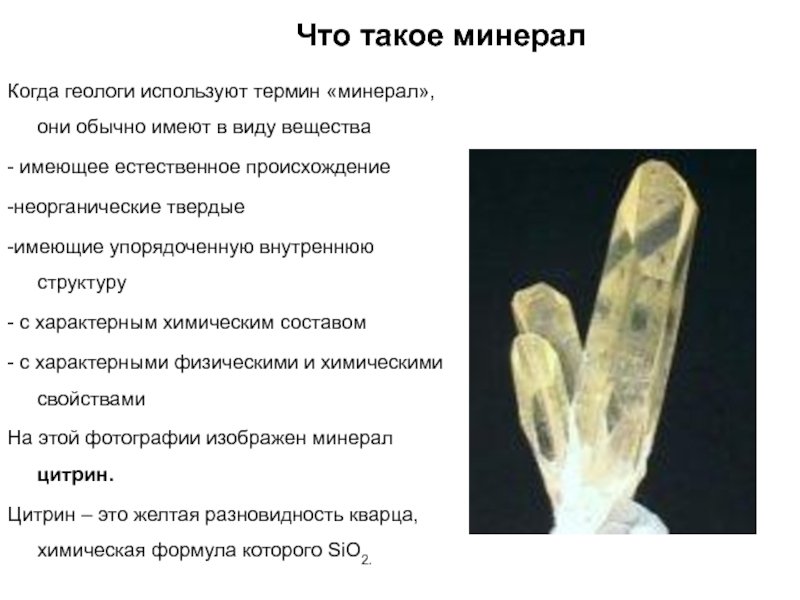
Слайд 10Что такое минерал
Когда геологи используют термин «минерал», они обычно имеют
в виду вещества
- имеющее естественное происхождение
-неорганические твердые
-имеющие упорядоченную внутреннюю
структуру
- с характерным химическим составом
- с характерными физическими и химическими свойствами
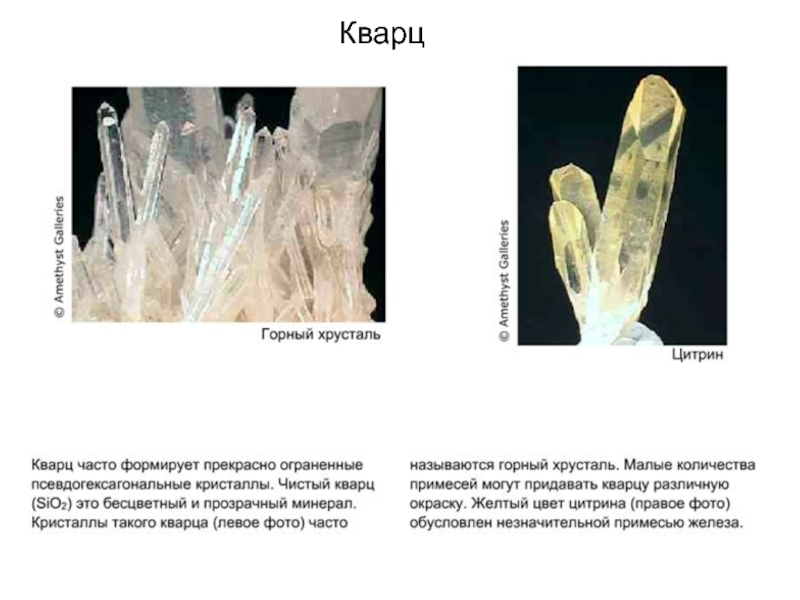
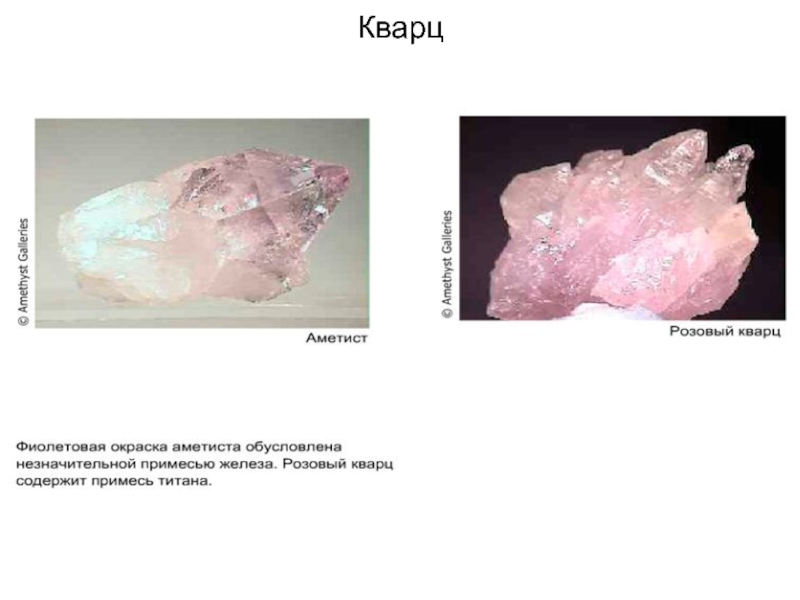
На этой фотографии изображен минерал цитрин.
Цитрин – это желтая разновидность кварца, химическая формула которого SiO2.
Слайд 11Кристаллы граната в форме ромбододекаэдров
Альмандин. Мама, Вост. Сибирь, Россия. Кристаллы
до 2,5 см. Образцы: Мин. Музей им. А.Е. Ферсмана РАН.
(К-4824, К-4825, обмен 2000 г.). Фото: А.А. Евсеев.
Слайд 12Что такое минерал
Голубой минерал на этой фотографии – кианит –
Al2SiO5
Слайд 131. Кристалл пирита, 4,5 см. Навахун, Испания.
2. «Пиритовый доллар» -
дисковый сферолит пирита. Диаметр 8 см. Иллинойс, США.
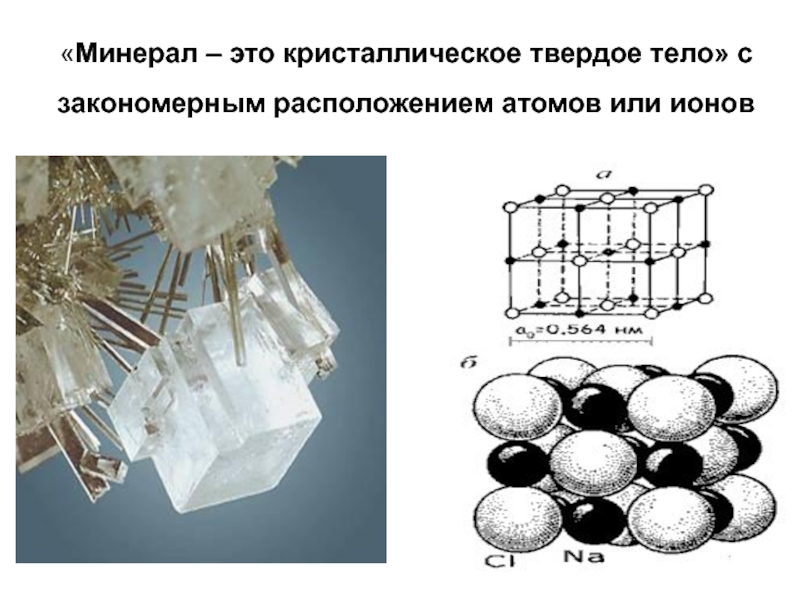
Слайд 14«Минерал – это кристаллическое твердое тело» с закономерным расположением атомов
или ионов
Слайд 15Образование любого минерала
Можно представить как присоединение химических элементов друг ко
другу на минимальное расстояние, которое зависит:
от строения атомов,
атомных
или ионных радиусов химических элементов и
типа химических связей
Слайд 16Внутренняя структура минералов
Мы можем условно рассматривать ионы в структуре минералов
как сферы различного размера. Ионы в противоположными зарядами образуют связи.
Формирование внутренней структуры растущих кристаллов минералов зависит от размера ионов, слагающих данный минерал. На этом слайде показаны относительные размеры ионов, слагающих наиболее распространенные минералы. Цифры соответствуют тонному радиусу в Ангстрёмах (Ангстрёмы = 0,00000001 см.
Слайд 17Периодическая система
Периодическая система включает все известные химические элементы. Атомный номер
химического элемента соответствует числу протонов в ядре атома данного элемента
в ядре натрия (Na) 11 протонов, в ядре титана (Ti) 22 протона и т. Д. У всех элементов в первой колонке периодической системы (H, Li, Na, K, Rb, Cs и Fr) есть только один валентный электрон ( т. Е. электрон внешней электронной оболочки). Атомы этих элементов с легкостью отдают этот электрон другим атомам, например атомам галогенных элементов (F, Cl, Br, I и At). В результате между этими атомами образуются ионные химические связи.
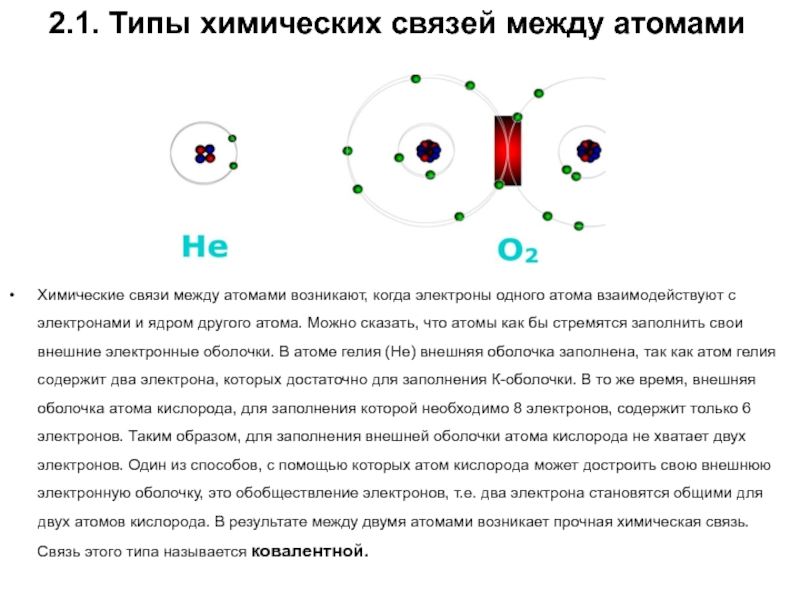
Слайд 182.1. Типы химических связей между атомами
Химические связи между атомами возникают,
когда электроны одного атома взаимодействуют с электронами и ядром другого
атома. Можно сказать, что атомы как бы стремятся заполнить свои внешние электронные оболочки. В атоме гелия (He) внешняя оболочка заполнена, так как атом гелия содержит два электрона, которых достаточно для заполнения К-оболочки. В то же время, внешняя оболочка атома кислорода, для заполнения которой необходимо 8 электронов, содержит только 6 электронов. Таким образом, для заполнения внешней оболочки атома кислорода не хватает двух электронов. Один из способов, с помощью которых атом кислорода может достроить свою внешнюю электронную оболочку, это обобществление электронов, т.е. два электрона становятся общими для двух атомов кислорода. В результате между двумя атомами возникает прочная химическая связь. Связь этого типа называется ковалентной.
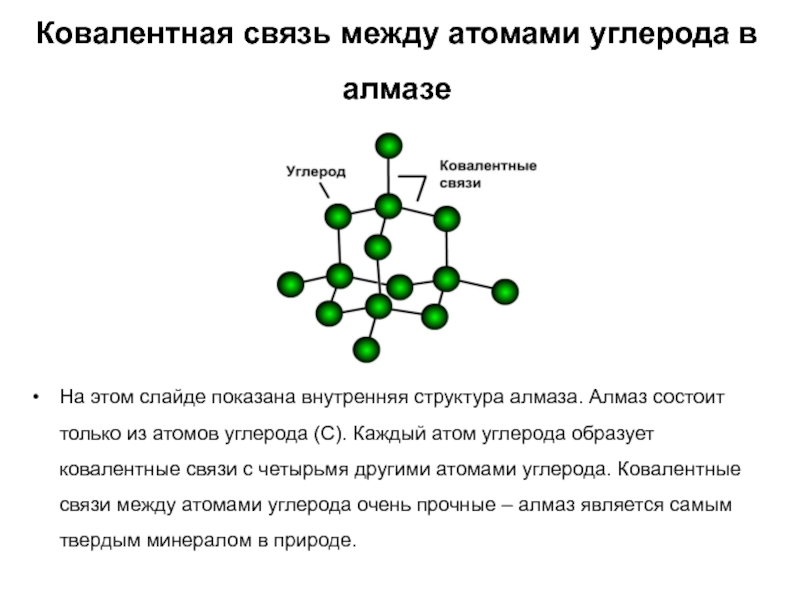
Слайд 19Ковалентная связь между атомами углерода в алмазе
На этом слайде показана
внутренняя структура алмаза. Алмаз состоит только из атомов углерода (С).
Каждый атом углерода образует ковалентные связи с четырьмя другими атомами углерода. Ковалентные связи между атомами углерода очень прочные – алмаз является самым твердым минералом в природе.
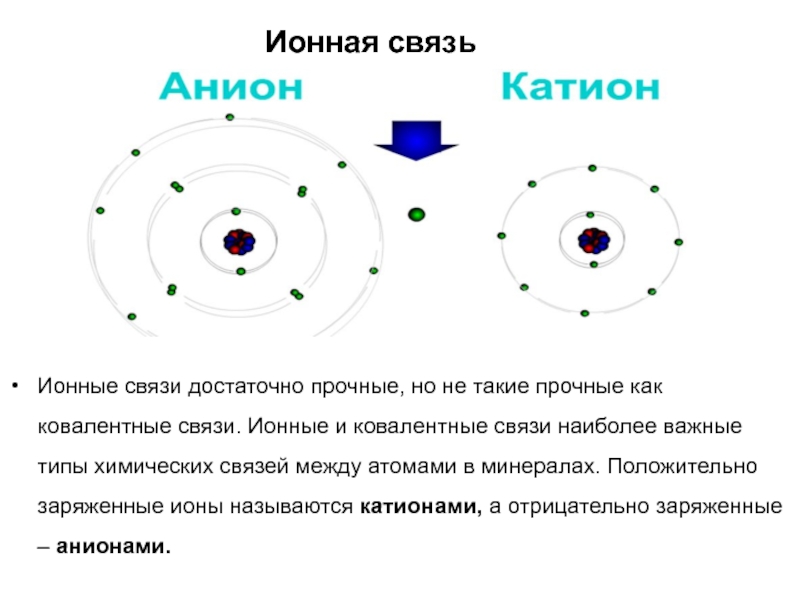
Слайд 20Ионная связь
Атом хлора на этом слайде достраивает
свою электронную оболочку другим способом. Хлору (Cl) требуется один электрон,
чтобы достроить свою внешнюю электронную оболочку. Атом натрия (Na), наоборот, имеет один «лишний» электрон ( на его внешней оболочке только один электрон, и необходимо ещё 7, чтобы ее достроить). Если атом Cl сближается с атомом Na, он может «отобрать» у Na один электрон. Если это происходит, атом Cl приобретает электрический заряд. Ион хлора имеет символ Cl. Поскольку атом натрия теряет одну частицу с отрицательным зарядом (электрон), он становится положительно заряженным. Символ иона натрия Na. Ионы натрия и хлора, имеющие противоположные по знаку заряды, притягиваются друг к другу. Поэтому когда атом хлора «отбирает» электрон у атома натрия, между ними возникает химическая связь.
Слайд 21Ионная связь
Ионные связи достаточно прочные, но не такие прочные как
ковалентные связи. Ионные и ковалентные связи наиболее важные типы химических
связей между атомами в минералах. Положительно заряженные ионы называются катионами, а отрицательно заряженные – анионами.
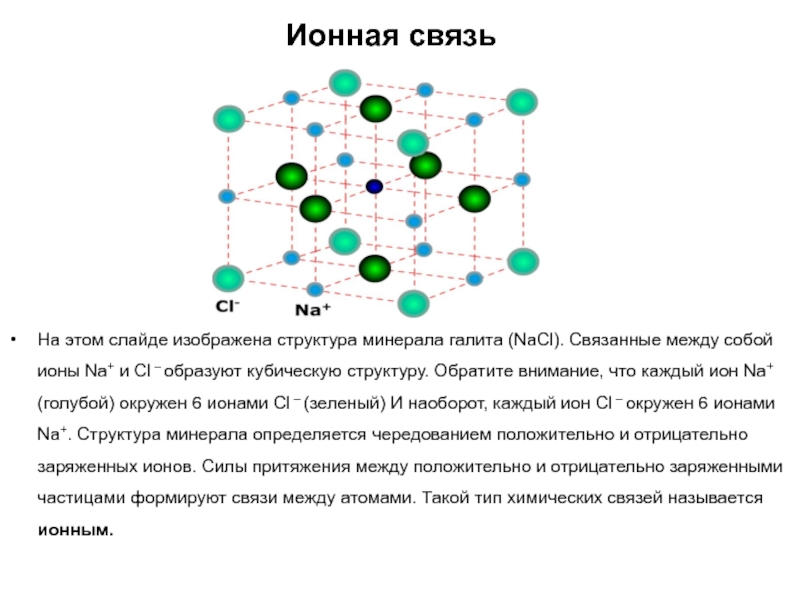
Слайд 22Ионная связь
На этом слайде изображена структура минерала галита (NaCl). Связанные
между собой ионы Na+ и Cl – образуют кубическую структуру.
Обратите внимание, что каждый ион Na+ (голубой) окружен 6 ионами Cl – (зеленый) И наоборот, каждый ион Cl – окружен 6 ионами Na+. Структура минерала определяется чередованием положительно и отрицательно заряженных ионов. Силы притяжения между положительно и отрицательно заряженными частицами формируют связи между атомами. Такой тип химических связей называется ионным.
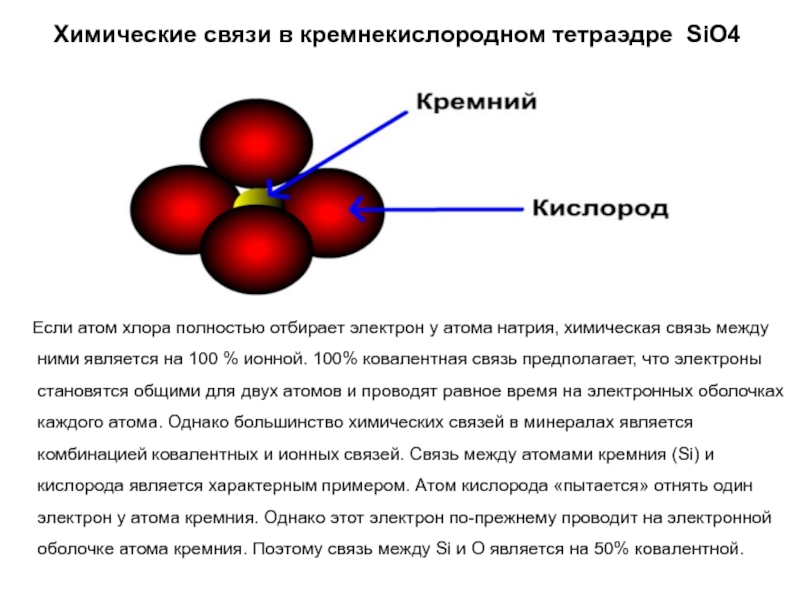
Слайд 23Химические связи в кремнекислородном тетраэдре SiO4
Если атом
хлора полностью отбирает электрон у атома натрия, химическая связь между
ними является на 100 % ионной. 100% ковалентная связь предполагает, что электроны становятся общими для двух атомов и проводят равное время на электронных оболочках каждого атома. Однако большинство химических связей в минералах является комбинацией ковалентных и ионных связей. Связь между атомами кремния (Si) и кислорода является характерным примером. Атом кислорода «пытается» отнять один электрон у атома кремния. Однако этот электрон по-прежнему проводит на электронной оболочке атома кремния. Поэтому связь между Si и О является на 50% ковалентной.
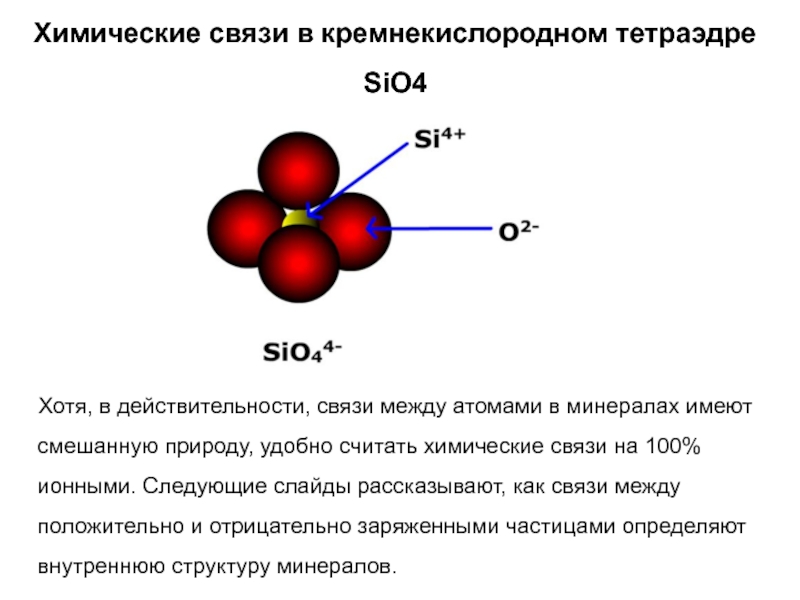
Слайд 24Химические связи в кремнекислородном тетраэдре SiO4
Хотя, в
действительности, связи между атомами в минералах имеют смешанную природу, удобно
считать химические связи на 100% ионными. Следующие слайды рассказывают, как связи между положительно и отрицательно заряженными частицами определяют внутреннюю структуру минералов.
Слайд 25Другие типы химических связей
Металлическая связь характерна для
атомов металлов, которые имеют тенденцию легко расставаться с электронами внешней
оболочки. Свободные электроны становятся общими для всех ионов в структуре металла. Минералы с металлическими связями являются хорошими проводниками и имеют металлический блеск. Пирит, показанный на этом слайде, состоит из атомов железа (Fe) и серы (S).Для атомов в структуре пирита характерен металлический тип связи.
Слайд 26Другие типы химических связей
Ван дер Ваальсовы
связи это слабые химические связи, которые возникают между электрически нейтральными
частицами. Минералы, в которых атомы связаны Ван дер Ваальсовыми связями, обычно отличаются низкой твердостью. Графит состоит из атомов углерода, которые образуют плоскостные структуры с прочными ковалентными связями. Однако, индивидуальные плоские слои атомов углерода связаны между собой слабыми Ван дер Ваальсовыми связями. Благодаря этому, графит очень мягкий минерал.
Слайд 27Другие типы химических связей
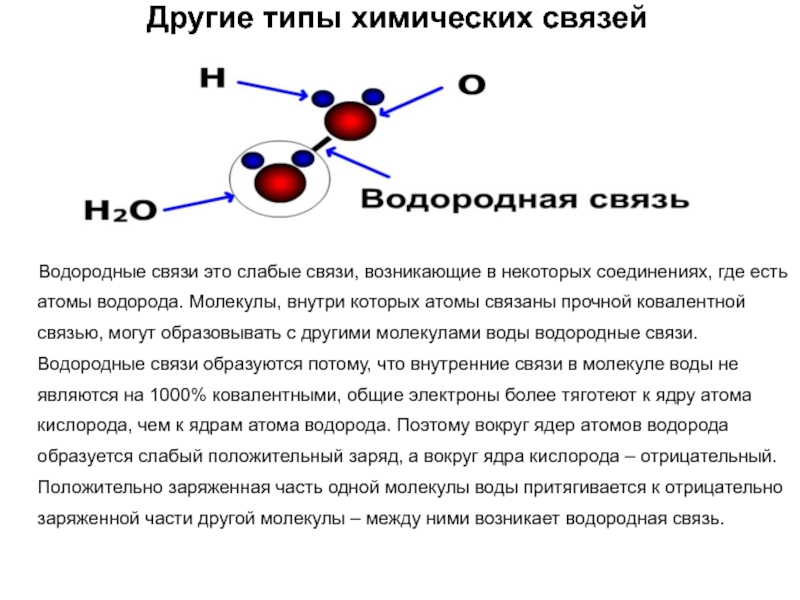
Водородные связи это слабые
связи, возникающие в некоторых соединениях, где есть атомы водорода. Молекулы,
внутри которых атомы связаны прочной ковалентной связью, могут образовывать с другими молекулами воды водородные связи. Водородные связи образуются потому, что внутренние связи в молекуле воды не являются на 1000% ковалентными, общие электроны более тяготеют к ядру атома кислорода, чем к ядрам атома водорода. Поэтому вокруг ядер атомов водорода образуется слабый положительный заряд, а вокруг ядра кислорода – отрицательный. Положительно заряженная часть одной молекулы воды притягивается к отрицательно заряженной части другой молекулы – между ними возникает водородная связь.
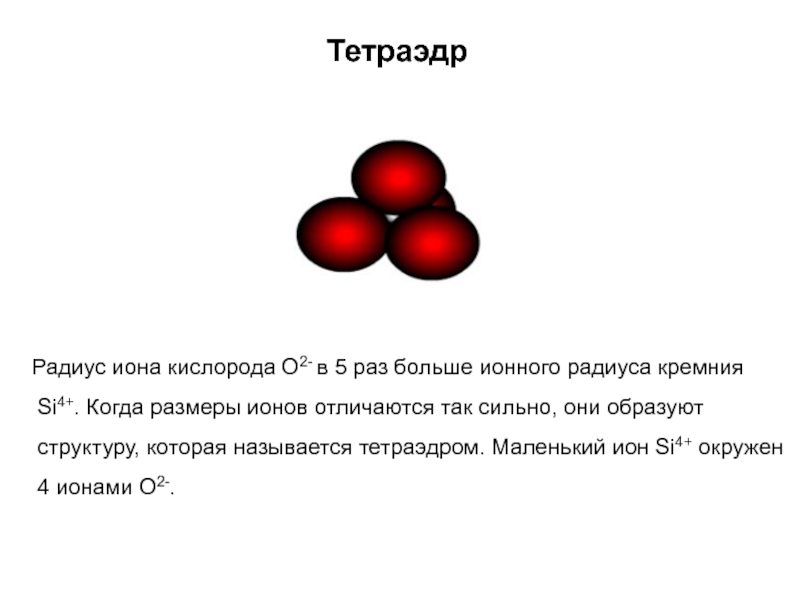
Слайд 28Тетраэдр
Радиус иона кислорода О2- в 5 раз больше
ионного радиуса кремния Si4+. Когда размеры ионов отличаются так сильно,
они образуют структуру, которая называется тетраэдром. Маленький ион Si4+ окружен 4 ионами О2-.
Слайд 29Октаэдр
Ионный радиус Na+ равен 0.99 и сильно
отличается от ионного радиуса Cl- равного 1.81 Ангстрёма. В минерале
галите (NaCl) атомы хлора и натрия образуют структуру, показанную на этом слайде. Обратите внимание, что маленький ион натрия окружен 6 ионами хлора. Такая структура называется октаэдром.
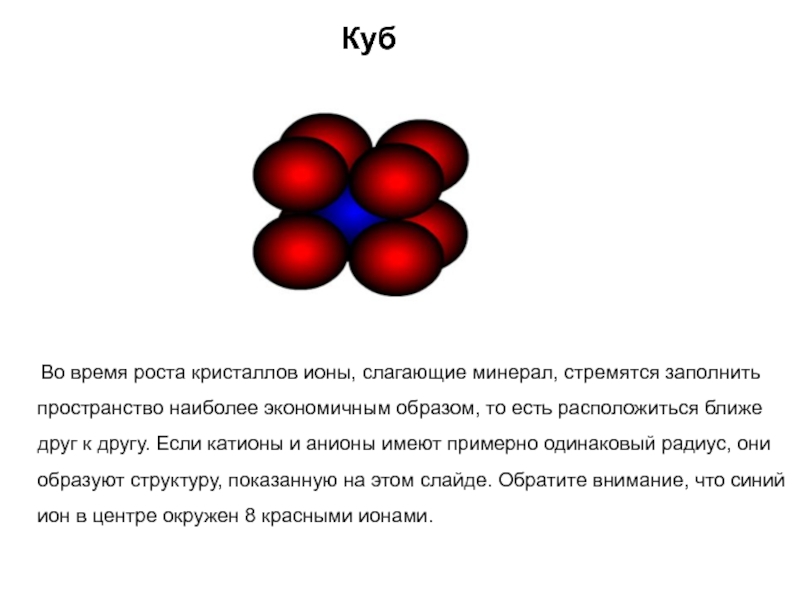
Слайд 30Куб
Во время роста кристаллов ионы, слагающие минерал,
стремятся заполнить пространство наиболее экономичным образом, то есть расположиться ближе
друг к другу. Если катионы и анионы имеют примерно одинаковый радиус, они образуют структуру, показанную на этом слайде. Обратите внимание, что синий ион в центре окружен 8 красными ионами.
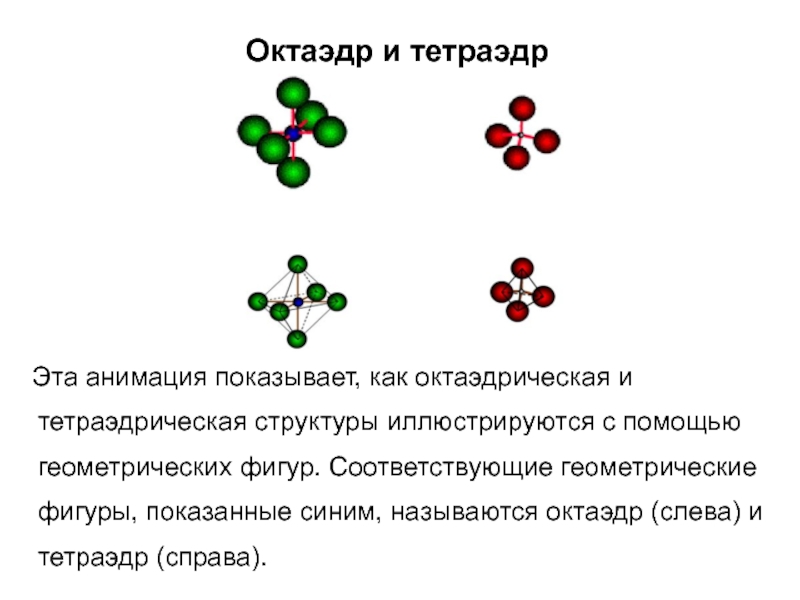
Слайд 31Октаэдр и тетраэдр
Эта анимация показывает, как октаэдрическая и
тетраэдрическая структуры иллюстрируются с помощью геометрических фигур. Соответствующие геометрические фигуры,
показанные синим, называются октаэдр (слева) и тетраэдр (справа).
Слайд 322.2. Внутренняя структура и форма кристаллов
Форма кристаллов минерала
зависит от его внутренней структурой.
При формировании кристалла
галита ионы Na+ и Cl- образуют кубическую структуру. Каждый ион Na+ окружен 6 ионами Cl- , поэтому позиция, которую занимает натрий называется октаэдрической. Размеры кубических кристаллов галита на этой фотографии 1-2 мм. Каждый кристалл построен
из миллионов ионов Na+ и Cl- , образующих кубическую структуру, показанную на этом слайде.
Слайд 33Внутренняя структура и форма кристаллов
Минералы пирит (FeS2)
и галенит (PbS) также имеют кубическую структуру.
Слайд 34Внутренняя структура и форма кристаллов
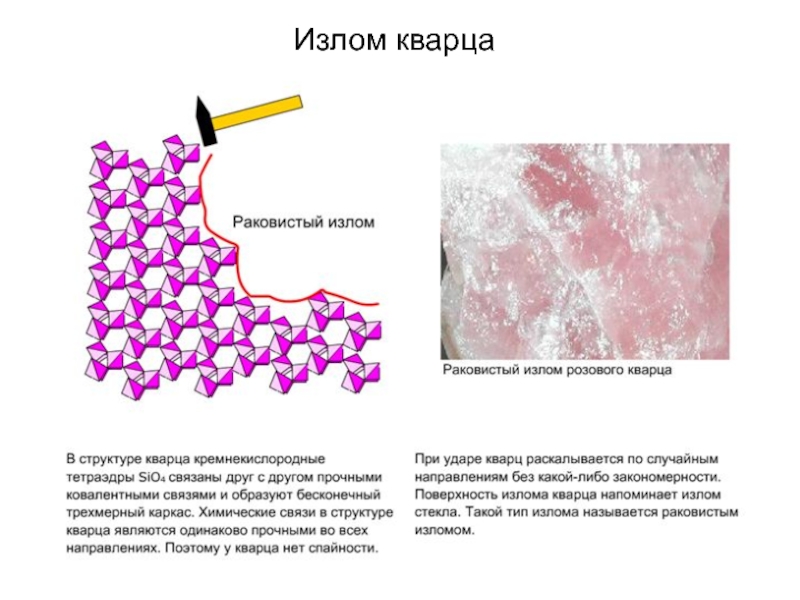
В основе структуры минерала
кварца лежат кремнекислородные тетраэдры SiO4. В структуре кварца каждый тетраэдр
образует связи с 4 другими тетраэдрами,
в результате чего формируется трехмерная структура. Обычно кристаллы кварца имеют форму гексагональных призм, что обусловлено его внутренней структурой.
Слайд 35Внутренняя структура минералов
На этих фотографиях кристаллы некоторых других
минералов. Форма кристаллов минерала зависит от его внутренней (кристаллической) структуры.
Слайд 36Морфология индивидов :
алмаз, пирит гранат (куб.), турмалин (триг.)
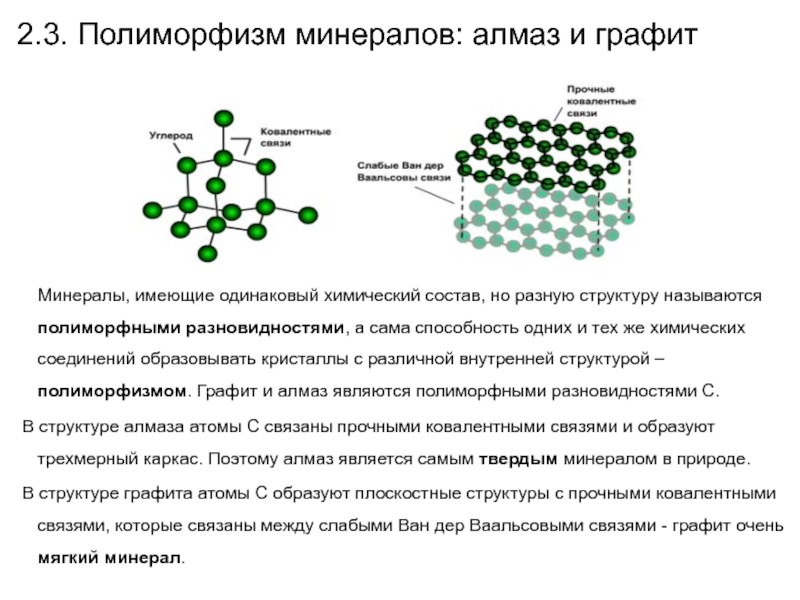
Слайд 372.3. Полиморфизм минералов: алмаз и графит
Минералы,
имеющие одинаковый химический состав, но разную структуру называются полиморфными разновидностями,
а сама способность одних и тех же химических соединений образовывать кристаллы с различной внутренней структурой – полиморфизмом. Графит и алмаз являются полиморфными разновидностями С.
В структуре алмаза атомы С связаны прочными ковалентными связями и образуют трехмерный каркас. Поэтому алмаз является самым твердым минералом в природе.
В структуре графита атомы С образуют плоскостные структуры с прочными ковалентными связями, которые связаны между слабыми Ван дер Ваальсовыми связями - графит очень мягкий минерал.
Слайд 38Полиморфизм
- это явление кристаллизации химических соединений одного состава
с образованием различных кристаллических структур и морфологий.
Примеры полиморфных
разновидностей (модификаций):
С в виде графита и алмаза;
СаСО3 – кальцита и арагонита.
Слайд 39Полиморфизм минералов
Графит, плотность которого 2,1 г/см3, стабилен до
глубин порядка 50-60 км. Если кристалл графита поместить на большую
глубину, давление повышается настолько, что структура графита становится неустойчивой, и атомы углерода образуют новую структуру с более плотной упаковкой – структуру алмаза. Плотность алмаза 3,5 г/см3.
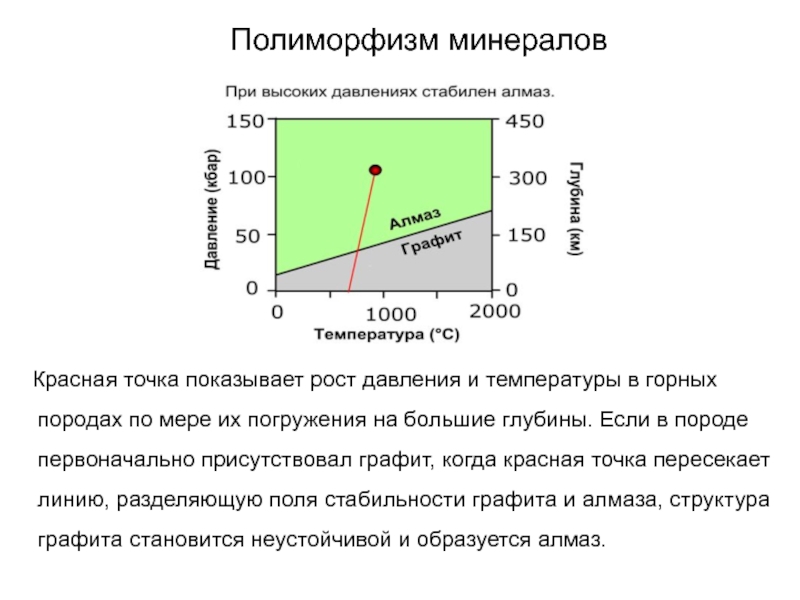
Слайд 40Полиморфизм минералов
Красная точка показывает рост давления и температуры
в горных породах по мере их погружения на большие глубины.
Если в породе первоначально присутствовал графит, когда красная точка пересекает линию, разделяющую поля стабильности графита и алмаза, структура графита становится неустойчивой и образуется алмаз.
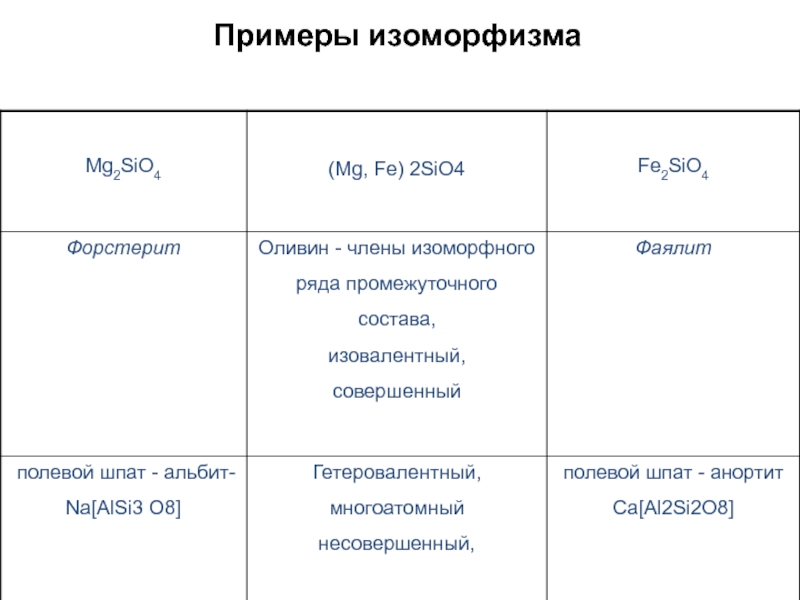
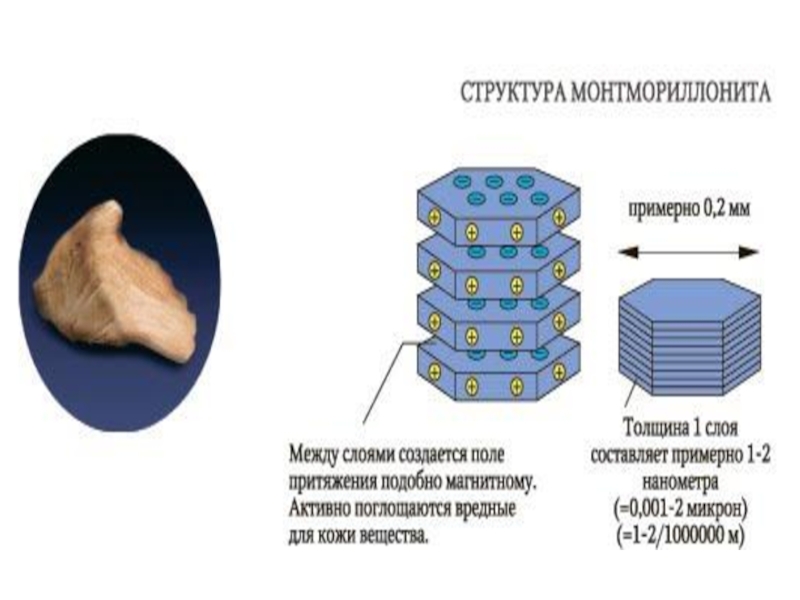
Слайд 412.4. Изоморфизм
- это способность химических элементов одиноковой валентности
и близких ионных радиусов
замещать друг друга в
кристаллической
решетке минерала в ограниченном (несовершенный)
или от 0 до 100% (совершенный) количестве
.
Это способность отражается на оптических свойствах минералов: цвет, преломление света и др.
Слайд 42Изоморфизм
На этом рисунке показаны размеры ионов, которые слагают наиболее распространенные
породообразующие минералы. Цифрами обозначен радиус ионов в Ангстрёмах (1 Ангстрём
= 0.00000001см). Ионы Fe2+ и Mg2+ имеют одинаковый заряд и близкие ионные радиусы. Благодаря этому сходству, Fe2+ и Mg2+ сходным образом участвуют в геохимических процессах. Если какой-либо минерал содержит Fe2+, в его структуре с большой вероятностью будет участвовать также некоторое количество ионов Mg2+. Оба иона занимают одинаковые позиции в структуре минералов. Замещение одних атомов или их соединений в структуре минералов другими называется изоморфизмом.
Na и K имеют одинаковый заряд и относительно близкие ионные радиусы, также могут замещать друг друга в структуре некоторых минералов.
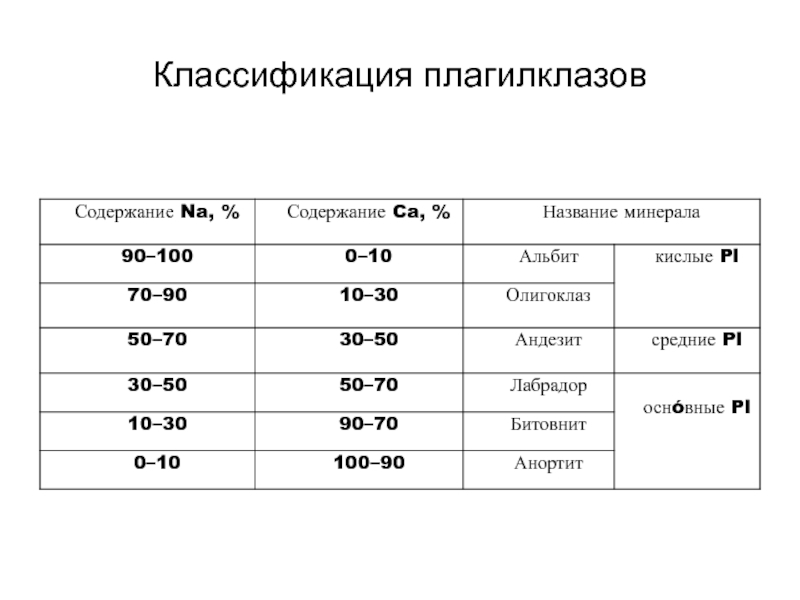
Слайд 44Изоморфизм
Na+ и К+ имеют одинаковый заряд (+1) и
относительно крупные размеры. Na+ и К+ могут замещать друг
друга в структуре некоторых минералов. Формула полевого шпата микроклина KAlSi3O8. Если кристаллизация микроклина происходила в присутствии богатого натрием флюида, часть ионов К+ в структуре этого минерала может замещаться ионами Na+. Чисто натровая разновидность щелочного полевого шпата называется альбитом (Na AlSi3O8).
Слайд 45Изоморфизм
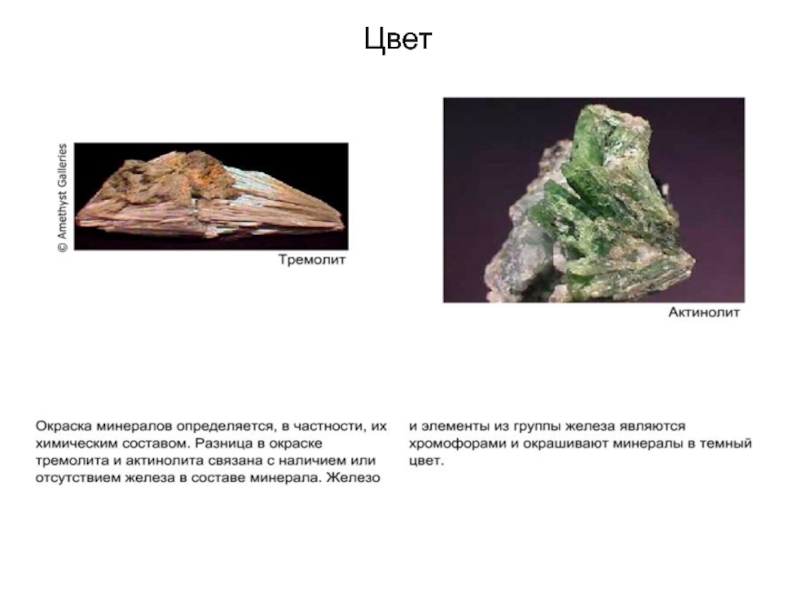
Ионы Fe2+ и Mg2+ имеют одинаковый заряд и
близкие размеры, поэтому они могут замещать друг друга в структуре
некоторых минералов. Тремолит, в котором почти нет железа, образуется в бедных железом породах. Если кристалл тремолита взаимодействует с богатым железом флюидом, содержание железа в тремолите может увеличиваться. В ходе этого процесса происходит изоморфизное замещение атомов магния атомами железа, и тремолит превращается в актинолит.
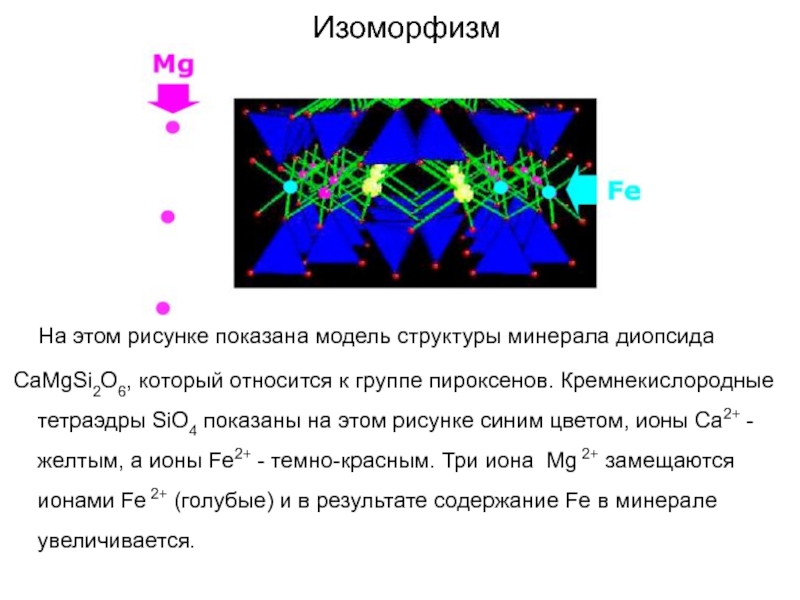
Слайд 46Изоморфизм
На этом рисунке показана модель структуры минерала
диопсида
CaMgSi2O6, который относится к группе пироксенов. Кремнекислородные тетраэдры SiO4
показаны на этом рисунке синим цветом, ионы Ca2+ -желтым, а ионы Fe2+ - темно-красным. Три иона Mg 2+ замещаются ионами Fe 2+ (голубые) и в результате содержание Fe в минерале увеличивается.
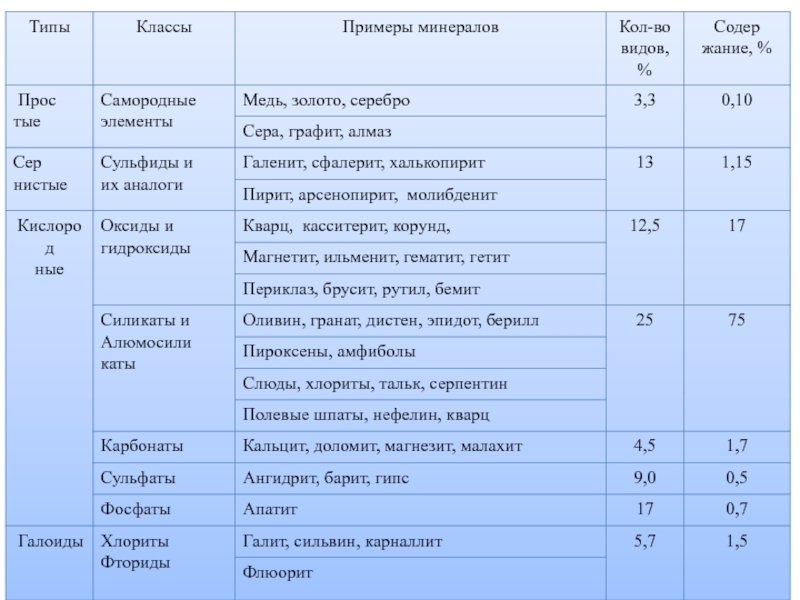
Слайд 473. Классификация минералов
В природе зарегистрировано около 4000 (около 5000)
минеральных видов.
Часто минералы одного и
того
же состава - Al2SiO5
– андалузит
– силлиманит
– кианит
отличаются друг от друга кристаллической структурой и физическими свойствами - полиморфизм.
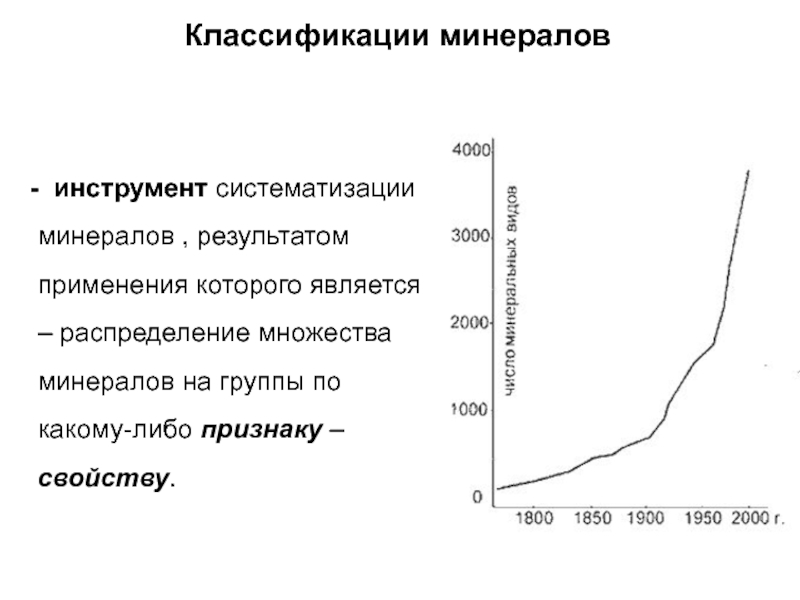
Слайд 48Классификации минералов
- инструмент систематизации минералов , результатом применения
которого является – распределение множества минералов на группы по какому-либо
признаку – свойству.
Слайд 49Первые классификации минералов(18 век):
по цвету
по форме кристаллов
по твердости (шкала Мооса,
которую до сих пор используют для определения относительной твердости минералов)
Актинолит-биссолит,
поле ок. 4 см. Дашкесан, Азербайджан.
Слайд 50Классификации минералов (19 век):
По химическому составу – по преобладающему элементу
(минералы вольфрама, минералы бериллия, др.)
По кристаллографическому признаку – например, имеющие
кубическую форму кристаллов (в результате пирит (FeS2) и галит (NaCl) попадали в одну группу кубических минералов)
По генетическому признаку – по происхождению, объединяются в одну группу минералы вулканов, минералы гидротермальных жил и минералы осадочного происхождения и т.п. Одни и те же минералы часто оказываются в разных классах.
Выделяются типоморфные минералы, имеющие определенный генезис, например: нефелин, лабрадор – только магматического генезиса, серпентин, тальк – метаморфическое происхождение
Слайд 51Современная кристаллохимическая классификация минералов
опирается на 2 принципа:
сходство
химического состава – ведущий признак (№1), по которому выделяют классы
минералов;
сходство кристаллической структуры – признак №2 – подклассы минералов
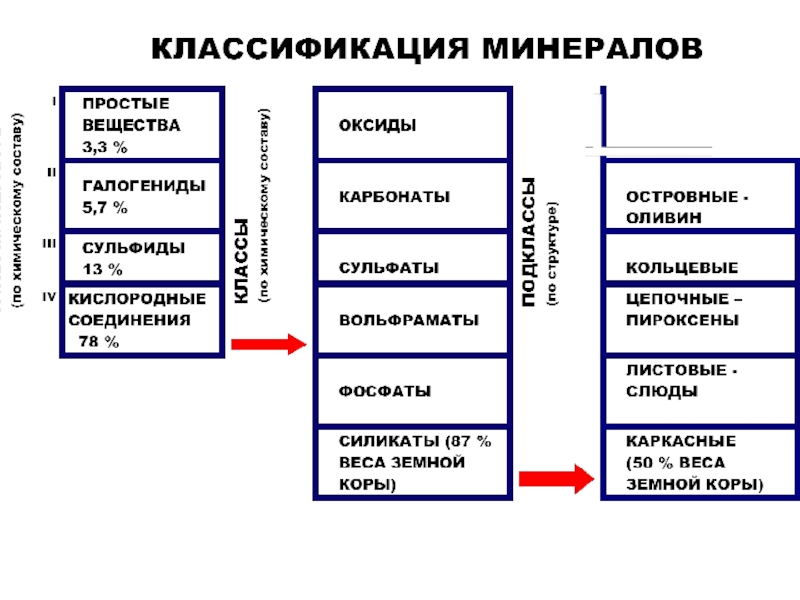
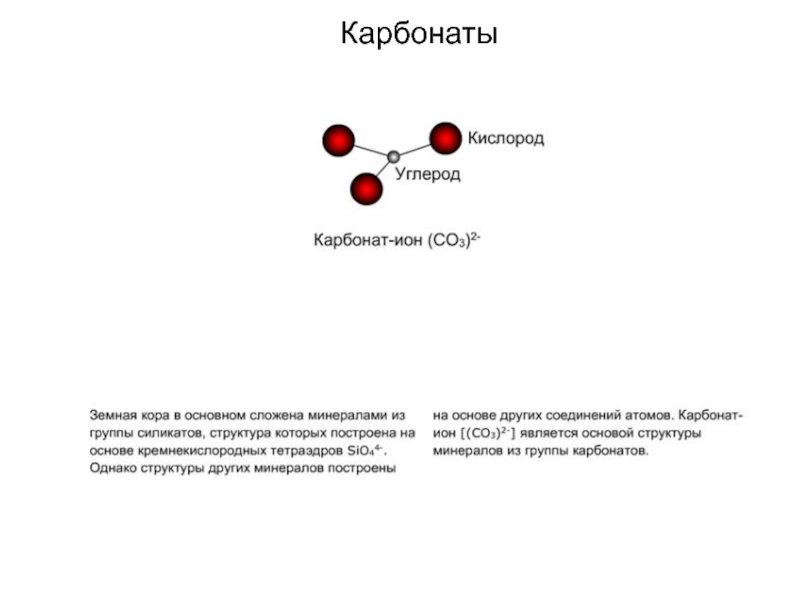
Слайд 54Учитывая ХС земной коры, мы видим, что
среди минералов преобладают -
класса силикаты, которые составляют примерно 75% массы и 25 %
(- около 1000 минералов) от общего количества видов;
в основе силикатов лежат кремнекислородные тетраэдры – группировки SiO4, которые соединяются друг с другом, а также с катионами натрия , калия, кальция, магния и другими по-разному,
в результате чего выделяют подклассы силикатов;
На 2-ом месте по распространенности находятся оксиды и гидроксиды, к которым относят и кварц - SiO2 (кварц можно отнести и к простым силикатам, без катионов, а из одних кремнекислородных тетраэдров).
Поэтому силикаты и оксиды – породообразующие минералы, которые чаще всего мы видим в горных породах.
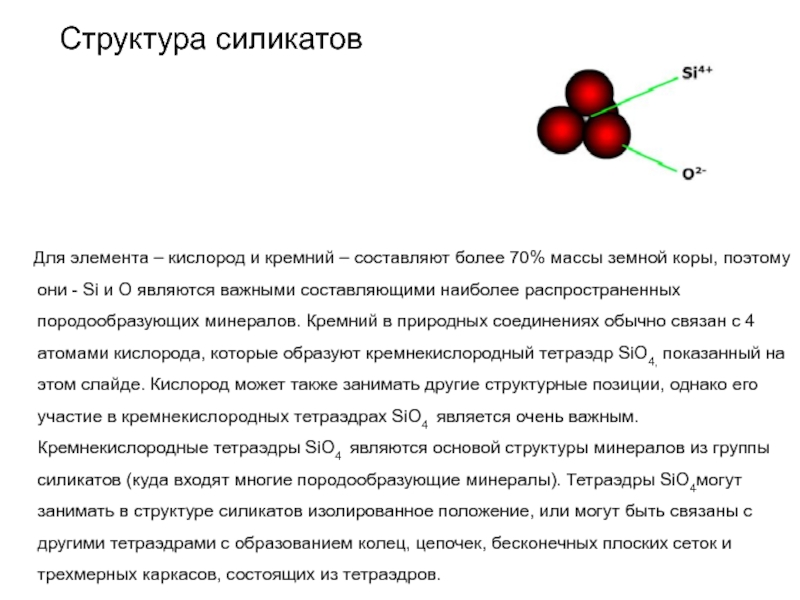
Слайд 55Структура силикатов
Для элемента – кислород и кремний
– составляют более 70% массы земной коры, поэтому они -
Si и O являются важными составляющими наиболее распространенных породообразующих минералов. Кремний в природных соединениях обычно связан с 4 атомами кислорода, которые образуют кремнекислородный тетраэдр SiO4, показанный на этом слайде. Кислород может также занимать другие структурные позиции, однако его участие в кремнекислородных тетраэдрах SiO4 является очень важным. Кремнекислородные тетраэдры SiO4 являются основой структуры минералов из группы силикатов (куда входят многие породообразующие минералы). Тетраэдры SiO4могут занимать в структуре силикатов изолированное положение, или могут быть связаны с другими тетраэдрами с образованием колец, цепочек, бесконечных плоских сеток и трехмерных каркасов, состоящих из тетраэдров.
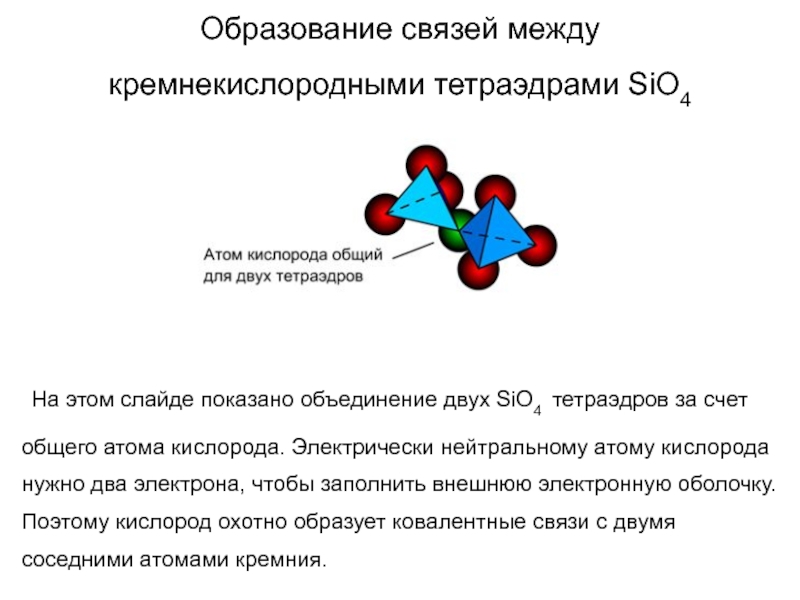
Слайд 56Образование связей между кремнекислородными тетраэдрами SiO4
На этом слайде
показано объединение двух SiO4 тетраэдров за счет общего атома кислорода.
Электрически нейтральному атому кислорода нужно два электрона, чтобы заполнить внешнюю электронную оболочку. Поэтому кислород охотно образует ковалентные связи с двумя соседними атомами кремния.
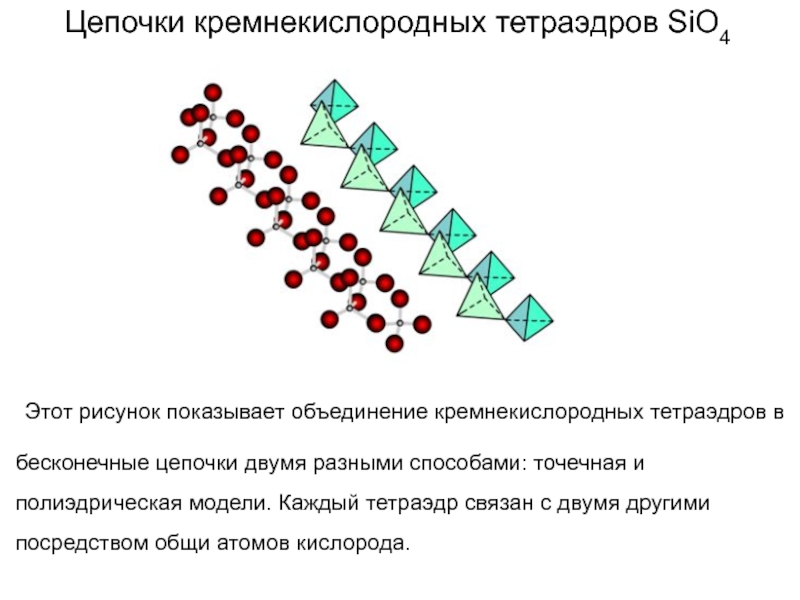
Слайд 57Цепочки кремнекислородных тетраэдров SiO4
Этот рисунок показывает объединение кремнекислородных
тетраэдров в бесконечные цепочки двумя разными способами: точечная и полиэдрическая
модели. Каждый тетраэдр связан с двумя другими посредством общи атомов кислорода.
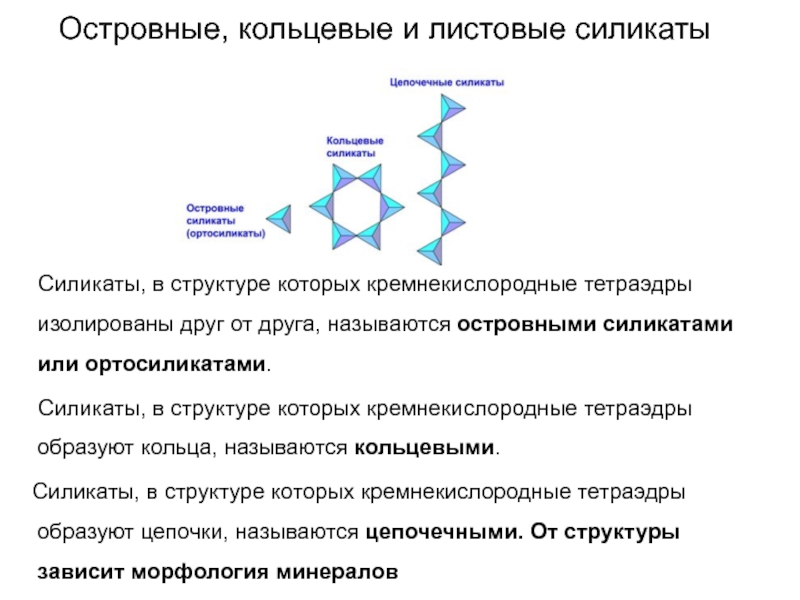
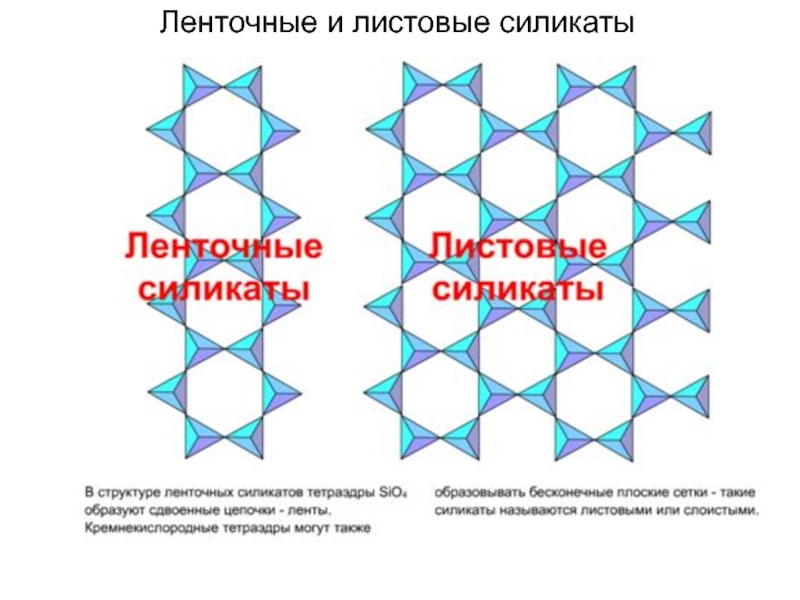
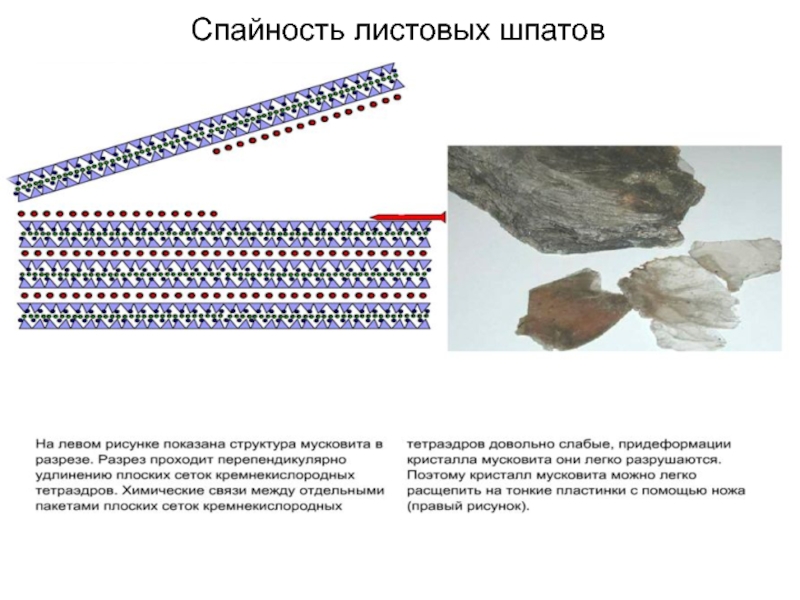
Слайд 58Островные, кольцевые и листовые силикаты
Силикаты, в структуре
которых кремнекислородные тетраэдры изолированы друг от друга, называются островными силикатами
или ортосиликатами.
Силикаты, в структуре которых кремнекислородные тетраэдры образуют кольца, называются кольцевыми.
Силикаты, в структуре которых кремнекислородные тетраэдры образуют цепочки, называются цепочечными. От структуры зависит морфология минералов
Слайд 59Гроссуляр и циркон
К островным или ортосиликатам относятся
несколько минералов и минеральных групп. В структуре островных силикатов кремнекислородные
тетраэдры SiO4 изолированы друг от друга. На этих фотографиях показаны минералы гроссуляр Ca3Al2(SiO4 )3 и ZrSiO4 .
Слайд 60Оливин и кианит
Оливин и кианит также относятся к
ортосиликатам.
Формула оливина (Mg, Fe)2SiO4, а формула
кианита Al2SiO3.
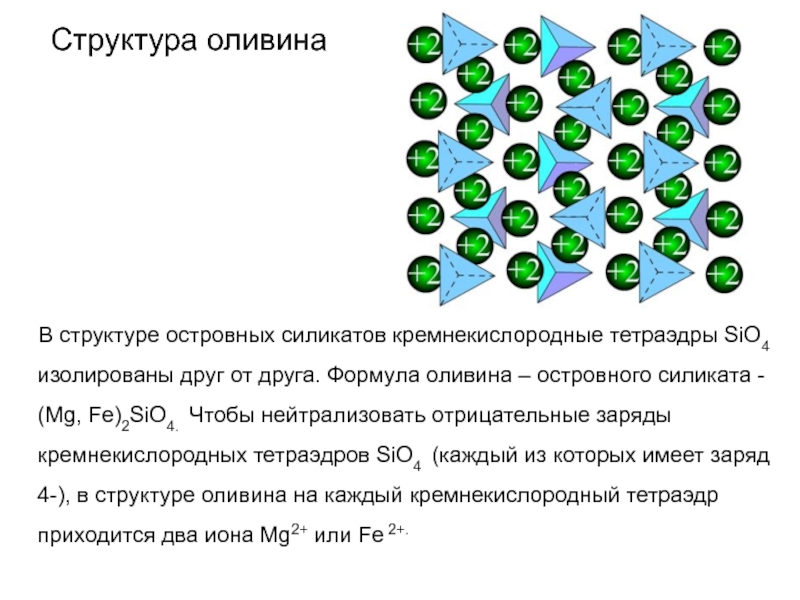
Слайд 61Структура оливина
В структуре островных силикатов кремнекислородные тетраэдры
SiO4 изолированы друг от друга. Формула оливина – островного силиката
- (Mg, Fe)2SiO4. Чтобы нейтрализовать отрицательные заряды кремнекислородных тетраэдров SiO4 (каждый из которых имеет заряд 4-), в структуре оливина на каждый кремнекислородный тетраэдр приходится два иона Mg2+ или Fe 2+.
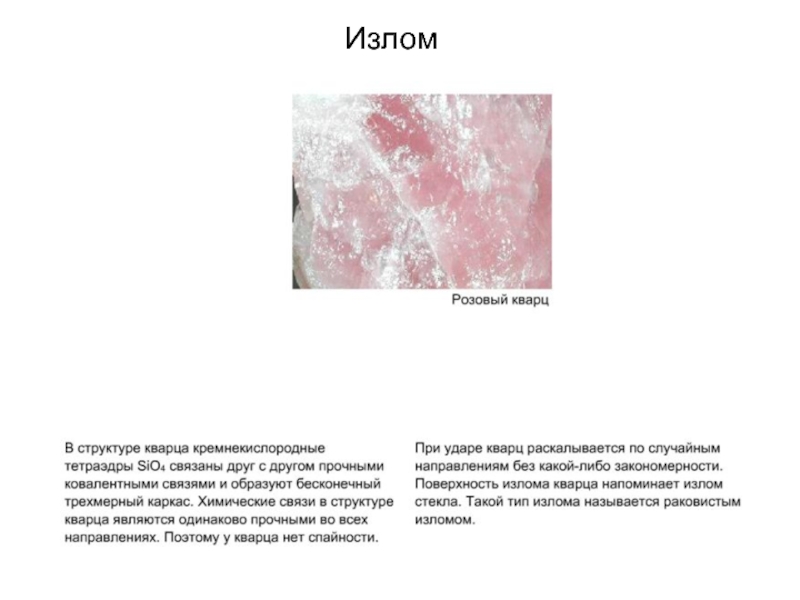
Слайд 62Излом оливина
В структуре оливина между ионами Mg2+
и Fe 2+ и кремнекислородными тетраэдрами возникают ионные связи. Эти
связи характеризуются одинаковой прочностью во всех направлениях, то есть в структуре оливина отсутствуют такие плоскости, в пределах которых связи были бы менее прочными. Если кристалл оливина расколоть геологическим молотком, то поверхность раскола будет иметь случайную (незакономерную) форму. Излом оливина напоминает излом стекла или керамики - называется раковистым. На фотографии справа изображен раковистым излом вулканического стекла.
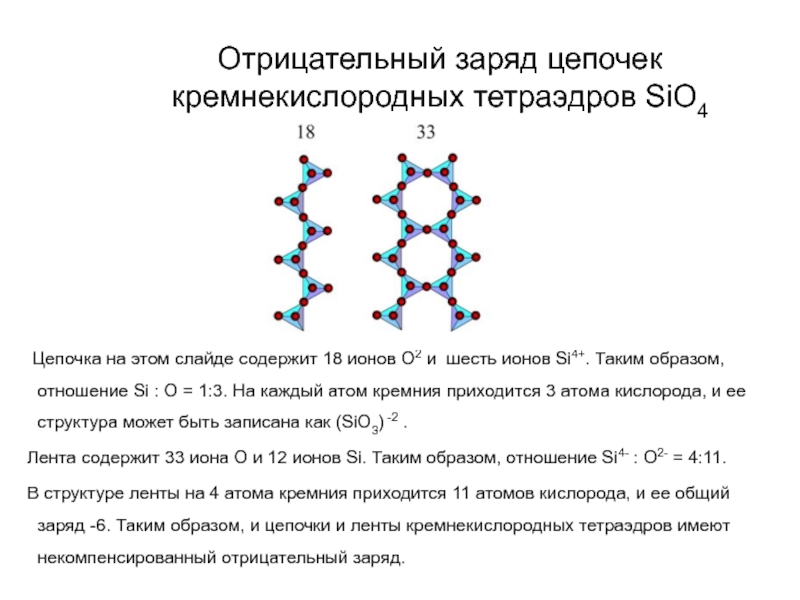
Слайд 63Отрицательный заряд цепочек кремнекислородных тетраэдров SiO4
Цепочка на
этом слайде содержит 18 ионов О2 и шесть ионов Si4+.
Таким образом, отношение Si : O = 1:3. На каждый атом кремния приходится 3 атома кислорода, и ее структура может быть записана как (SiO3) -2 .
Лента содержит 33 иона О и 12 ионов Si. Таким образом, отношение Si4- : O2- = 4:11.
В структуре ленты на 4 атома кремния приходится 11 атомов кислорода, и ее общий заряд -6. Таким образом, и цепочки и ленты кремнекислородных тетраэдров имеют некомпенсированный отрицательный заряд.
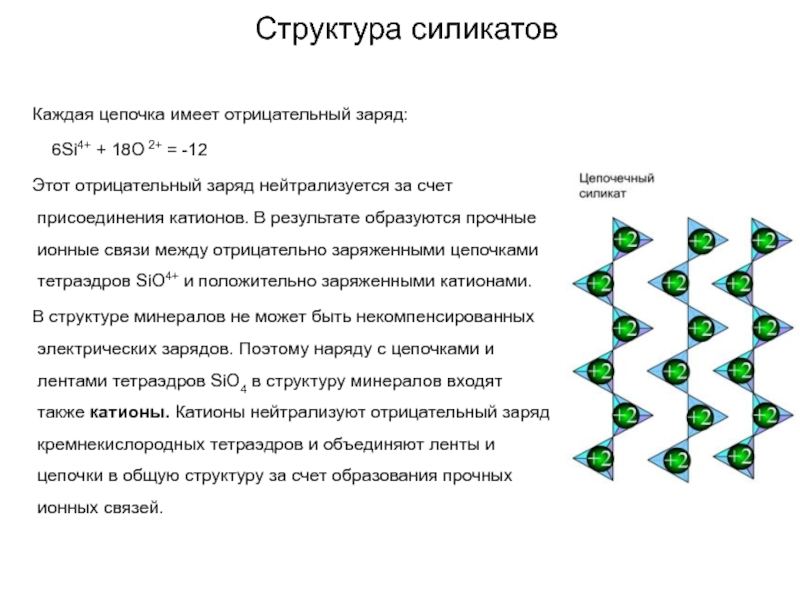
Слайд 64Структура силикатов
Каждая цепочка имеет отрицательный заряд:
6Si4+ + 18O 2+ = -12
Этот отрицательный заряд нейтрализуется за счет присоединения катионов. В результате образуются прочные ионные связи между отрицательно заряженными цепочками тетраэдров SiO4+ и положительно заряженными катионами.
В структуре минералов не может быть некомпенсированных электрических зарядов. Поэтому наряду с цепочками и лентами тетраэдров SiO4 в структуру минералов входят также катионы. Катионы нейтрализуют отрицательный заряд кремнекислородных тетраэдров и объединяют ленты и цепочки в общую структуру за счет образования прочных ионных связей.
Слайд 65Пироксены
Минералы из группы пироксенов являются наиболее распространенными
цепочечными силикатами. Авгит – минерал из группы пироксенов. Пироксены обычно
образуют короткопризматические кристаллы (см. слайд).
Формула авгита: (Ca,Na)(Mg,Fe,Al)(Al,Si)2O6
Слайд 66Пироксены
Другой минерал из группы пироксенов – диопсид.
Формула диопсида CaMgSi2O6. В структуре диопсида нет атомов железа. Поэтому
диопсид имеет светлую окраску. Цвет многих минералов зависит от присутствия железа.
Богатые железом минералы имеют темную окраску, а бедные – светлую.
Слайд 67Пироксены
Геденбергит, который также относится к пироксенам,
темно-зеленого цвета из-за присутствия железа. Формула геденбергита:
CaFeSi2O6
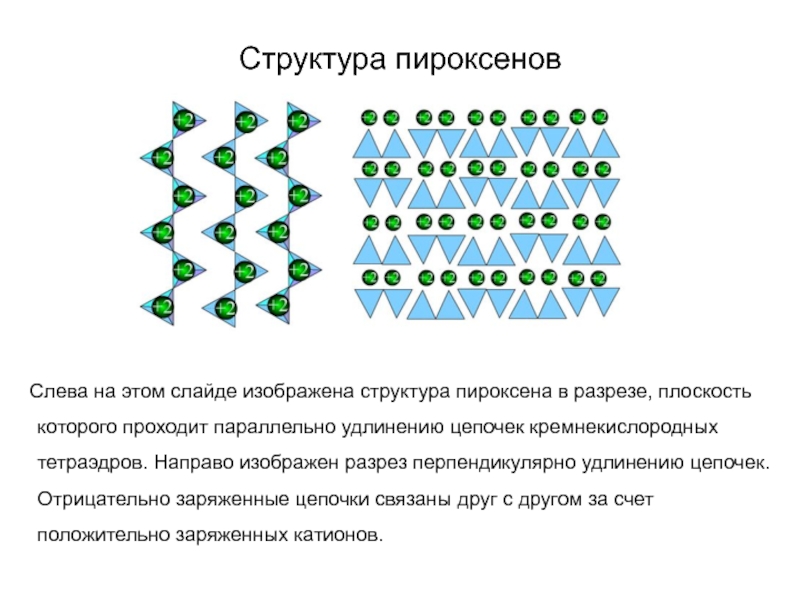
Слайд 68Структура пироксенов
Слева на этом слайде изображена структура пироксена
в разрезе, плоскость которого проходит параллельно удлинению цепочек кремнекислородных тетраэдров.
Направо изображен разрез перпендикулярно удлинению цепочек. Отрицательно заряженные цепочки связаны друг с другом за счет положительно заряженных катионов.
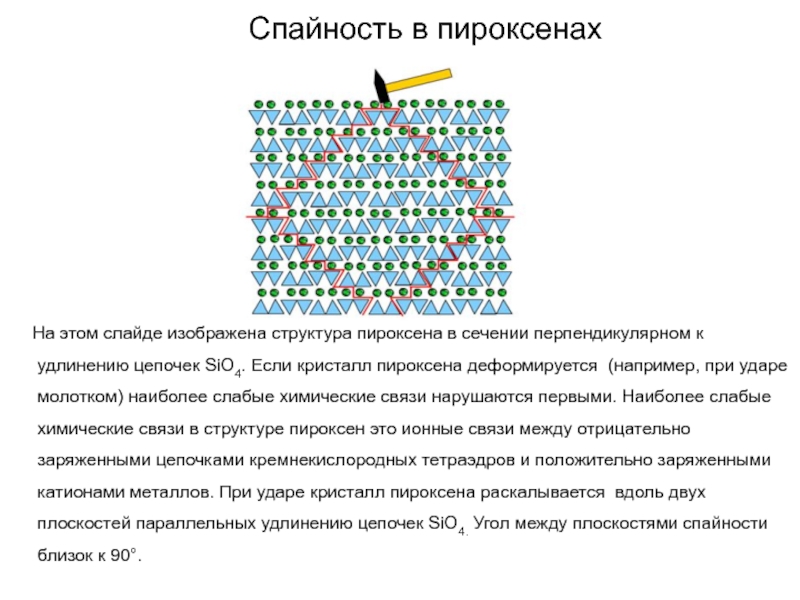
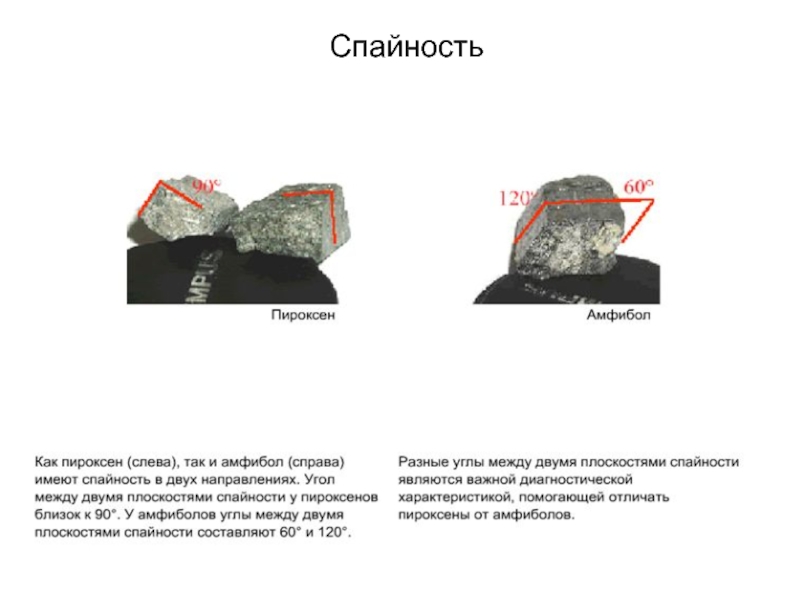
Слайд 69Спайность в пироксенах
На этом слайде изображена структура
пироксена в сечении перпендикулярном к удлинению цепочек SiО4. Если кристалл
пироксена деформируется (например, при ударе молотком) наиболее слабые химические связи нарушаются первыми. Наиболее слабые химические связи в структуре пироксен это ионные связи между отрицательно заряженными цепочками кремнекислородных тетраэдров и положительно заряженными катионами металлов. При ударе кристалл пироксена раскалывается вдоль двух плоскостей параллельных удлинению цепочек SiO4. Угол между плоскостями спайности близок к 90°.
Слайд 70Спайность в пироксенах
Способность кристаллов минералов раскалываться по
определенным направлениям называется спайностью. Спайность это важное свойство, которое используется
при определении минералов. На этой фотографии показана спайность в кристалле пироксена в двух направлениях под угол между плоскостями спайности ~ 90°.
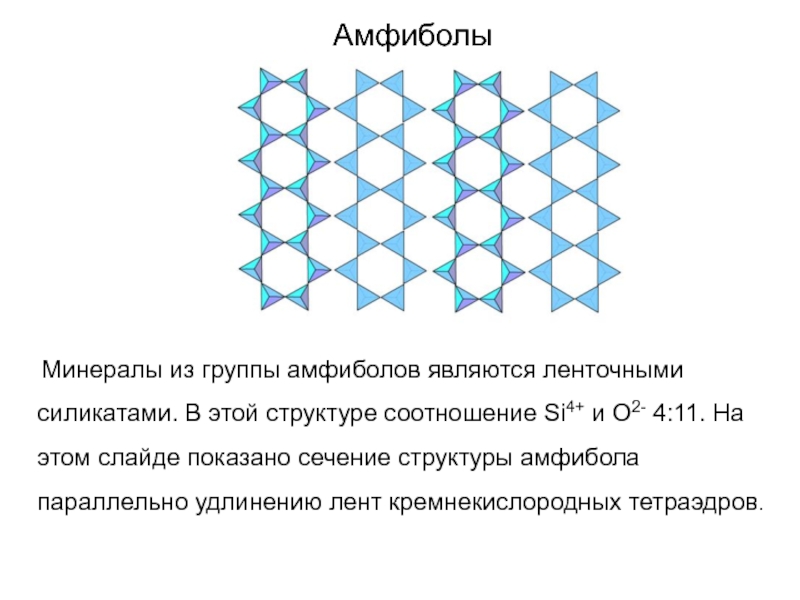
Слайд 71Амфиболы
Минералы из группы амфиболов являются ленточными силикатами.
В этой структуре соотношение Si4+ и O2- 4:11. На этом
слайде показано сечение структуры амфибола параллельно удлинению лент кремнекислородных тетраэдров.
Слайд 72Амфиболы
Тремолит и актинолит относятся к группе амфиболов. Формула
тремолита: Ca2Mg5Si8O22(OH) 2. Актинолит имеет сходную формулу,
однако в его структуре есть железо и несколько меньше магния. Поэтому актинолит имеет более темную окраску, чем тремолит. Формула актинолита: Ca2 (Mg, Fe)5Si8O22(OH) 2.
Слайд 73Амфиболы
Слева кристалл из группы амфиболов - роговая
обманка -
Ca2 (Mg, Fe, Al)5Si8O22(OH) 2. Справа
горная порода, сложенная светлыми зернами плагиоклаза - к группе полевых шпатов, и черными зернами роговой обманки. Роговая обманка - наиболее распространенный темноцветный минерал в земной коре. В структуру амфиболов могут входить разные химические элементы, включая K, Na, Ca, Fe, Mg, Si и O. Кроме того, амфиболы содержат ионы OH. При нагревании кристаллы амфибола теряют воду, которая содержится в их структуре.
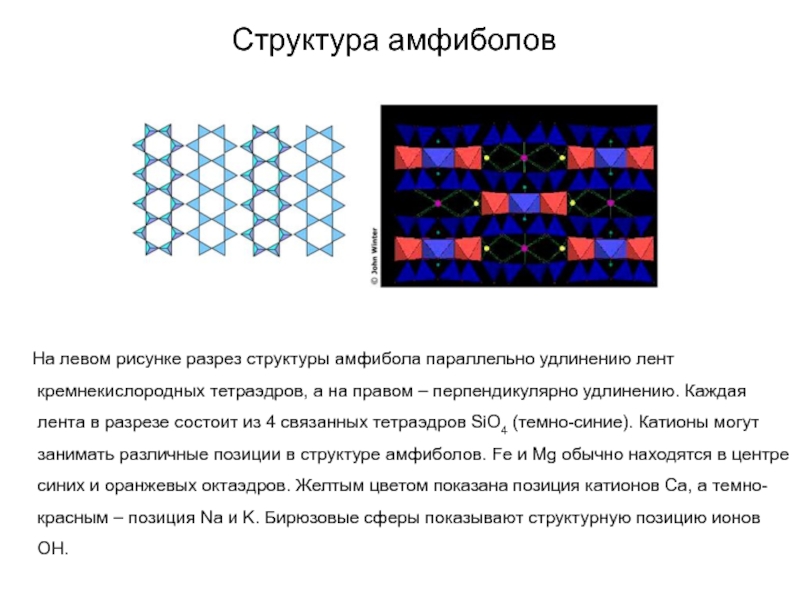
Слайд 74Структура амфиболов
На левом рисунке разрез структуры амфибола
параллельно удлинению лент кремнекислородных тетраэдров, а на правом – перпендикулярно
удлинению. Каждая лента в разрезе состоит из 4 связанных тетраэдров SiO4 (темно-синие). Катионы могут занимать различные позиции в структуре амфиболов. Fe и Mg обычно находятся в центре синих и оранжевых октаэдров. Желтым цветом показана позиция катионов Ca, а темно-красным – позиция Na и K. Бирюзовые сферы показывают структурную позицию ионов OH.
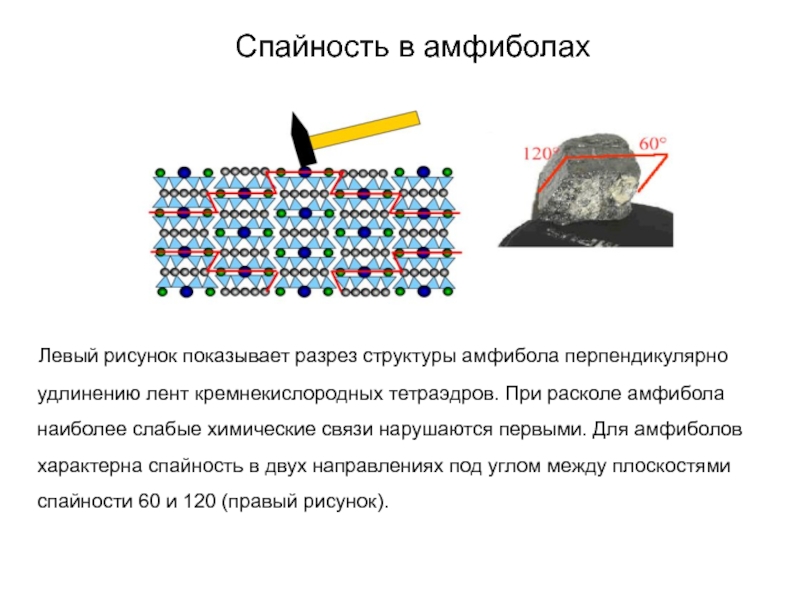
Слайд 75Спайность в амфиболах
Левый рисунок показывает разрез структуры
амфибола перпендикулярно удлинению лент кремнекислородных тетраэдров. При расколе амфибола наиболее
слабые химические связи нарушаются первыми. Для амфиболов характерна спайность в двух направлениях под углом между плоскостями спайности 60 и 120 (правый рисунок).
Слайд 91Все породообразующие силикаты делятся:
Лейкократовые (светлые):
- кварц
- нефелин
- гр. полевые шпаты:
-
K-Na-ортоклаз
и микроклин
- Ca-Na-плагиоклазы
Меланократовые
(темные, Fe-содержащие):
- гр.пироксенов (цепочечные):
авгит, диопсид,
- гр. амфиболов (ленточные):
роговая обманка, актинолит,
- гр. слюд (слоистые): биотит
мусковит
Слайд 100Кристаллы кальцита, до 3,5 см – агрегат – сростки, Ущ.
Лухумисцкали, Грузия
Слайд 104Современная минералогия
Твердые природные
соединения (вещества)
аморфного, т.е. не
упорядоченного строения -
без кристаллической
решетки, относит
к минералоидам
(- сотни видов, характерны
для приповерхностной части земной коры)
Опал (SiO2хН2О
) – аморфный
Слайд 123Минералы под микроскопом
Электронный микроскоп используется для изучения очень
мелких зерен минералов - нм. Многие электронные микроскопы оборудованы детекторами,
которые позволяют анализировать химический состав минералов.