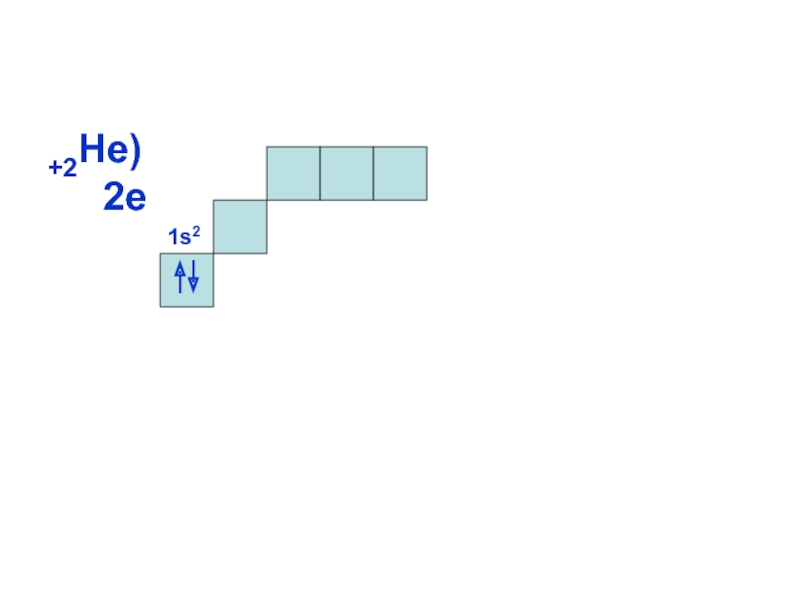
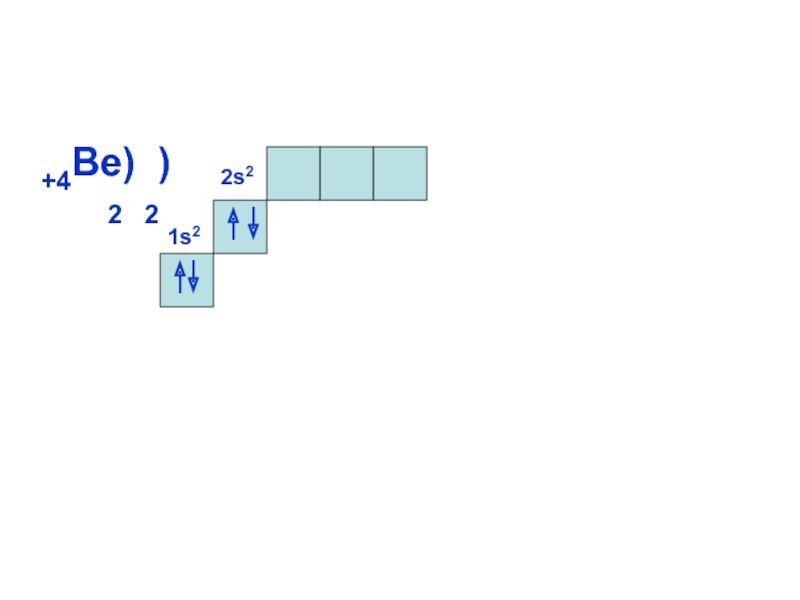
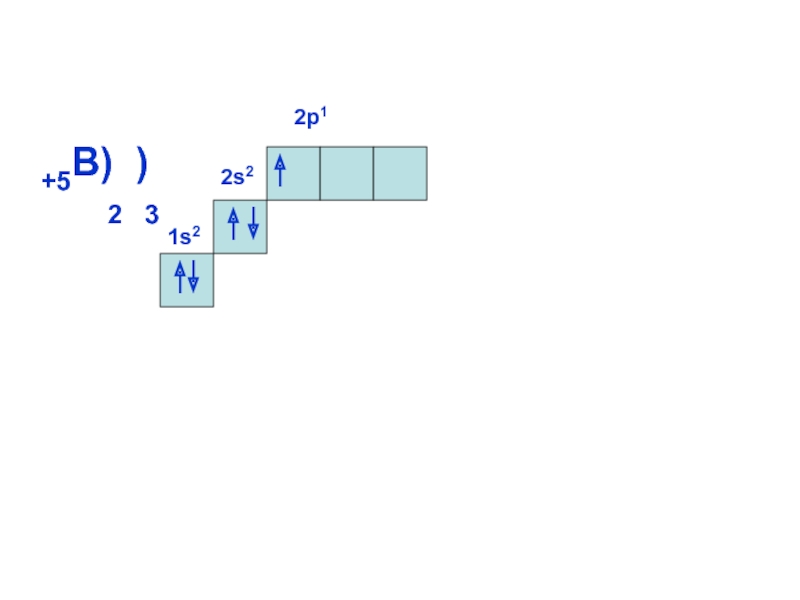
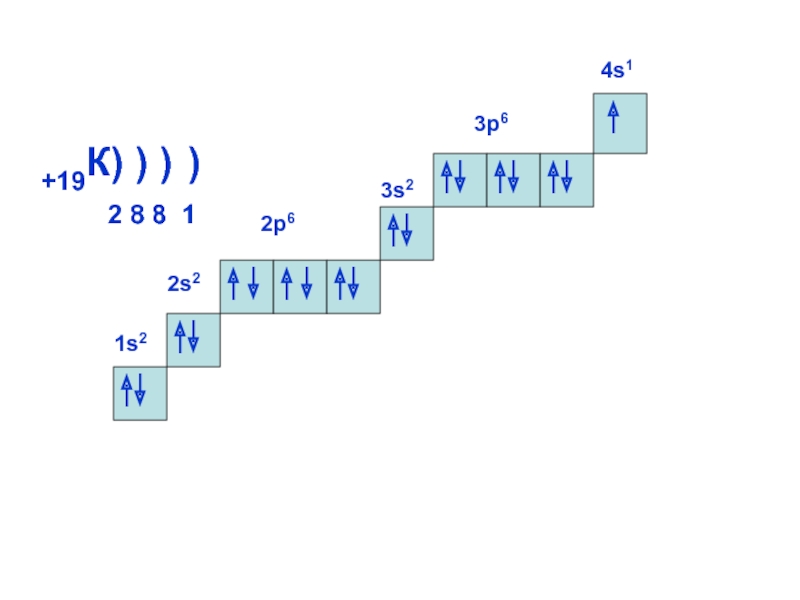
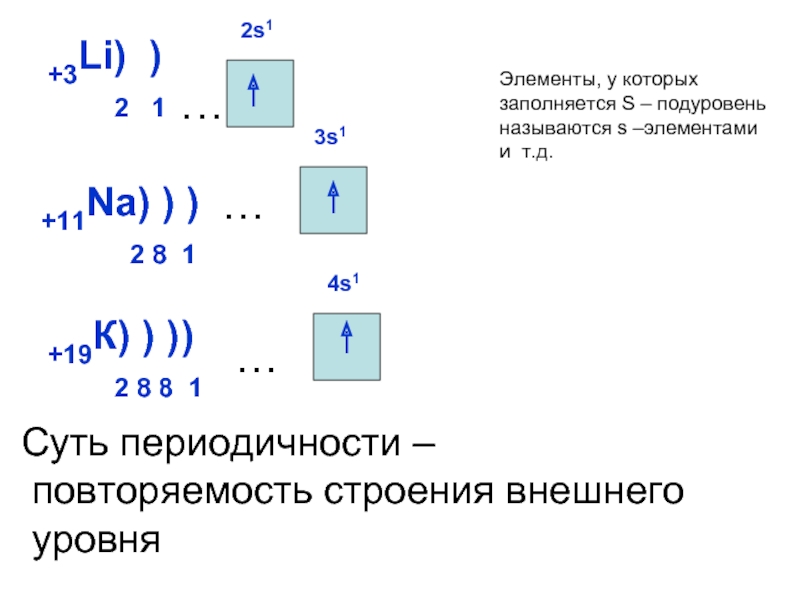
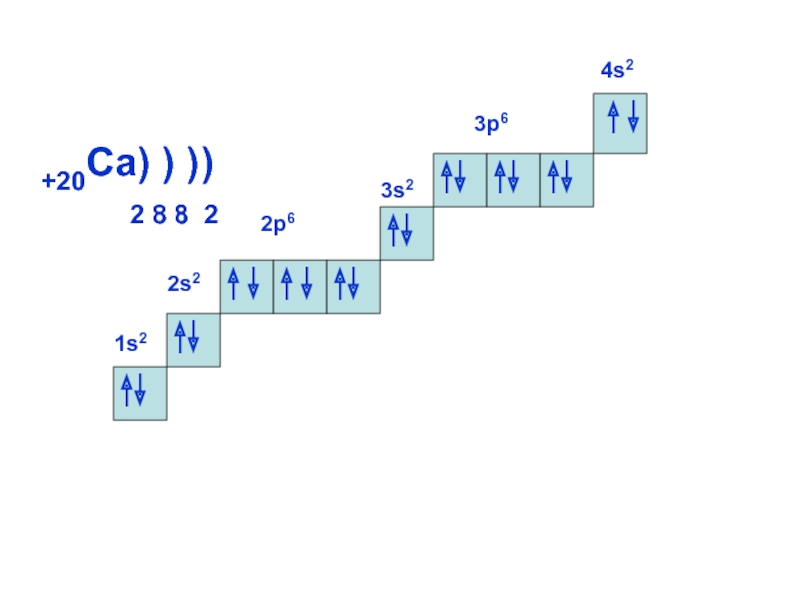
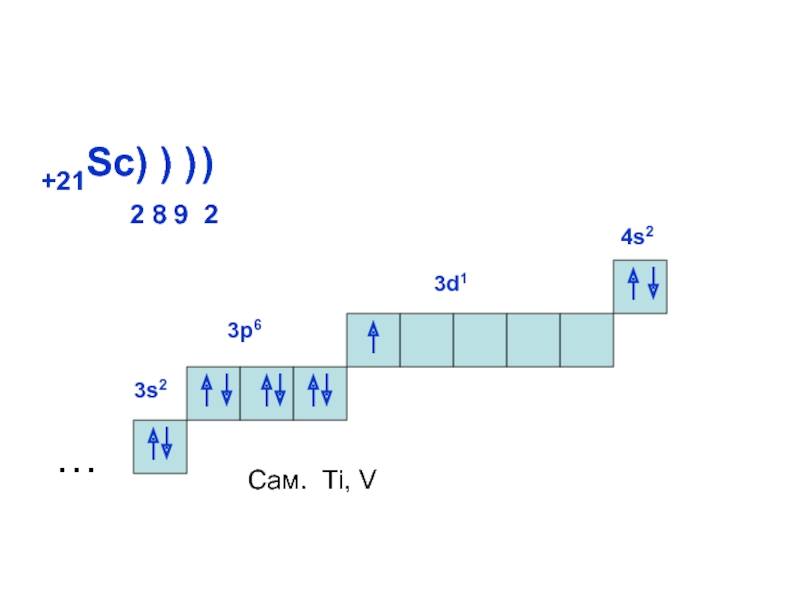
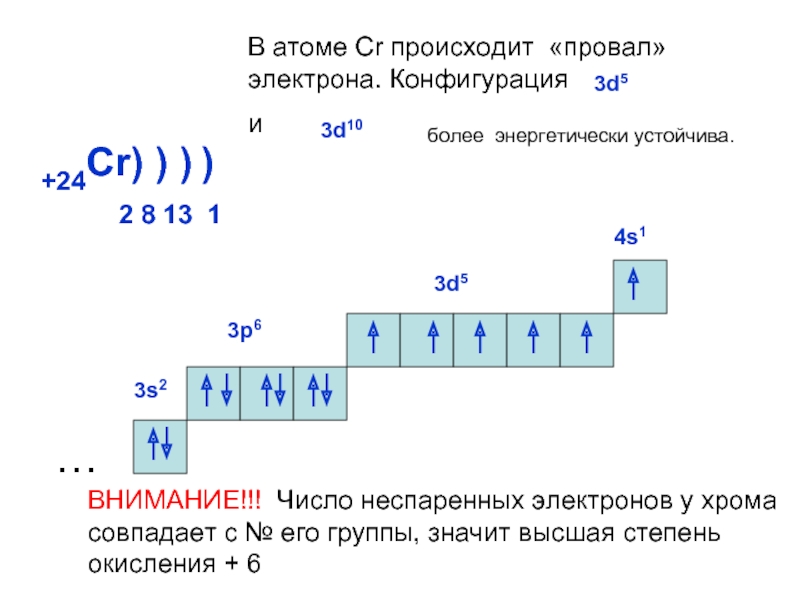
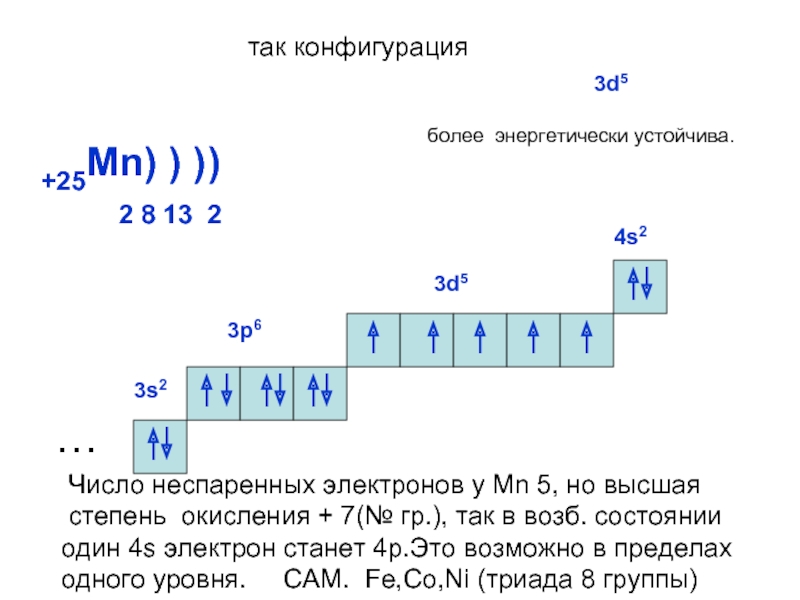
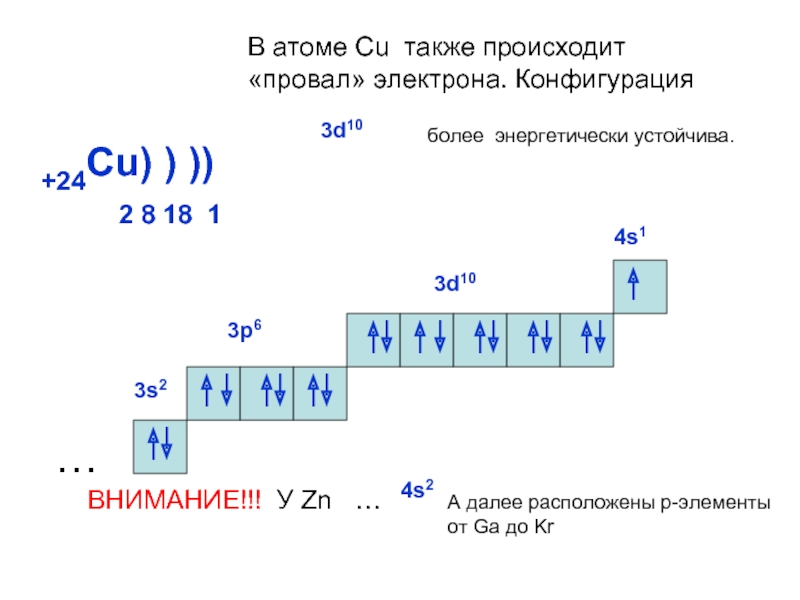
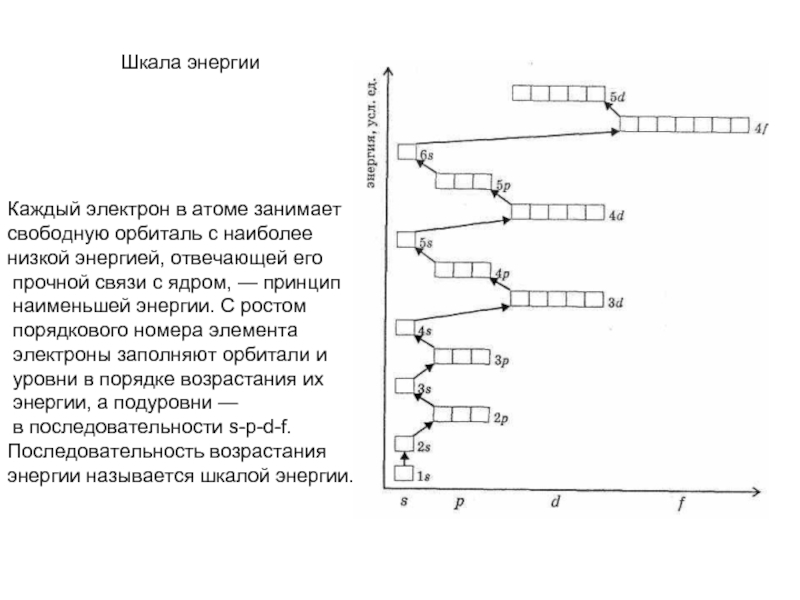
теория подразумевает, что энергия электрона
может принимать только определенные значения,
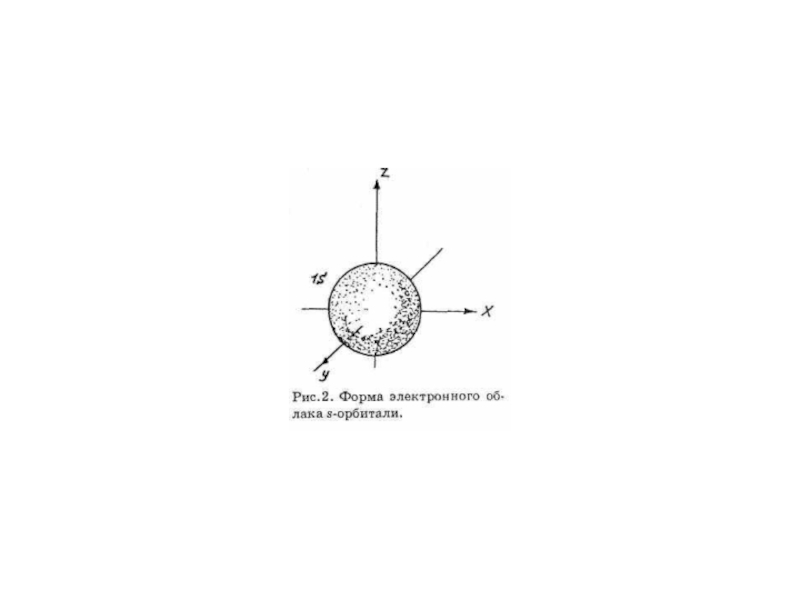
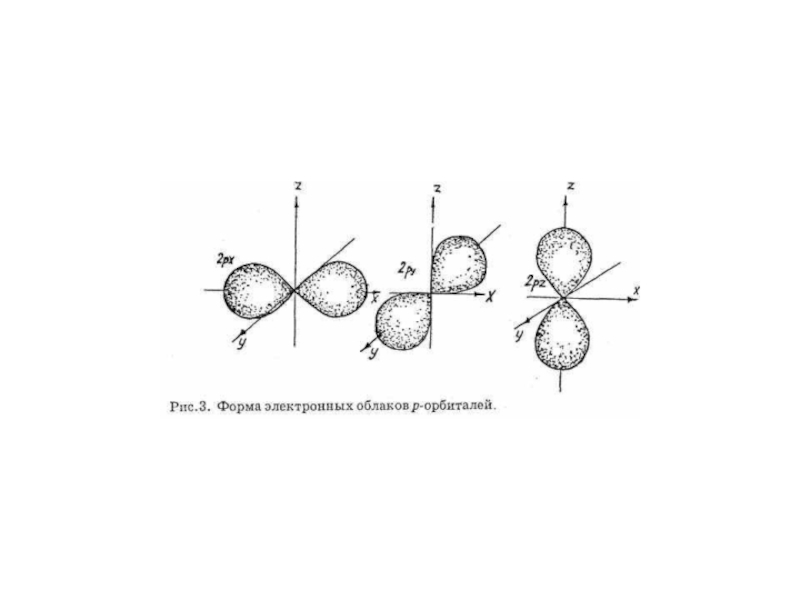
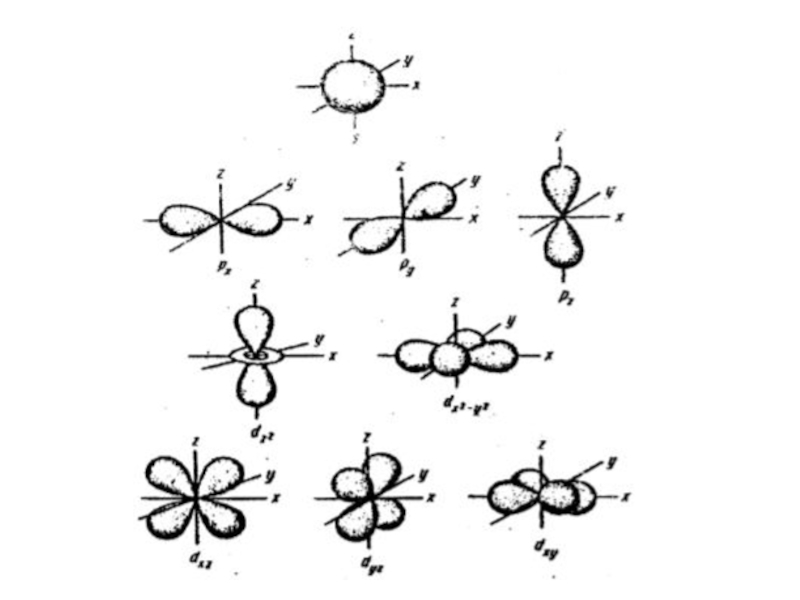
т.е.квантуется. Энергия электрона, форма электронного облака
и другие параметры описывают состояние электрона в атоме.
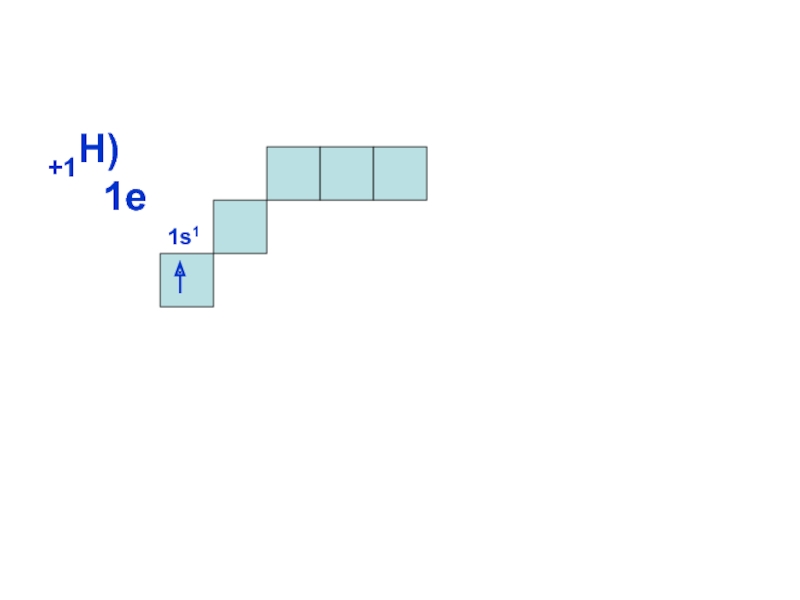
Состояние электрона характеризуется совокупностью чисел,
называемых квантовыми числами. Главное квантовое число n служит для отнесения состояния
электрона к тому или иному энергетическому уровню, под
которым понимается набор орбиталей с близкими значениями
энергии. Главное квантовое число может принимать любое
значение из области натуральных чисел, т.е.n=1, 2, 3.
ОРБИТАЛИ - место расположения
электрона в атоме.