Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Современные подходы к ХТ, таргетная терапия, роль ИГХ и
Содержание
- 1. Современные подходы к ХТ, таргетная терапия, роль ИГХ и
- 2. Таргетная терапия (син: целевая, молекулярно-нацеленная) от англ.
- 3. Принципиальное отличие отличие таргетных от классических противоопухолевых
- 4. Таргетные препаратыМоноклональные антитела к факторам роста и
- 5. Таргетные препаратыМалые синтетические молекулы – ингибиторы протеинкиназ:
- 6. Природные соединения (неовастат, флавоперидол)Вирусы (AdP53, ONIX-015)
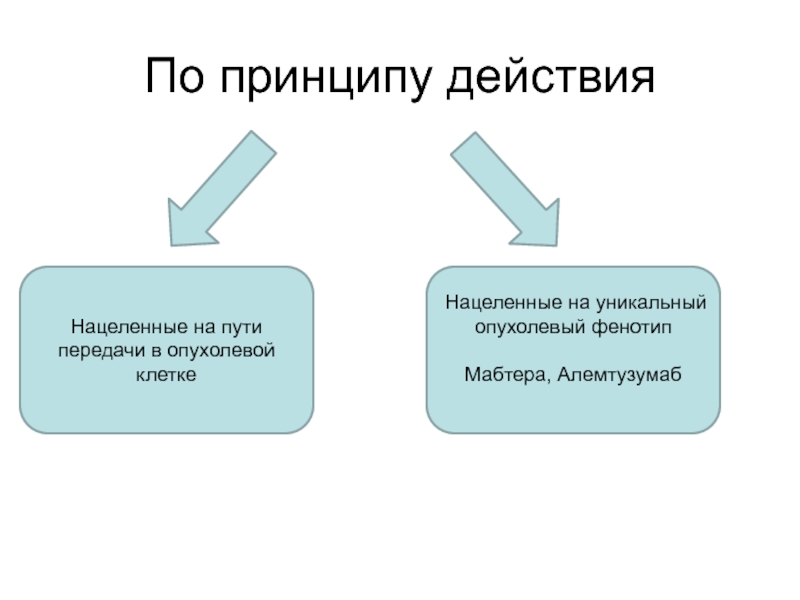
- 7. По принципу действияНацеленные на пути передачи в опухолевой клеткеНацеленные на уникальный опухолевый фенотипМабтера, Алемтузумаб
- 8. На принципе блокирования передачи митогенных и антиапоптических
- 9. Слайд 9
- 10. Стратегия таргетной терапииБлокада циркулирующих лигандовБлокада связывания лигандов
- 11. На сегодняшний день практическое применение получило 17
- 12. Учитывая механизм действия таргетных препаратов, теоретически их
- 13. На основании убедительных лабораторных данных рецептор HER2
- 14. Определение HER – статуса.В рутинной клинической практике
- 15. ИГХДифференциальная диагностика определение гистогенеза (цитоспецифические АГ: ПСА,ТГ;
- 16. ИГХ- метод позволяющий определение локализации антигенов с
- 17. Принцип ИГХ
- 18. Иммуногистохимия имеет колоссальные преимущества по сравнению с
- 19. Антитела могут частично разрушаться при хранении, особенно
- 20. Слайд 20
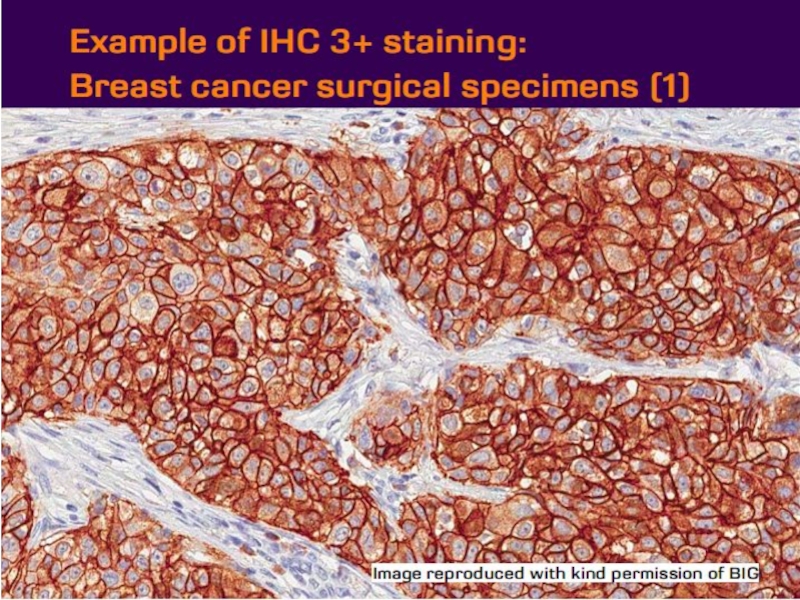
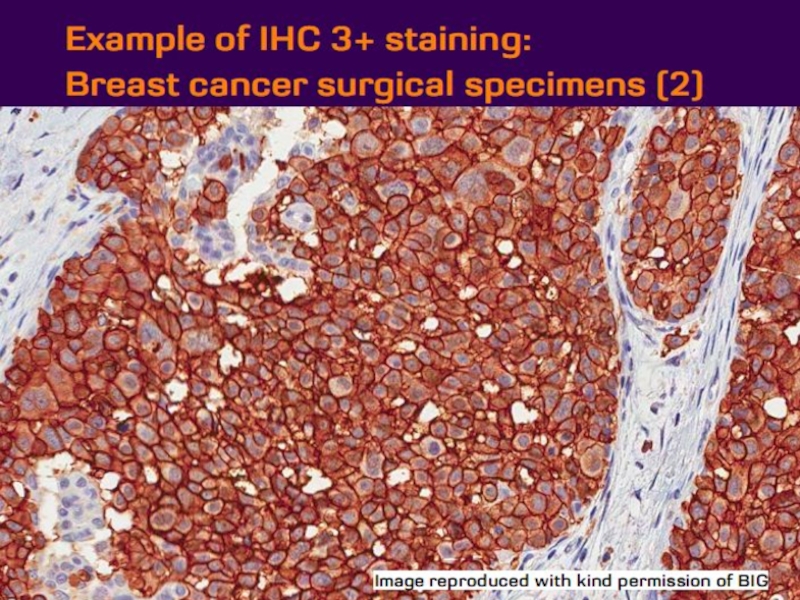
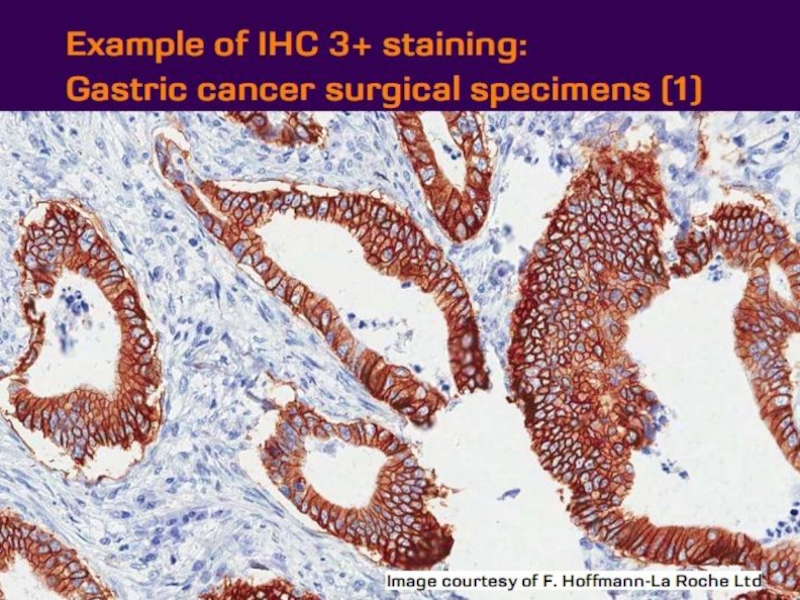
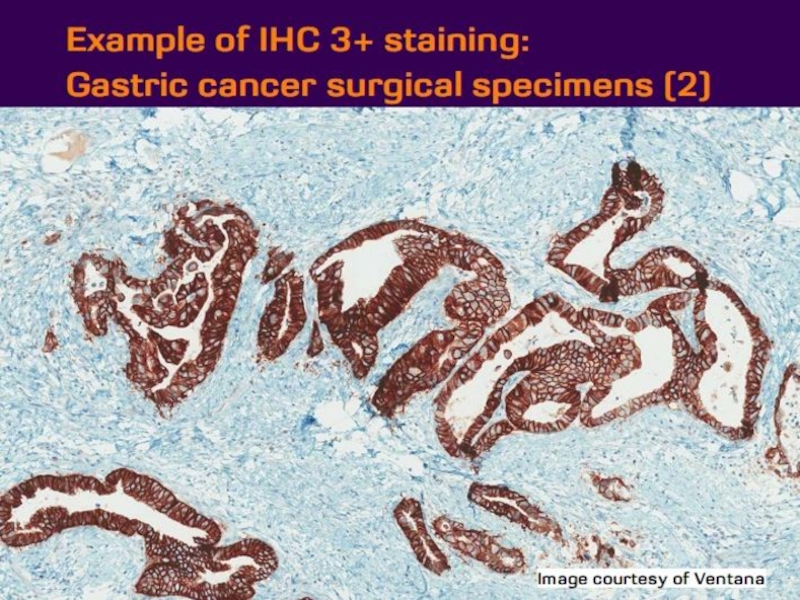
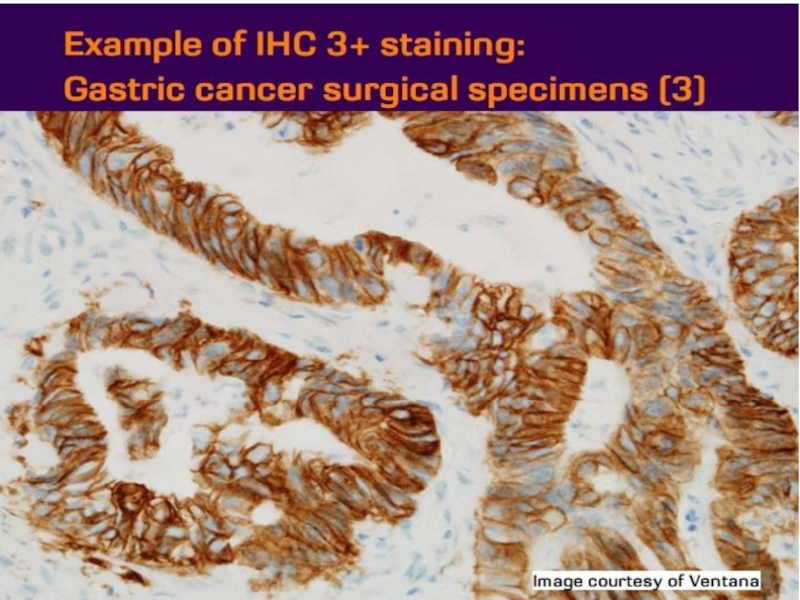
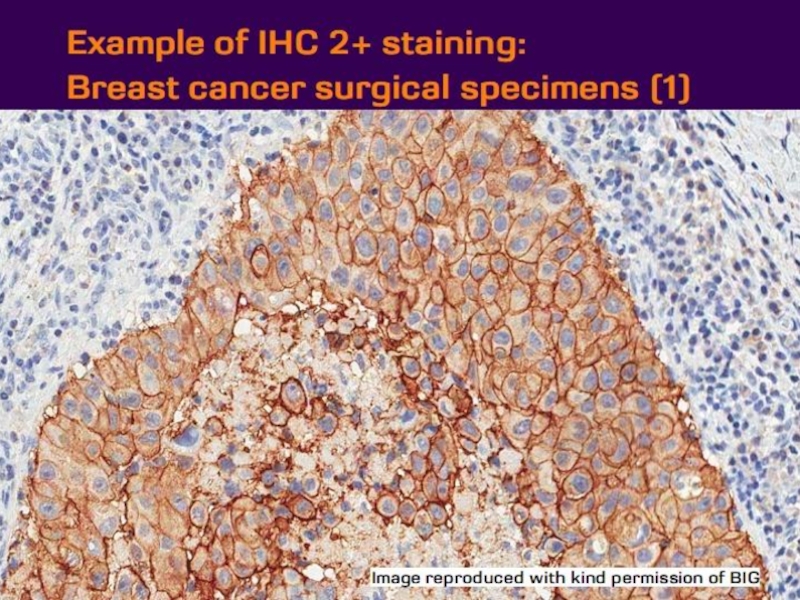
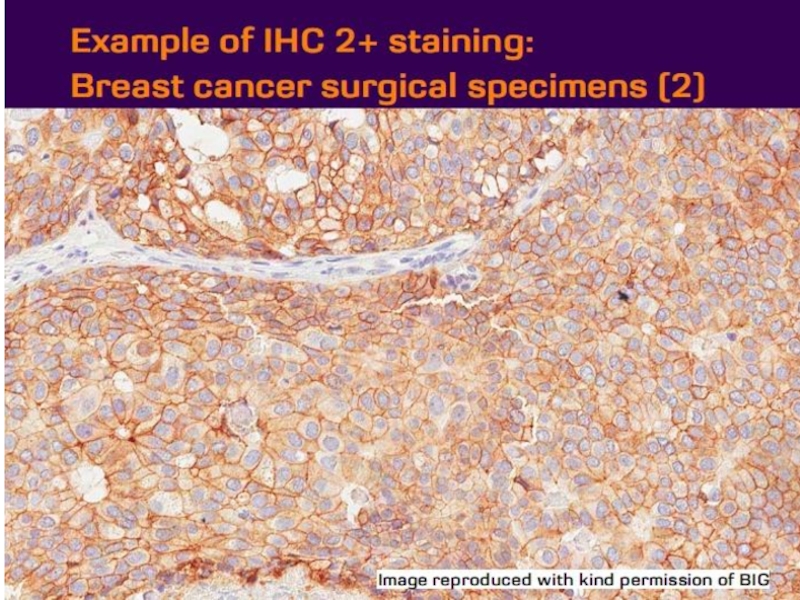
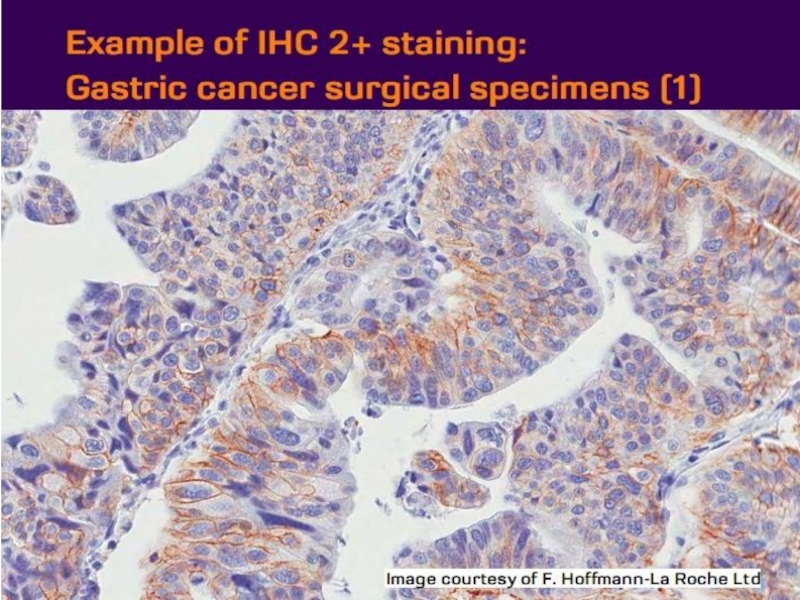
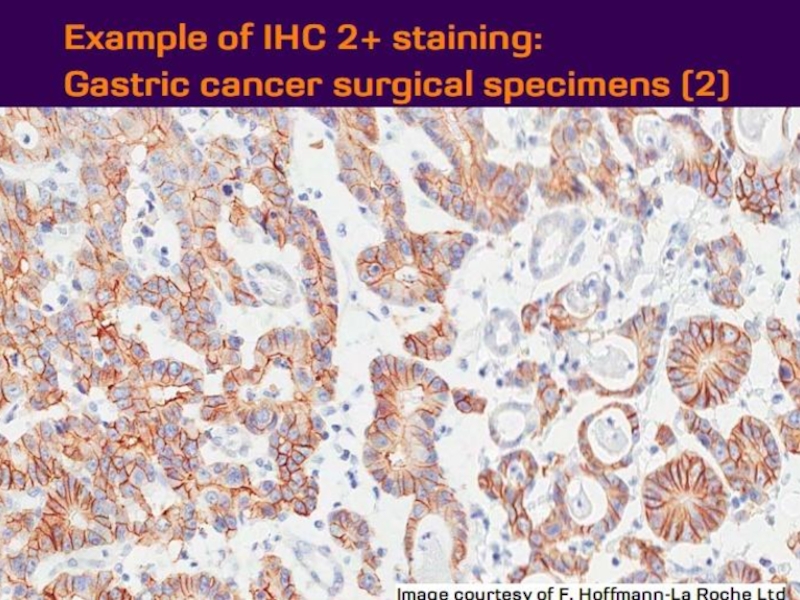
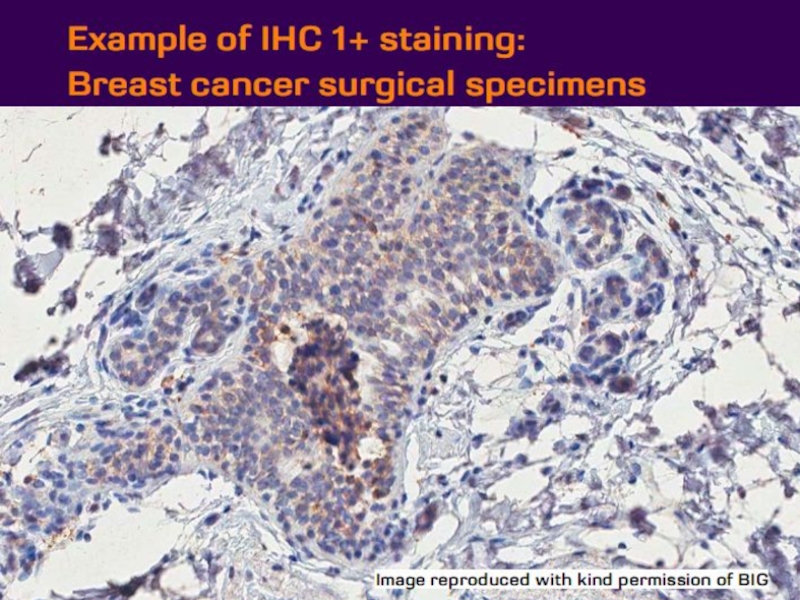
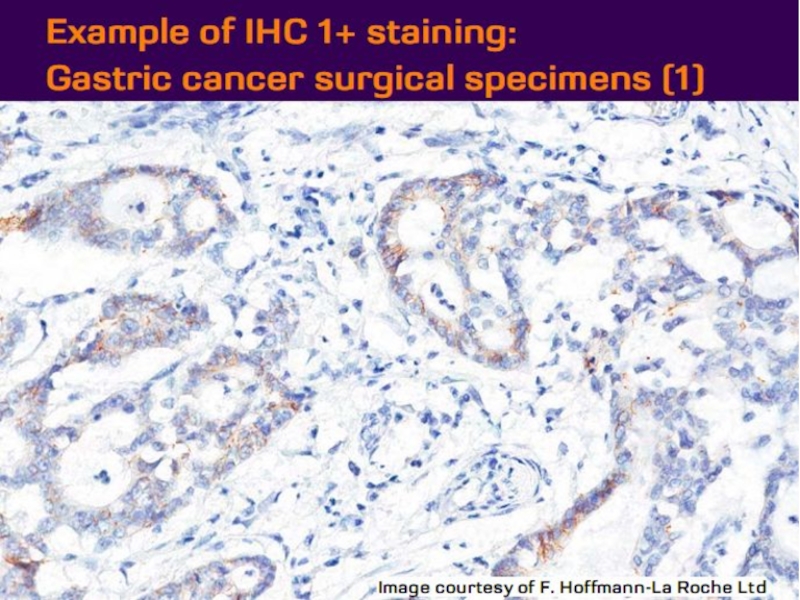
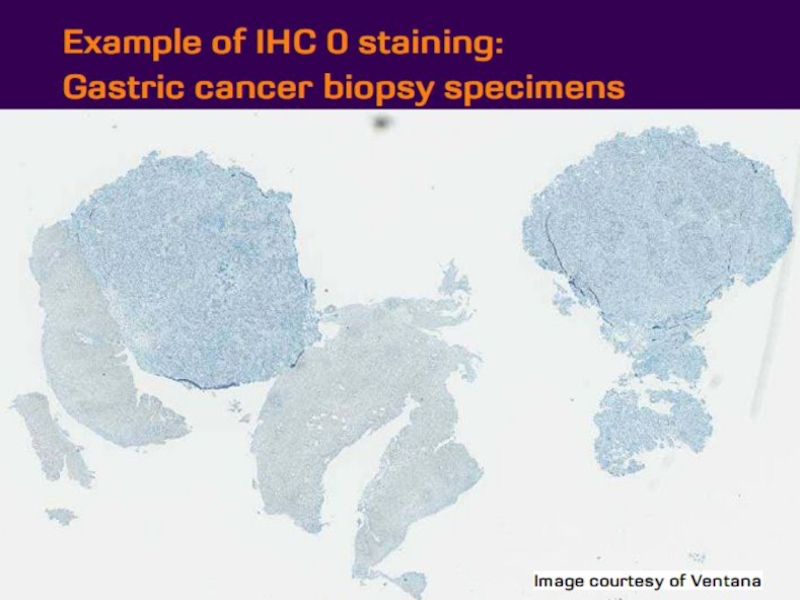
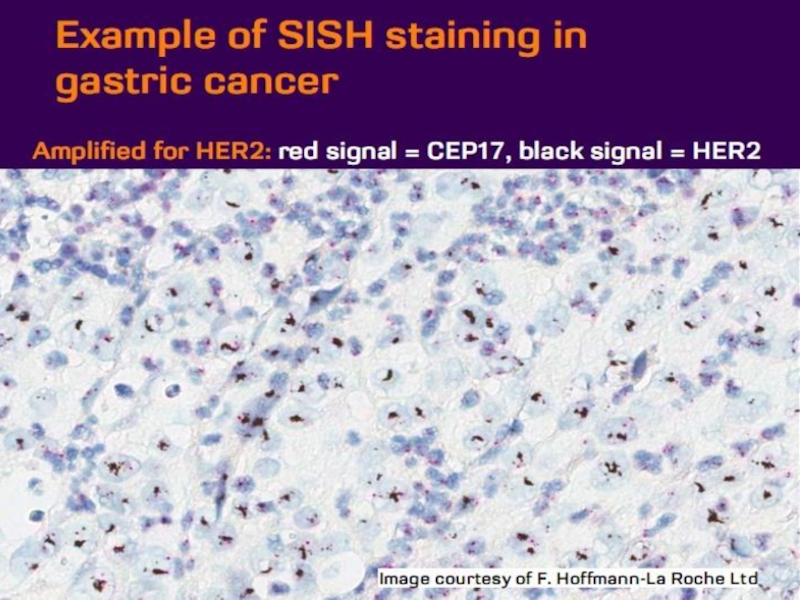
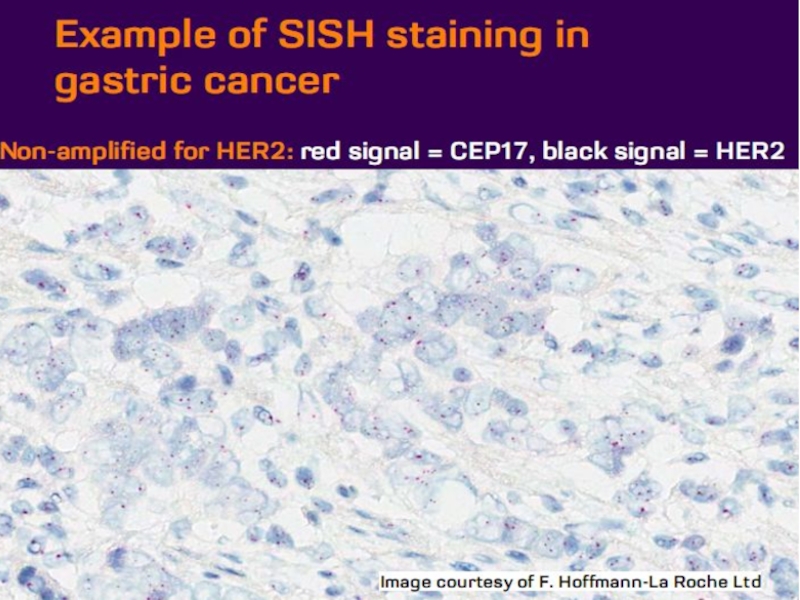
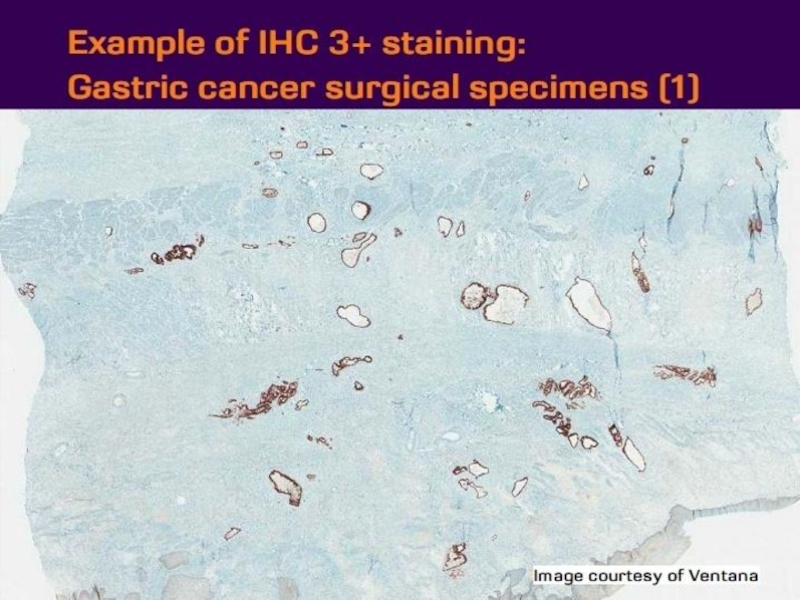
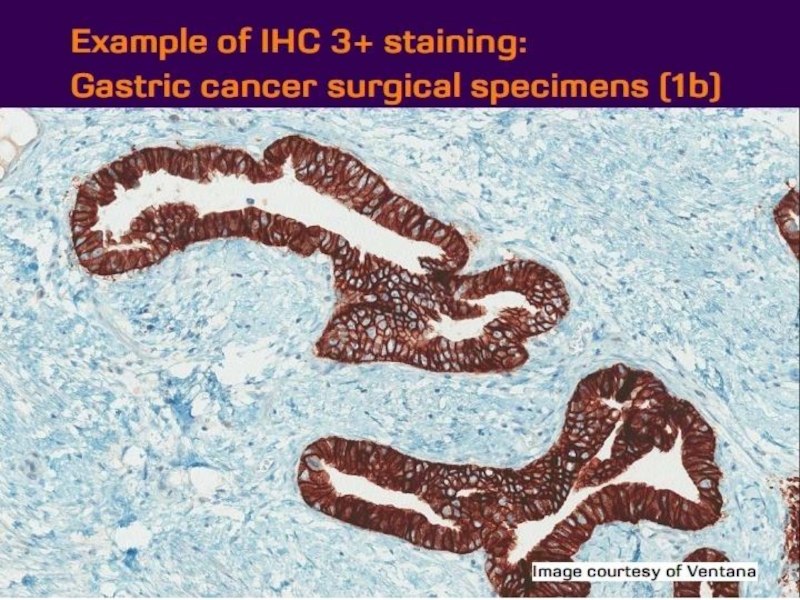
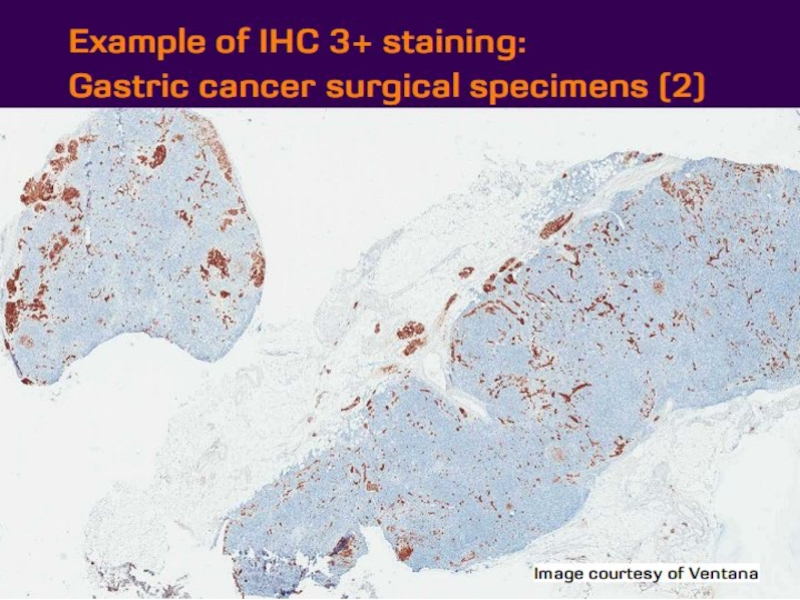
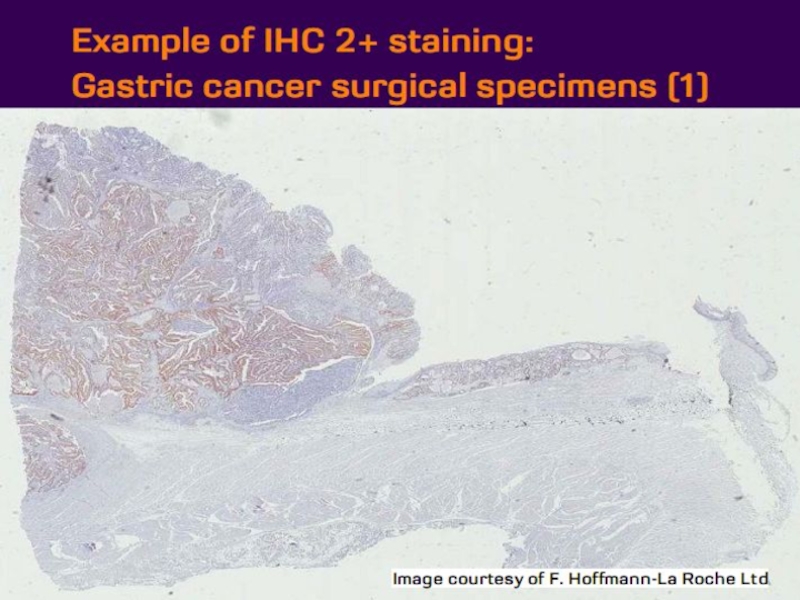
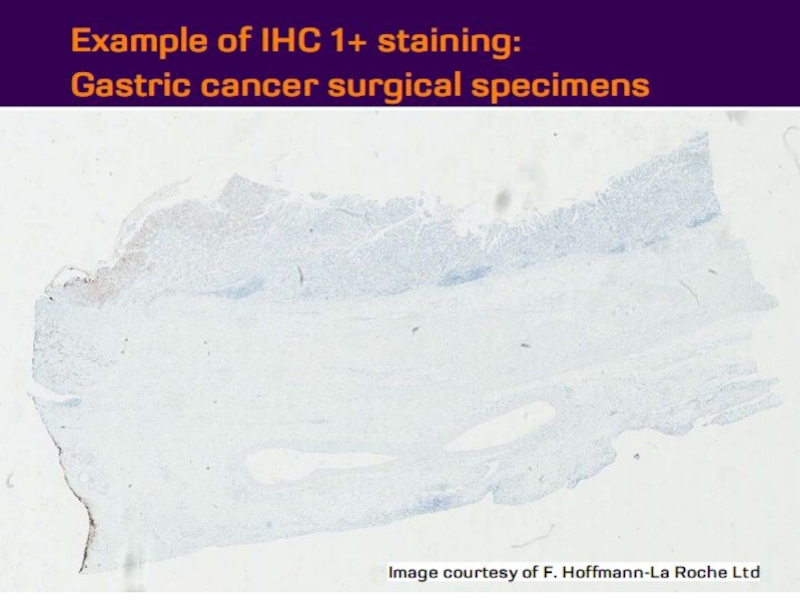
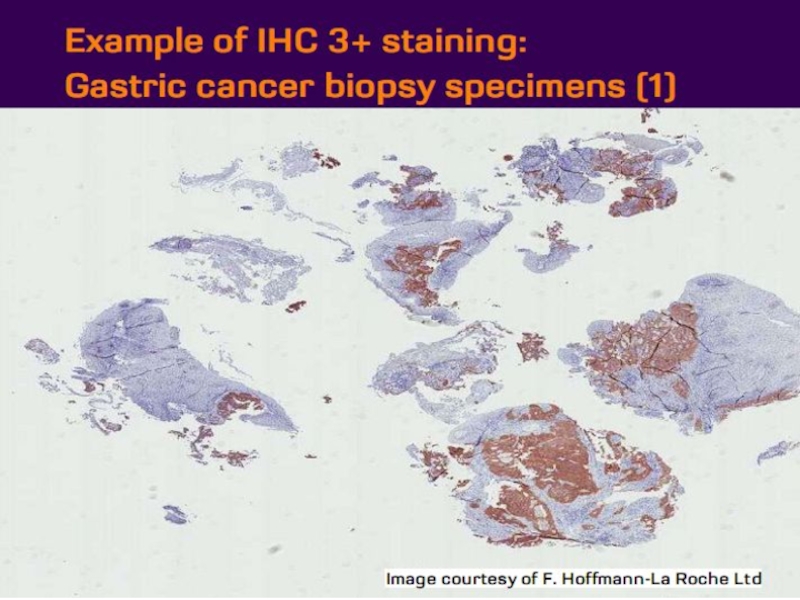
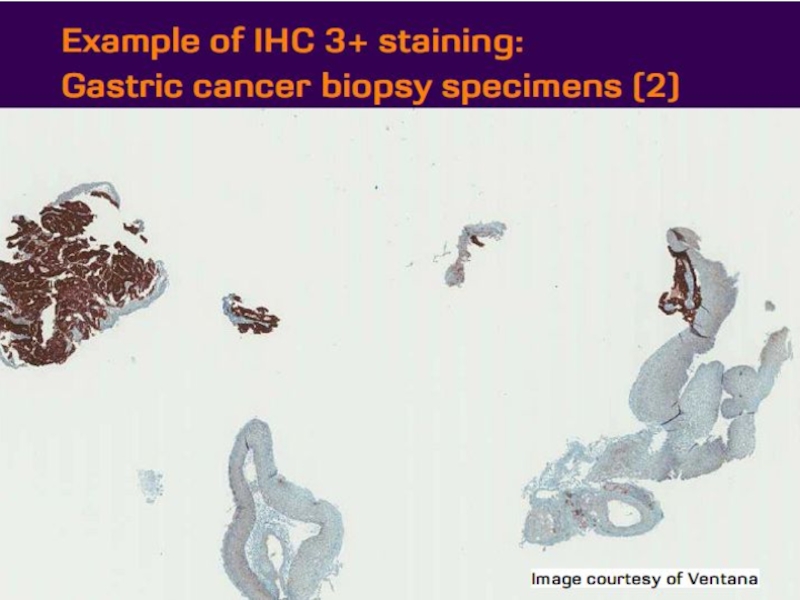
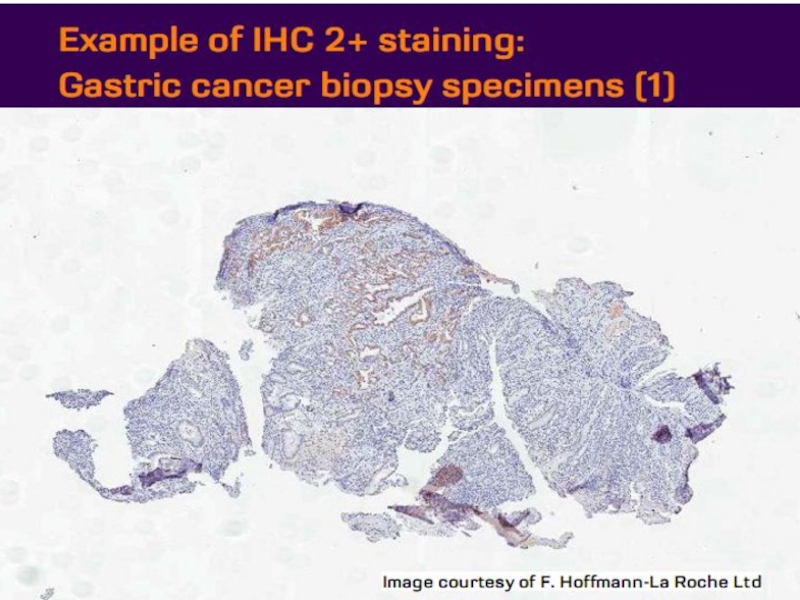
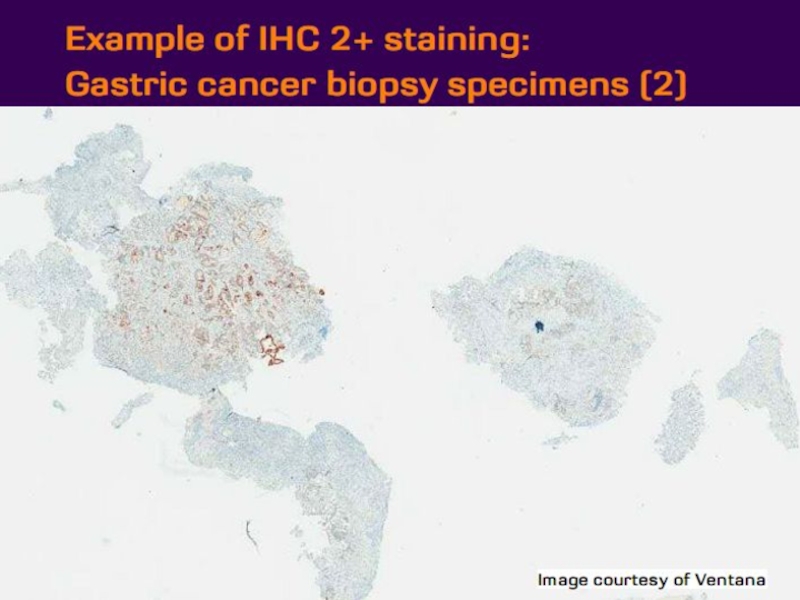
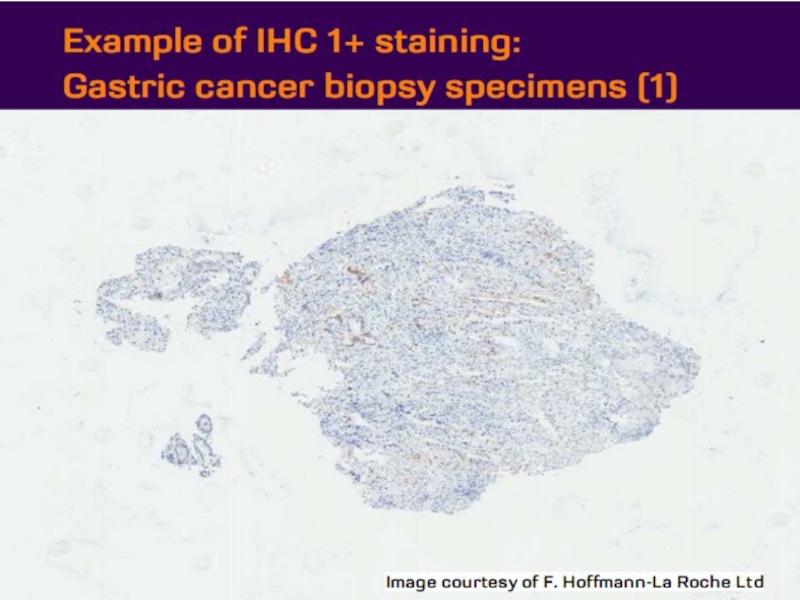
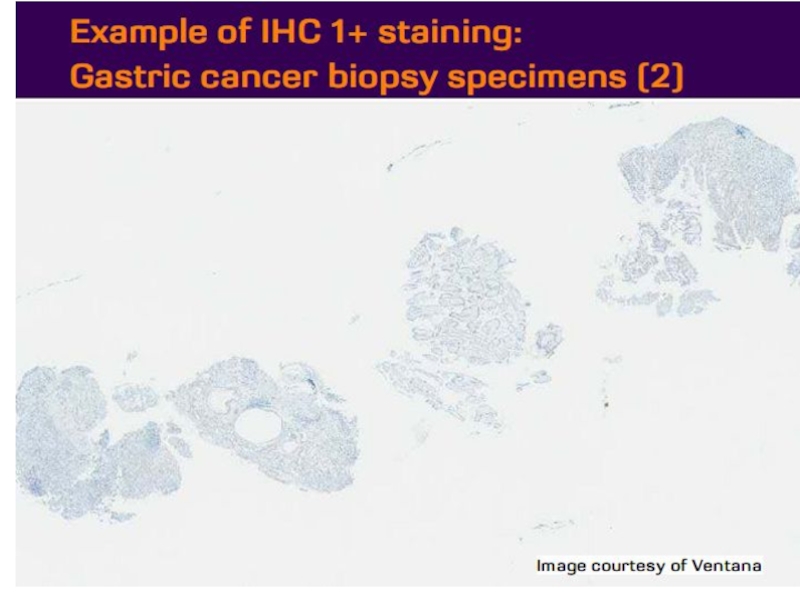
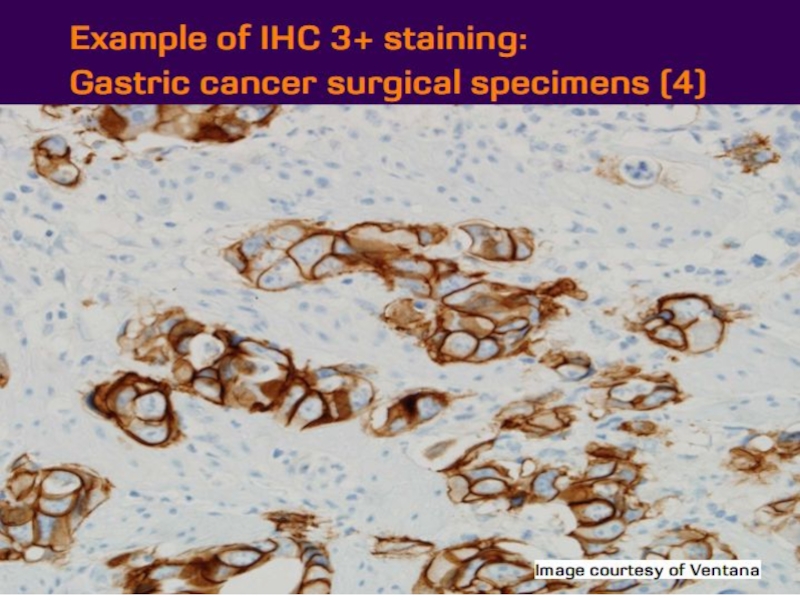
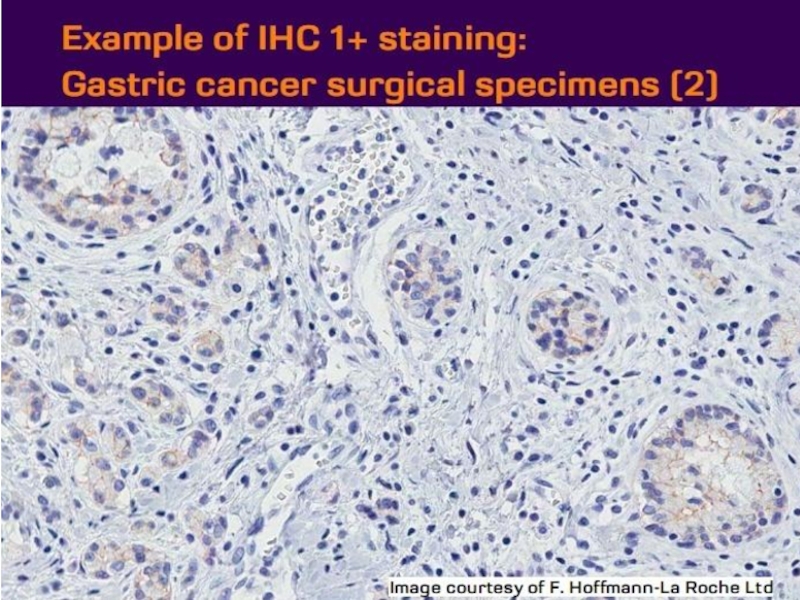
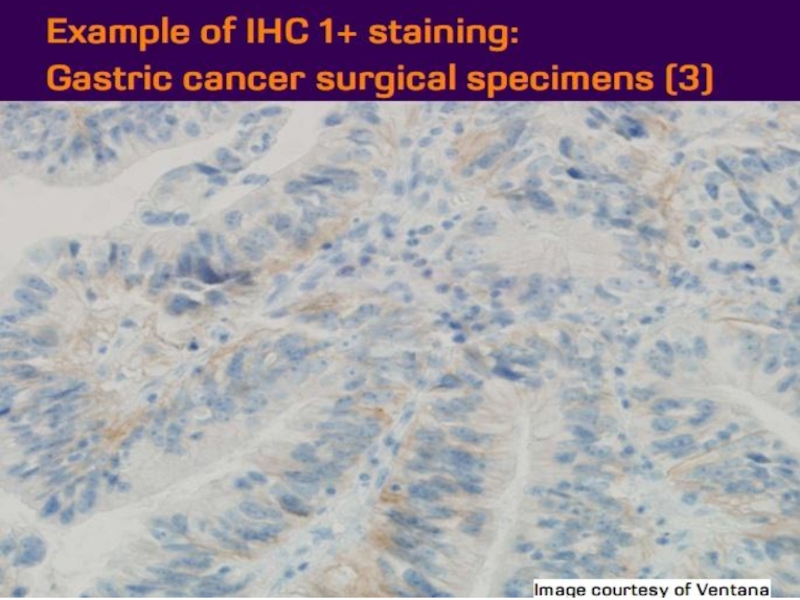
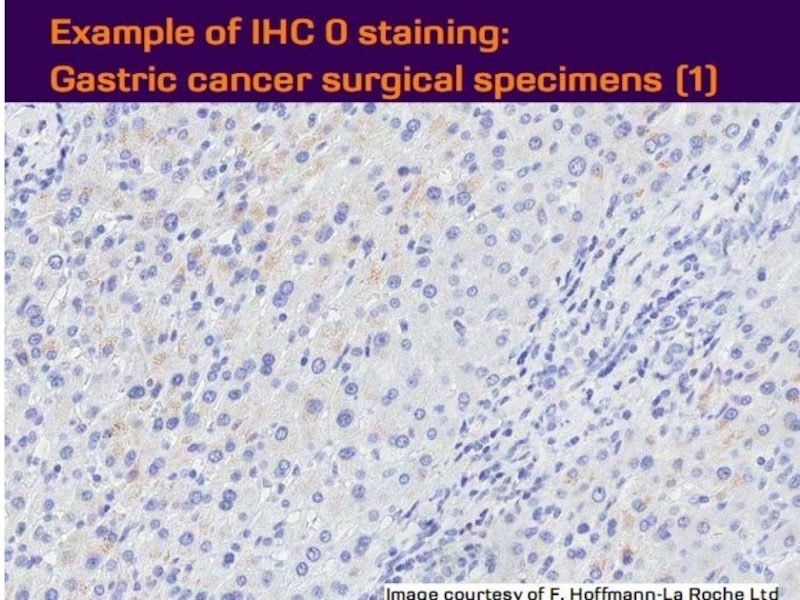
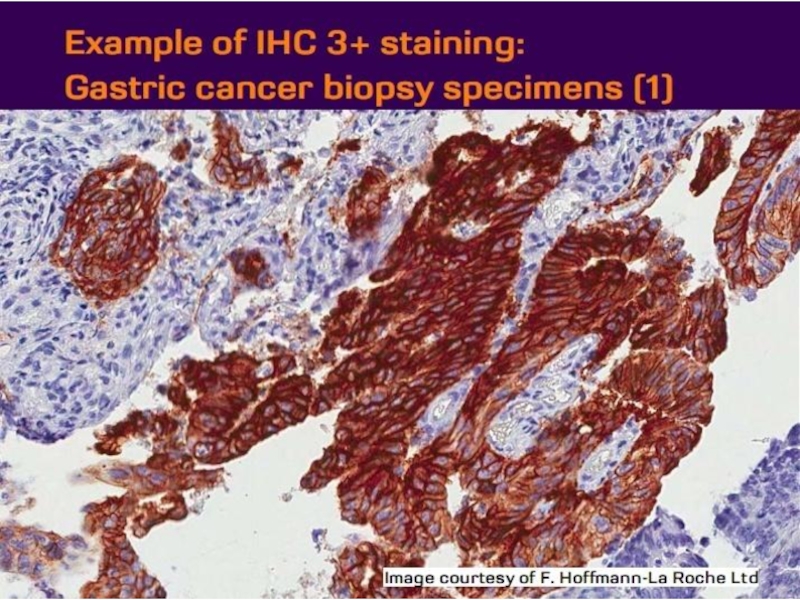
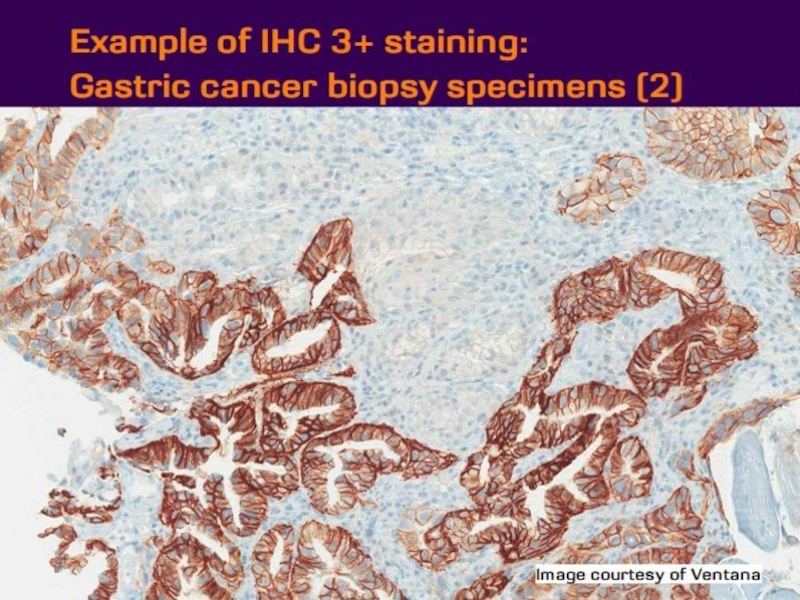
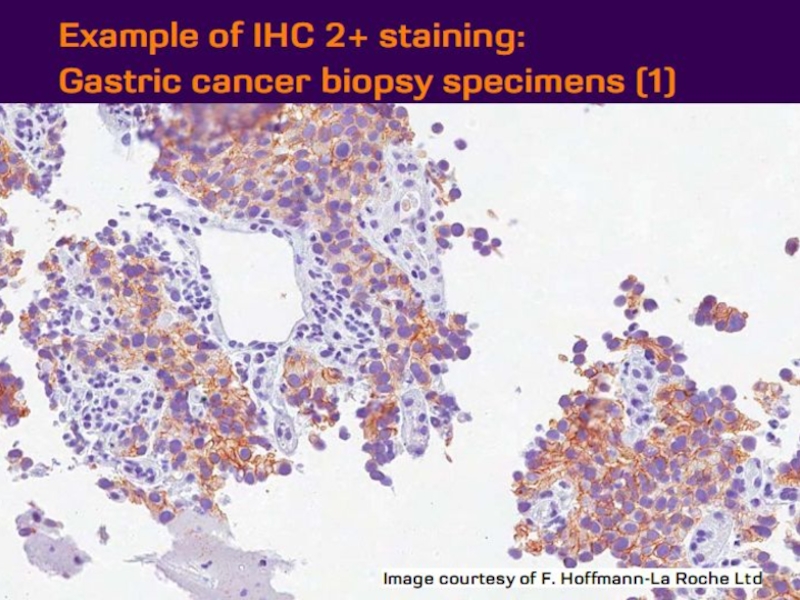
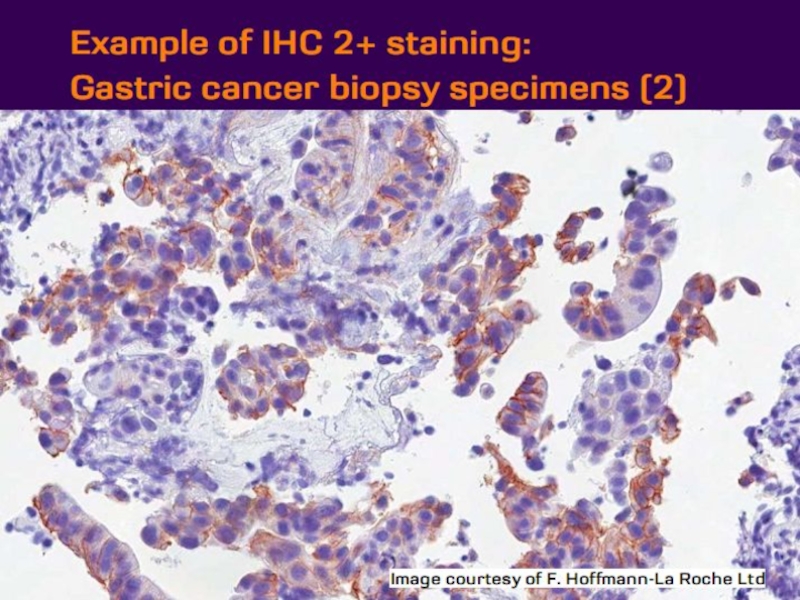
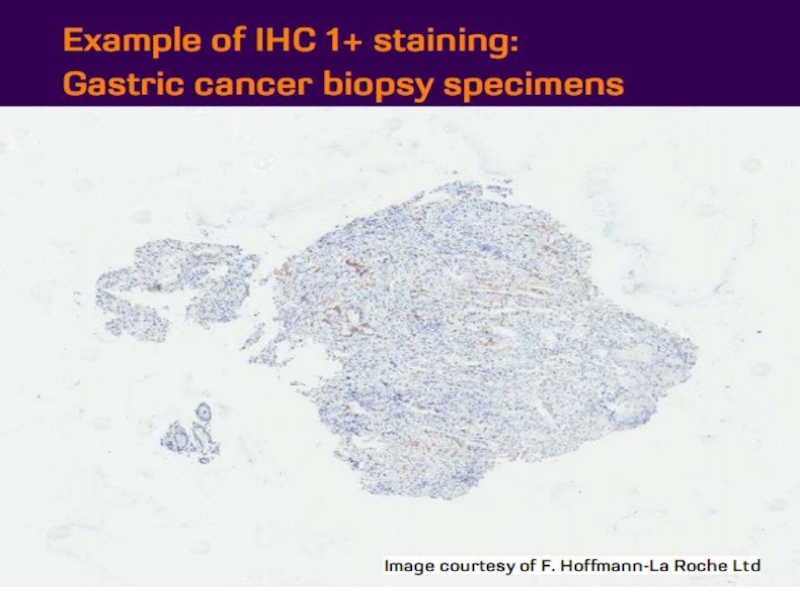
- 21. Оценка HER2 статуса при раке желудка
- 22. Слайд 22
- 23. Слайд 23
- 24. Слайд 24
- 25. Слайд 25
- 26. Слайд 26
- 27. Слайд 27
- 28. Слайд 28
- 29. Слайд 29
- 30. Слайд 30
- 31. Слайд 31
- 32. Слайд 32
- 33. Слайд 33
- 34. С помощью ИГХ в клетках определяется наличие
- 35. Гибридизация in situ (ГИС)Метод прямого выявления нуклеиновых
- 36. Слайд 36
- 37. Наибольшее распространение получила т.н. флуоресцентная гибридизация in
- 38. Слайд 38
- 39. Слайд 39
- 40. При лечении рака толстой кишки использование антител
- 41. Применение экспериментального ингибитора протеинкиназы BRAF для
- 42. В настоящее время одинаково широко используются следующие
- 43. Генетическое секвенирование (Genetic sequencing) - это современный
- 44. Определение статуса мутации гена EGFRНаличие мутаций гена
- 45. Определение статуса мутации гена EGFRНаиболее широко применяются методы полимеразной цепной реакции в различных вариантах и секвенирования.
- 46. Слайд 46
- 47. Спасибо за внимание!!!
- 48. Слайд 48
- 49. Слайд 49
- 50. Слайд 50
- 51. Слайд 51
- 52. Слайд 52
- 53. Слайд 53
- 54. Слайд 54
- 55. Слайд 55
- 56. Слайд 56
- 57. Слайд 57
- 58. Слайд 58
- 59. Слайд 59
- 60. Слайд 60
- 61. Слайд 61
- 62. Слайд 62
- 63. Слайд 63
- 64. Слайд 64
- 65. Слайд 65
- 66. Слайд 66
- 67. Слайд 67
- 68. Скачать презентанцию
Таргетная терапия (син: целевая, молекулярно-нацеленная) от англ. Target –цель, мишень.В ее основе лежит точечное воздействие на определенные клеточные рецепторы или сигнальные пути, передающие информацию в ядро клетки.
Слайды и текст этой презентации
Слайд 1Современные подходы к ХТ, таргетная терапия, роль ИГХ и молекулярно-генетических
исследований.
Слайд 2Таргетная терапия (син: целевая, молекулярно-нацеленная) от англ. Target –цель, мишень.
В
ее основе лежит точечное воздействие на определенные клеточные рецепторы или
сигнальные пути, передающие информацию в ядро клетки.Слайд 3Принципиальное отличие отличие таргетных от классических противоопухолевых препаратов цитотоксического действия
состоит в том, что первые действуют направлено на молекулы, участвующие
в процессе канцерогенеза.Классические противоопухолевые препараты действуют на такие общебиологические процессы как синтез ДНК и митоз.
Слайд 4Таргетные препараты
Моноклональные антитела к факторам роста и их рецепторам: трастузумаб
(Герцептин), цетуксимаб(Эрбитукс), панитумумаб(Вектибикс), бевацизумаб (Авастин);
Нерецепторные МКА и их коньюгаты: ритуксимаб
(Мабтера), алемтузумаб (Кэмпас);Слайд 5Таргетные препараты
Малые синтетические молекулы – ингибиторы протеинкиназ: иматиниб (Гливек), гефитиниб
(Иресса), эрлотиниб (Тарцева), сунитиниб (Сутент), лапатиниб (Тайкерб), дазатиниб (Спрайсел), сорафениб
(Нексавар), нилотиниб (Тасигна), темсиролимус (Торисел), эверолимус (Афинитор).Антисмысловые нуклеотиды( короткие синтетические отрезки ДНК, связывающиеся с мРНК) – облимерсен (Генасенс)
Слайд 7По принципу действия
Нацеленные на пути передачи в опухолевой клетке
Нацеленные на
уникальный опухолевый фенотип
Мабтера, Алемтузумаб
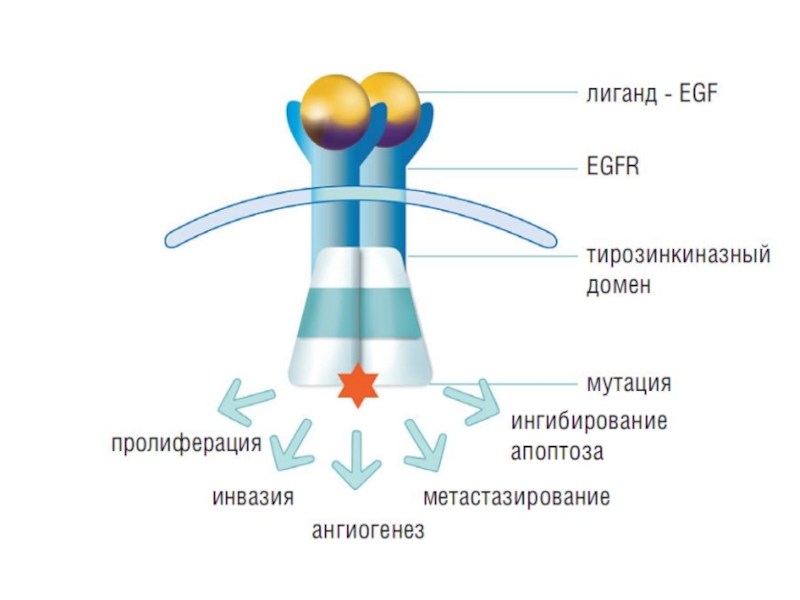
Слайд 8На принципе блокирования передачи митогенных и антиапоптических сигналов основано действие
препаратов, имеющих своей мишенью рецепторы эпидермального фактора роста (EGFR)
EGFR1(син: HER1,
ErbB1)EGFR2(син: HER2, ErbB2)
EGFR3(син: HER3, ErbB3)
EGFR4(син: HER4, ErbB4)
Слайд 10Стратегия таргетной терапии
Блокада циркулирующих лигандов
Блокада связывания лигандов с экстрацеллюлярным доменом
рецептора.
Ингибиция тирозинкиназ внутриклеточного домена рецптора
Внутриклеточная ингибиция белков осуществляющих интрацеллюлярную передачу
сигнала.Слайд 11На сегодняшний день практическое применение получило 17 препаратов, используемых как
в онкогематологии, так и при лечении солидных опухолей
Слайд 12Учитывая механизм действия таргетных препаратов, теоретически их применение оправдано у
больных, опухоли которых содержат конкретные мишени для воздействия.
Слайд 13На основании убедительных лабораторных данных рецептор HER2 был признан перспективной
мишенью для противоопухолевой терапии.
Первым препаратом, созданным для подавления функции
HER2 и вошедшим в онкологическую практику, стало гуманизированное антитело трастузумаб (Герцептин; trastuzumab; Herceptin;). Показания
Рак молочной железым
Метастатический рак молочной железы с опухолевой гиперэкспрессией HER2:
Ранние стадии рака молочной железы с опухолевой гиперэкспрессией HER2:
Распространенный рак желудка
Распространенная аденокарцинома желудка или пищеводно-желудочного перехода с опухолевой гиперэкспрессией HER2:
Низкомолекулярный ингибитор тирозинкиназы HER2 – лапатиниб (Тайверб, Тайкерб);
Разрешен для лечения Герцептин-резистентных РМЖ, а также для комбинированного применения с ингибиторами ароматазы.
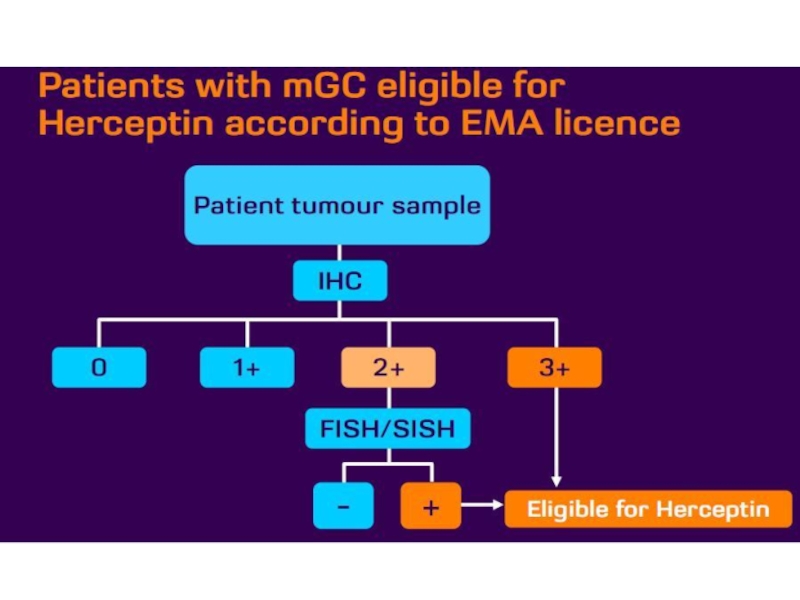
Слайд 14Определение HER – статуса.
В рутинной клинической практике используется 2 основных
метода диагностики статуса онкогена HER2: иммуногистохимия (ИГХ) и гибридизация in
situ (in situ hybridization, ISH)Слайд 15ИГХ
Дифференциальная диагностика определение гистогенеза (цитоспецифические АГ: ПСА,ТГ; тканеспецифичные АГ:общий цитокератин-
эпителиальная ткань; опухоль-ассоциированые аг- СА – 125, СА – 19-9)
Определение
иммунофенотипа опухолиОпределение молекулярно-биологических факторов прогноза (пролиферативная активность, уровень апоптоза, уровень супрессоров опухолевого роста, состояние показателей биологической агрессивности и мтс-активности)
Определение чувствительности к препаратам таргетной терапии (фармакодиагностика)
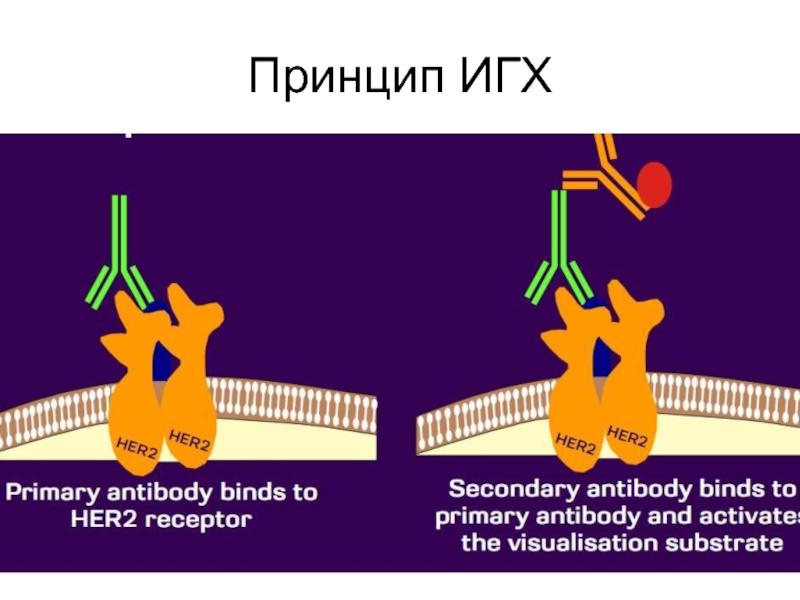
Слайд 16ИГХ- метод позволяющий определение локализации антигенов с помощью специфических антител
на замороженном или парафиновом срезе.
При помощи меченых АТ или методом
вторичного мечения.Слайд 18Иммуногистохимия имеет колоссальные преимущества по сравнению с другими методами.
не
требует дорогостоящего оборудования
дифференцировать опухолевую и внеопухолевую экспрессию того или
иного белка.дискриминировать между мембранным, цитоплазматическим и ядерным окрашиванием.
Слайд 19
Антитела могут частично разрушаться при хранении, особенно при несоблюдении требуемых
условий или сроков.
Помимо этого, скорость взаимодействия антител и антигена
чрезвычайно зависит от температуры инкубации: столь важный фактор должен контролироваться с точностью до градуса, однако подобное требование на практике не всегда выполняется. Многие лаборатории практикуют нанесение раствора антител на поверхность гистологического среза; подобное прокрашивание «в капле» позволяет экономить антитела, но не обеспечивает идеальных условий инкубации.
Альтернативой является применение специальных ванночек для предметных стекол, которые предназначены для относительно больших объемов раствора антител (десятки миллилитров); в этом случае условия инкубации отличаются хорошей воспроизводимостью, однако расход антител существенно возрастает.
В большинстве отечественных лабораторий в целях экономии практикуется разведение антител ниже рекомендованных производителем концентраций.
Слайд 34С помощью ИГХ в клетках определяется наличие специфических белков, но
это НЕ ГОВОРИТ О СИНТЕЗЕ ЭТИХ ВЕЩЕСТВ В ОПУХОЛЕВУХ КЛЕТКАХ,
они могут поступать в клетку извнеОтсутствие какого-либо белка может указывать на временное отсутствие его экспрессии, а не на отсутствие в геноме.
Поэтому в онкоморфологии возникают ситуации когда важно выявить повышенную экспрессию белка или доказать амплификацию гена.
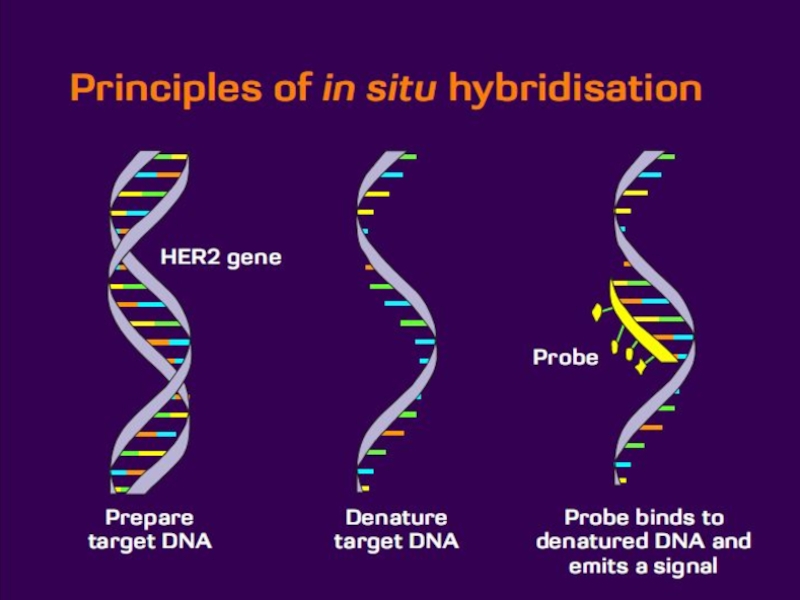
Слайд 35Гибридизация in situ (ГИС)
Метод прямого выявления нуклеиновых кислот (ДНК и
РНК) в клеточных и тканевых структурах.
Зонд наносят на образец содержащий
генетический материал.Проводят на разных объектах от индивидуальных хромосом в метафазных пластинках до архивного материала залитого в парафин.
Слайд 37Наибольшее распространение получила т.н. флуоресцентная гибридизация in situ (FISH).
Недостатки:
проблематичность визуальной гистологической оценки препарата;
необходимость в специальном оборудовании.
Значительную
популярность приобрели различные модификации FISH, в частности «chromogenic in situ hybridization» (CISH, хромогенная гибридизация in situ). В отличие от исходного метода, в CISH используются цветные метки, поддающиеся визуализации в обычном световом микроскопе.
CISH не требует специального оборудования для детекции флуоресцентного сигнала и позволяет осуществлять гистологическую оценку изучаемого препарата.
Слайд 40При лечении рака толстой кишки использование антител к рецептору эпидермального
фактора роста (epidermal growth factor receptor, EGFR) – цетуксимаба и
панитумумаба – допускается только в том случае, если в опухоли отсутствует мутация в онкогене KRAS.Низкомолекулярные ингибиторы EGFR (гефитиниб и эрлотиниб), применяемые для терапии рака лёгкого, рекомендуется в первую очередь назначать тем больным, у которых обнаружена активирующая мутация
данного рецептора.
Использование иммуногистохимических и/или цитогенетических методов позволило разработать эффективные подходы для отбора больных на лечение антагонистами эстрогенов, ритуксимабом, трастузумабом, иматинибом.
Слайд 41
Применение экспериментального ингибитора протеинкиназы BRAF для лечения меланомы оказалось
успешным только в тех случаях, когда опухоль содержала мутированную версию
упомянутого онкогена.Другой подход к лечению меланомы, предусматривающий назначение специфических или мультитаргетных антагонистов тирозинкиназ (иматиниб, дасатиниб, сорафениб, сунитиниб), предусматривает анализ нуклеотидной последовательности гена KIT.
Использование антагониста тирозинкиназы RET – вандетаниба - допустимо только при условии диагностирования повреждения соответствующего гена.
Таким образом, востребованность молекулярной диагностики в практической онкологии представляется достаточно очевидной. Не вызывает никаких сомнений, что потребность в соответствующих тестах будет нарастать с каждым годом, по мере расширения арсенала противоопухолевых препаратов и уточнения показаний к их применению.
Слайд 42В настоящее время одинаково широко
используются следующие методы вери-
фикации мутаций
гена KRAS: различные виды секвенирования и аллель-специфической ПЦР. Определяются генетические
нарушенияв ДНК, выделенной из ткани опухоли,
фиксированной в формалине и залитой
в парафин. Для выполнения исследо-
вания необходимо обязательное пре-
доставление биопсийного материала
с достаточным количеством опухолевой
ткани.
Слайд 43Генетическое секвенирование (Genetic sequencing) - это современный высокотехнологичный метод онкологического
обследования, определяющий последовательность кодирующих участков генов.
При секвенировании определяют последовательность всех
экзонов – то есть кодирующих фрагментов молекулы ДНК (а не отдельных элементов). Далее, устанавливаются последовательности более чем 50 миллионов базовых пар ДНК и анализируются свыше 20 000 кодирующих участков генов. Процесс секвенирования повторяется 50-100 раз, чтобы гарантировать высокую степень уверенности в полученных результатах. Дополнительно делаются анализы, позволяющие выявить амплификацию или делецию.
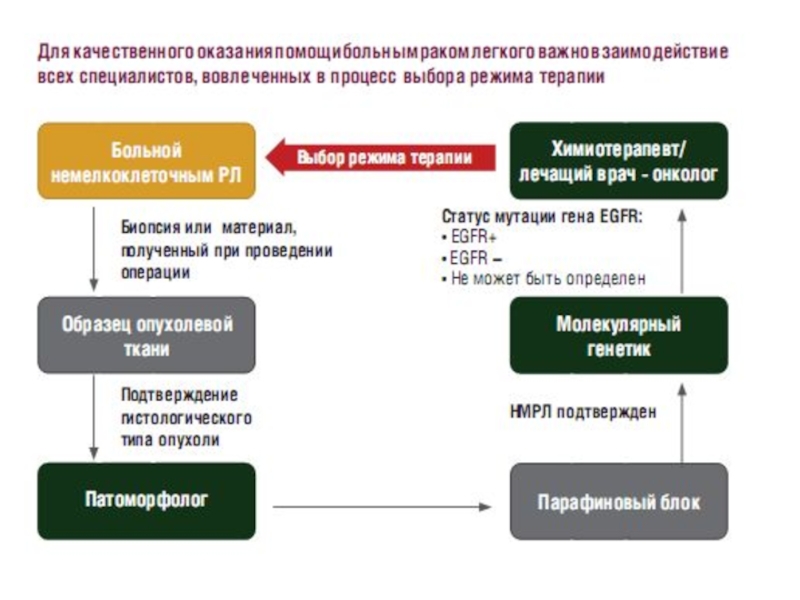
Слайд 44Определение статуса мутации гена EGFR
Наличие мутаций гена EGFR позволяет выделить
группу пациентов с наибольшей вероятностью выраженного ответа на терапию ингибиторами
тирозинкиназы (гефитиниб*)Определение статуса мутации гена EGFR и персонализированной подход к выбору терапии, основанный на результатах молекулярно-генетического тестирования, позволят сделать лечение рака легкого более эффективным и приблизится к международным тенденциям клинической практики.