Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Спирты
Содержание
- 1. Спирты
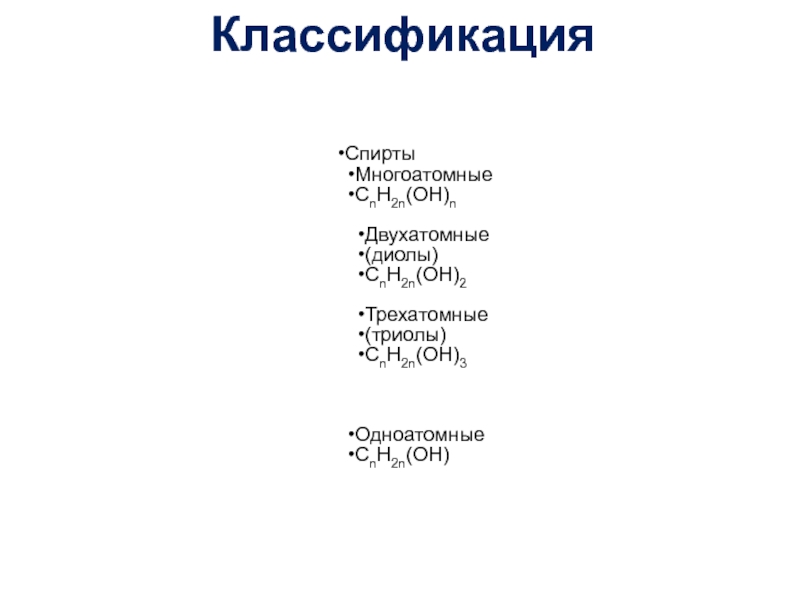
- 2. Классификация
- 3. Классификация
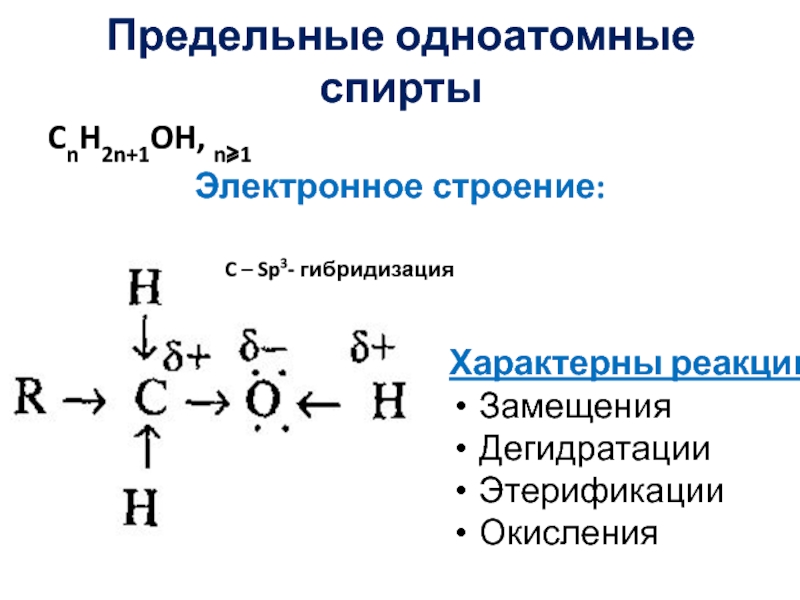
- 4. Предельные одноатомные спиртыCnH2n+1OH, n⩾1Электронное строение:C – Sp3- гибридизацияХарактерны реакции: ЗамещенияДегидратацииЭтерификацииОкисления
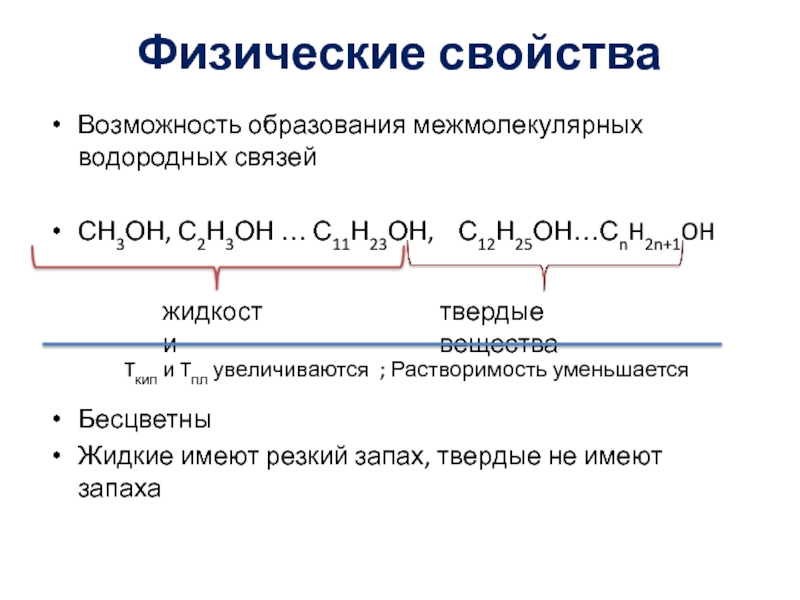
- 5. Физические свойстваВозможность образования межмолекулярных водородных связейСН3ОН, С2Н3ОН
- 6. ХИМИЧЕСКИЕ СВОЙСТВА
- 7. Реакции замещения1. Замещение атома водорода группы –ОН:С
- 8. Реакции замещения2. Замещение группы –ОН:С NH3 с
- 9. Реакции отщепления1. Дегидратация (отщепление H2O в присут.
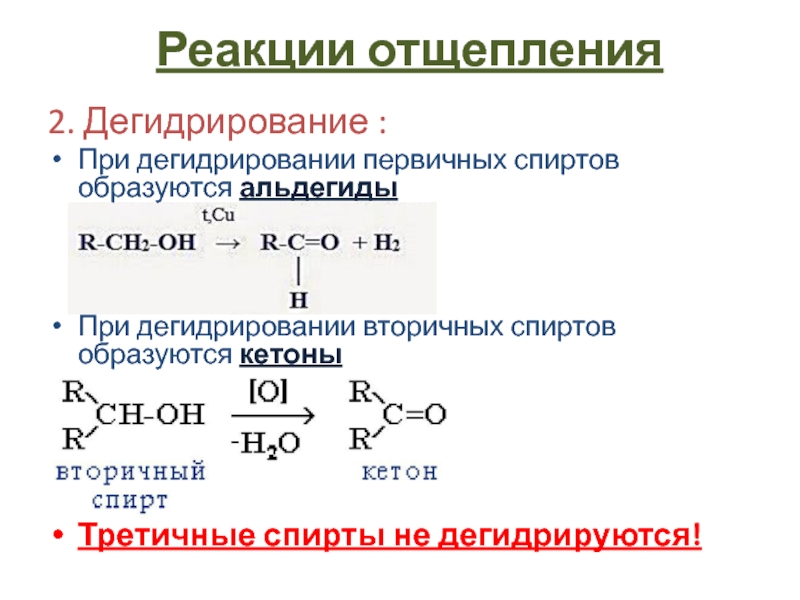
- 10. 2. Дегидрирование :При дегидрировании первичных спиртов образуются
- 11. Реакции окисления1.Горение (полное окисление):R-OH + O2 CO2+H2O2.
- 12. СПОСОБЫ ПОЛУЧЕНИЯ В ПРОМЫШЛЕННОСТИ
- 13. 1. Из водяного газа (получение метанола – древесный
- 14. СПОСОБЫ ПОЛУЧЕНИЯ В ЛАБОРАТОРИИ
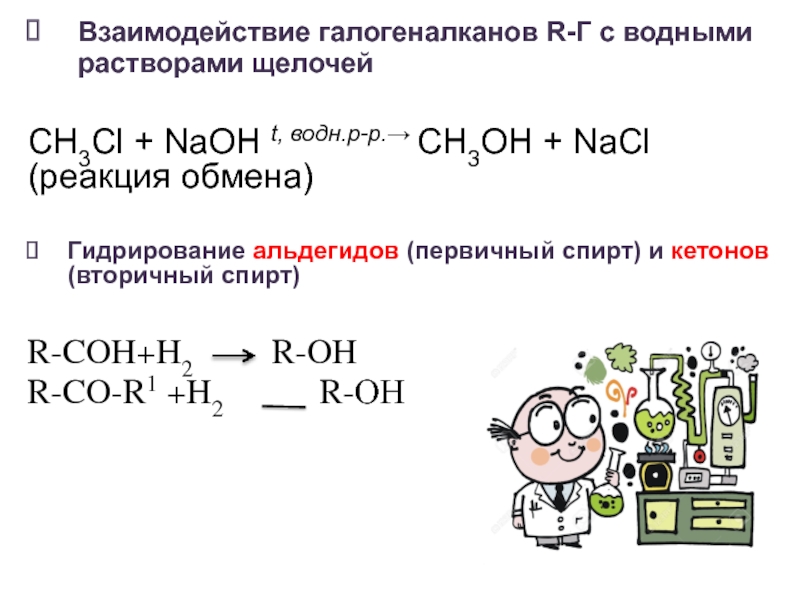
- 15. Взаимодействие галогеналканов R-Г с водными растворами щелочей
- 16. Предельные многоатомные спиртыR-(OH)n: гликоли (диолы), триолы
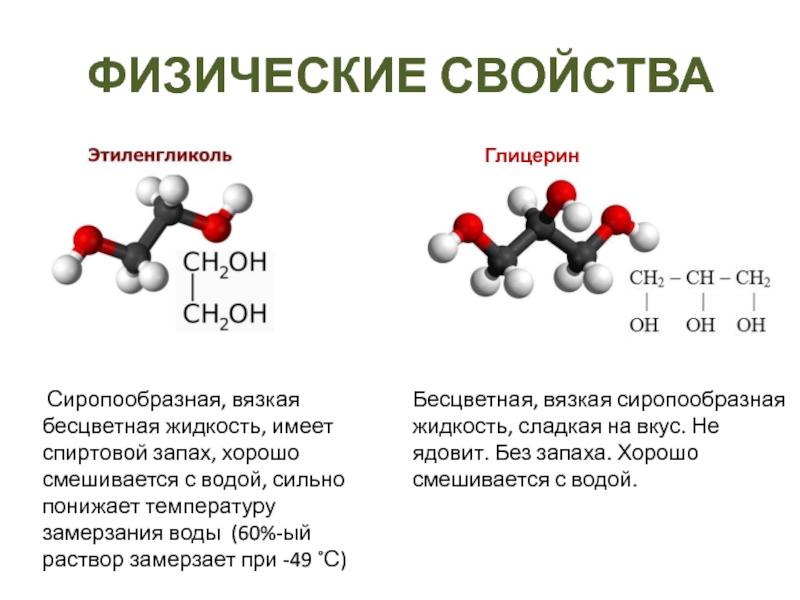
- 17. ФИЗИЧЕСКИЕ СВОЙСТВАГлицерин Сиропообразная, вязкая бесцветная жидкость, имеет
- 18. ХИМИЧЕСКИЕ СВОЙСТВА
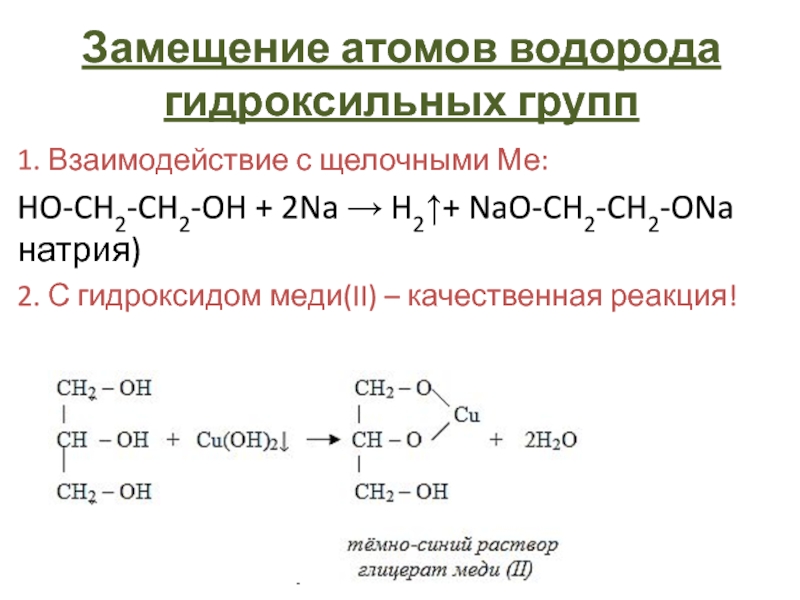
- 19. Замещение атомов водорода гидроксильных групп1. Взаимодействие с
- 20. Замещение гидроксильных групп1. Взаимодействие с галогенводородными кислотами:HO-CH2-CH2-OH
- 21. Способы получения
- 22. I. Получение двухатомных спиртов
- 23. II. Получение трёхатомных спиртов (глицерина)В промышленностиОмыление жиров (триглицеридов):
- 24. Скачать презентанцию
Классификация
Слайды и текст этой презентации
Слайд 4Предельные одноатомные спирты
CnH2n+1OH, n⩾1
Электронное строение:
C – Sp3- гибридизация
Характерны реакции:
Замещения
Дегидратации
Этерификации
Окисления
Слайд 5Физические свойства
Возможность образования межмолекулярных водородных связей
СН3ОН, С2Н3ОН … С11Н23ОН,
С12Н25ОН…СnH2n+1OH
Tкип и Tпл увеличиваются ; Растворимость уменьшаетсяСлайд 7Реакции замещения
1. Замещение атома водорода группы –ОН:
С активными Ме (
без Н2О) с образованием алкоголятов:
R – OH + Na
R – ONa + H2Гидролиз: R-ONa + HOH R-OH + NaOH
С органическими и неорганическими кислотами с образованием сложных эфиров:
R - OH + R1-COOH R1-COOR + HOH
R-OH + HONO2 R-O-NO2 + HOH
Алкоголят натрия
H2SO4
Слайд 8Реакции замещения
2. Замещение группы –ОН:
С NH3 с образованием аминов:
R-OH +
HNH2 R-NH2 + H2O
При избытке спирта:
R-OH
+ NH3 R-NH-R + H2OR-OH+ NH3 (R)3N + H2O
С галогенводородами с образованием галогеналканов
R-OH + HHal R-Hal + H2O
Слайд 9Реакции отщепления
1. Дегидратация (отщепление H2O в присут. H2SO4):
Межмолекулярная дегидратация с
образованием R-O-R1
R-OH + OH-R1 R-O-R1 +
H2OВнутримолекулярная дегидратация с образованием алкенов
C2H5OH H2C=CH2+H2O
CH3OH не вступает в реакции внутримолекулярной дегидратации
Дегидратация вторичных и первичных спиртов происходит по правилу Зайцева:
Слайд 102. Дегидрирование :
При дегидрировании первичных спиртов образуются альдегиды
При дегидрировании вторичных
спиртов образуются кетоны
Третичные спирты не дегидрируются!
Реакции отщепления
Слайд 11Реакции окисления
1.Горение (полное окисление):
R-OH + O2 CO2+H2O
2. Неполное окисление (при kat: CuO,
KMnO4, K2Cr2O7)
R-OH + [O] R-COH + H2O
(Перв. Спирт)R-OH + [O] R-CO-R1 + H2O
(Втор.спирт)
[O] - окислитель
Слайд 13
1. Из водяного газа (получение метанола – древесный спирт)
CO + 2H2 t,p → CH3OH
2. Брожение глюкозы (получение
этанола) C6H12O6 дрожжи → 2C2H5OH + 2CO2
3. Гидратация алкенов
Слайд 15Взаимодействие галогеналканов R-Г с водными растворами щелочей
CH3Cl + NaOH t,
водн.р-р.→ CH3OH + NaCl (реакция обмена) Гидрирование альдегидов (первичный спирт) и кетонов (вторичный спирт)
R-COH+H2 R-OH
R-CO-R1 +H2 R-ОН
Слайд 17ФИЗИЧЕСКИЕ СВОЙСТВА
Глицерин
Сиропообразная, вязкая бесцветная жидкость, имеет спиртовой запах, хорошо
смешивается с водой, сильно понижает температуру замерзания воды (60%-ый раствор
замерзает при -49 ˚С)Бесцветная, вязкая сиропообразная жидкость, сладкая на вкус. Не ядовит. Без запаха. Хорошо смешивается с водой.
Слайд 19Замещение атомов водорода гидроксильных групп
1. Взаимодействие с щелочными Ме:
HO-CH2-CH2-OH +
2Na → H2↑+ NaO-CH2-CH2-ONa
(гликолят натрия)2. С гидроксидом меди(II) – качественная реакция!
Слайд 20Замещение гидроксильных групп
1. Взаимодействие с галогенводородными кислотами:
HO-CH2-CH2-OH + 2HCl
Cl-CH2-CH2-Cl + 2H2O
2. Взаимодействие с азотной кислотой
H+
Слайд 22I. Получение двухатомных спиртов
В промышленности
1. Каталитическая
гидратация оксида этилена (получение этиленгликоля):2. Взаимодействие дигалогенпроизводных алканов с водными растворами щелочей:
3. Из синтез-газа:
2CO + 3H2 250°,200МПа,kat → CH2(OH)-CH2(OH)
В лаборатории
Окисление алкенов:






![Спирты Реакции окисления1.Горение (полное окисление):R-OH + O2 CO2+H2O2. Неполное окисление (при kat: CuO, KMnO4, Реакции окисления1.Горение (полное окисление):R-OH + O2 CO2+H2O2. Неполное окисление (при kat: CuO, KMnO4, K2Cr2O7)R-OH + [O] R-COH + H2O](/img/thumbs/abab8454828bc3e3e6085cd0c2c14b8e-800x.jpg)