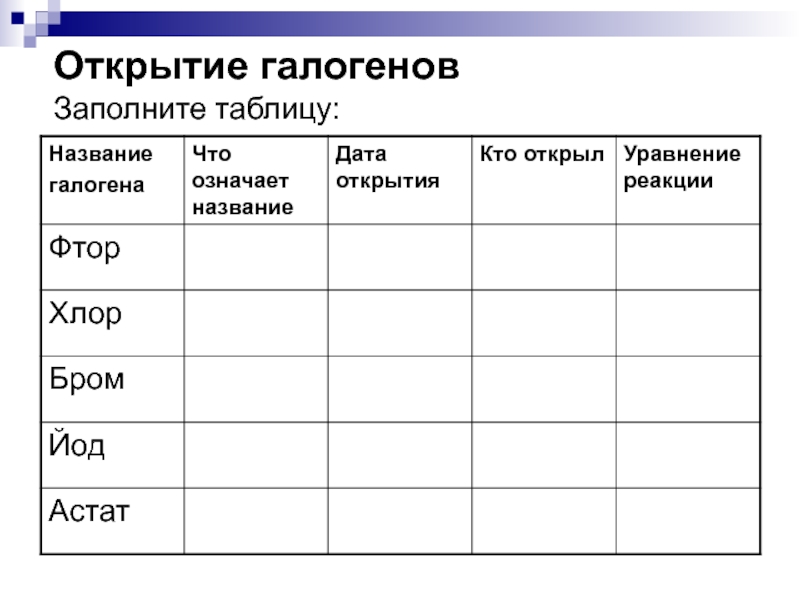
1866 году
французским химиком Анри Муассаном
электролизом смеси жидкого безводного HF
и гидродифторида калия KHF2 в платиновом сосуде:2HF→H2↑ + F2↑
катод анод
В 1906 году Муассан был удостоен Нобелевской премии за открытие элемента фтора и введение в практику электрической печи, названной его именем