Слайд 1СТРОЕНИЕ И СВОЙСТВА ФЕРМЕНТОВ
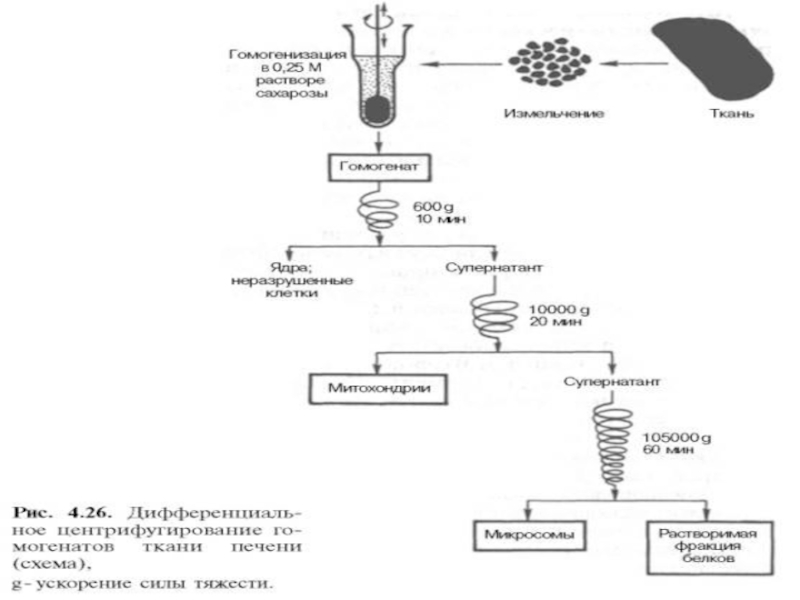
Слайд 2ВНУТРИКЛЕТОЧНАЯ ЛОКАЛИЗАЦИЯ ФЕРМЕНТОВ
Слайд 3ядерная фракция печени и почек содержит незначительное число ферментов (осуществляется
синтез некоторых белков).
Основное место синтеза белка – фракция рибосом
цитоплазмы
ферменты гликолиза сосредоточены преимущественно в растворимой фракции цитоплазмы
цитохромоксидаза и ферменты цикла Кребса локализованы во фракции митохондрий.
ферменты, катализирующие окислительное фосфорилирование и распад жирных кислот – в митохондриях.
Ферменты, катализирующие биосинтез жирных кислот, содержатся в растворимой фракции цитоплазмы.
Слайд 5ФЕРМЕНТЫ (энзимы) – это высокоспецифичные белки, выполняющие функции биологических катализаторов.
Катализатор – это вещество, которое ускоряет химическую реакцию, но само
в ходе этой реакции не расходуется.
Слайд 6Условия необходимые для химического взаимодействия молекул, чтобы произошла химическая реакция
1) Молекулы должны сблизиться (столкнуться). Но не всякое столкновение приводит
к взаимодействию.
2) Необходимо, чтобы это столкновение стало эффективным – завершилось бы химическим превращением. Обязательное условие для эффективности столкновения – чтобы запас энергии молекул в момент столкновения был не ниже энергетического уровня реакции.
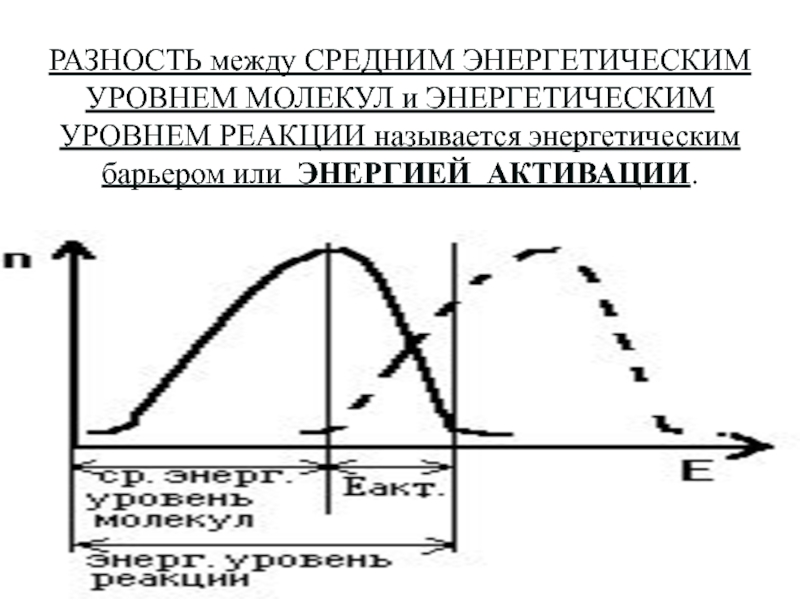
Слайд 7ЭНЕРГЕТИЧЕСКИЙ УРОВЕНЬ РЕАКЦИИ
- это запас энергии, которым должны обладать молекулы,
чтобы их столкновение стало эффективным (чтобы произошла химическая реакция). Этот
запас энергии является постоянной характеристикой (константой) для каждой данной реакции.
Слайд 8СРЕДНИЙ ЭНЕРГЕТИЧЕСКИЙ УРОВЕНЬ МОЛЕКУЛ
Это энергия, которой обладает большинство молекул системы
в данный момент времени.
Эта средняя величина энергетического запаса, которая
характеризует совокупность данных молекул в данных конкретных условиях (температура, давление и другие).
Энергетический запас молекул – это понятие статистическое (вероятностное).
Молекулы постоянно находятся в тепловом движении. Поэтому энергетический запас каждой из них все время изменяется, колеблется около величины, которая и представляет собой
СРЕДНИЙ ЭНЕРГЕТИЧЕСКИЙ УРОВЕНЬ МОЛЕКУЛ.
Слайд 9ФЕРМЕНТЫ (энзимы) – это высокоспецифичные белки, выполняющие функции биологических катализаторов.
Катализатор – это вещество, которое ускоряет химическую реакцию, но само
в ходе этой реакции не расходуется.
Слайд 10РАЗНОСТЬ между СРЕДНИМ ЭНЕРГЕТИЧЕСКИМ УРОВНЕМ МОЛЕКУЛ и ЭНЕРГЕТИЧЕСКИМ УРОВНЕМ РЕАКЦИИ
называется энергетическим барьером или ЭНЕРГИЕЙ АКТИВАЦИИ.
Слайд 11Ускорение химической реакции
Повышение среднего энергетического уровня молекул (повышение температуры, давления
и других параметров среды, которое используют на химических заводах и
фабриках) НЕВОЗМОЖНО для живых организмов, которые нормально функционируют только при постоянных значениях температуры, давления и других параметров. Невозможен и другой путь - уменьшение энергии активации путем снижения энергетического уровня реакции, поскольку эта величина является постоянной характеристикой данной реакции.
Слайд 12
Энергетический барьер или ЭНЕРГИЯ АКТИВАЦИИ (Еакт.)
РАЗНОСТЬ между СРЕДНИМ ЭНЕРГЕТИЧЕСКИМ УРОВНЕМ
МОЛЕКУЛ и ЭНЕРГЕТИЧЕСКИМ УРОВНЕМ РЕАКЦИИ
Чем больше эта энергия активации,
тем медленнее идет химическая реакция.
Слайд 13
Способы ускорения химической реакции
Повышение среднего энергетического уровня молекул (повышение температуры,
давления и других параметров среды, которое используют на химических заводах
и фабриках)
НЕВОЗМОЖНО
Живые организмы нормально функционируют только при постоянных значениях температуры, давления и других параметров.
НЕВОЗМОЖНО
уменьшение энергии активации путем снижения энергетического уровня реакции;
эта величина является постоянной характеристикой данной реакции.
только явление катализа (применение катализаторов) может обеспечить ускорение химических реакций в живых организмах.
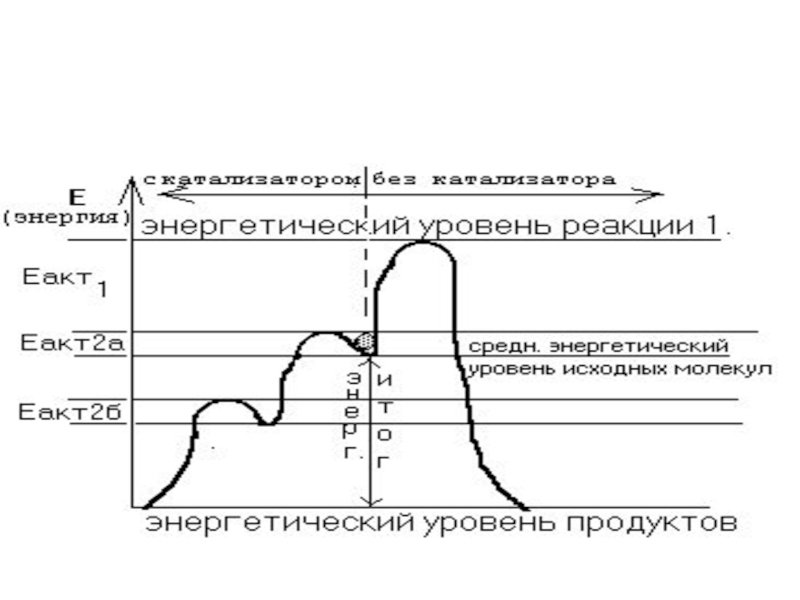
Слайд 14 1) Еакт2а и/или Еакт2б ≥ Еакт1.
реакция образования "АВ" с
участием вещества "К" пойдет медленнее.
"К" - ИНГИБИТОР реакции.
2) Еакт2а
и/или Еакт2б < Еакт1.
реакция с участием вещества "К" пойдет быстрее
"К" - КАТАЛИЗАТОР химической реакции.
Варианты образования вещества АВ
Слайд 15КАТАЛИЗАТОР – это вещество, которое направляет реакцию по такому обходному
пути, на котором энергетические барьеры ниже.
Слайд 16энергия, которую надо затратить для "подъема" молекулы от среднего энергетического
уровня реакции, полностью компенсируется при самостоятельном "скатывании" молекулы по склону
"вулкана". При дальнейшем самопроизвольном "скатывании" до подошвы "вулкана" (то есть, до среднего энергетического уровня молекул, которые являются продуктами данной реакции). Энергия, которая при этом выделяется, называется
"ЭНЕРГЕТИЧЕСКИЙ ИТОГ РЕАКЦИИ".
Слайд 18ЭНЕРГЕТИЧЕСКИЙ ИТОГ РЕАКЦИИ
- это разность между энергетическим уровнем исходных веществ
(субстратов) и энергетическим уровнем продуктов реакции.
Энергетический итог реакции не зависит
от пути, по которому идет реакция (он одинаков и для реакции с участием катализатора, и для реакции без его участия). Он не зависит и от величины энергии активации – от нее зависит только скорость протекания каждого из путей этой реакции.
Слайд 20энергия активации в уравнении Аррениуса входит в показатель степени
незначительное изменение энергии активации приводит к большим изменениям скорости
реакции.
Слайд 21ОБЩИЕ СВОЙСТВА КАТАЛИЗАТОРОВ
1. Катализаторы сами НЕ ВЫЗЫВАЮТ химическую реакцию, а
только УСКОРЯЮТ реакцию, которая протекает и без них.
2. Не влияют
на энергетический итог реакции.
3. В обратимых реакциях катализаторы ускоряют как прямую, так и обратную реакцию, причем в ОДИНАКОВОЙ степени, из чего следует, что катализаторы:
а) НЕ ВЛИЯЮТ на НАПРАВЛЕННОСТЬ обратимой реакции, которая определяется только соотношением концентраций исходных веществ (субстратов) и конечных продуктов;
б) НЕ ВЛИЯЮТ на ПОЛОЖЕНИЕ РАВНОВЕСИЯ обратимой реакции, а только ускоряют его достижение.
Слайд 22Отличительные признаки ферментативного и химического катализа:
1) Скорость ферментативного катализа намного
выше, чем небиологического.
Н2О2 а Н2О + 1/2 О2 равна 75,3
кДж/моль
неорганического катализатора – железа или платины- энергия активации снижается до 54,1 кДж/моль,
Фермент каталаза, разлагающий перекись водорода, снижает энергию активации более, чем в 4 раза и ускоряет реакцию разложения в миллиард раз.
2) Ферменты обладают высокой специфичностью, направляя превращение вещества в строгое русло.
Слайд 233) Ферментативные процессы не дают побочных реакций, для них характерен
100% выход целевого продукта.
4) Ферменты катализируют реакции в мягких условиях,
то есть при обычном давлении, небольшой температуре и значениях рН, близких к нейтральным, однако весьма чувствительны к сдвигам рН среды и изменению температуры.
5) Ферменты регулируемы. То есть они могут изменять свою активность под воздействием ряда факторов, изменяя количественные выходы продуктов. Этим обеспечивается скоординированность всех метаболических процессов во времени.
6) Скорость ферментативной реакции прямо пропорциональна количеству фермента, поэтому недостаток фермента в организме означает низкую скорость превращения какого-либо соединения, и наоборот, одним из путей приспособления организма является увеличение количества требуемого фермента.
Слайд 24ОСОБЕННОСТИ ФЕРМЕНТОВ КАК БИОЛОГИЧЕСКИХ КАТАЛИЗАТОРОВ
1. Высокая эффективность действия. Ферменты
могут ускорять реакцию в 108 -1012 раз
2. Высокая избирательность
ферментов к субстратам (субстратная специфичность) и к типу катализируемой реакции (специфичность действия)
3. Высокая чувствительность ферментов к неспецифическим физико-химическим факторам среды – температуре, рН, ионной силе раствора и т.д.
4. Высокая чувствительность к химическим реагентам;
5. Высокая и избирательная чувствительность к физико-химическим воздействиям тех или иных химических веществ, которые благодаря этому могут взаимодействовать с ферментом, улучшая или затрудняя его работу
Слайд 25СТРОЕНИЕ ФЕРМЕНТОВ
Субстратом (S) называют вещество, химические превращения которого в продукт
(Р) катализирует фермент (Е). Тот участок поверхности молекулы фермента, который
непосредственно взаимодействует с молекулой субстрата, называется
АКТИВНЫМ ЦЕНТРОМ ФЕРМЕНТА.
Слайд 26АКТИВНЫЙ ЦЕНТР ФЕРМЕНТА
Активный центр фермента образован из остатков аминокислот, находящихся
в составе различных участков полипептидной цепи или различных полипептидных цепей,
пространственно сближенных. Образуется на уровне третичной структуры белка-фермента.
В его пределах различают АДСОРБЦИОННЫЙ УЧАСТОК (центр) и КАТАЛИТИЧЕСКИЙ УЧАСТОК (центр).
вне активного центра фермента встречаются особые функциональные участки; каждый из них обозначают термином АЛЛОСТЕРИЧЕСКИЙ ЦЕНТР.
Слайд 27КАТАЛИТИЧЕСКИЙ ЦЕНТР
- это та область (зона) активного центра фермента,
которая непосредственно Формируется он за счет радикалов двух, иногда трех
аминокислот, расположенных в разных местах полипептидной цепи фермента, но пространственно сближенных между собой за счет изгибов этой цепи.
Каталитический центр «серин-гистидиновых» ферментов формируется за счет радикалов аминокислот серина и гистидина. Если фермент является сложным белком, то в формировании каталитического центра нередко участвует простетическая группа молекулы фермента (кофермент). Коферментную функцию выполняют все водорастворимые витамины и жирорастворимый витамин K.
Слайд 28АДСОРБЦИОННЫЙ ЦЕНТР
- участок активного центра молекулы фермента, на котором
происходит сорбция (связывание) молекулы субстрата.
Он формируется одним, двумя, чаще
тремя радикалами аминокислот, которые обычно расположены рядом с каталитическим центром. Главная его функция - связывание молекулы субстрата и передача этой молекулы каталитическому центру в наиболее удобном положении (для каталитического центра).
Эта сорбция происходит ТОЛЬКО ЗА СЧЕТ СЛАБЫХ ТИПОВ СВЯЗЕЙ и потому ЯВЛЯЕТСЯ ОБРАТИМОЙ. По мере формирования этих связей происходит конформационная перестройка адсорбционного центра, которая приводит к более тесному сближению субстрата и активного центра фермента, более точному соответствию между их пространственными конфигурациями. Такое соответствие - не заранее "готовое", а формирующееся в ходе взаимодействия - американский ученый Кошленд положил в основу теории ИНДУЦИРОВАННОГО СООТВЕТСТВИЯ (или «НАВЕДЕННОГО» СООТВЕТСТВИЯ), которая преодолела ограниченность существовавшей ранее теории КЛЮЧА И ЗАМКА (жесткого соответствия структуры субстрата структуре адсорбционного центра).

Слайд 29Структура адсорбционного центра определяет
субстратную специфичность фермента (требования фермента к
молекуле химического вещества, чтобы она могла стать для него подходящим
субстратом).
Некоторые вещества, (похожие на субстрат), могут тоже связываться с адсорбционным центром фермента.
Если в их молекуле химической связи, на которую может воздействовать каталитический центр данного фермента, то химических превращений этого вещества не произойдет.
Слайд 30Занимая активный центр фермента, такие молекулы блокируют его работу, то
есть являются ОБРАТИМЫМИ ИНГИБИТОРАМИ данного фермента (обратимыми, потому что связаны
с ферментом слабыми типами связей).
Повышая концентрацию субстрата, их можно ВЫТЕСНИТЬ из адсорбционного центра.
Такие ингибиторы называют КОНКУРЕНТНЫМИ. (Они конкурируют с истинным субстратом данного фермента за обладание его адсорбционным центром).
Слайд 31АЛЛОСТЕРИЧЕСКИЕ ЦЕНТРЫ
- участки молекулы фермента вне его активного центра, которые
способны связываться СЛАБЫМИ ТИПАМИ СВЯЗЕЙ (обратимо) с тем или иным
веществом (лигандом). Связывание приводит к такой конформационной перестройке молекулы фермента, которая распространяется и на активный центр, облегчая, либо затрудняя (замедляя) его работу.
Эти вещества называются АЛЛОСТЕРИЧЕСКИМИ АКТИВАТОРАМИ или АЛЛОСТЕРИЧЕСКИМИ ИНГИБИТОРАМИ данного фермента.
Термин "аллостерический" (то есть "имеющий иную пространственную структуру") появился в связи с тем, что эти эффекторы по своей пространственной конфигурации совсем не похожи на молекулу субстрата данного фермента (и потому не могут связываться с активным центром фермента). Было сделано заключение, что и аллостерический центр не похож по своей структуре на активный центр фермента.
Слайд 32Аллостерические центры найдены не у всех ферментов.
Они есть у
тех ферментов, работа которых может изменяться под действием гормонов, медиаторов
и других биологически активных веществ.
Некоторые искусственно синтезированные лекарства обладают биологической активностью потому, что их молекулы комплементарны аллостерическому центру некоторых ферментов организма.
Слайд 33СПЕЦИФИЧНОСТЬ ФЕРМЕНТОВ
Различают два главных вида специфичности ферментов:
СУБСТРАТНУЮ СПЕЦИФИЧНОСТЬ
СПЕЦИФИЧНОСТЬ
ДЕЙСТВИЯ.
Слайд 34СУБСТРАТНАЯ СПЕЦИФИЧНОСТЬ
- способность фермента катализировать превращения только одного определенного субстрата
или же группы сходных по строению субстратов. Определяется структурой адсорбционного
участка активного центра фермента.
Различают 3 типа субстратной специфичности:
1) АБСОЛЮТНАЯ субстратная специфичность - это способность фермента катализировать превращение только одного, строго определенного субстрата.
2) ОТНОСИТЕЛЬНАЯ субстратная специфичность - способность фермента катализировать превращения нескольких, сходных по строению, субстратов.
3) СТЕРЕОСПЕЦИФИЧНОСТЬ - способность фермента катализировать превращения определенных стереоизомеров.
фермент оксидаза L-аминокислот способен окислять все аминокислоты, но относящиеся только к L-ряду ( обладает относительной субстратной специфичностью и стереоспецифичностью одновременно) .
Слайд 35СПЕЦИФИЧНОСТЬ ДЕЙСТВИЯ
Специфичность действия – это способность фермента катализировать только определенный
тип химической реакции.
В соответствии со специфичностью действия все ферменты делятся
на
6 классов.
Классы ферментов обозначаются латинскими цифрами. Название каждого класса ферментов соответствует этой цифре.
Слайд 36Ферменты-простые белки встречаются примерно в половине случаев.
Если молекула фермента
состоит из белковой части (полипептидная нить) и небелковой части, то
это сложные ферменты.
Белковая часть, называемая апоферментом, самостоятельно (т. е. без наличия небелковой части) часто нефункциональна.
Небелковая часть сложного фермента, называемая КОФЕРМЕНТОМ (если сравнительно независима от белковой части молекулы) или ПРОСТЕТИЧЕСКОЙ ГРУППОЙ (если сравнительно прочно и постоянно связана с белковой частью) в комбинации с белковой частью составляет ХОЛОФЕРМЕНТ, т. е. функционально действенный энзим. Соединение в ХОЛОФЕРМЕНТ осуществляется любыми типами связей, кроме ковалентных.
Слайд 37ФУНКЦИИ КОФЕРМЕНТОВ(КФ) И ПРОСТЕТИЧЕСКИХ ГРУПП (ПГ)
1. Участие в акте катализа
2.
Осуществление контакта между энзимом и субстратом
3. Стабилизация апофермента
Апофермент, в свою
очередь, усиливает каталитическую активность небелковой части (КФ и ПГ). Например, одна и та же NAD+ является КФ многих дегидрогеназ, отличие – в апоферментной части.
АКТИВНЫЙ ЦЕНТР- часть молекулы Ф. где происходит связывание и превращение субстрата. У Ф., имеющих четвертичную структуру, число АЦ может быть равно числу Субъединиц.
Сам АЦ функционально неоднороден и имеет КАТАЛИТИЧЕСКУЮ ЗОНУ и СВЯЗЫВАЮЩУЮ З. Связывание субстрата- многоточечное.
СПЕЦИФИЧНОСТЬ Ф. бывает ОТНОСИТЕЛЬНАЯ (катализ превращений небольшой группы близких по свойствам СУБСТРАТОВ) и АБСОЛЮТНАЯ – катализ превращения только одного вещества.
Слайд 38СТРОЕНИЕ И ФУНКЦИИ ОТДЕЛЬНЫХ КФ И ПГ.
. нуклеотидного типа
строения
2. витамины и их производные
3. металлы и металлсодержащие КФ и
ПГ
4. другие
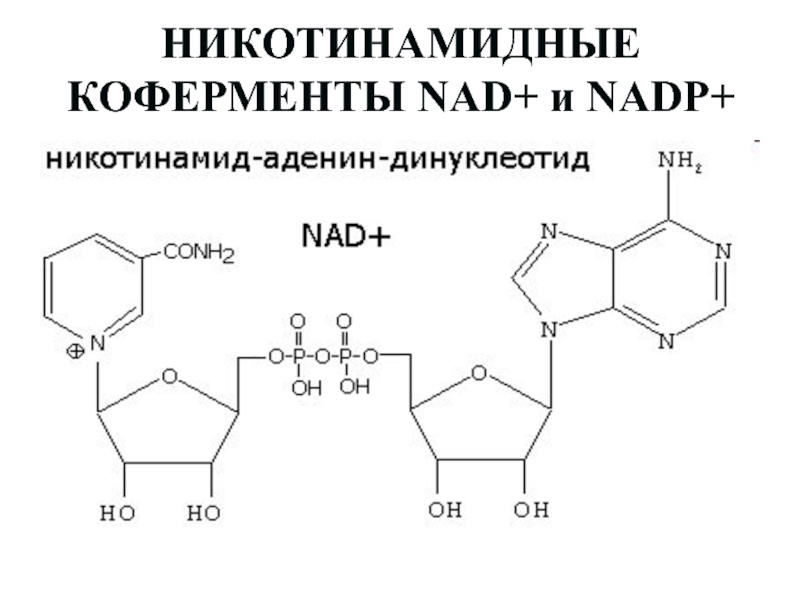
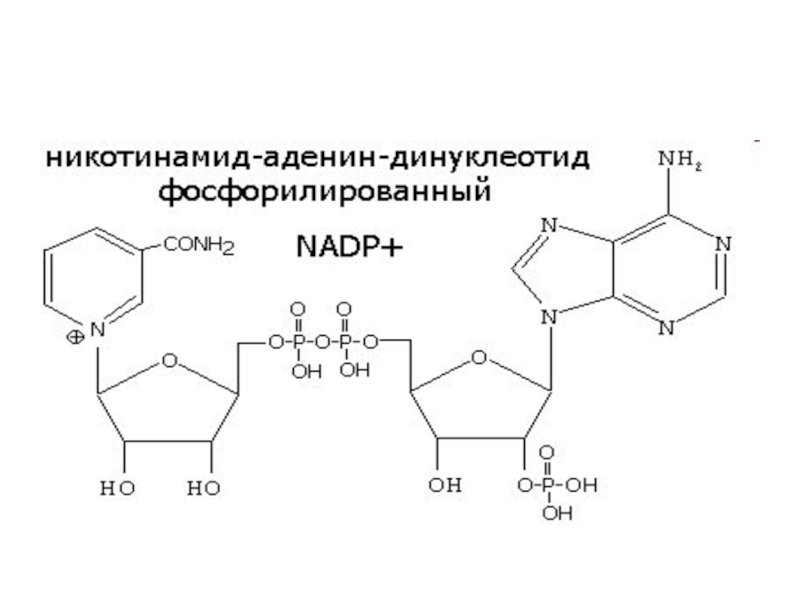
Слайд 39НИКОТИНАМИДНЫЕ КОФЕРМЕНТЫ NAD+ и NADP+
Слайд 41Механизм действия
NAD+, NADP+- содержащие дегидрогеназы катализируют перенос гидрид-иона (Н-) от
субстрата к никотинамидной части кофермента: Восстановленная при этом часть кофермента
отличается от окисленной только по производному никотиновой кислоты: Восстановленные формы NADH и NADPH отсоединяются от апофермента и отделяются от дегидрогеназы. Затем они переносят гидрид ион на другую молекулу фермента (чаще всего- FMN, FAD-зависимого).
Катализируют обратимые реакции окисления спиртов, оксикислот, аминов и др. Хорошо изучены LDH- лактатдегидрогеназа, MDH- малатдегидрогеназа, ADH- алкогольдегидрогеназа. Для дегидрогеназ характерно наличие четвертичной структуры (ADH, MDH- димеры, LDH-тетрамер).
Спектральные различия- NAD+, NADP+- 260 nm, NADH, NADPH- 260, 340 nm).
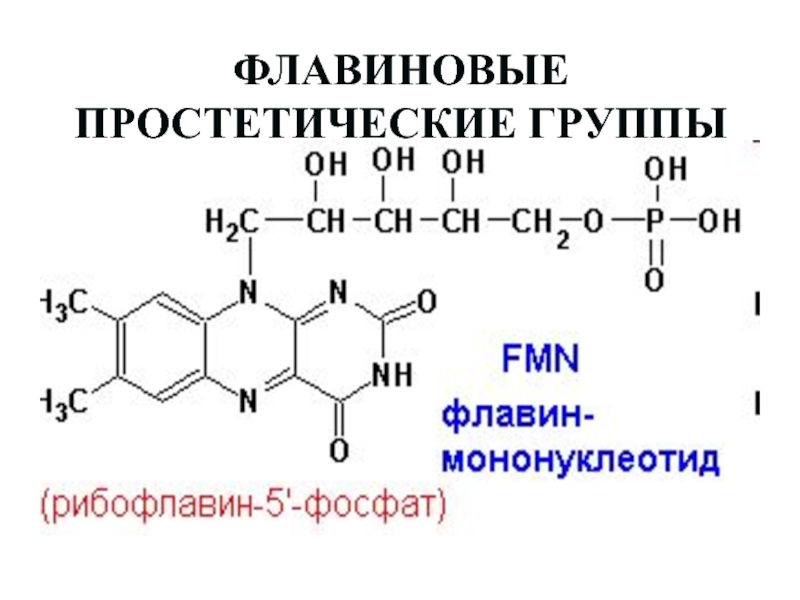
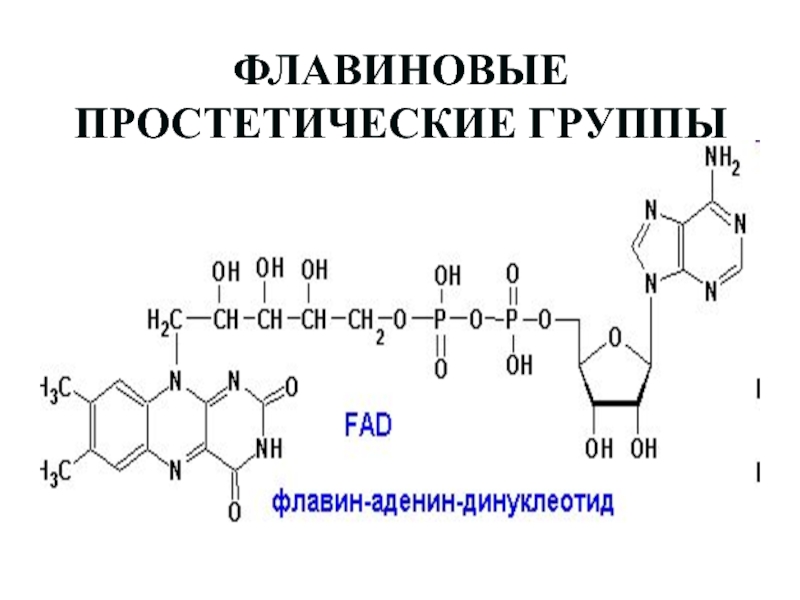
Слайд 42ФЛАВИНОВЫЕ ПРОСТЕТИЧЕСКИЕ ГРУППЫ
Слайд 43ФЛАВИНОВЫЕ ПРОСТЕТИЧЕСКИЕ ГРУППЫ
Слайд 44FMN, FAD- более сильные окислители. Сами передают гидрид ион непосредственно
на кислород:
FADH2, FMNH2 + O2 а FAD, FMN + H2O2
Изоаллоксазиновое кольцо флавиновых ПГ имеет следующие спектральные свойства: окисленная форма – 280, 350-380, 450 нм, восстановленная- 280, 350-380 (с меньшими e).
FMN и FAD катализируют переходы: спирты-альдегиды, амины-имины, насыщ. карбонильные-a,b – ненасыщ. карбонильные, NADH, NADPH-NAD+, NADP+.
Слайд 45НУКЛЕОЗИДТРИФОСФАТЫ И НУКЛЕОЗИДДИФОСФАТ-САХАРА (НДФС)
АТФ, УТФ, ГТФ, ЦТФ – коферменты
фосфотрансфераз (перенос ФОСФАТА, ПИРОФОСФАТА, АМФ ИЛИ АДЕНОЗИНОВОЙ ЧАСТИ).
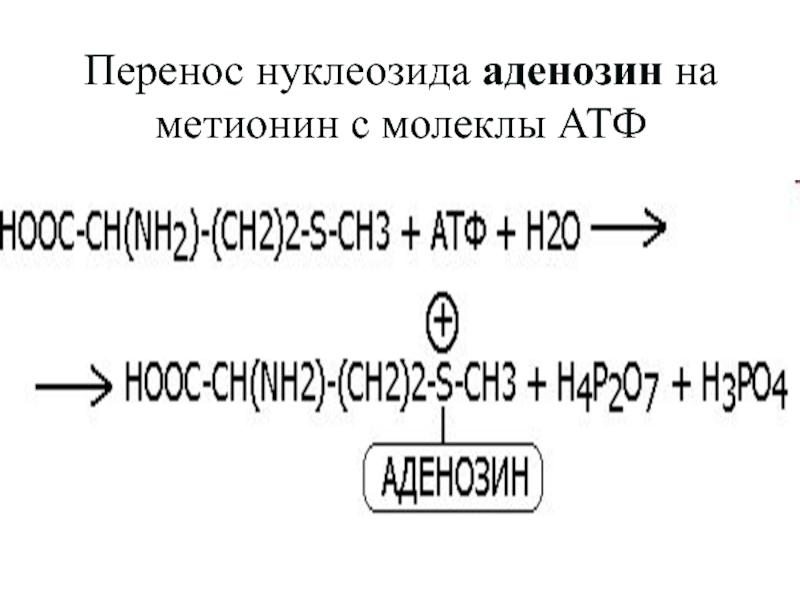
Слайд 46Перенос нуклеозида аденозин на метионин с молеклы АТФ
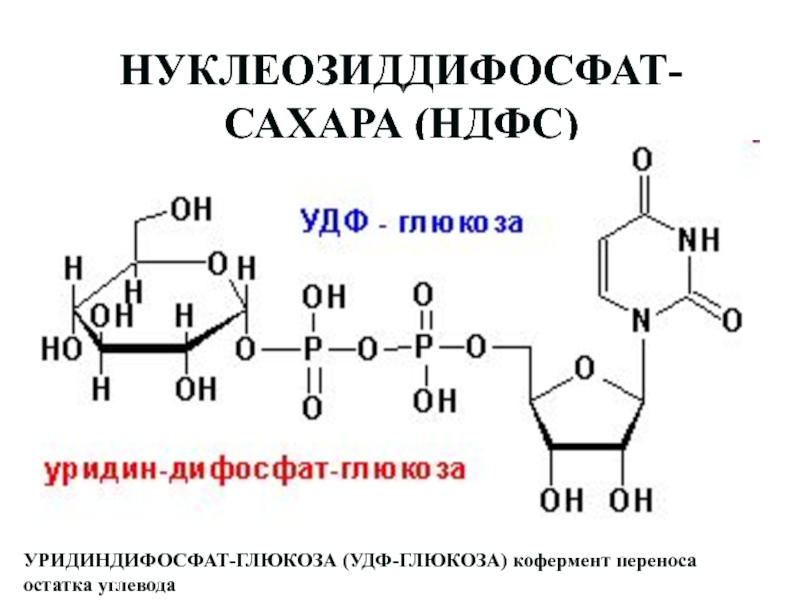
Слайд 47НУКЛЕОЗИДДИФОСФАТ-САХАРА (НДФС)
УРИДИНДИФОСФАТ-ГЛЮКОЗА (УДФ-ГЛЮКОЗА) кофермент переноса остатка углевода
Слайд 48КОФЕРМЕНТ АЦЕТИЛИРОВАНИЯ (КОЭНЗИМ А, или просто КоА)
УЧАСТВУЕТ В РЕАКЦИЯХ АКТИВАЦИИ
И ПЕРЕНОСА АЦЕТИЛЬНЫХ И АЦИЛЬНЫХ ГРУПП (присоединяется к S- в
составе КоА, с образованием ацетил-КоА или ацил-КоА.
Слайд 49Всего в клетке насчитывают около 10000 ферментов, которые катализируют около
2000 реакций. Известно 1800 ферментов из них 150 выделены в
кристаллическом виде.
По классификации ферментов (КФ- русскоязычная, ЕС-англоязычная) каждый фермент (энзим) имеет свой определенный номер, состоящий из четырех групп цифр, разделенных точками.
Первая цифра обозначает отнесение фермента к классу, вторая – к подклассу,
Третья – к подподклассу
Четвертая – номер фермента.
Например, шифр алкогольдегидрогеназы ADH по классификации – ЕС 1.1.1.1, малатдегидрогеназы – ЕС 1.1.1.37.
Разделение ферментов на классы строгое !
Слайд 50Классификация ферментов:
четырехчисловая система, первое число – класс (один из
шести):
1. Оксидоредуктазы (катализаторы окислительно-восстановительных реакций)
2. Трансферазы (реакции переноса групп с
одной молекулы на другую)
3. Гидролазы (реакции с участием молекул воды)
4. Лиазы (Синтазы) (реакции соединения или расщепления молекул, присоединения-отсоединения воды, аммиака, СО2 и т.д.)
5. Изомеразы (изменение строения внутри одной молекулы)
6. Лигазы (Синтетазы) (то же, что 4,но с участием энергии АТФ)
Слайд 51Внутри каждого класса происходит разделение на подклассы,
EC
1.1 Действующие на CH-OH группы донора
EC 1.2 Действующие на альдегидные
или оксо- группы донора
EC 1.3 Действующие на CH-СH группы донора
EC 1.4 Действующие на CH-NH2 группы донора
EC 1.5 Действующие на CH-NH группы донора
EC 1.6 Действующие на NADH или NADPH
Внутри каждого подкласса происходит разделение на подподклассы:
EC 1.1.1 Акцептор NAD или NADP
EC 1.1.2 Акцептор- цитохром
EC 1.1.3 Акцептор- кислород
EC 1.1.4 Акцептор- сульфид
EC 1.1.5 Акцептор- хинон или подобная группировка
EC 1.1.99 Другой акцептор
Слайд 52Последнее число- номер конкретного энзима:
EC 1.1.1.1 alcohol dehydrogenase
EC 1.1.1.2 alcohol
dehydrogenase (NADP+)
EC 1.1.1.3 homoserine dehydrogenase
EC 1.1.1.4 (R,R)-butanediol dehydrogenase
EC 1.1.1.5 acetoin
dehydrogenase ... и т. д.
Слайд 53Классификация названий
рабочие и систематические.
Рабочие названия образуются из объединения
названия субстрата, типа реакции и окончания "-аза". Например: ЛАКТАТ +
ДЕГИДРОГЕНизация + АЗА =
ЛАКТАТДЕГИДРОГЕНАЗА.
Систематическое название фермента формируется следующим образом: (название субстратов (через дробь), название типа химического превращения + аза). Та же лактатдегидрогеназа будет иметь систематическое название
"L-лактат:NAD+ оксидоредуктаза".
Слайд 54Номенклатура и классификация ферментов
Название фермента формируется из следующих частей:
название субстрата
с которым он взаимодействует
характер катализируемой реакции
наименование класса ферментов (но это
необязательно)
суффикс -аза-
пируват - декарбоксил - аза, сукцинат - дегидроген - аза
Слайд 56I класс Оксидоредуктазы катализируют реакции окисления-восстановления
II класс - ТРАНСФЕРАЗЫ
Катализируют реакции
переноса химических групп с молекулы одного вещества на молекулу другого
вещества.
III класс - ГИДРОЛАЗЫ
Катализируют реакции разрушения химических связей с участием воды.
IV класс - ЛИАЗЫ
Катализируют реакции разрушения химических связей без участия воды.
V класс - ИЗОМЕРАЗЫ
Катализируют реакции изомерных превращений.
VI класс - ЛИГАЗЫ (СИНТАЗЫ, СИНТЕТАЗЫ)
Катализируют реакции синтеза.
Слайд 57Оксидоредуктазы.
Катализируют окислительно-восстановительные реакции.
Делятся на 17
подклассов. Все ферменты содержат небелковую часть в виде гема или
производных витаминов В2, В5. Субстрат, подвергающийся окислению выступает как донор водорода.
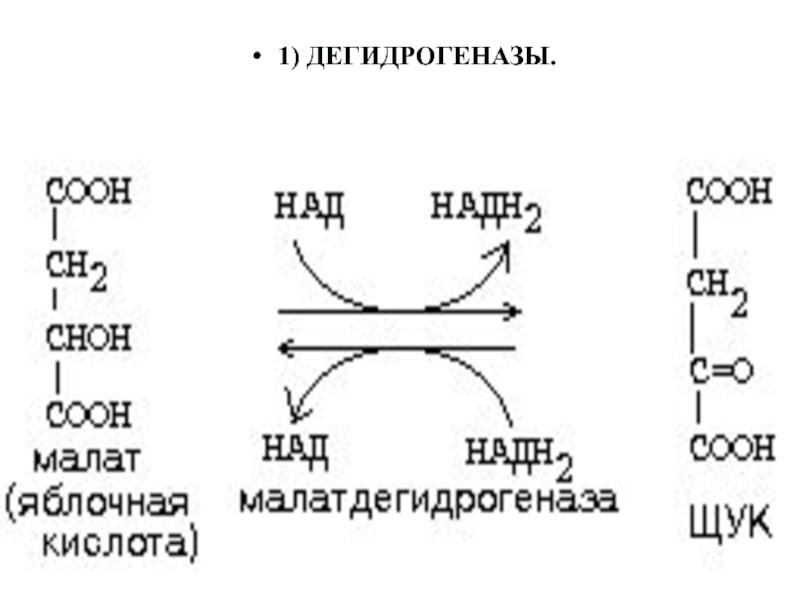
2.1. Дегидрогеназы
отщепляют от одного субстрата водород и переносят на другие субстраты. Коферменты НАД, НАДФ, ФАД, ФМН. Они акцептируют на себе отщепленный ферментом водород превращаясь при этом в восстановленную форму (НАДН, НАДФН, ФАДН) и переносят к другому фермент-субстратному комплексу, где его и отдают.
Слайд 59Дегидрогеназы
Лактатдегидрогеназа (LDH, EC 1.1.1.27) катализирует превращение молочной кислоты (лактат) в
пировиноградную (пируват):
СН3СН(ОН)СООН + NAD+ а CH3COCООH + NADH +
H+
Слайд 60 2.2.Оксидазы – катализируют перенос водорода на кислород с образованием воды
или Н2О2. Ф. Цитохромокисдаза дыхательной цепи.
RH + NAD H + O2 = ROH + NAD + H2O
2.3.Монооксидазы – цитохром Р450. По своему строению одновременно гемо- и флавопротеид. Он гидроксилирует липофильные ксенобиотики (по вышеописанному механизму).
2.3.Пероксидазы и каталазы – катализируют разложение перекиси водорода, которая образуется в ходе метаболических реакций.
2.4.Оксигеназы – катализируют реакции присоединения кислорода к субстрату
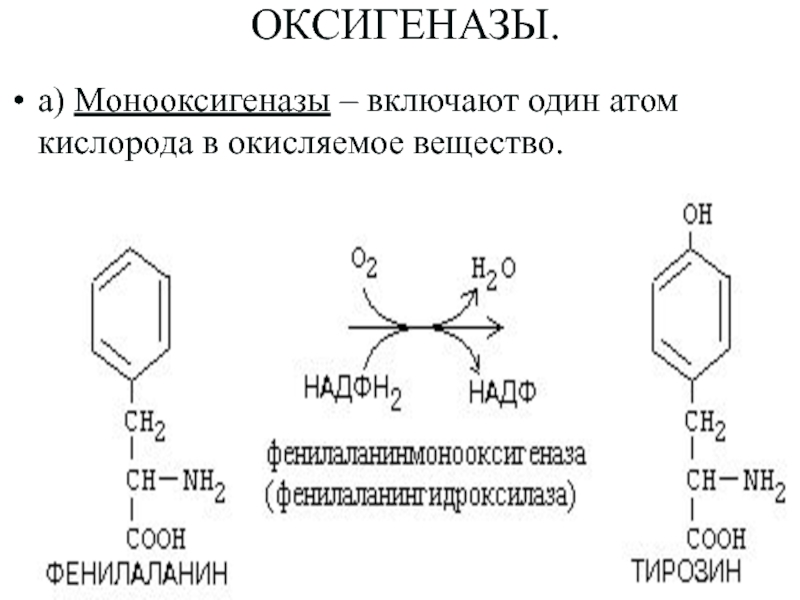
Слайд 61 ОКСИГЕНАЗЫ.
a) Монооксигеназы – включают один атом кислорода в окисляемое
вещество.
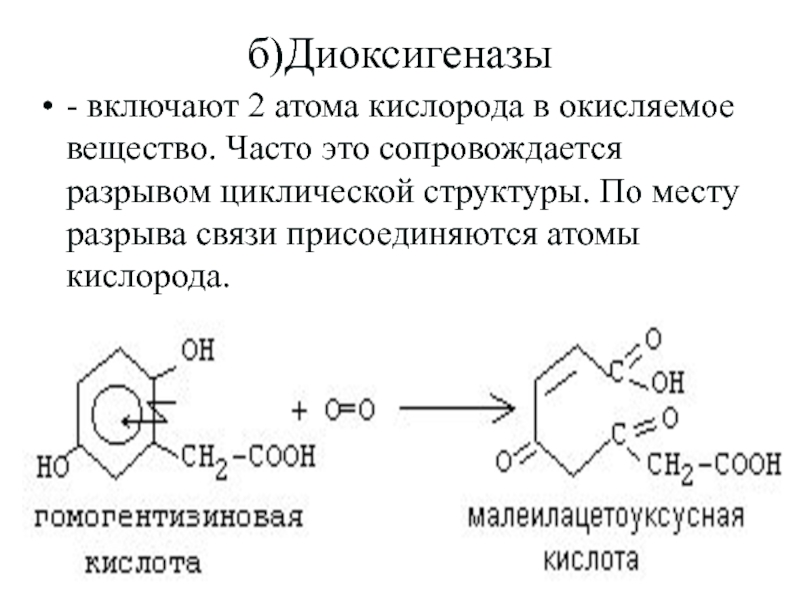
Слайд 62б)Диоксигеназы
- включают 2 атома кислорода в окисляемое вещество. Часто это
сопровождается разрывом циклической структуры. По месту разрыва связи присоединяются атомы
кислорода.
Слайд 632. Трансферазы
- катализируют перенос различных радикалов от молекулы донора к
молекуле акцептору.
Аа + Е + В = Еа +
А + В = Е + Ва + А
2.1. Метилтрансферазы (СН3-).
2.2. Карбоксил- и карбамоилтрансферазы.
2.3.Ацилтрансферазы – Кофермент А (перенос ацильной группы -R-С=О).
Пример: синтез нейромедиатора ацетилхолина
2.4.Гексозилтрансферазы - катализируют перенос гликозильных остатков.
Пример: отщепление молекулы глюкозы от гликогена под действием фосфорилазы.
Слайд 642.5. Аминотрансферазы – перенос аминогрупп
R1- CO - R2 + R1 -
CH-NH3 - R2 = R1 - CH-NH3 - R2 +
R1- CO - R2
Играют важную роль в превращении АК. Общим коферментом является пиридоксальфосфат.
Пример: аланинаминотрансфераза (АлАТ): пируват + глутамат = аланин + альфа-кетоглутарат
2.6.Фосфотрансфереза (киназа) - катализируют перенос остатка фосфорной кислоты. В большинстве случает донором фосфата является АТФ. В процессе расщепления глюкозы в основном принимают участие ферменты этого класса.
Пример: Гексо (глюко)киназа.
Слайд 652. ТРАНСФЕРАЗЫ
(Рабочее название - холинацетилтрансфераза, ЕС 2.3.1.6,
систематическое название: ацетил-КоА:
холин О-ацетилтрансфераза)
СH3CO-S-KoA + HO-СН2-СН2-N+(CН3)3 а КоА-SH + СН3СОO-СН2-СН2-N+(CН3)3
Слайд 663. Класс ГИДРОЛАЗЫ (фосфатазы, эстеразы, фосфолипазы)
разрыв связей с присоединением воды
пищеварительные ферменты, однокомпонентные (не содержат небелковой части)
3.1. Дипептидаза расщепляет дипептид
на две аминокислоты при участии воды:
H2N-CH(R)-CO-NH-CH(R')-COOH + H2O
а H2N-CH(R)-COOH + NH2-CH(R')-COOH
Слайд 673. Гидролазы
3.2.Гликозидазы – расщепляют гликозидные связи в молекулах
поли- и олигосахаридов.
Пример: амилаза, сахараза, мальтаза.
3.3.Пептидазы – катализируют гидролиз
пептидных связей.
Пример: карбоксипептидаза, химотрипсин, трипсин.
3.4.Амидазы – расщепляют амидные связи (СО-NH2).
Пример: аргиназа (цикл мочевины).
3.5.Эстеразы – расщепляют эфирные связи. Это большой подкласс ферментов, катализирующих гидролиз тиоловых эфиров, фосфоэфиров.
Пример: липаза.
Слайд 68 ГИДРОЛАЗЫ – эстеразы,
3.6. Холинэстераза (ЕС 3.1.1.7, ацетилхолин ацетилгидролаза) катализирует
реакцию гидролиза сложного эфира холина и уксусной кислоты (ацетилхолина):
CH3COO-CH2-CH2-N+(CH3)3 +
H2O а CH3COOH + HO-CH2-CH2-N+(CH3)3
Слайд 694. Лиазы (альдолазы, гидратазы-дегидратазы, синтазы, декарбоксилазы)
- катализируют реакции расщепления молекул
без присоединения воды. Имеют небелковую часть в виде тиаминпирофосфата (В1)
и пиридоксальфосфата (В6).
карбоксилаза (плюс СО2)
дегидратаза (минус Н2О)
Слайд 704.1.Лиазы связи С-С. декарбоксилазы
Пример: пируватдекарбоксилаза.
4.2.Лиазы связи (гидратазы-дегидратазы)
С-О.
Пример: енолаза.
4.3.Лиазы связи С-N.
4.4.Лиазы связи С-S.
Слайд 714. ЛИАЗЫ
пируватдекарбоксилаза (ЕС 4.1.1.1, 2-кетокислоты карбоксилиаза) катализирует расщепление пирувата до
уксусного альдегида с отщеплением СО2:
CH3COCООH а CH3COH + СО2
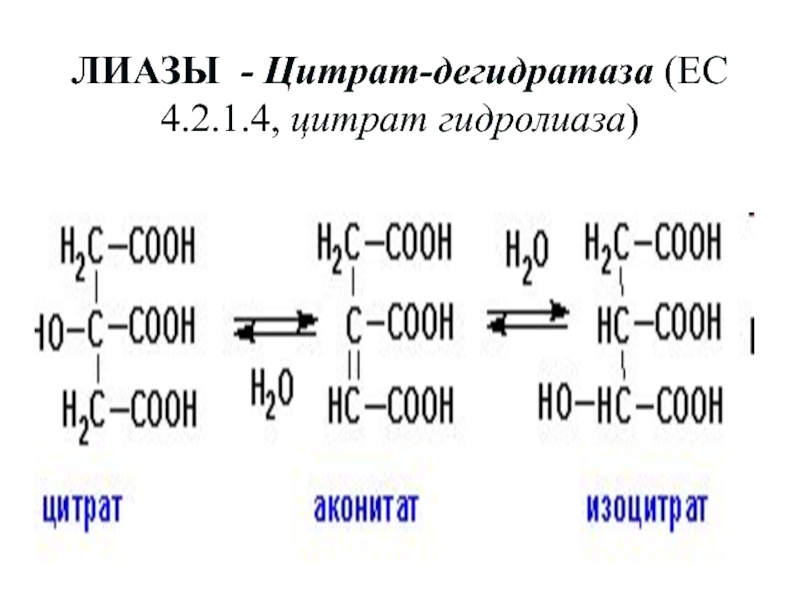
Слайд 72ЛИАЗЫ - Цитрат-дегидратаза (ЕС 4.2.1.4, цитрат гидролиаза)
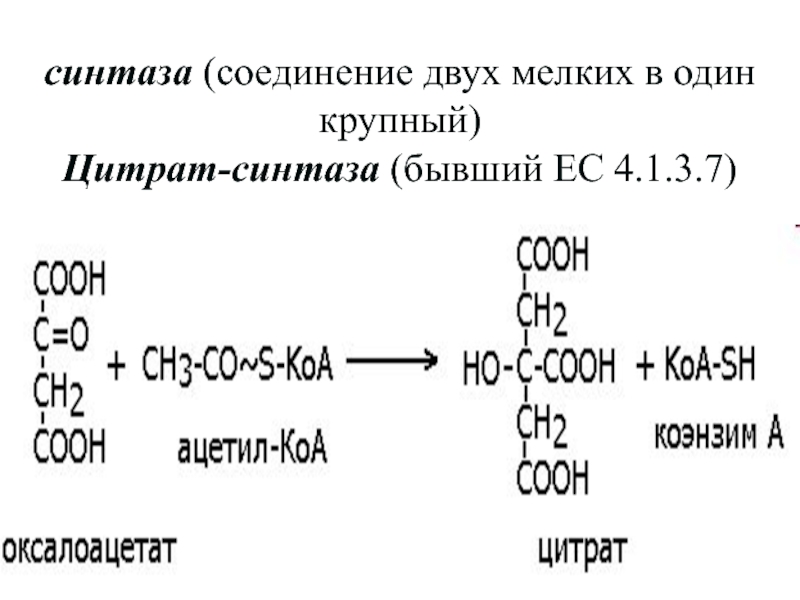
Слайд 73синтаза (соединение двух мелких в один крупный)
Цитрат-синтаза (бывший ЕС 4.1.3.7)
Слайд 74в настоящее время цитрат-синтаза отнесена к энзимам трансферазами (энзимы 2-го
класса), имеет номер ЕС 2.3.3.1 и систематическое название ацетил-КоА: оксалоацетат
С-ацетилтрансфераза (acetyl-CoA:oxaloacetate C-acetyltransferase [thioester-hydrolysing, (pro-S)-carboxymethyl forming]).
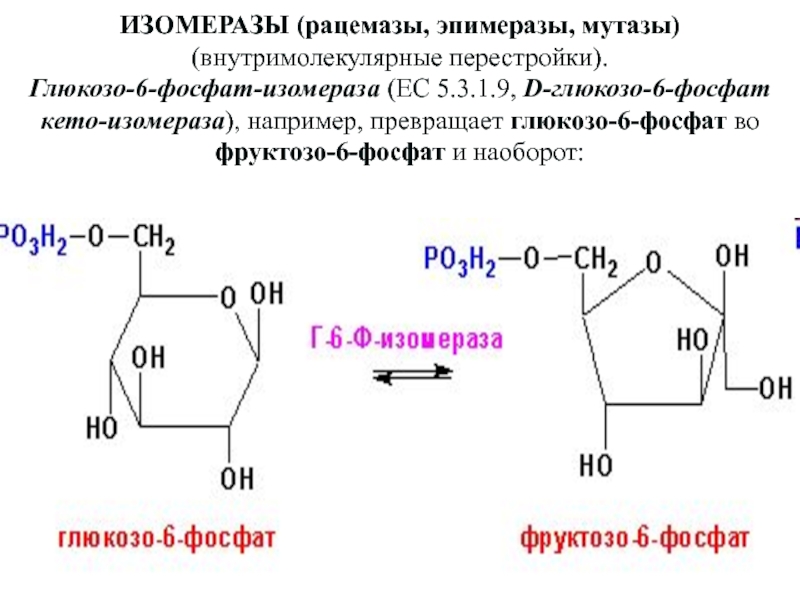
Слайд 75ИЗОМЕРАЗЫ (рацемазы, эпимеразы, мутазы) (внутримолекулярные перестройки).
Глюкозо-6-фосфат-изомераза (ЕС 5.3.1.9, D-глюкозо-6-фосфат кето-изомераза),
например, превращает глюкозо-6-фосфат во фруктозо-6-фосфат и наоборот:
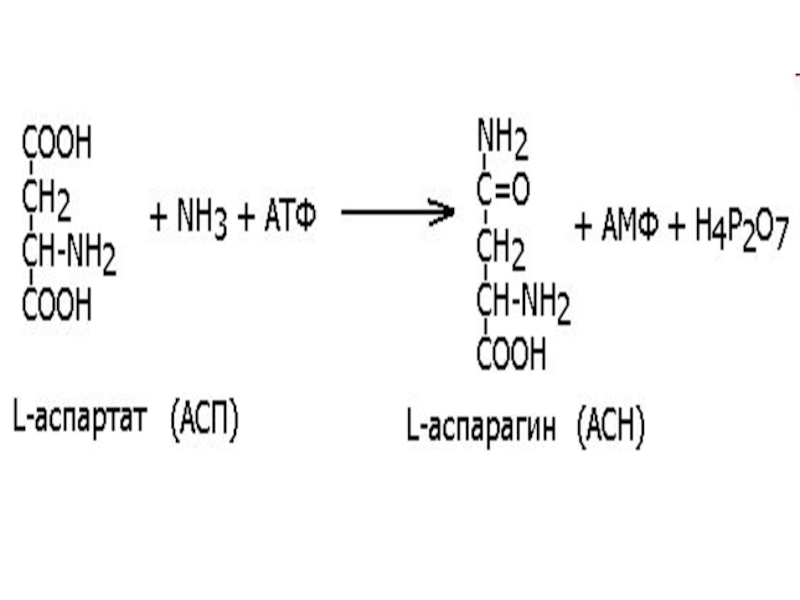
Слайд 766. ЛИГАЗЫ
(синтетазы, соединяют 2 части с использованием энергии АТФ). Реакции
ферментов этого класса, как правило, необратимы.
Так, аспартат-синтетаза (ЕС 6.3.1.1, L-аспартат:
аммиак-лигаза (АМФ-образующая) при участии молекулы АТФ синтезирует аспарагин из аспарагиновой кислоты и аммиака:
Слайд 77К подклассу 6.1 относят ферменты, катализирующие образование связей С-О (в
том числе Аминоацил-т-РНК-синтетазы), к подклассу 6.2- образование связей C-S, 6.3-
связей C-N, 6.4- связей С-С и 6.5- связей Р-О.
Например, к подклассу 6.4 относится фермент пируваткарбоксилаза (ЕС 6.4.1.1, пируват: СО2-лигаза (АДФ-образующая), при участии которой происходит превращение пирувата в оксалоацетат:
СО2 + СН3-СО-СООН + АТФ а HOOC-CH2-CO-COOH + АДФ + Н3РО4
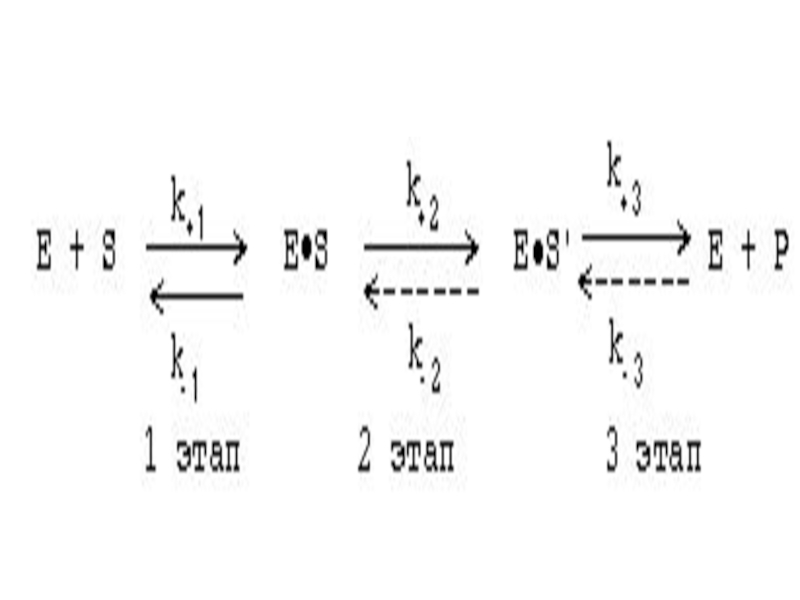
Слайд 79ОСНОВНЫЕ ЭТАПЫ ФЕРМЕНТАТИВНОГО КАТАЛИЗА
ферментативная реакция протекает через ряд промежуточных стадий.
Различают три основных этапа ферментативного катализа:
Слайд 811 этап. ОРИЕНТИРОВАННАЯ СОРБЦИЯ СУБСТРАТА НА АКТИВНОМ ЦЕНТРЕ ФЕРМЕНТА С
ОБРАЗОВАНИЕМ ОБРАТИМОГО E-S КОМПЛЕКСА (ФЕРМЕНТ-СУБСТРАТНОГО).
взаимодействие адсорбционного центра фермента с молекулой
субстрата.
При этом и субстрат подвергается конформационной перестройке.
Все это происходит за счет возникновения слабых типов связей между субстратом и адсорбционным центром фермента.
В результате этого молекула субстрата подается на каталитический центр в наиболее удобном для него положении.
Этап является легко обратимым ( участвуют только слабые типы связей).
Кинетическая характеристика 1-го этапа ферментативного катализа – константа Михаэлиса (Км).
Слайд 822 этап. ХИМИЧЕСКИЕ ПРЕВРАЩЕНИЯ МОЛЕКУЛЫ СУБСТРАТА В СОСТАВЕ ФЕРМЕНТ-СУБСТРАТНОГО КОМПЛЕКСА
С ОБРАЗОВАНИЕМ КОМПЛЕКСА ФЕРМЕНТА С ХИМИЧЕСКИ ПРЕОБРАЗОВАННЫМ СУБСТРАТОМ
Разрываются одни ковалентные
связи и возникают новые.Этот этап протекает значительно медленнее, чем 1-й и 3-й этапы.
Именно скорость второго этапа определяет скорость всей ферментативной реакции в целом.
Скорость ферментативного процесса в целом характеризуется величиной k+2, которая является почти всегда самой маленькой из всех частных констант скоростей. Кинетическая характеристика 2-го этапа - максимальная скорость (Vmax).
Слайд 833 этап. ДЕСОРБЦИЯ ГОТОВОГО ПРОДУКТА ИЗ ЕГО КОМПЛЕКСА С ФЕРМЕНТОМ.
Этот
этап протекает легче, чем 2-й. Он, как и 2-й этап,
тоже необратим. Исключение – обратимые ферментативные реакции.