Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Структурные компоненты нуклеиновых кислот. Уровни организации ДНК и РНК
Содержание
- 1. Структурные компоненты нуклеиновых кислот. Уровни организации ДНК и РНК
- 2. В каждом живом организме присутствуют
- 3. История открытия60 – е года 19 в.
- 4. Локализация в клеткеОсновная часть ДНК находится в
- 5. Структурная организацияНК – полимеры, мономерами которых являются
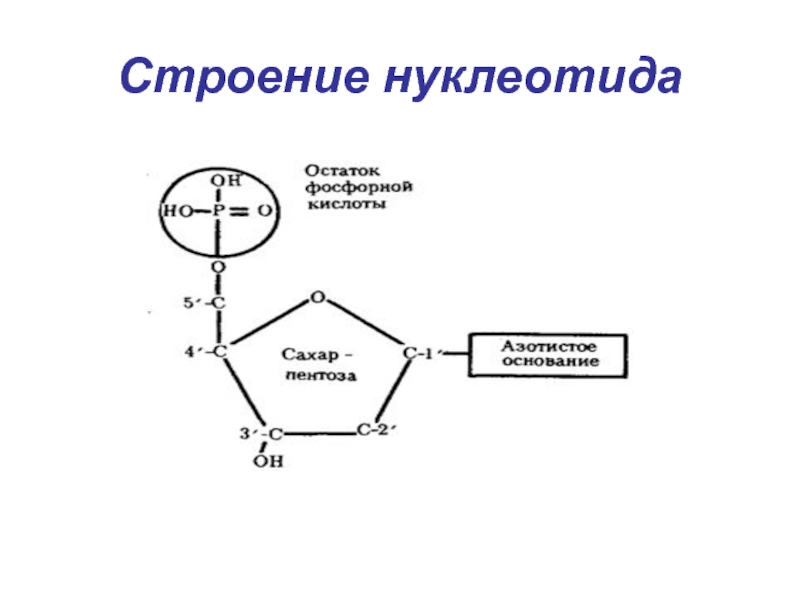
- 6. Строение нуклеотида
- 7. Нуклеотиды - фосфорные эфиры нуклеозидов. Остаток фосфорной кислоты присоединён к 5'-углеродному атому пентозы (5'-фосфоэфирная связь).
- 8. Азотистые основанияАроматические гетероциклические соединения, производные пиримидина и пурина.
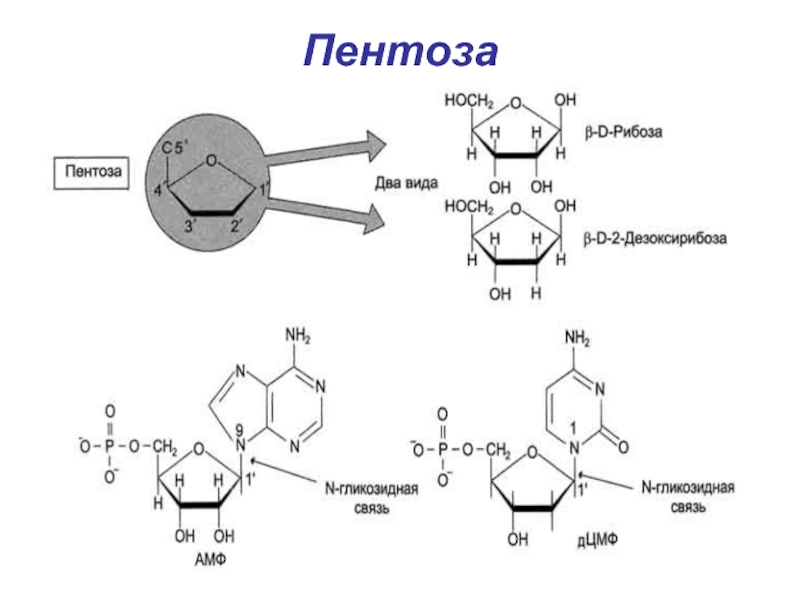
- 9. Пентоза
- 10. Строение – структура - функция
- 11. Репликация – синтез дочерней молекулы двухцепочечной ДНК,
- 12. Схема реализации генетической информации в фенотипические признаки.
- 13. Структура ДНКПервичная структура ДНК – порядок чередования
- 14. Фрагмент цепи ДНК
- 15. Макромолекулярная структура ДНК В 1953
- 16. Модель пространственной структуры ДНК.
- 17. Связи, участвующие в образовании вторичной структуры ДНКВодородные
- 18. Правило Чаргаффа: число пуриновых оснований
- 19. Формы ДНК и их характеристики Для человека
- 20. Третичная структура ДНК (суперспирализация ДНК). Компактизация и
- 21. Все связывающиеся с ДНК эукариотов белки можно
- 22. Структура нуклеосом. Восемь молекул гистонов (Н2А, Н2В,
- 23. РНКПервичная структура РНК - порядок чередования рибонуклеозидмонофосфатов (НМФ)
- 24. Основные типы РНКМатричная (информационная) РНК (мРНК)Рибосомальная РНК (рРНК)Транспортная РНКМалые ядерные РНК (мяРНК)
- 25. Процессинг мРНКПроцессинг РНК – совокупность процессов в
- 26. Ковалентная модификация концевых нуклеотидных остатков первичного транскрипта мРНК.
- 27. СплайсингВ процессе сплайсинга принимают участие различные малые
- 28. Предшественники рРНК и тРНК – таже как и мРНК подвергаются в ядре химической модификации (процессингу).
- 29. Процессинг первичного транскрипта тРНКПроцессинг тРНК включает формирование
- 30. Процессинг первичного транскрипта рРНК – формирование рибосом.Рибосомы
- 31. Занятие № 2 Методы молекулярной биологии
- 32. Выделение НКОсновными требованиями, предъявляемыми к методу выделения,
- 33. Выделение нуклеиновых кислот основано на методе разделения веществ при помощи магнитных шариков
- 34. Определение концентрации и качества препаратов нуклеиновых кислот
- 35. СеквенированиеСеквенирование (sequencing) – это общее название методов,
- 36. В настоящее время для секвенирования
- 37. Секвенирование ДНК по СенгеруПусть есть образец ДНК,
- 38. Секвенирование ДНК по СенгеруА теперь разобьем всю
- 39. Секвенирование ДНК по СенгеруПозволим полимеразе работать в
- 40. Применение в медицине:Микробиология:1) Выявление патогенов: холера
- 41. Секвенирование ДНК по Максаму и Гилберту: метод
- 42. Пиросеквенирование Это метод секвенирования ДНК (определение последовательности нуклеотидов в молекуле ДНК), основанный
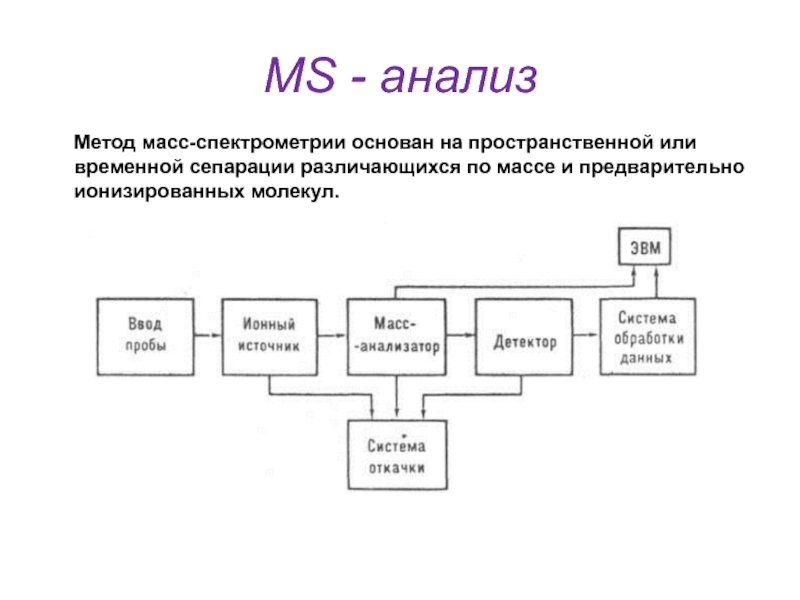
- 43. MS - анализМетод масс-спектрометрии основан на пространственной
- 44. Слайд 44
- 45. Рентгеноструктурный анализ
- 46. Слайд 46
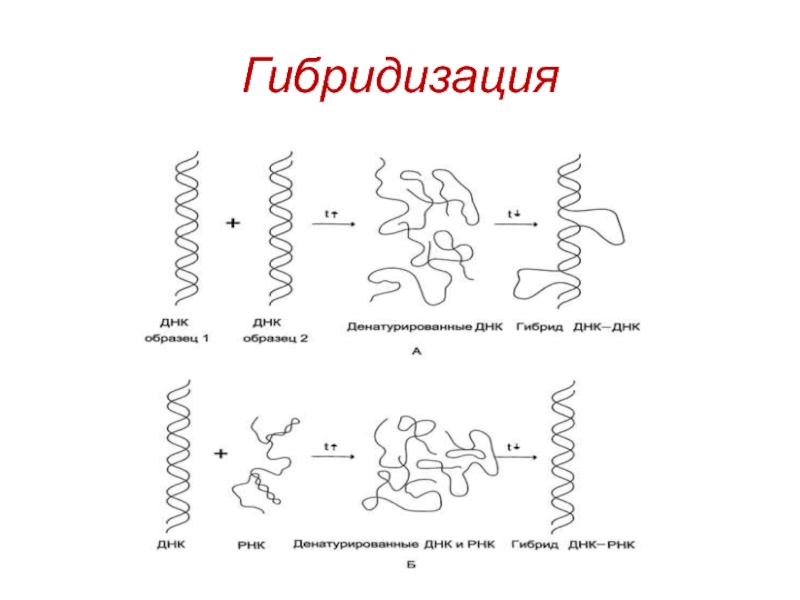
- 47. Гибридизация
- 48. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2 В каждом живом организме присутствуют 2 типа нуклеиновых
кислот: рибонуклеиновая кислота (РНК) и дезоксирибонуклеиновая кислота (ДНК).
Молекулярная масса самой "маленькой" из известных нуклеиновых кислот - транспортной РНК (тРНК) составляет примерно 25 кД. ДНК - наиболее крупные полимерные молекулы; их молекулярная масса варьирует от 1 000 до 1 000 000 кД. Слайд 3История открытия
60 – е года 19 в. – швейцарский ученый
Фридрих Мишер выделил из ядер клеток гноя вещество, названное им
нуклеин (от греч. nucleus - ядро).1944 г. – Эвери с сотрудниками установили, что ДНК отвечает за передачу наследственной информации.
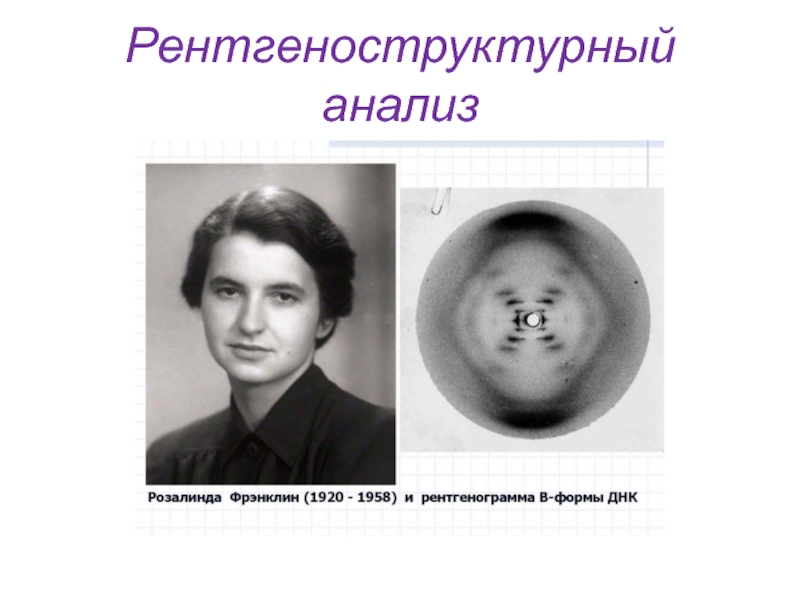
1953 г. – Дж. Уотсоном и Ф. Криком была предложена модель пространственной структуры ДНК (Нобелевская премия по физиологии и медицине). Модель открыта с помощью рентгеноструктурного анализа. Рентгенограммы получала Р. Франклин, работавшая в команде Дж. Уотсона и Ф. Крика.
Иоганн Фридрих Мишер
Джеймс Уотсон
Слайд 4Локализация в клетке
Основная часть ДНК находится в ядре клетки –
в составе хроматина. 0, 25 % - митохондриях (мДНК), также
имеется в хлоропластах у растений. РНК обнаружена во всех частях клетки.Нуклеиновые кислоты в клетке находятся не в свободном виде, а в комплексе с белками.
Слайд 5Структурная организация
НК – полимеры, мономерами которых являются нуклеотиды и выполняющие
в клетке функции хранения, передачи и реализации генетической информации.
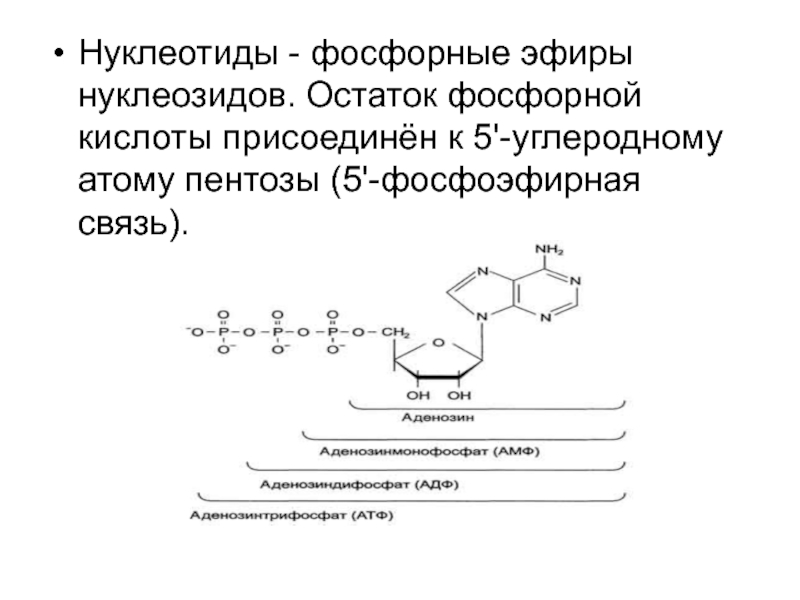
Слайд 7Нуклеотиды - фосфорные эфиры нуклеозидов. Остаток фосфорной кислоты присоединён к
5'-углеродному атому пентозы (5'-фосфоэфирная связь).
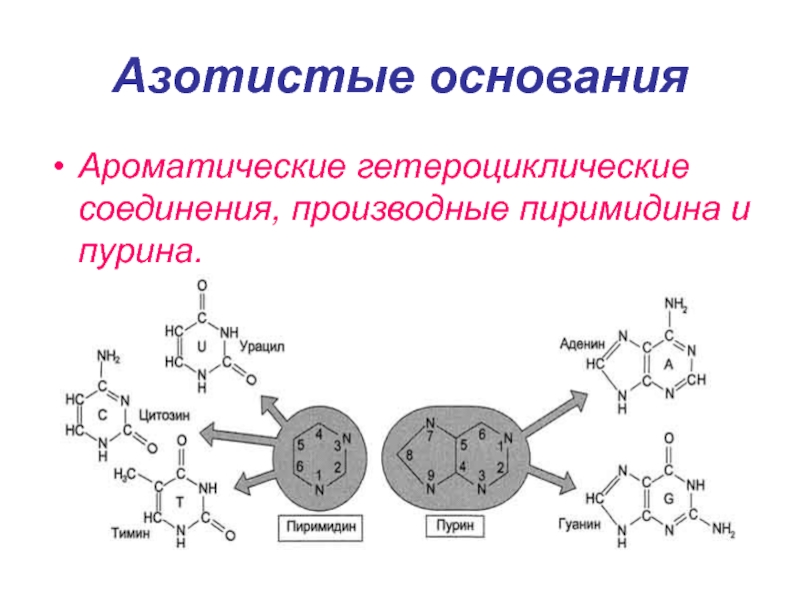
Слайд 8Азотистые основания
Ароматические гетероциклические соединения, производные пиримидина и пурина.
Слайд 11Репликация – синтез дочерней молекулы двухцепочечной ДНК, идентичной родительской двухцепочечной
ДНК (матрица – нити родительской ДНК).
Транскрипция – ферментативный процесс, при
котором генетическая информация, содержащаяся в одной цепи ДНК, используется для синтеза комплементарной нуклеотидной последовательности в цепи мРНК (матрица – одна из цепей ДНК).Трансляция – процесс, при котором генетическая информация, содержащаяся в молекуле мРНК, направляет синтез соответствующей аминокислотной последовательности в белке (матрица – мРНК).
Репарация – исправление ошибок в структуре ДНК, возникающих под воздействием факторов внешней и внутренней среды (матрица – участок неповрежденной нити ДНК)
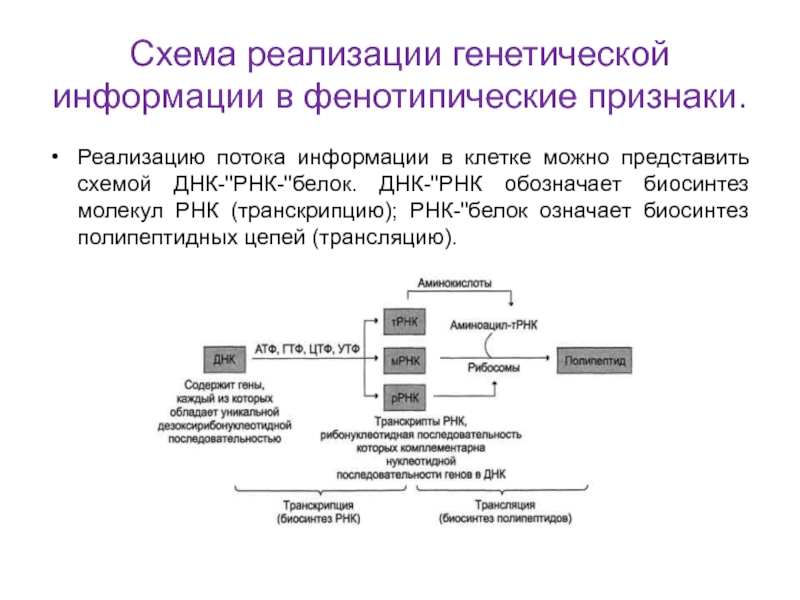
Слайд 12Схема реализации генетической информации в фенотипические признаки.
Реализацию потока информации
в клетке можно представить схемой ДНК-"РНК-"белок. ДНК-"РНК обозначает биосинтез молекул
РНК (транскрипцию); РНК-"белок означает биосинтез полипептидных цепей (трансляцию).Слайд 13Структура ДНК
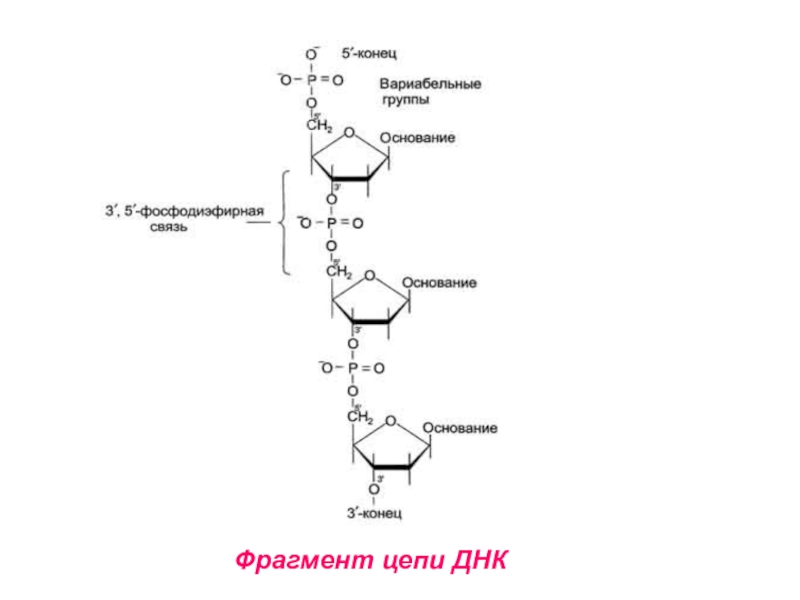
Первичная структура ДНК – порядок чередования дезоксирибонуклеозидмонофосфатов (дНМФ) в
полинуклеотидной цепи.
Связь между нуклеотидами – 3’, 5’ – фосфодиэфирная связь
(между фосфатной группой и 3’ и 5’ - углеродными атомами двух соседних дезоксирибоз.Слайд 15Макромолекулярная структура ДНК
В 1953 г. Дж. Уотсон
и Ф. Крик предложили модель структуры ДНК. При построении модели
ученые основывались на четырех группах данных:1. ДНК представляет собой полимер, состоящий из нуклеотидов, соединенных 3'-5'-фосфодиэфирными связями.
2. Состав нуклеотидов ДНК подчиняется правилам Чаргаффа: в любой ДНК содержание пуриновых нуклеотидов (A+G) всегда Равно содержанию пиримидиновых нуклеотидов (Т+С); число остатков А всегда равно числу остатков Т, число остатков G — Числу остатков С.
3. Рентгенограммы волокон ДНК, впервые полученные М. Уилкинсом и Р. Франклин, указывают на то, что молекула обладает спиральной структурой и содержит более одной ноли нуклеотидной цепи.
4. Кислотно-щелочное титрование ДНК показывает, что ее структура стабилизируется водородными связями. Титрование и нагревание нативной ДНК вызывает заметные изменения ее физических свойств, в частности вязкости, переводя ее в «денатурированную» форму, причем ковалентные связи при этом не разрушаются.
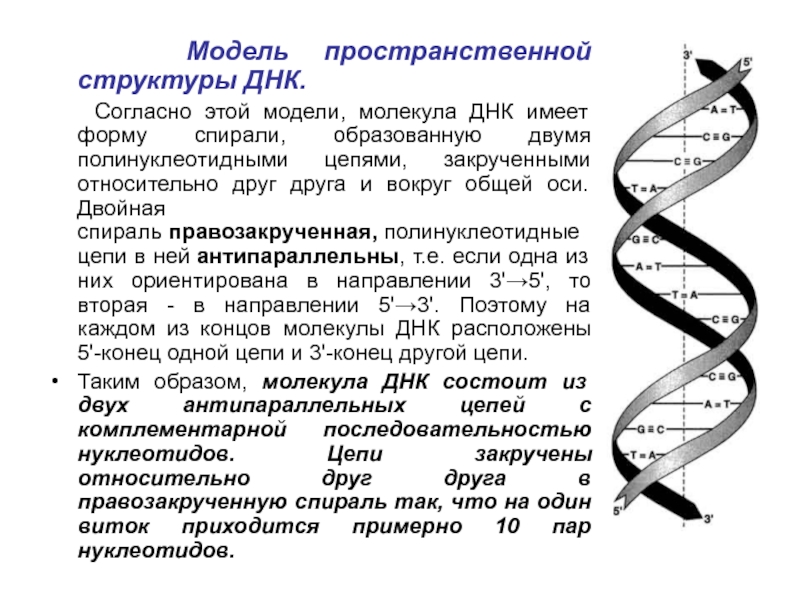
Слайд 16 Модель пространственной структуры ДНК.
Согласно этой модели,
молекула ДНК имеет форму спирали, образованную двумя полинуклеотидными цепями, закрученными
относительно друг друга и вокруг общей оси. Двойная спираль правозакрученная, полинуклеотидные цепи в ней антипараллельны, т.е. если одна из них ориентирована в направлении 3'→5', то вторая - в направлении 5'→3'. Поэтому на каждом из концов молекулы ДНК расположены 5'-конец одной цепи и 3'-конец другой цепи.Таким образом, молекула ДНК состоит из двух антипараллельных цепей с комплементарной последовательностью нуклеотидов. Цепи закручены относительно друг друга в правозакрученную спираль так, что на один виток приходится примерно 10 пар нуклеотидов.
Слайд 17Связи, участвующие в образовании вторичной структуры ДНК
Водородные связи между комплементарными
азотистыми основаниями;
Комплементарые основания уложены в стопку в сердцевине спирали. Между
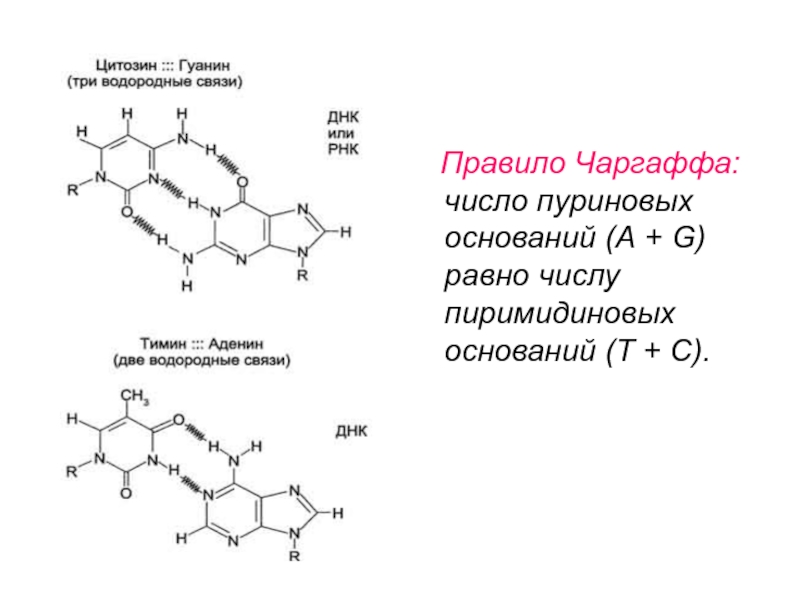
основаниями двухцепочечной молекулы в стопке возникают гидрофобные взаимодействия, стабилизирующие двойную спираль. Слайд 18 Правило Чаргаффа: число пуриновых оснований (А + G)
равно числу пиримидиновых оснований (Т + С).
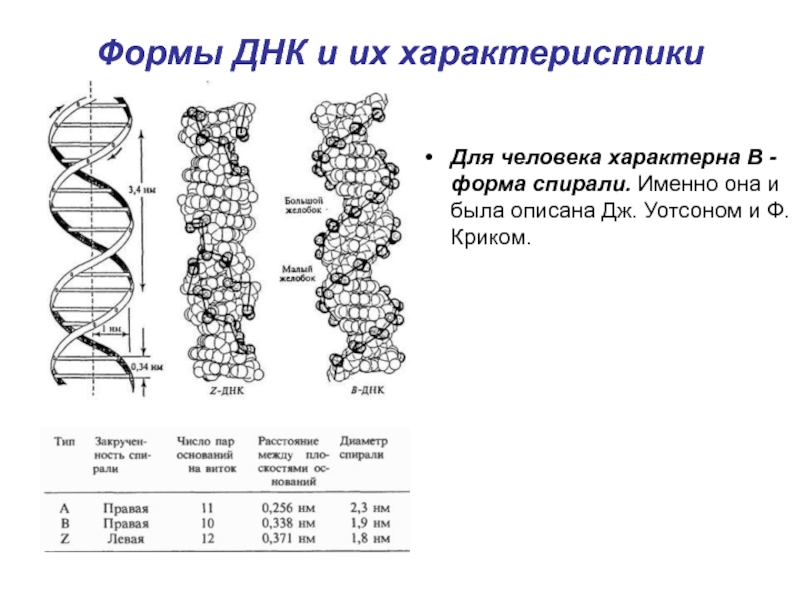
Слайд 19Формы ДНК и их характеристики
Для человека характерна B -
форма спирали. Именно она и была описана Дж. Уотсоном и
Ф. Криком.Слайд 20Третичная структура ДНК (суперспирализация ДНК). Компактизация и суперспирализация ДНК осуществляются
с помощью разнообразных белков, взаимодействующих с определёнными последовательностями в структуре
ДНК.Комплекс белков с ядерной ДНК клеток называют хроматином.
Слайд 21Все связывающиеся с ДНК эукариотов белки можно разделить на 2
группы: гисгоновые и негистоновые белки.
Гистоны - белки с молекулярной массой 11-21
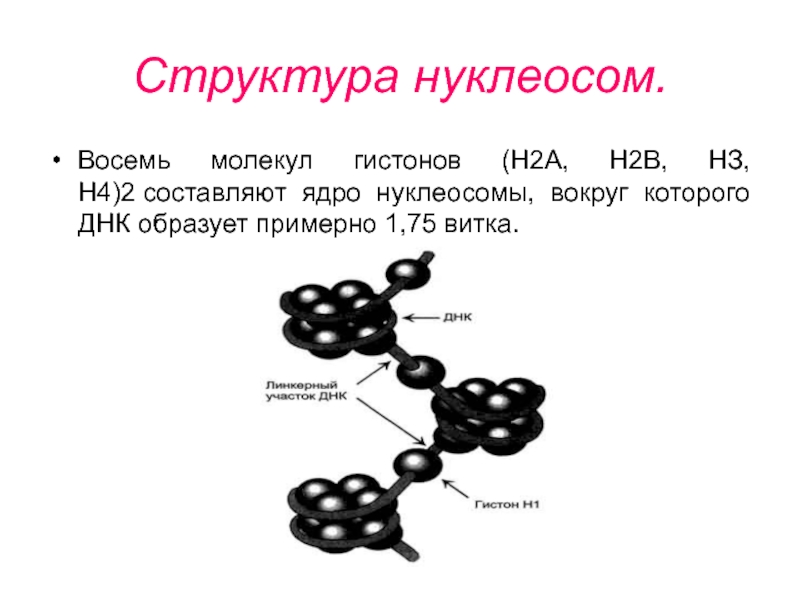
кД, содержащие много остатков аргинина и лизина. Благодаря положительному заряду гистоны образуют ионные связи с отрицательно заряженными фосфатными группами, расположенными на внешней стороне двойной спирали ДНК. Слайд 22Структура нуклеосом.
Восемь молекул гистонов (Н2А, Н2В, НЗ, Н4)2 составляют ядро
нуклеосомы, вокруг которого ДНК образует примерно 1,75 витка.
Слайд 23РНК
Первичная структура РНК - порядок чередования рибонуклеозидмонофосфатов (НМФ) в полинуклеотидной.
Вторичная структура
РНК
Молекула рибонуклеиновой кислоты построена из одной полинуклеотидной цепи.
Отдельные участки цепи РНК образуют спирализованные петли - "шпильки", за счёт водородных связей между комплементарными азотистыми основаниями A-U и G-C.
Третичная структура РНК
Одноцепочечные РНК характеризуются компактной и упорядоченной третичной структурой, возникающей путём взаимодействия спирализованных элементов вторичной структуры.
Слайд 24Основные типы РНК
Матричная (информационная) РНК (мРНК)
Рибосомальная РНК (рРНК)
Транспортная РНК
Малые ядерные
РНК (мяРНК)
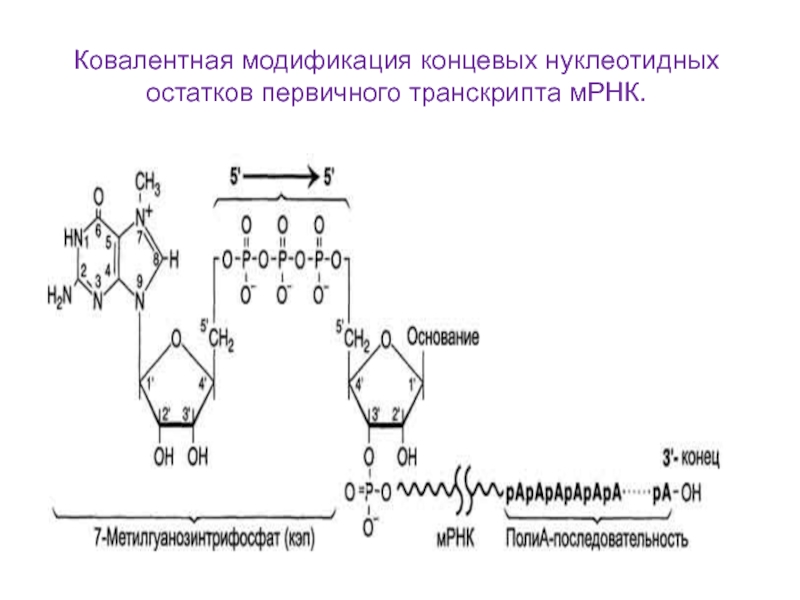
Слайд 25Процессинг мРНК
Процессинг РНК – совокупность процессов в клетке, которые способствуют
превращению первичных транскриптов (пре – мРНК) в зрелую РНК. Включает
следующие процессы:Кепирование – присоединение к 5’ концу пре – мРНК 7 – метилгуанозин – 5’ – трифосфата (кеп).
Полиаденилирование – присоединение к 3’ концу пре – мРНК 100 – 200 остатков аденина.
Сплайсинг - удаление интронов (участков, не кодирующих белок) и объединение экзонов (кодирующих участков).
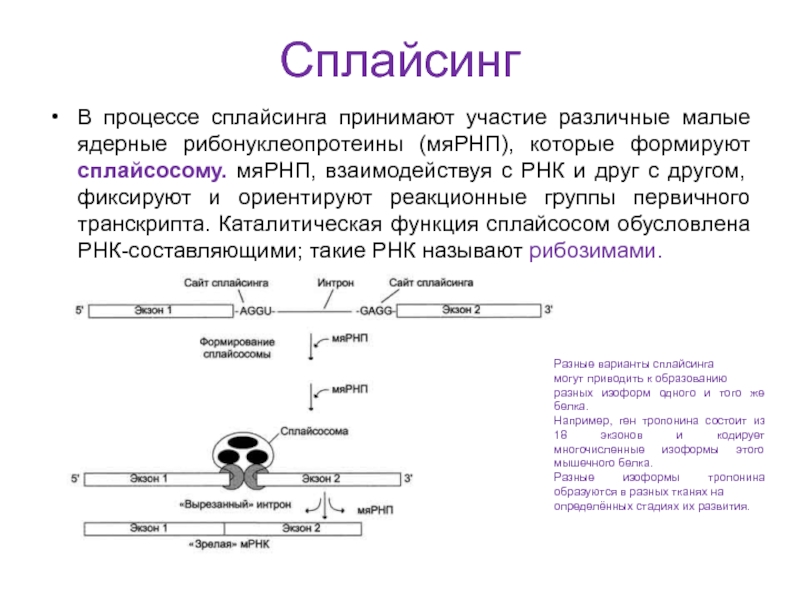
Слайд 27Сплайсинг
В процессе сплайсинга принимают участие различные малые ядерные рибонуклеопротеины (мяРНП),
которые формируют сплайсосому. мяРНП, взаимодействуя с РНК и друг с
другом, фиксируют и ориентируют реакционные группы первичного транскрипта. Каталитическая функция сплайсосом обусловлена РНК-составляющими; такие РНК называют рибозимами.Разные варианты сплайсинга
могут приводить к образованию
разных изоформ одного и того же белка.
Например, ген тропонина состоит из 18 экзонов и кодирует многочисленные изоформы этого мышечного белка.
Разные изоформы тропонина образуются в разных тканях на
определённых стадиях их развития.
Слайд 28Предшественники рРНК и тРНК – таже как и мРНК подвергаются
в ядре химической модификации (процессингу).
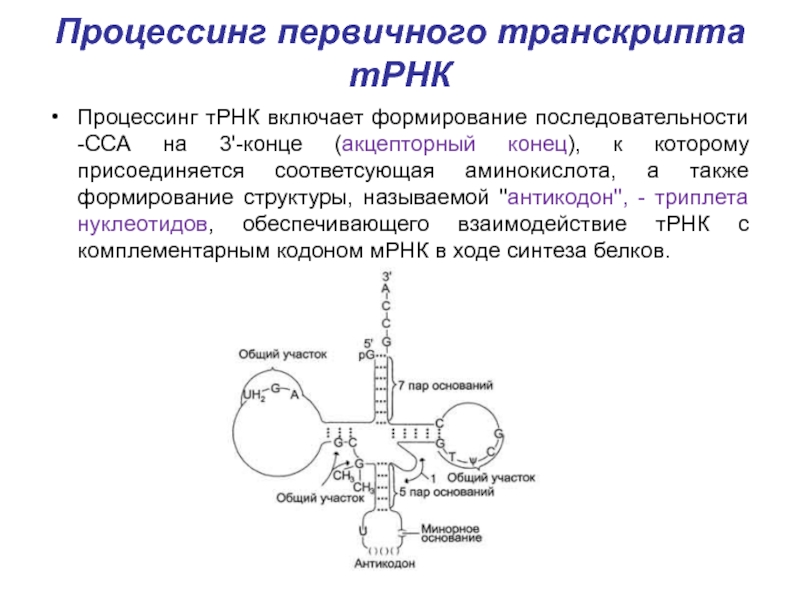
Слайд 29Процессинг первичного транскрипта тРНК
Процессинг тРНК включает формирование последовательности -ССА на
3'-конце (акцепторный конец), к которому присоединяется соответсующая аминокислота, а также
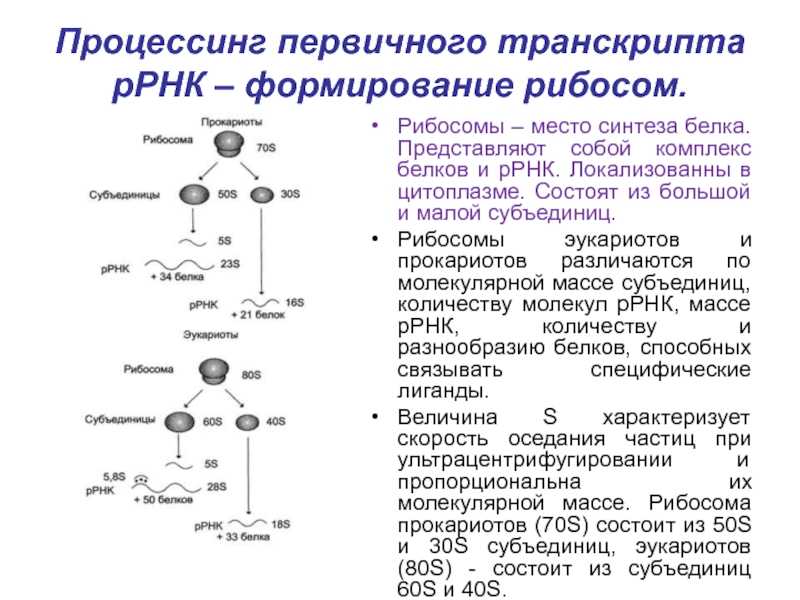
формирование структуры, называемой "антикодон", - триплета нуклеотидов, обеспечивающего взаимодействие тРНК с комплементарным кодоном мРНК в ходе синтеза белков.Слайд 30Процессинг первичного транскрипта рРНК – формирование рибосом.
Рибосомы – место синтеза
белка. Представляют собой комплекс белков и рРНК. Локализованны в цитоплазме.
Состоят из большой и малой субъединиц.Рибосомы эукариотов и прокариотов различаются по молекулярной массе субъединиц, количеству молекул рРНК, массе рРНК, количеству и разнообразию белков, способных связывать специфические лиганды.
Величина S характеризует скорость оседания частиц при ультрацентрифугировании и пропорциональна их молекулярной массе. Рибосома прокариотов (70S) состоит из 50S и 30S субъединиц, эукариотов (80S) - состоит из субъединиц 60S и 40S.
Слайд 32Выделение НК
Основными требованиями, предъявляемыми к методу выделения, являются эффективное отделение
нуклеиновых кислот от белков, а также минимальная степень фрагментации полученных препаратов.
Клеточные стенки исследуемого биологического материала разрушаются одним из стандартных методов, а затем обрабатываются анионным детергентом. При этом белки выпадают в осадок, а нуклеиновые кислоты остаются в водном растворе.
ДНК может быть осаждена в виде геля осторожным добавлением этанола к её солевому раствору. Концентрацию полученной нуклеиновой кислоты, а также наличие примесей (белки, фенол) обычно определяют спектрофотометрически по поглощению на А260 нм.
Нуклеиновые кислоты легко деградируют под действием особого класса ферментов — нуклеаз. В связи с этим при их выделении важно обработать лабораторное оборудование и материалы соответствующими ингибиторами.
Слайд 33Выделение нуклеиновых кислот основано на методе разделения веществ при помощи
магнитных шариков
Слайд 34Определение концентрации и качества препаратов нуклеиновых кислот методом спектрофотомерии
Спектрофотометрия (абсорбционная)
– физико-химический метод исследования растворов и твердых веществ, основанный на
изучении спектров поглощения в ультрафиолетовой (200–400 нм), видимой (400–760 нм) и инфракрасной (>760 нм) областях спектра. В соответствии с законом Бугера–Ламберта–Бера оптическая плотность раствора прямо пропорциональна концентрации поглощающего вещества. Нуклеиновые кислоты (НК) поглощают УФ излучение в области 240–290 нм с максимумом при 260 нм. Хромофорами служат азотистые основания НК (пиримидиновые).Слайд 35Секвенирование
Секвенирование (sequencing) – это общее название методов, которые позволяют установить
последовательность нуклеотидов в молекуле ДНК. В настоящее время нет ни
одного метода секвенирования, который бы работал для молекулы ДНК целиком; все они устроены так: сначала готовится большое число небольших участков ДНК (клонируется молекула ДНК многократно и «разрезается» её в случайных местах), а потом читается каждый участок по отдельности.Слайд 36 В настоящее время для секвенирования генов обычно применяют метод
Сенгера с дидезоксинуклеозидтрифосфатами (ddNTP).
Обычно до начала секвенирования производят амплификацию
участка ДНК, последовательность которого требуется определить, при помощи ПЦР. Секвенирование полного генома обычно осуществляют при помощи технологий секвенирования нового поколения (next-generation sequencing).Слайд 37Секвенирование ДНК по Сенгеру
Пусть есть образец ДНК, надо узнать его
последовательность.
Возьмем раствор, содержащий наш образец (одноцепочечную ДНК в достаточном количестве),
дезоксинуклеотиды dNTP (кирпичи, из которых строится ДНК), ДНК-полимеразу (белок-строитель), и праймер к образцу (праймер – это комплементарная «затравка» - кусочек ДНК, комплементарный началу нашего фрагмента, достаточной длины, чтобы с него начался синтез комплементарной цепи):Если позволить полимеразе работать (то есть, держать температуру, в которой ей удобно вести синтез), то в результате мы получим полностью достроенные комплементарные цепи.
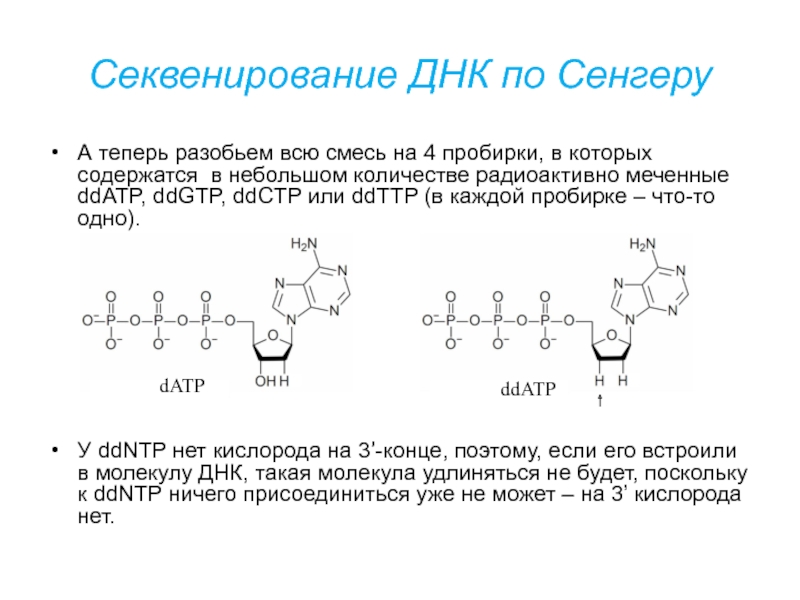
Слайд 38Секвенирование ДНК по Сенгеру
А теперь разобьем всю смесь на 4
пробирки, в которых содержатся в небольшом количестве радиоактивно меченные ddATP,
ddGTP, ddCTP или ddTTP (в каждой пробирке – что-то одно).У ddNTP нет кислорода на 3’-конце, поэтому, если его встроили в молекулу ДНК, такая молекула удлиняться не будет, поскольку к ddNTP ничего присоединиться уже не может – на 3’ кислорода нет.
dATP
ddATP
Слайд 39Секвенирование ДНК по Сенгеру
Позволим полимеразе работать в каждой из смесей.
Для каждой молекулы образца она будет достраивать комплементарную цепь, пока
не встроит ddNTP. Притом в пробирке с ddATP это может случиться только в тех местах, где в образце содержался тимин (комплементарный аденину ddATP). Тогда, если в образце были тимины в положениях 5, 7, 14, 15, то в пробирке с ddATP мы получим фрагменты ДНК комплементарной цепи с такими длинами.Сделаем форез, чтобы различить фрагменты разной длины в каждой пробирке, каждая дорожка фореза – одна пробирка.
Поскольку ddNTP был радиоактивно помечен, то, проявив гель на фотопленке, мы увидим только комплементарные цепи с ddNTP.
Слайд 40Применение в медицине:
Микробиология:
1) Выявление патогенов: холера – на Гавайях,
токсичная E.coli в Германии.
2) Анализ симбиотических организмов: микробиом.
Болезнь
профиль экспрессии:Классификация опухолей, тонкий и/или ранний диагноз.
Спектр мутагенеза – причина опухолеобразования.