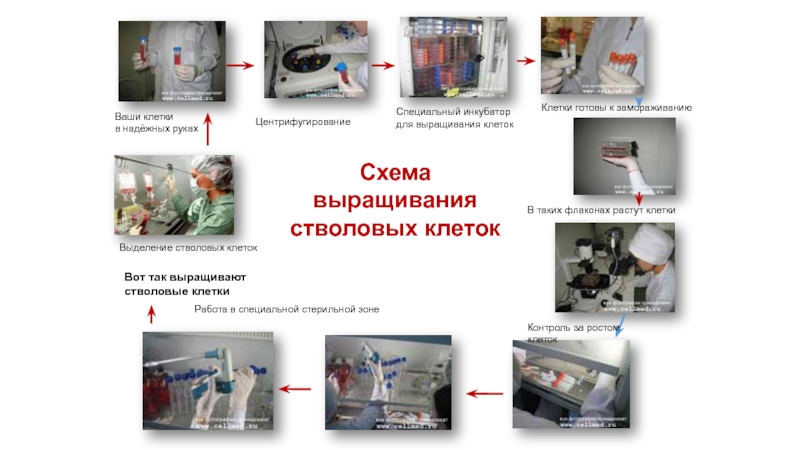
Слайд 2Схема
выращивания стволовых клеток
Вот так выращивают
стволовые клетки
Центрифугирование
Специальный инкубатор
для выращивания клеток
Клетки готовы к замораживанию
В таких флаконах растут клетки
Контроль
за ростом клеток
Работа в специальной стерильной зоне
Ваши клетки
в надёжных руках
Выделение стволовых клеток
Слайд 3Классификация стволовых клеток [6]
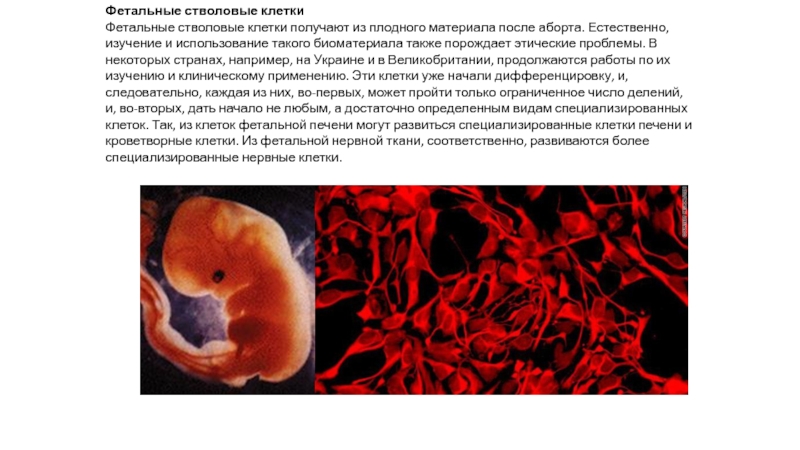
Слайд 4Фетальные стволовые клетки
Фетальные стволовые клетки получают из плодного материала после аборта. Естественно,
изучение и использование такого биоматериала также порождает этические проблемы. В
некоторых странах, например, на Украине и в Великобритании, продолжаются работы по их изучению и клиническому применению. Эти клетки уже начали дифференцировку, и, следовательно, каждая из них, во-первых, может пройти только ограниченное число делений, и, во-вторых, дать начало не любым, а достаточно определенным видам специализированных клеток. Так, из клеток фетальной печени могут развиться специализированные клетки печени и кроветворные клетки. Из фетальной нервной ткани, соответственно, развиваются более специализированные нервные клетки.
Слайд 51968: доказана возможность восстановления кроветворения у реципиента после трансплантации костного
мозга. Трансплантация костного мозга восьмилетнему мальчику приводит к исцелению от
тяжёлой формы иммунодефицита. Донором стала сестра с совместимым набором лейкоцитарных антигенов (HLA).
1988: Элиан Глюкман провела первую успешную трансплантацию ГСК пуповинной крови пациенту, больному анемией Фанкони. Э. Глюкман доказала, что применение пуповинной крови эффективно и безопасно. С тех пор пуповинная кровь широко применяется в трансплантологии.
1992: первая именная коллекция стволовых клеток. Профессор Дэвид Харрис заморозил стволовые клетки пуповинной крови своего первенца. Сегодня Дэвид Харрис — директор крупнейшего в мире банка стволовых клеток пуповинной крови.
1997: в России проведена первая операция онкологическому больному по пересадке стволовых клеток пуповинной крови.
1998: первая в мире трансплантация аутологичных стволовых клеток пуповинной крови девочке с нейробластомой (опухолью мозга). Общее число проведенных операций по трансплантации пуповинной крови к этому году превышает 600.
История применения СК в медицине
Элиан Глюкман

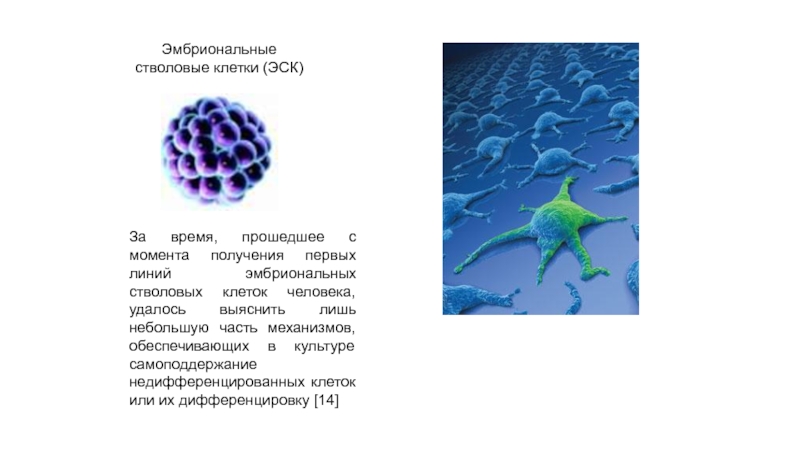
Слайд 6За время, прошедшее с момента получения первых линий эмбриональных стволовых
клеток человека, удалось выяснить лишь небольшую часть механизмов, обеспечивающих в
культуре самоподдержание недифференцированных клеток или их дифференцировку [14]
Эмбриональные
стволовые клетки (ЭСК)
Слайд 7Схема
получения эмбриональных стволовых клеток [6]
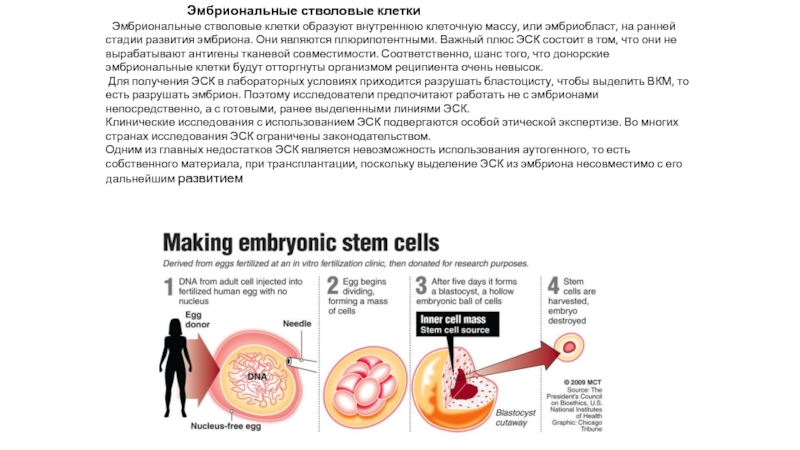
Эмбриональные стволовые клетки
Эмбриональные стволовые клетки образуют внутреннюю клеточную массу,
или эмбриобласт, на ранней стадии развития эмбриона. Они являются плюрипотентными. Важный плюс ЭСК состоит в том, что они не вырабатывают антигены тканевой совместимости. Соответственно, шанс того, что донорские эмбриональные клетки будут отторгнуты организмом реципиента очень невысок.
Для получения ЭСК в лабораторных условиях приходится разрушать бластоцисту, чтобы выделить ВКМ, то есть разрушать эмбрион. Поэтому исследователи предпочитают работать не с эмбрионами непосредственно, а с готовыми, ранее выделенными линиями ЭСК.
Клинические исследования с использованием ЭСК подвергаются особой этической экспертизе. Во многих странах исследования ЭСК ограничены законодательством.
Одним из главных недостатков ЭСК является невозможность использования аутогенного, то есть собственного материала, при трансплантации, поскольку выделение ЭСК из эмбриона несовместимо с его дальнейшим развитием
Слайд 9Разорванная бластоциcта с несколькими стволовыми клетками (красные), оставшимися внутри.
Несколько
эмбриональных стволовых клеток на кончике иглы.
[14]
Слайд 10Рис.1. Ранние стадии развития мыши [5,9]
Рис. 2. Мышиный эмбрион на
ранней стадии развития.
А. Стадия двух клеток
Б. Стадия четырех клеток
В. Стадия
морулы (8-16 клеток; происходит уплотнение зародыша)
Г. Бластоцита
Слайд 111908: термин «стволовая клетка» предложен к широкому использованию русским гистологом
Александром Максимовым
1978: в пуповинной крови обнаружены гемопоэтические стволовые клетки.
1981: эмбриональные
клетки мыши получены из эмбриобласта учёными Мартином Эвансом, Мэттью Кауфманом и, независимо от них, Гэйл Р. Мартин. Введение в обиход термина «эмбриональная стволовая клетка» приписывается Гэйл Мартин.
1992: нейральные стволовые клетки получены in vitro. Разработаны протоколы их культивирования в виде нейросфер.
1998: Джеймс Томсон и его сотрудники из Висконсинского университета в Мадисоне вывели первую линию человеческих ЭСК.
1999: журнал Science признал открытие эмбриональных стволовых клеток третьим по значимости событием в биологии после расшифровки двойной спирали ДНК и проекта «Геном человека».
Основные вехи исследования стволовых клеток
Гейл Р. Мартин
Джеймс Томсон
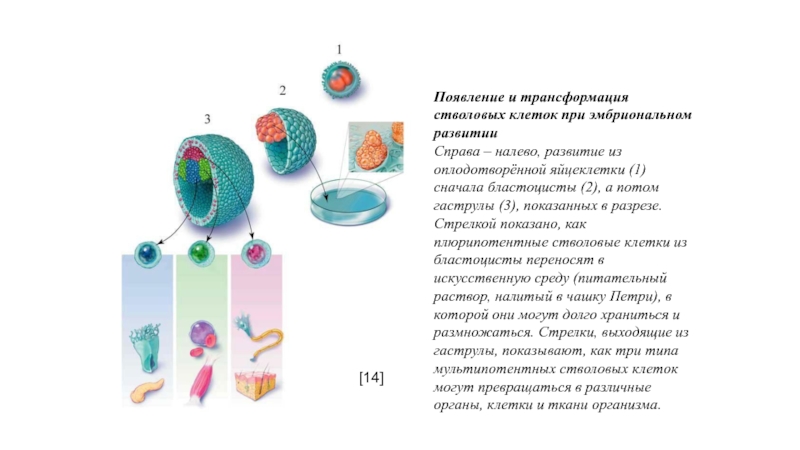
Слайд 12Появление и трансформация стволовых клеток при эмбриональном развитии
Справа – налево,
развитие из оплодотворённой яйцеклетки (1) сначала бластоцисты (2), а потом
гаструлы (3), показанных в разрезе. Стрелкой показано, как плюрипотентные стволовые клетки из бластоцисты переносят в искусственную среду (питательный раствор, налитый в чашку Петри), в которой они могут долго храниться и размножаться. Стрелки, выходящие из гаструлы, показывают, как три типа мультипотентных стволовых клеток могут превращаться в различные органы, клетки и ткани организма.
[14]
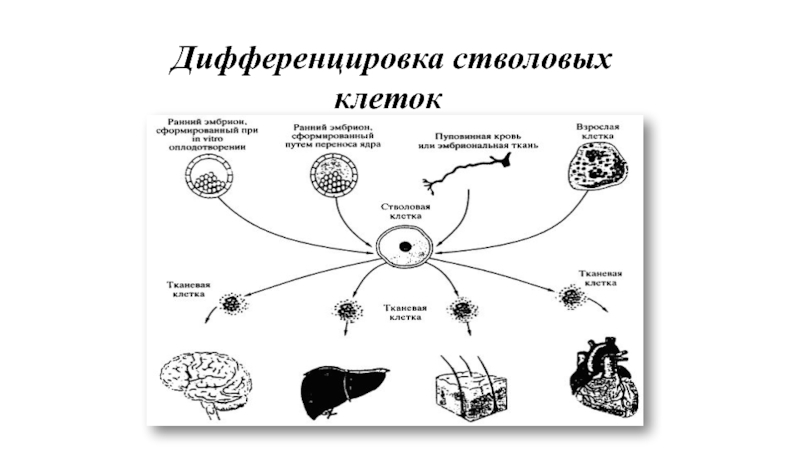
Слайд 13 Дифференцировка стволовых клеток
Слайд 15 Клеточная инженерия животных
[5]
Слайд 16Клонирование овцы методом переноса ядра [3,12]
Слайд 17Клонирование :работы Я.Вильмунта
[15]
Слайд 20Лекция
Возможности и достижения тканевой и органной инженерии человека.
Применение технологий
в медицине и сельском хозяйстве
Слайд 21Определен механизм роста и дифференцировки взрослых стволовых клеток мышечной ткани
Во
время регенерации мышечной ткани, являющейся ответом на механическое повреждение, внешние
факторы приводят к тому, что покоящаяся популяция стволовых клеток мышечной ткани (т.н. клеток-сателлитов или клеток-спутников) переходит к пролиферации и дифференцировке.
Регенеративная медицина базируется на концепции замены поврежденных или отмерших клеток новыми клетками, которые облегчают или излечивают болезни.[14]
Регенеративная медицина дает возможность замены поврежденных или больных клеток и тканей, порождает надежду на продление молодости и улучшение качества жизни.
В регенеративной медицине существует два основных подхода:
Первый – «вынудить» стволовые или прогениторные клетки в организме пациента размножаться и дифференцировать в нужные клетки и ткани с применением специфических цитокинов или факторов роста.
Второй – получение донорских клеток с последующей инъекцией или трансплантацией пациентам. Стволовые клетки могут быть также выделены от пациентов, пройти определенную обработку in vitro и затем назад возвращены пациентам.

Слайд 22Первопроходцы метода тканевой инженерии
химик Ваканти Чак, хирург Ваканти Джозеф,
инженер Лангер Роберт
ЭТО МИКРОУСТРОЙСТВО,
содержащее "сосудистую сеть", которая пронизывает подложки
с культурами клеток, - один из продуктов тканевой инженерии, созданный с использованием новейших материалов и технологий. Прямой контакт сосудов с монослоями клеток исключается с помощью мембран с нанопорами, прослаивающих всю конструкцию
Слайд 23Получение эквивалента кожи.[7]
Предварительная подготовка и соединение основных (клеточного и внеклеточного)
компонентов дермы при создании слабощелочного рН.
Тщательное перемешивание, перенесение в культуральную
посуду и образование коллагенового геля с заключенными в него фибробластами в результате полимеризации коллагена.
Дальнейшая контракция коллагенового геля во время инкубации и образование эквивалента дермы.
Получение эквивалента кожи в результате внесения суспензии кератиноцитов и их культивирования на поверхности дермального эквивалента.
Слайд 24Схема экспериментального использования эмбриональных стволовых клеток для получения инсулинпродуцирующих клеток
Слайд 25Реконструкция кровеносных сосудов [12]
Слайд 26Схема биоинженерной реконструкции кровеносного сосуда [15]
I: а) обвитие волокон биоматрикса
вокруг силиконового стержня;
б) заселение биоматрикса культивированными гладкомышечными клетками в статичной
культуре;
в) средняя оболочка сформирована в результате биодеградации и ремоделинга матрикса.
II: а) обвитие волокон биоматрикса вокруг сформированного среднего слоя;
Б) заселение биоматрикса культивированными фибробластами в статичной культуре;
В) наружная оболочка сформирована в результате биодеградации и ремоделинга матрикса.
III: а) извлечение силиконового стержня из сформированной двухслойной соединительно-тканномышечной трубки;
Б) внесение суспензии культивированных эндотелиоцитов внутрь через полый стержень;
В) герметизация концов сосуда и кратковременная инкубация.
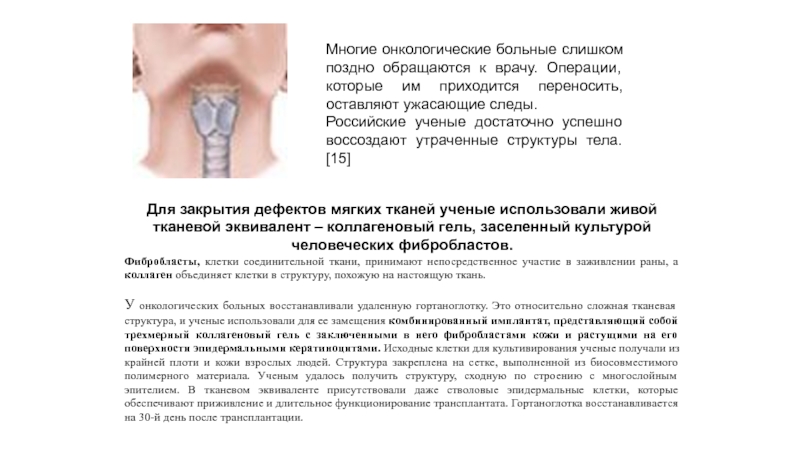
Слайд 27Многие онкологические больные слишком поздно обращаются к врачу. Операции, которые
им приходится переносить, оставляют ужасающие следы.
Российские ученые достаточно успешно
воссоздают утраченные структуры тела. [15]
Для закрытия дефектов мягких тканей ученые использовали живой тканевой эквивалент – коллагеновый гель, заселенный культурой человеческих фибробластов.
Фибробласты, клетки соединительной ткани, принимают непосредственное участие в заживлении раны, а коллаген объединяет клетки в структуру, похожую на настоящую ткань.
У онкологических больных восстанавливали удаленную гортаноглотку. Это относительно сложная тканевая структура, и ученые использовали для ее замещения комбинированный имплантат, представляющий собой трехмерный коллагеновый гель с заключенными в него фибробластами кожи и растущими на его поверхности эпидермальными кератиноцитами. Исходные клетки для культивирования ученые получали из крайней плоти и кожи взрослых людей. Структура закреплена на сетке, выполненной из биосовместимого полимерного материала. Ученым удалось получить структуру, сходную по строению с многослойным эпителием. В тканевом эквиваленте присутствовали даже стволовые эпидермальные клетки, которые обеспечивают приживление и длительное функционирование трансплантата. Гортаноглотка восстанавливается на 30-й день после трансплантации.
Слайд 29Конструирование зубов [15]
Зубы поросят измельчали в порошок и обрабатывали ферментами.
Полученные изолированные клетки поместили в биодеградируемый каркас. После недельной инкубации
по периметру формы образовалось скопление клеток (рис. А).
А
Б
В
Г
В последующие 25 недель (рис.Б) каркас растворялся, появились пульпа, эмаль и дентин). Результатом таких экспериментов стало образование крошечных структур, похожих на зубы.
Правильная организация тканей новообразований (рис.В) наблюдалась в 15-20 % случаев.
Чаще зуб не имел упорядоченной структуры (рис. Г).
Эти эксперименты свидетельствуют о способности изолированных клеток зубов к самоорганизации и образованию островков тканей зуба.
Слайд 30Биоматрикс
ОСНОВНЫЕ ПОЛОЖЕНИЯ
За последние десять лет достигнуты большие успехи в создании
заменителей различных тканей человека; некоторые наиболее простые трансплантаты уже используются
в клинике.
Основной предпосылкой к таким успехам стало более глубокое понимание поведения клеток и появление новых "строительных материалов".
На "предстартовой" позиции находятся еще несколько искусственных заменителей, но им предстоит пройти испытания на соответствие требованиям, предъявляемым к "живым" материалам.
Слайд 31Бионанотехнологии
Биомедицинская нанотехнология – это особая область биохимических и биомедицинских наук,
занимающихся изучением принципов создания и функционирования биологических наноразмерных систем, применением
полученных знаний для усовершенствования существующих и создания принципиально новых бионаноматериалов, биотехнологических процессов, устройств для селективной диагностики,терапии, хирургии, генной инженерии, биотехнологии (Артюхов,2015). Размеры наноструктур от 1 до 1000 нм, что соразмерно с квантовыми точками, белками и пептидами, вирусами.
Слайд 32 ЭТО МИКРОУСТРОЙСТВО,
содержащее "сосудистую сеть", которая пронизывает подложки с культурами
клеток, - один из продуктов тканевой инженерии, созданный с использованием
новейших материалов и технологий. Прямой контакт сосудов с монослоями клеток исключается с помощью мембран с нанопорами, прослаивающих всю конструкцию
ОСНОВНЫЕ ПОЛОЖЕНИЯ
За последние десять лет достигнуты большие успехи в создании заменителей различных тканей человека; некоторые наиболее простые трансплантаты уже используются в клинике.
Основной предпосылкой к таким успехам стало более глубокое понимание поведения клеток и появление новых "строительных материалов".
На "предстартовой" позиции находятся еще несколько искусственных заменителей, но им предстоит пройти испытания на соответствие требованиям, предъявляемым к "живым" материалам.
Слайд 33Перспективные направления наномедицины
- имплантируемые материалы для восстановления и замены
тканей биосовместимыми покрытиями имплантов. Структурные имплантируемые материалы для восстановления кости,
биодеградируемые (или саморассасывающиеся) для имплантации, Умные (smart) материалы.
- имплантируемые устройства (мониторирующие и лечащие): сенсоры, импланты сеттчатки, слухопротезирование.
Слайд 34Классификация наночастиц:
- липосомы
-вирусные наночастицы
--собственно наночастицы ( из готовых полимеров, дендримеры
на основе неорганических веществ, углеродные нанотрубки и фуллерены)
Слайд 35Классификация наночастиц , применяемых в медицине
1 Биологические и биогенные :
липосомы, вирусные , микросферы, нанокапсулы, наносферы из липидов, пептидов.,
полисахаридов.
2. Полимерные : мицеллы, дендримеры,микросферы, из полимолочной, полигликолевой,кислот, полиэтиленгликоля и др.
3.Неорганические: наностержни, нанооболочки, наносферы из металлов и их оксидов и солей ,из кремния
4 На основе углерода : фуллерены. Углеродные нанотрубки из углерода используют в качестве нано контейнеров. Фуллерены открыты в 1985 году, слово произошло от фамилии архитектора Б. Фуллера,. Фуллерены представляют собой свернутый в замкнутую сферу плоский одноатомный слой графита (графен), состоящих из чередующихся правильных шести- и пятичленных циклов.
Слайд 36Углеродная нанотрубка, покрытая полиэтиленгликолем [15]
Цилиндрические углеродные нанотрубки настолько тонки, что
50000 таких нанотрубок, сложенных в ряд, едва ли достигнут толщины
человеческого волоса. Благодаря своим уникальным свойствам нанотрубки могут стать эффективным средством доставки самых разнообразных терапевтических агентов в клетки пациентов. Углеродные нанотрубки, в которых молекулы углерода организованы в гексагональные кольца, в ответ на облучение генерируют весьма сильный сигнал, что позволяет с высокой точностью определять местонахождение интересующих молекул, а также их концентрацию в тканях и в периферической крови.
Покрытие нанотрубок различными соединениями расширяет спектр их применения и варьировать типы препаратов, доставляемых с помощью нанотрубок к клеткам.
Слайд 37Новая технология создания костных имплантатов [15]
Модель нижней челюсти, полученная с
помощью «спекания» металлического порошка
Имплантаты, которые могли бы стать функциональной заменой
поврежденных костей, теперь могут быть получены благодаря новой методике.
На первом этапе с помощью компьютерного моделирования создается модель новой «кости», учитывающая ее внутреннюю структуру и пористость. Затем из металлического порошка «спекается» имплантат нужной конфигурации. Металлический порошок, обычно состоящий из таких биосовместимых материалов, как титан и сталь – идеальный материал для получения легко приживляемых конструкций
В настоящее время разработанная методика вполне пригодна для внедрения ее в клиническую практику. Модель формируется последовательным наслоением на исходный «прототип» тончайших слоев металлического порошка. С помощью лазера порошок сплавляется в плотную пористую массу. Конечный продукт получается весьма легким и при этом крайне прочным, по этим характеристикам соответствуя костной ткани.
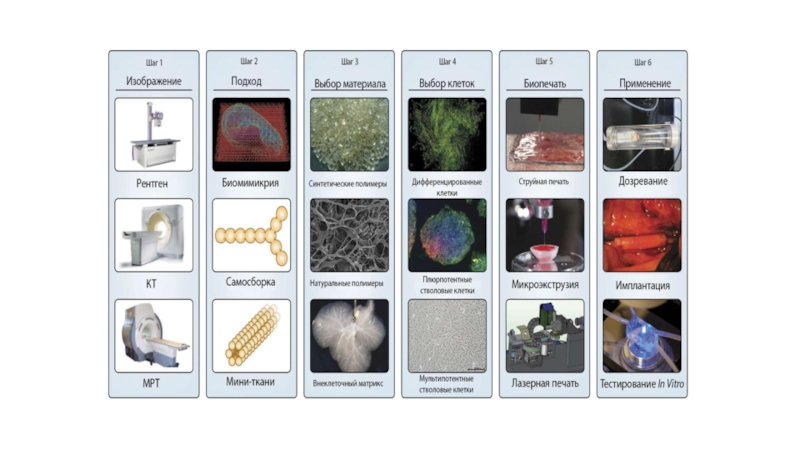
Слайд 39Трехмерная биопечать основывается на трех основных подходах: биомимикрии, автономной самосборке
и построении тканевых мини-блоков.
БИОМИМИКРИЯ
Такой подход к 3D-биопечати подразумевает изготовление
идентичных копий клеточных и внеклеточных компонентов ткани или органа. Этого можно достичь путем создания определённых клеточных компонентов ткани или биоматериалов, физиологически соответствующих данной ткани. Для того, чтобы достичь результатов при использовании данного метода, необходима репликация биологических тканей уже на микроскопическом уровне.
Слайд 40АВТОНОМНАЯ САМОСБОРКА
Еще одним подходом к воспроизведению биологических тканей является использование
стратегии развития органов в эмбриогенезе как базовой основы. Так, ранние
клеточные компоненты развивающейся ткани производят свои собственные элементы внеклеточного матрикса, приобретают сигнальные системы, организацию и характеристики, обусловливающие желаемую микроархитектуру и функции
Слайд 41МИНИ-ТКАНИ
Концепция мини-тканей уместна для обеих вышеупомянутых стратегий трехмерной биопечати. Органы
и ткани будут состоять из небольших функционирующих блоков, так называемых
«мини-тканей» — наименьших структурных и функциональных компонентов ткани
Выбор соответствующих материалов для использования в биопечати и их эффективность в конкретном случае зависит от нескольких особенностей
• Пригодность для печати
Свойства, которые облегчают обработку и осаждение со стороны биопринтера могут включать вязкость, методы гелеобразования и реологические свойства.
• Биологическая совместимость
• Кинетика распада и его продукты
• Структурные и механические свойства
• Биомимикрия материалов
Слайд 42Материалы, используемые в настоящее время в медицине для восстановления и
регенерации, преимущественно создаются либо на основе материалов природного происхождения (в
том числе полимеров альгината, желатина, коллагена, хитозана, фибрина и гиалуроновой кислоты, часто выделенного из животных тканей), либо из синтетических молекул (полиэтиленгликоля)
Вариантов для биопечати клеток всего два: изначальное внесение шаблонных клеток разных типов как основы будущей ткани или печать стволовых клеток с их дальнейшей пролиферацией и дифференциацией
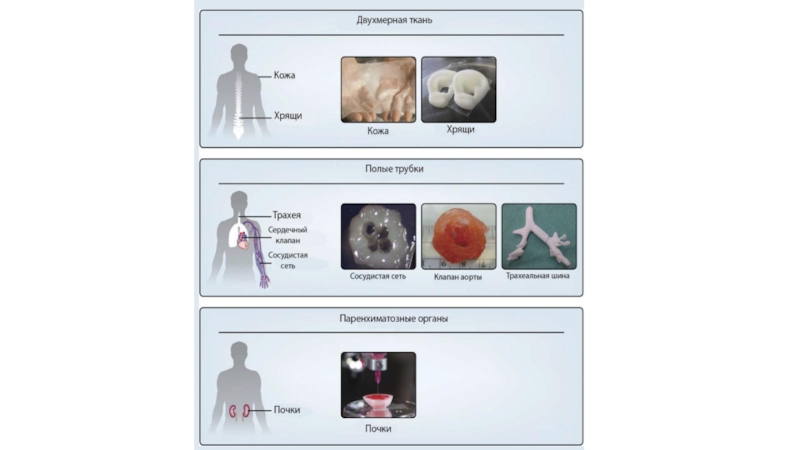
Существуют 4 типа тканей, которые можно упорядочить по схеме «от простого к сложному» в следующем порядке: двухмерные ткани(кожа) – полые трубки (кровеносные сосуды) – полые органы (мочевой пузырь) – паренхиматозные органы (почки).
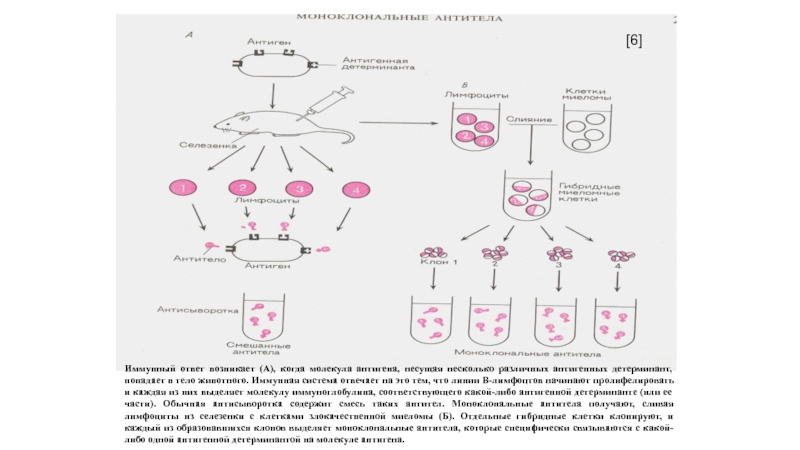
Слайд 46Иммунный ответ возникает (А), когда молекула антигена, несущая несколько различных
антигенных детерминант, попадает в тело животного. Иммунная система отвечает на
это тем, что линии В-лимфоцтов начинают пролифелировать и каждая из них выделяет молекулу иммуноглобулина, соответствующего какой-либо антигенной детерминанте (или ее части). Обычная антисыворотка содержит смесь таких антител. Моноклональные антитела получают, сливая лимфоциты из селезенки с клетками злокачественной миеломы (Б). Отдельные гибридные клетки клонируют, и каждый из образовавшихся клонов выделяет моноклональные антитела, которые специфически связываются с какой-либо одной антигенной детерминантой на молекуле антигена.
[6]
Слайд 47Скрининг клеток, вырабатывающих моноклональные антитела [5]
Выделяют клетки селезенки мыши, иммунизированной
специфическим антигеном, и проводят их слияние с клетками миеломы, не
вырабатывающими антитела. Слившиеся клетки отбирают по способности к росту на среде ГАТ (гипоксантин, аминоптерин, тимидин). Клетки, вырабатывающие специфические антитела к иммунизирующему антигену (клетки гибридомы), идентифицируют иммунологическими методами и субкультивируют, чтобы получить отдельные клоны. Из гибридомы, растущей в культуре и секретирующей единственный тип молекул антител, получают моноклональные антитела.
Слайд 48Использование моноклональных антител
Слайд 49Схема. Система целевой доставки лекарственного вещества,
основанной на использовании моноклональных
антител. [6]
А. Молекула лекарственного вещества присоединена к моноклональному антителу.
Б. К
моноклональному антителу присоединен фермент, превращающий инертную форму лекарственного вещества в активную только в непосредственной близости от клетки-мишени.
В обоих случаях моноклональное антитело связывается с одним специфическим белком на поверхности клетки-мишени.
Слайд 502003: журнал Национальной Академии Наук США (PNAS USA) опубликовал сообщение
о том, что через 15 лет хранения в жидком азоте
стволовые клетки пуповинной крови полностью сохраняют свои биологические свойства. С этого момента криогенное хранение стволовых клеток стало рассматриваться как «биологическая страховка». Мировая коллекция стволовых клеток, хранящихся в банках, достигла 72000 образцов. По данным на сентябрь 2003 г. в мире произведено уже 2592 трансплантаций стволовых клеток пуповинной крови, из них 1012 — взрослым пациентам.
2011: израильская исследовательница Инбар Фридрих Бен-Нун возглавила группу учёных, которая вывела первые стволовые клетки вымирающих видов животных. Это прорыв, и благодаря ему можно спасти виды, которым грозит исчезновение.
2012: Группа японских исследователей во главе с профессором Митинори Сайто из Университета Киото впервые в истории науки смогли вырастить яйцеклетки из стволовых клеток, оплодотворить их и добиться рождения здорового потомства у лабораторных мышей. 5 октября в электронном выпуске научного журнала «Science» они высказали предположение, что результаты их исследований внесут вклад в решение проблемы бесплодия.
23 января 2013: та же группа Центра исследования и применения стволовых клеток Университета Киото вырастила из стволовых клеток ткани почек, надпочечников и половые клетки: были получены пять типов клеток почек, а также выращен фрагмент почечного канальца, участвующего в фильтрации крови.
16 мая 2013: Международная команда исследователей из Америки объявила, что впервые в истории, им удалось создать новые стволовые клетки человека путем клонирования полноценных клеток организма.
Др. Инбар Фридрих Бен-Нун

Слайд 54 Дифференцировка стволовых клеток
Слайд 55Получение стволовых клеток из фибробластов кожи [15]
Методом генетического репрограммирования можно
получить из фибробластов кожи клетки, по своим характеристикам неотличимые от
эмбриональных стволовых клеток (ЭСК).
Это открытие является не только выдающимся научным достижением, но в перспективе может привести к кардинальному изменению политических и этических аспектов биологии стволовых клеток. Исследование было проведено в лаборатории профессора Джеймса Томсона – человека, которому в 1998 году удалось впервые получить стволовые клетки из человеческих эмбрионов.
Помимо того, что полученные таким путём «ЭСК» могут решить многие спорные вопросы, относящиеся к биологии стволовых клеток, репрограммированные фибробласты могут использоваться в терапевтических целях для получениях клеток самых различных тканей.
«Эмбриональные стволовые клетки», полученные из фибробластов кожи.
«Полученные клетки обладают теми же свойствами, что и эмбриональные стволовые клетки», «и это может совершенно изменить область работы клеточных биологов, работающих со стволовыми клетками».
Слайд 56Август 2006: журнал Cell публикует исследование Кадзутоши Такагаши и Шинъя
Яманака, посвящённое способу возвращения дифференцированных клеток в плюрипотентное состояние. Начинается
эра индуцированных плюрипотентных стволовых клеток.
Июнь 2007: три независимые исследовательские группы сообщили, что зрелые клетки кожи мышей могут быть репрограммированы в состояние ЭСК. В том же месяце учёный Шухрат Миталипов заявил о создании линии стволовых клеток примата путём терапевтического клонирования.
Ноябрь 2007: в журнале Cell опубликовано исследование
К. Такагаши и Ш. Яманака «Индукция плюрипотентных стволовых клеток из фибробластов зрелого человека при определённых факторах», а в журнале Science вышла статья «Индуцированные плюрипотентные стволовые клетки, выведенные из соматических клеток человека» Джунинга Ю. Было доказано, что возможно индуцировать практически любую зрелую клетку человека и придать ей свойства стволовой, вследствие чего необходимость разрушения эмбрионов в лаборатории отпала.
Январь 2008: Роберт Ланза и его коллеги из Advanced Cell Technology и Калифорнийского университета в Сан-Франциско вывели первые ЭСК человека без разрушения эмбриона.
28 мая 2009: Ким Гвансу и его коллеги из Гарварда заявили о том, что им удалось разработать способ манипулирования клетками кожи для выведения индуцированных плюрипотентных стволовых клеток с учётом индивидуальной специфики пациента, утверждая, что это «окончательное решение проблемы стволовых клеток».
Др. Роберт Ланза

Слайд 57Нобелевская премия – за генетически модифицированные стволовые клетки (2007 г.)
американские
ученые: Марио Капекки (Mario Capecchi) и Oливер Смитис (Oliver Smithies),
и британец Мартин Эванс (Martin Evans).[14]
Марио Капекки (1937 г.).
В 1967 г. получил докторскую степень по биофизике в Гарвардском университете.
Сотрудник Медицинского института Говарда Хьюза и заслуженный профессор генетики человека и биологии Университета Юты в Солт-Лейк-Сити.
Оливер Смитис (1925 г).
В 1951 г. получил докторскую степень по биохимии в Оксфордском университете. Профессор патологии и лабораторной медицины Северокаролинского университета в городе Чэпел-Хилл.
Сэр Мартин Эванс (1941 г). В 1969 году получил докторскую степень по анатомии и эмбриологии в Университетском колледже в Лондоне. Руководитель биологического отделения и профессор генетики млекопитающих Кардиффского университета (Уэльс).
Слайд 58Они удостоены награды за исследования основ введения специфических генетических модификаций
в организмы мышей путем использования стволовых клеток эмбрионов. Речь идет
о разработке способа «выключать» те или иные гены в клетках зародыша (методика получила название «генетического нокаута» – gene knockout).
При помощи этой технологии ученые получили возможность получать клеточные линии с заданными физиологическими особенностями, исследуя таким образом развитие предопределяемых генетически болезней – рака, диабета, муковисцидоза, заболеваний сердечно-сосудистой системы.
Работы Капекки посвящены роли генов в органогенезе (эмбриональном развитии органов) у млекопитающих и могут пролить свет на причину врожденных аномалий у человека.
Эванс занимался генной терапией муковисцидоза.
Смиттис также работал над выявлением генов муковисцидоза, артериосклероза, повышенного артериального давления и талассемии (болезни, вызванной генетически обусловленным изменением в структуре гемоглобина).
Нобелевская премия –
за генетически модифицированные стволовые клетки (2007 г.) [14]
Слайд 59Марио Капекки, Мартин Эванс, Оливер Смитис - Нобелевская премия «За
открытие принципов введения специфических генных модификаций у мышей с использованием эмбриональных
стволовых клеток» 2007 г.
Джон Гёрдон и Шинъя Яманака Нобелевская премия по физиологии и медицине «За работы в области биологии развития и получения индуцированных стволовых клеток.» 2012 г.
Слайд 61Нобелевские премии 21 век
2007 г.
Марио Капекки, Мартин Эванс, Оливер Смитис
- Нобелевская премия «За открытие принципов введения специфических генных модификаций
у мышей с использованием эмбриональных стволовых клеток»
2010г - 85-ти летний ученый из Великобритании Роберт Джефри Эдвардс - За разработку метода ЭКО ( к 30-ти летию в 2008 году)
2011г- Ральф Штейнман Работы по изучению Дендритных клеток (посмертно)
2012 год - Джон Гердон и Синья Яманаки –За работу по возможности перепрограммирования дифференцированных и плюрипотентных клеток
Слайд 62Клонирование человека.
Что дальше?
Клонирование перестало быть предметом из области отдаленного
будущего. Клонирование человека, возможно, будет произведено в ближайшее время. О
работах в этом направлении уже заявлено американскими и английскими учеными в средствах массовой информации [13]
![Стволовые клетки Классификация стволовых клеток [6] Классификация стволовых клеток [6]](/img/thumbs/fa03e9dffa96ade82cefed6aa6b75e1a-800x.jpg)

![Стволовые клетки Схема получения эмбриональных стволовых клеток [6] Схема получения эмбриональных стволовых клеток [6]](/img/thumbs/004f0c461a31c779fc5ff5aedc578186-800x.jpg)
![Стволовые клетки Разорванная бластоциcта с несколькими стволовыми клетками (красные), оставшимися внутри. Несколько эмбриональных Разорванная бластоциcта с несколькими стволовыми клетками (красные), оставшимися внутри. Несколько эмбриональных стволовых клеток на кончике иглы. [14]](/img/thumbs/e050f13c259c9ae7bcaa60ca67125e76-800x.jpg)
![Стволовые клетки Рис.1. Ранние стадии развития мыши [5,9]Рис. 2. Мышиный эмбрион на ранней Рис.1. Ранние стадии развития мыши [5,9]Рис. 2. Мышиный эмбрион на ранней стадии развития.А. Стадия двух клетокБ. Стадия](/img/thumbs/783e4aa2d6b63d03709e9711e58d7018-800x.jpg)

![Стволовые клетки [7] [7]](/img/thumbs/013cde5f5ebbefdb7150544fbd3f4976-800x.jpg)
![Стволовые клетки Клеточная инженерия животных[5] Клеточная инженерия животных[5]](/img/thumbs/b72feb545cb1c11232f687d62d72cddc-800x.jpg)
![Стволовые клетки Клонирование овцы методом переноса ядра [3,12] Клонирование овцы методом переноса ядра [3,12]](/img/thumbs/c9067775e1b25de65b1cd5a39148c035-800x.jpg)
![Стволовые клетки Клонирование :работы Я.Вильмунта[15] Клонирование :работы Я.Вильмунта[15]](/img/thumbs/d1f9ed972b9b047390a59d8f211d8f3b-800x.jpg)
![Стволовые клетки [15] [15]](/img/thumbs/39c060c5d09463c36b149ac1e0406425-800x.jpg)
![Стволовые клетки Мать и дитя [14,15] Мать и дитя [14,15]](/img/thumbs/44115acde4e3b756e2b886361456b1be-800x.jpg)



![Стволовые клетки Получение эквивалента кожи.[7]Предварительная подготовка и соединение основных (клеточного и внеклеточного) компонентов Получение эквивалента кожи.[7]Предварительная подготовка и соединение основных (клеточного и внеклеточного) компонентов дермы при создании слабощелочного рН.Тщательное перемешивание,](/img/thumbs/ad83e3fd0a68d35574cd49db7da35eb2-800x.jpg)
![Стволовые клетки Схема экспериментального использования эмбриональных стволовых клеток для получения инсулинпродуцирующих клеток [9] Схема экспериментального использования эмбриональных стволовых клеток для получения инсулинпродуцирующих клеток [9]](/img/thumbs/e6508cbe73a75c4440351a57fbad7ce5-800x.jpg)
![Стволовые клетки Реконструкция кровеносных сосудов [12] Реконструкция кровеносных сосудов [12]](/img/thumbs/23670091f7cc98d64d8e5fadcb213a1a-800x.jpg)
![Стволовые клетки Схема биоинженерной реконструкции кровеносного сосуда [15]I: а) обвитие волокон биоматрикса вокруг Схема биоинженерной реконструкции кровеносного сосуда [15]I: а) обвитие волокон биоматрикса вокруг силиконового стержня;б) заселение биоматрикса культивированными гладкомышечными](/img/thumbs/8c5b07bb663a795de21db10d72798936-800x.jpg)

![Стволовые клетки Конструирование зубов[14] Конструирование зубов[14]](/img/thumbs/3494ac49bbc669e708690ffa9eb22d2c-800x.jpg)
![Стволовые клетки Конструирование зубов [15]Зубы поросят измельчали в порошок и обрабатывали ферментами. Полученные Конструирование зубов [15]Зубы поросят измельчали в порошок и обрабатывали ферментами. Полученные изолированные клетки поместили в биодеградируемый каркас.](/img/thumbs/eae84fde99a6b30f8dd1b208d8693e0f-800x.jpg)






![Стволовые клетки Углеродная нанотрубка, покрытая полиэтиленгликолем [15]Цилиндрические углеродные нанотрубки настолько тонки, что 50000 Углеродная нанотрубка, покрытая полиэтиленгликолем [15]Цилиндрические углеродные нанотрубки настолько тонки, что 50000 таких нанотрубок, сложенных в ряд, едва](/img/thumbs/efd2b62e19b13b79bb7f2092c371f0b5-800x.jpg)
![Стволовые клетки Новая технология создания костных имплантатов [15]Модель нижней челюсти, полученная с помощью Новая технология создания костных имплантатов [15]Модель нижней челюсти, полученная с помощью «спекания» металлического порошкаИмплантаты, которые могли бы](/img/thumbs/1ff1ce328f22f6e550557883b311f73c-800x.jpg)




![Стволовые клетки [4] [4]](/img/thumbs/f53a33558bea448d75f1e66cbab747ee-800x.jpg)
![Стволовые клетки Скрининг клеток, вырабатывающих моноклональные антитела [5]Выделяют клетки селезенки мыши, иммунизированной специфическим Скрининг клеток, вырабатывающих моноклональные антитела [5]Выделяют клетки селезенки мыши, иммунизированной специфическим антигеном, и проводят их слияние с](/img/thumbs/73853f0b4e0f046d9fbe75690efd0a8f-800x.jpg)

![Стволовые клетки Схема. Система целевой доставки лекарственного вещества, основанной на использовании моноклональных антител. Схема. Система целевой доставки лекарственного вещества, основанной на использовании моноклональных антител. [6]А. Молекула лекарственного вещества присоединена к](/img/thumbs/01c6a4dbd2aef1f7a7f3550a8ea53f63-800x.jpg)

![Стволовые клетки Схема клонирования растения[12] Схема клонирования растения[12]](/img/thumbs/bcab7a84423e763217b3cda15359d6eb-800x.jpg)
![Стволовые клетки [14] [14]](/img/thumbs/25b7f5dc7db21fa30b131bcb1fa83560-800x.jpg)
![Стволовые клетки [14] [14]](/img/thumbs/1e5efc70a3fd3a25f299a4dd9ff1141c-800x.jpg)

![Стволовые клетки Получение стволовых клеток из фибробластов кожи [15]Методом генетического репрограммирования можно получить Получение стволовых клеток из фибробластов кожи [15]Методом генетического репрограммирования можно получить из фибробластов кожи клетки, по своим](/img/thumbs/52090ace1082c8bfadb43dabeb22cf19-800x.jpg)




![Стволовые клетки [14] [14]](/img/thumbs/5539c87d9037caa6f00564ebb174a6b6-800x.jpg)





















