Слайд 19.1. Природа электролитической диссоциации
Тема 9. Электролитическая диссоциация
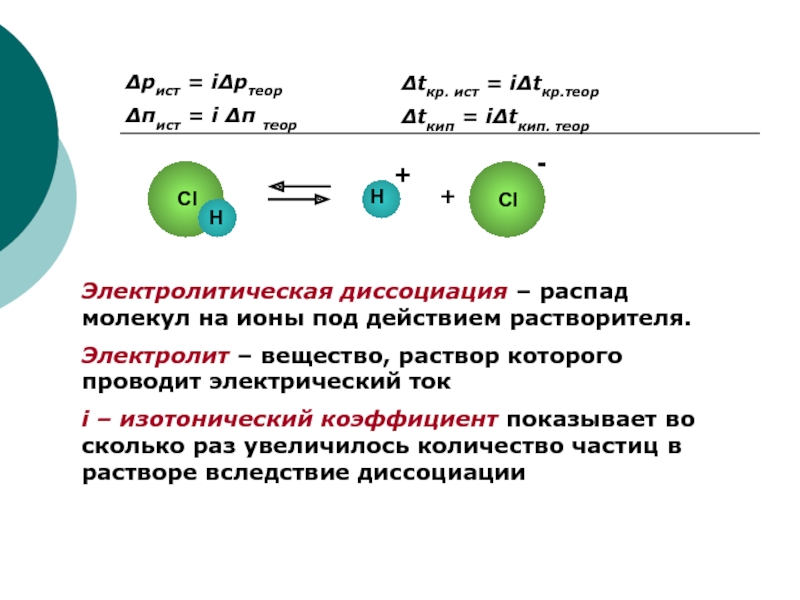
Слайд 2Δpист = iΔpтеор
Δπист = i Δπ теор
Δtкр. ист = iΔtкр.теор
Δtкип
= iΔtкип. теор
Электролитическая диссоциация – распад молекул на ионы под
действием растворителя.
Электролит – вещество, раствор которого проводит электрический ток
i – изотонический коэффициент показывает во сколько раз увеличилось количество частиц в растворе вследствие диссоциации
Слайд 3Количественные характеристики процесса диссоциации
Степень диссоциации, α – доля молекул, распавшихся
на ионы
Константа диссоциации Кд – константа равновесия процесса диссоциации
число молекул,
распавшихся на ионы
общее число молекул
Слайд 4Классификация электролитов
Значения степени диссоциации указаны для 0,1М растворов
Слайд 59.2. Факторы, влияющие на процесс диссоциации
1. Влияние концентрации электролита
С понижением
концентрации степень диссоциации увеличивается.
Для слабых электролитов:
C – исходная концентрация кислоты,
α – степень диссоциации
CH3COOH ⇄ CH3COO- + H+
С-αС αС αС - равновесные концентрации
;
- закон разбавления Освальда
Слайд 6Для сильных электролитов
NaClкр → Na+(водн)+Cl- (водн)
Активностью а называется та условная
концентрация, в соответствии с которой ион ведет себя в растворе.
a
– активность ионов в растворе
f – коэффициент активности (f≤1)
CM – молярная концентрация раствора
I – ионная сила раствора
Ci – концентрация i-го иона в растворе
Zi – заряд i-го иона в растворе
H2O
а=fCM
Слайд 72. Влияние температуры на процесс диссоциации
Процесс диссоциации – эндотермический. Поэтому
с повышением температуры степень диссоциации возрастает
3. Влияние природы растворителя на
процесс диссоциации
Чем выше дипольный момент у молекул растворителя, тем легче идет в нем процесс диссоциации растворенного вещества.
Слайд 84. Влияние природы вещества на процесс его диссоциации
Чем выше полярность
связи, тем легче вещество диссоциирует по этой связи.
По Аррениусу природа
химического вещества определяется характером его диссоциации.
Кислоты по Аррениусу – это водородсодержащие соединения, дающие в водном растворе ионы водорода (гидроксония)
Силу кислоты можно определить по константе кислотности Ка:
HAn ⇄ H+ +An-
Чем выше Ka, тем сильнее кислота
Слайд 9Сила бескислородных кислот зависит от радиуса аниона, а у анионов
с близкими радиусами - от величины электроотрица-тельности кислотообразующего элемента.
С
увеличением радиуса иона длина связи H-An увеличивается, и энергия связи уменьшается → сила кислоты возрастает. Поэтому в пределах одной подгруппы с увеличением заряда ядра атома кислотообразующего элемента сила кислоты увеличивается: HI – сильная кислота, HF – средняя.
В пределах одного периода с увеличением заряда ядра атома кислотообразующего элемента увеличивается электроотрицательность атома кислотообразующего элемента. Разность электроотрицательностей между атомами кислотообразующего элемента и водорода увеличивается, возрастает полярность связи, а с ней – и сила кислоты: H2S – слабая кислота, HCl – сильная.
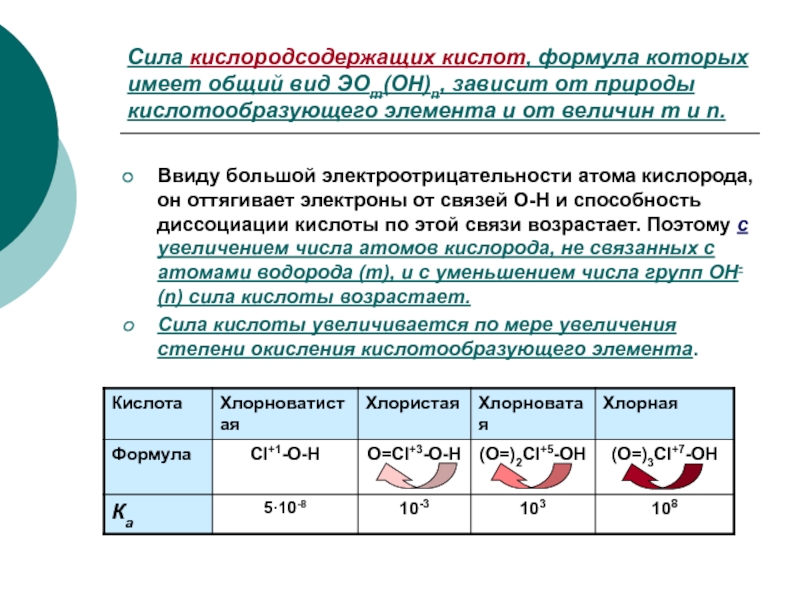
Слайд 10Сила кислородсодержащих кислот, формула которых имеет общий вид ЭОm(OH)n, зависит
от природы кислотообразующего элемента и от величин m и n.
Ввиду
большой электроотрицательности атома кислорода, он оттягивает электроны от связей О-Н и способность диссоциации кислоты по этой связи возрастает. Поэтому с увеличением числа атомов кислорода, не связанных с атомами водорода (m), и с уменьшением числа групп ОН- (n) сила кислоты возрастает.
Сила кислоты увеличивается по мере увеличения степени окисления кислотообразующего элемента.
Слайд 11Основания по Аррениусу – это гидроксилсо-держащие соединения, дающие в водном
растворе ионы гидроксила
Силу основания можно определить по константе основности Кв:
KtOH ⇄ Kt+ +OH-
Чем выше Kb, тем сильнее основание
К сильным электролитам относятся все основания щелочных металлов
С увеличением радиуса иона длина связи Kt-O увеличивается, и энергия связи уменьшается → сила основания возрастает. Поэтому в пределах одной подгруппы с увеличением заряда ядра атома металла сила его основания увеличивается: Ra(OH)2 – сильное основание, Mg(OH)2 – среднее.
В пределах одного периода с увеличением заряда ядра атома металла увеличивается его электроотрицатель-ность. Разность электроотрицательностей между атомами металла и кислорода уменьшается, уменьшается и полярность связи, а с ней – и сила основания: NaOH – сильное основание, Mg(OH)2 – среднее, Al(OH)3 - слабое.
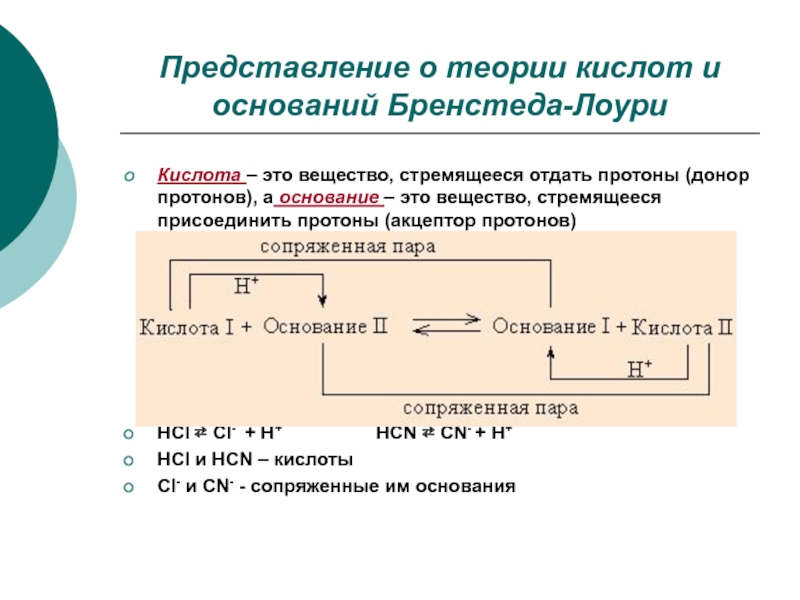
Слайд 12Представление о теории кислот и оснований Бренстеда-Лоури
Кислота – это вещество,
стремящееся отдать протоны (донор протонов), а основание – это вещество,
стремящееся присоединить протоны (акцептор протонов)
HCl ⇄ Cl- + H+ HCN ⇄ CN- + H+
HCl и HCN – кислоты
Сl- и CN- - сопряженные им основания
Слайд 13Представление о теории кислот и оснований Льюиса
Кислота – это акцептор
пары электронов, имеющий подходящую свободную орбиталь, а основание – это
донор электронов, имеющий неподеленную пару электронов
H+ - кислота
NH3 - основание
+H+→
Слайд 149.3. Ступенчатая диссоциация электролитов
Диссоциация кислот
Максимальное число ионов водорода, образующихся при
диссоциации из одной молекулы кислоты называется ее основностью. HCl –
одноосновная кислота, H2SO4 - двухосновная H3PO4 – трехосновная.
Многоосновные кислоты диссоциируют ступенчато, причем константа диссоциации по каждой последующей ступени примерно в 105 раз меньше, чем по предыдущей.
Слайд 15 Процесс по третьей ступени очень сильно сдвинут влево, то
есть в
растворе практически отсутствует ион РО4-
Способностью многоосновных кислот
диссоциировать ступенчато
объясняется их склонность к образованию кислых солей (NaHCO3)
Слайд 16Диссоциация оснований
Максимальное число ионов гидроксила, образующихся при диссоциации из одной
основания называется его кислотностью. NaOH – однокислотное основание, Mg(OH)2 -
двухкислотное Fe(OH)3 – трехкислотное.
Многокислотные основания диссоциируют ступенчато, причем константа диссоциации по каждой последующей ступени примерно в 105 раз меньше, чем по предыдущей.
I ступень: Mg(OH)2 ⇄ Mg(OH)++OH-
II ступень: Mg(OH)+ ⇄ Mg++OH-
Способностью оснований многозарядных ионов к ступенчатой диссоциации объясняется их склонность к образованию основных солей (CuOH)2CO3
Слайд 17Диссоциация солей
Средние соли диссоциируют полностью, в одну ступень:
Al2(SO4)3 ⇄ 2Al3+
+3SO42-
Кислые и основные соли диссоциируют ступенчато, легко – по 1-ой
ступени и очень незначительно – по последующим:
I ступень: NaHCO3 ⇄ Na+ + HCO3-
II ступень: HCO3- ⇄ H++CO32-
I ступень: (CuOH)2CO3 ⇄ 2CuOH- + CO32-
II ступень: CuOH+ ⇄ Cu2+ + OH-
Слайд 189.4. Диссоциация воды. Водородный показатель
H2O ⇄ H++OH-;
[H2O]р ≈ [H2O]исх;
Для объема
1 л m=10000 г, M=18г/моль
Kw =Const =10-14 при
25оС
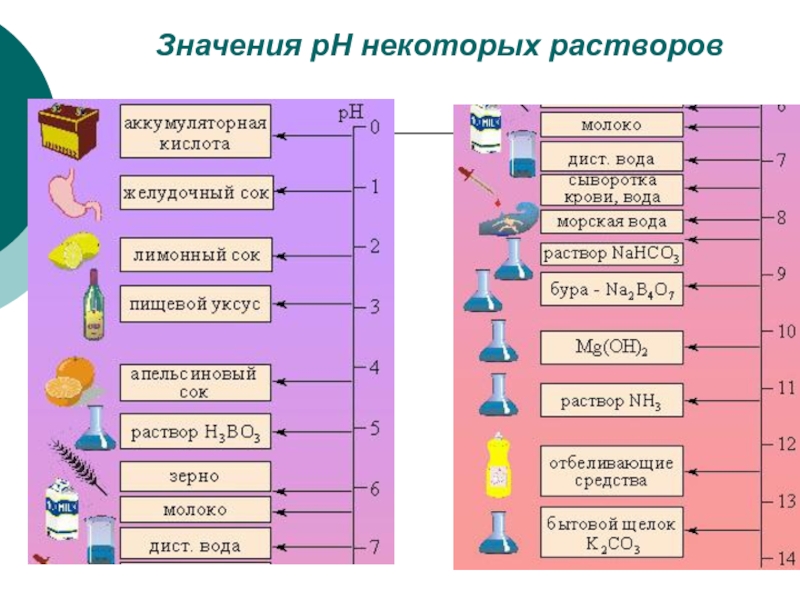
Слайд 19Для характеристики реакции среды ввели величину «водородный показатель». Водородный показатель
(рН) – это десятичный логарифм концентрации водородный ионов, взятый с
обратным знаком.
рН = -lg [H+]
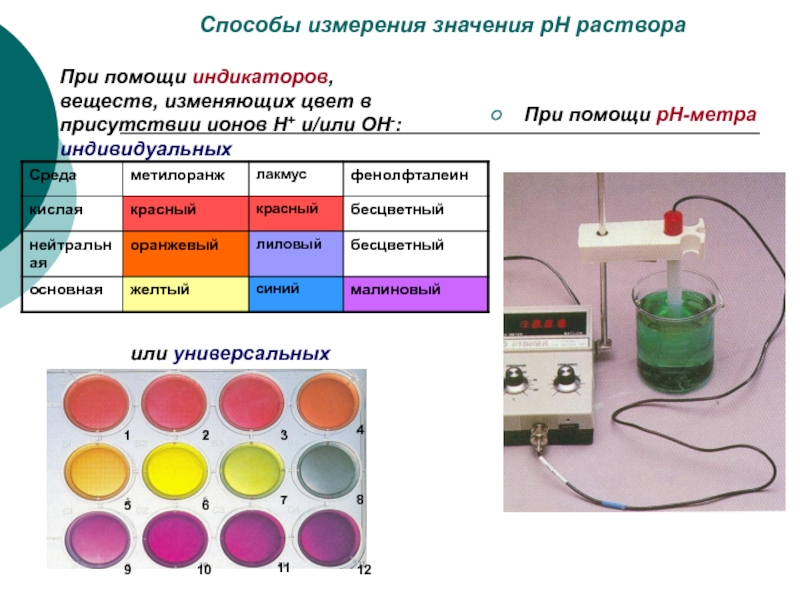
Слайд 21Способы измерения значения рН раствора
При помощи индикаторов, веществ, изменяющих цвет
в присутствии ионов Н+ и/или ОН-: индивидуальных
При помощи рН-метра
или универсальных













![Тема 9. Электролитическая диссоциация 9.4. Диссоциация воды. Водородный показательH2O ⇄ H++OH-;[H2O]р ≈ [H2O]исх;Для объема 1 9.4. Диссоциация воды. Водородный показательH2O ⇄ H++OH-;[H2O]р ≈ [H2O]исх;Для объема 1 л m=10000 г, M=18г/моль Kw =Const](/img/thumbs/7f8030988532e117f6cfe696e2911498-800x.jpg)