Слайд 1Тема урока «Факторы, влияющие на скорость химической реакции»
Цель: Показать
влияние на скорость реакций таких факторов, как природа реагирующих веществ,
их концентрация, площадь соприкосновения и температура. Дать понятие о катализаторах.
Одна из задач химиков характеризовать быстроту протекания химических реакций, чтобы уметь управлять скоростью химических реакций в своих интересах.
Слайд 2Теория столкновений.
Основная идея её такова: реакции происходят при столкновении
частиц реагентов, которые обладают определённой энергией.
Выводы:
Чем больше частиц реагентов, чем
ближе они друг к другу, тем больше шансов у них столкнуться и прореагировать.
К реакции приводят лишь эффективные соударения, т.е. такие при которых разрушаются или ослабляются «старые связи» и поэтому могут образоваться «новые». Но для этого частицы должны обладать достаточной энергией.
Минимальный избыток энергии (над средней энергией частиц в системе), необходимый для эффективного соударения частиц в системе), необходимый для эффективного соударения частиц реагентов, называется энергией активации Еа.
на примере реакции в общем виде А2 + В2 = 2АВ
Слайд 31. Природа реагирующих веществ.
Под природой реагирующих веществ понимают их
состав, строение, взаимное влияние атомов в неорганических и органических веществах.
Величина
энергии активации веществ – это фактор, посредством которого сказывается влияние природы реагирующих веществ на скорость реакции.
Слайд 42. Температура
При увеличении температуры на каждые 10° С общее число
столкновений увеличивается только на ~ 1,6 %, а скорость реакции
увеличивается в 2-4 раза.
Число, показывающее, во сколько раз увеличивается скорость реакции при повышении температуры на 10° С, называют температурным коэффициентом.
Правило Вант-Гоффа математически выражается следующей формулой:
где –скорость реакции при температуре t2,
– скорость реакции при температуре t1,
– температурный коэффициент.
Правило Якоба Хендрика Вант-Гоффа применимо только в узком интервале температур и не для всех химических реакций.
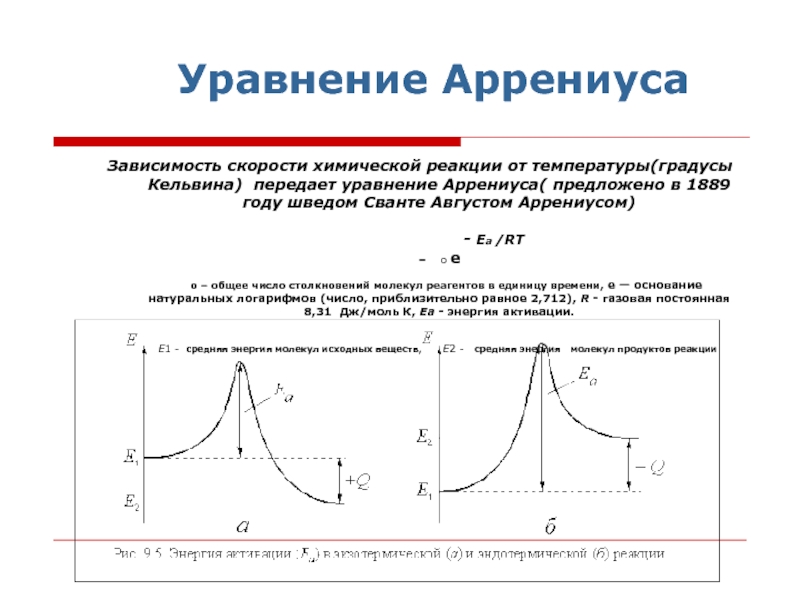
Слайд 5 Уравнение Аррениуса
Зависимость скорости химической реакции
от температуры(градусы Кельвина) передает уравнение Аррениуса( предложено в 1889 году
шведом Сванте Августом Аррениусом)
- Ea /RT
= o e
o – общее число столкновений молекул реагентов в единицу времени, е — основание натуральных логарифмов (число, приблизительно равное 2,712), R - газовая постоянная 8,31 Дж/моль К, Еa - энергия активации.
Е1 - средняя энергия молекул исходных веществ, Е2 - средняя энергия молекул продуктов реакции
Слайд 6Факторы, влияющие на скорость химической реакции
природа реагирующих веществ;
температура;
концентрация реагирующих веществ;
действие
катализаторов;
поверхность соприкосновения реагирующих веществ (в гетерогенных реакциях).
Слайд 7Задача на применение знаний:
Определите, как изменится скорость некоторой реакции:
а) при повышении температуры от 10° до 50° С;
б) при понижении температуры от 10° – 0° С.
Температурный коэффициент реакции равен 3.
Слайд 8Самопроверка
а) подставить данные задачи в формулу:
скорость реакции увеличится в 81
раз.
б)
Скорость реакции уменьшится в 3 раза.
Слайд 93. Концентрации реагирующих веществ.
На основе большого экспериментального материала в 1867
г. норвежские учёные Като Максимилиан Гульдберг и Петер Вааге и
независимо от них в 1865 г. русский учёный Н.И. Бекетов сформулировали основной закон химической кинетики- закон действующих масс, устанавливающий зависимость скорости реакции от концентраций реагирующих веществ:
скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях равных их коэффициентам в уравнении реакции.
Применим для химических реакций, уравнение которых непосредственно отражает элементарный акт.
Например, реакция H2 + I2 = 2HI, NO2 + CO = NO + CO2, 2NO + Cl2 = NOCl2.
К реакциям не отражающим элементарный акт, закон действующих масс применить нельзя.
Например, H2 + Cl2 = 2HCl, H2 + O2 = 2H2O (цепные реакции)
Слайд 10Математическое выражение
закона действующих масс.
По закону действующих масс скорость реакции,
уравнение которой nA+mB=cD может быть вычислена по формуле:
V=k*[A]n*[B]m - кинетическое уравнение , где
[A], [B]– молярные концентрации веществ А и В (моль/л), k– коэффициент пропорциональности, называемый константантой скорости реакции.
Зависит от природы реагирующих веществ, температуры и катализатора.
Слайд 11Задача на применение знаний:
1. Составьте кинетические уравнения для следующих реакций:
А) H2+I2=2HI;
Б) 2 Fe + 3CI2= 2
FeCI3.
2. Как изменится скорость реакции, имеющей кинетическое уравнение
v= kCA 2CB, если
А) концентрацию вещества А увеличить в 3 раза;
Б) концентрацию вещества А увеличить в 3 раза, а концентрацию В уменьшить в 3 раза?
Слайд 12Самопроверка.
Решение. Подставим соответствующие данные в кинетическое уравнение, сравним скорости реакций.
а)
скорость реакции увеличится в 9
раз.
б)
скорость реакции увеличится в 8 раз.
Слайд 134. Действие катализатора
Обсуждение вопросов:
1.Что такое катализатор и каталитические
реакции?
2. Приведите примеры известных вам каталитических реакций из органической и
неорганической химии. Укажите названия веществ – катализаторов.
3. Выскажите предположение о механизме действия катализаторов (на основе теории столкновений).
4. Каково значение каталитических реакций?
Слайд 14 Катализатор
Вещества, которые участвуют
в химической реакции и увеличивают её скорость, оставаясь к концу
реакции неизменными, называются катализаторами.
Вещества, которые замедляют скорость химической реакции, называют ингибиторами.
Механизм действия катализаторов связан с уменьшением энергии активации реакции за счет образования промежуточных соединений.
Термины катализ и катализатор ввел шведский химик Берцелиус в 1835году.
Катализ – это процесс изменения скорость химической реакции с помощью катализаторов.
При гомогенном катализе реагенты и катализатор составляют одну фазу (находятся в одном агрегатном состоянии), при гетерогенном катализе - разные фазы (находятся в различных агрегатных состояниях).
Слайд 155.Поверхность соприкосновения реагирующих веществ.
Скорость реакции увеличивается благодаря:
-увеличению площади
поверхности соприкосновения реагентов (измельчение);
-повышению реакционной способности частиц на поверхности
образующихся при измельчении микрокристаллов;
-непрерывному подводу реагентов и хорошему отводу продуктов с поверхности, где идёт реакция.
Фактор связан с гетерогенными реакциями, которые протекают на поверхности соприкосновения реагирующих веществ: газ - твердое вещество, газ - жидкость, жидкость - твердое вещество, жидкость - другая жидкость, твердое вещество - другое твердое вещество, при условии, что они не растворимы друг в друге.
Приведите примеры гетерогенных реакций.
Слайд 16Выводы по теме урока
Химические реакции протекают с различными скоростями.
На
пути всех частиц, вступающих в химическую реакцию, имеется энергетический барьер,
равный энергии активации Eа.
Скорость реакции зависит от факторов:
-природа реагирующих веществ;
-температура;
-концентрация реагирующих веществ;
- действие катализаторов;
-поверхность соприкосновения реагирующих веществ (в гетерогенных реакциях).
Слайд 17 Выводы по теме урока
Скорость
гомогенных реакций зависит от:
1)природы реагирующих веществ;
2) концентрации реагирующих веществ; 3)температуры; 4) наличия в реакционной смеси катализатора.
Скорость гетерогенных реакций зависит так же от: 1) скорости подвода реагентов к границе раздела фаз;2) скорости реакции на границе раздела фаз;3)скорости отвода продуктов реакции от границы раздела фаз.
Слайд 18Выводы по теме урока
Величина энергии активации веществ – это фактор,
посредством которого сказывается влияние природы реагирующих веществ на скорость реакции.
Чем меньше энергия активации, тем больше эффективных соударений реагирующих частиц.
При увеличении температуры на 10º С общее число активных соударений увеличивается в 2-4 раза.
Чем больше концентрации реагентов, тем больше соударений реагирующих частиц, а среди них и эффективных соударений.
Катализатор изменяет механизм реакции и направляет её по энергетически более выгодному пути с меньшей энергией активации. Ингибитор замедляет ход реакции.
Гетерогенные реакции протекают на поверхности соприкосновения реагирующих веществ. Нарушение правильной структуры кристаллической решётки приводит к тому, что частицы на поверхности образующихся микрокристаллов значительно реакционноспособнее, чем те же частицы на «гладкой» поверхности.