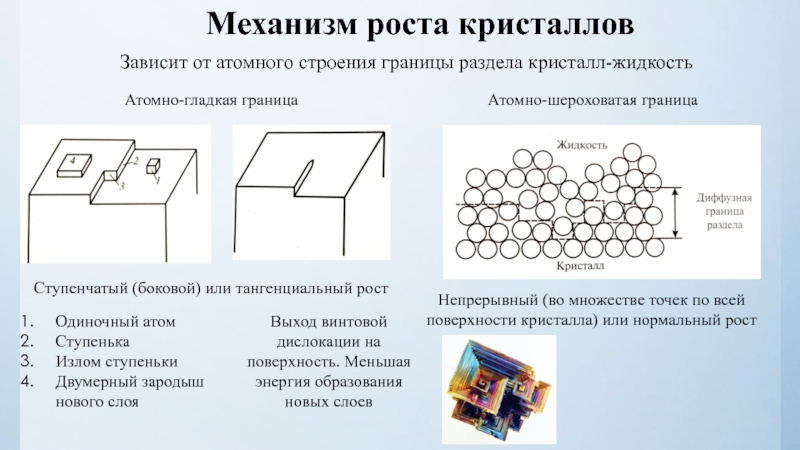
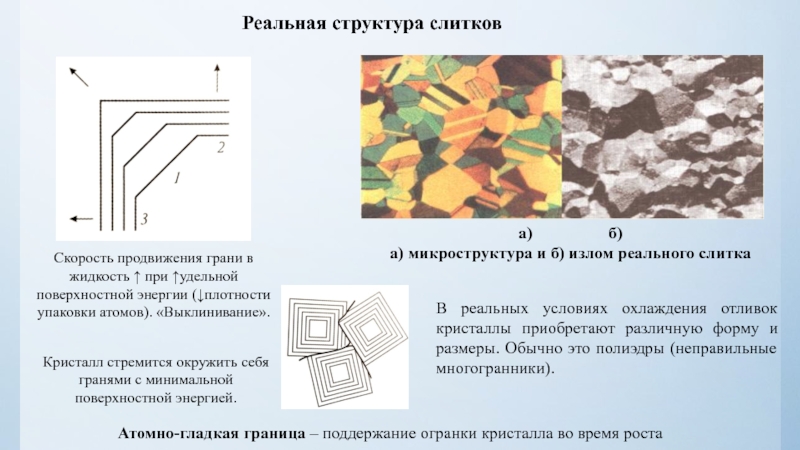
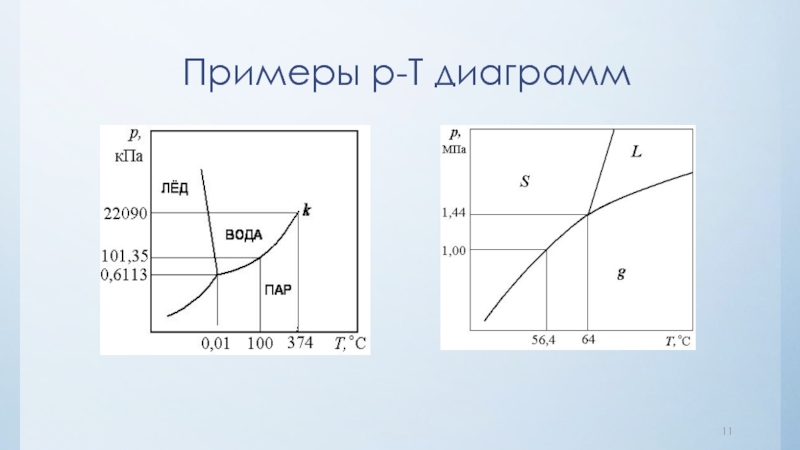
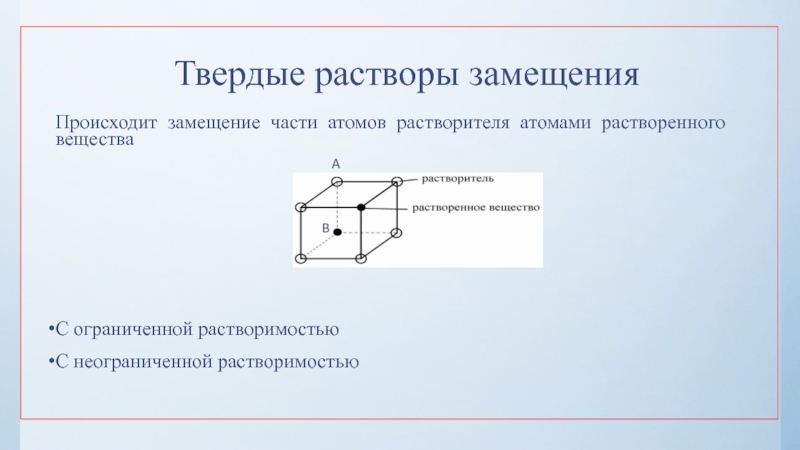
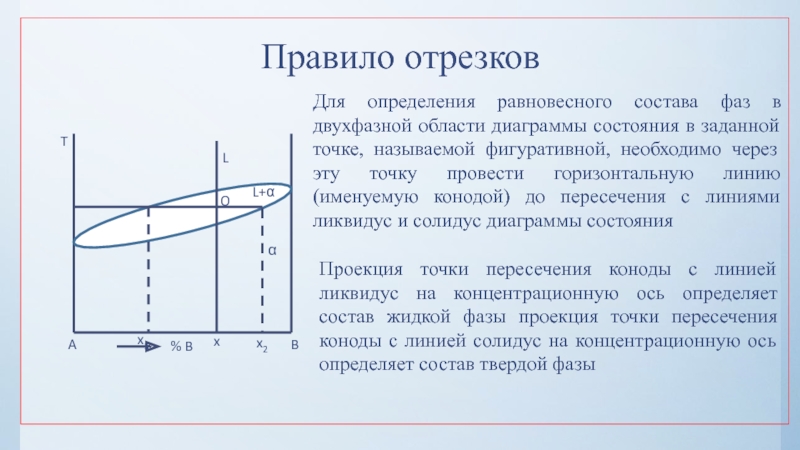
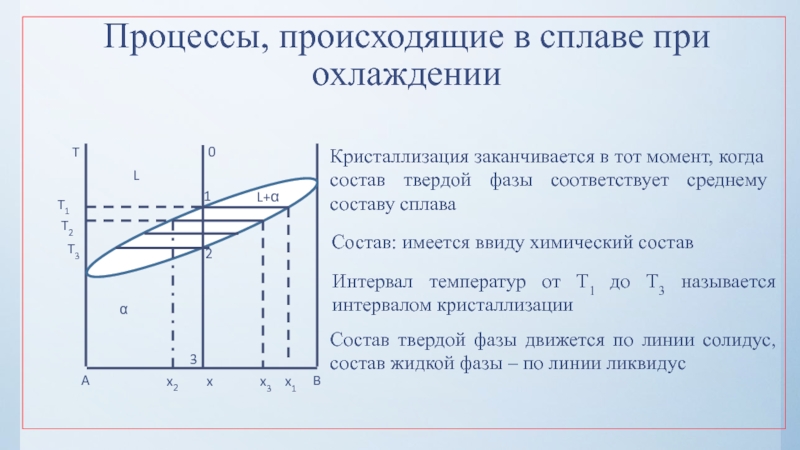
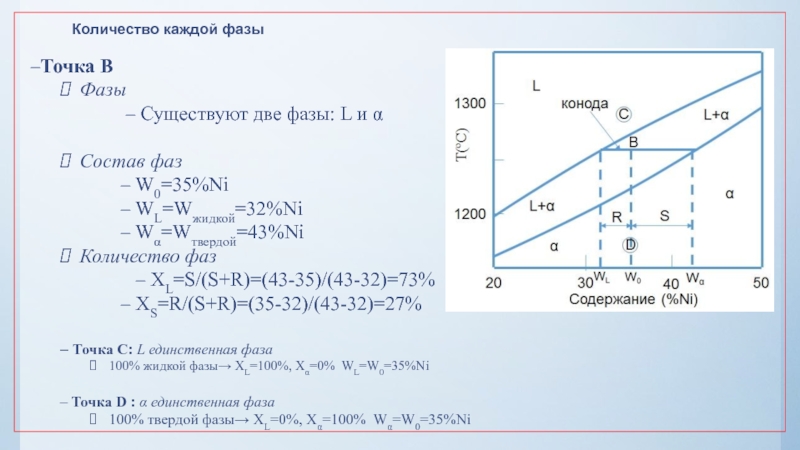
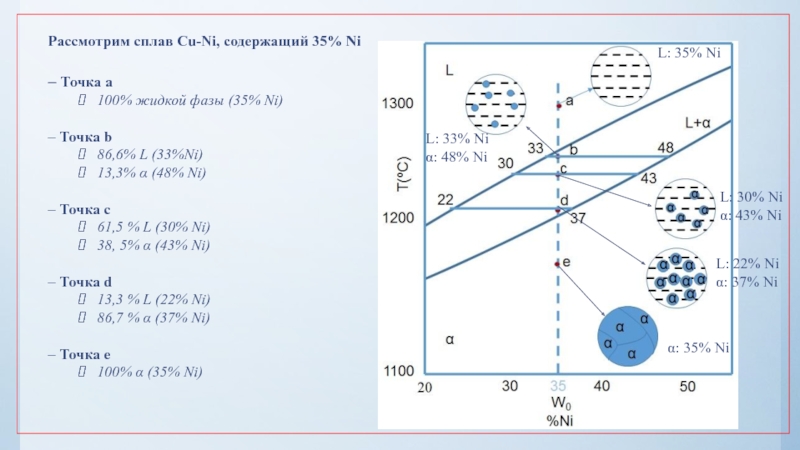
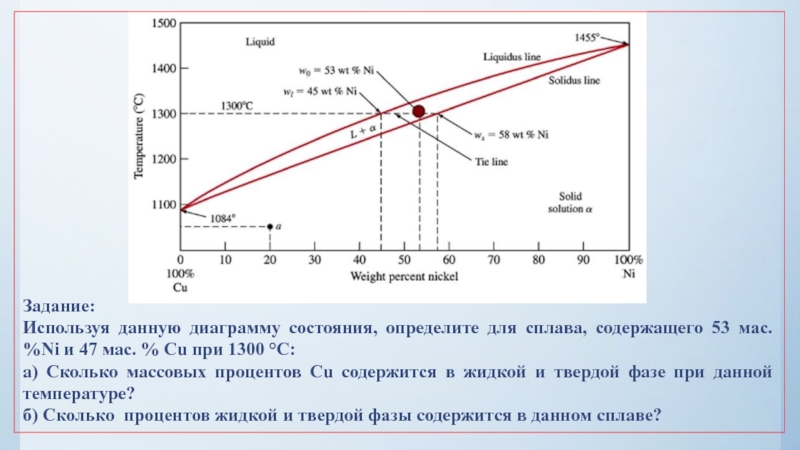
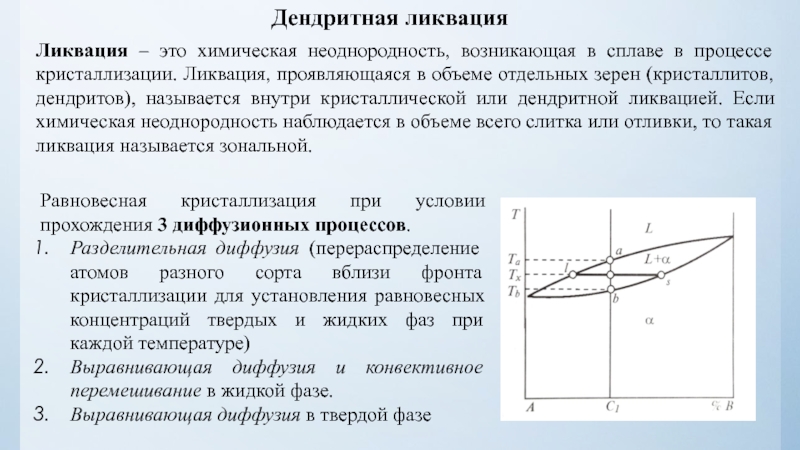
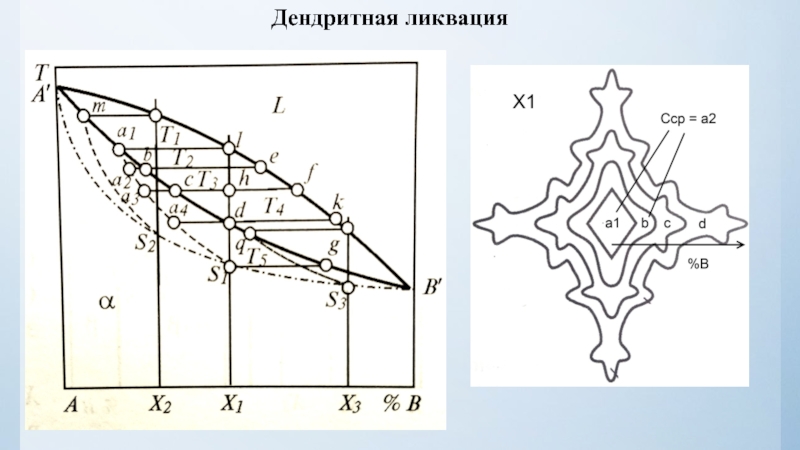
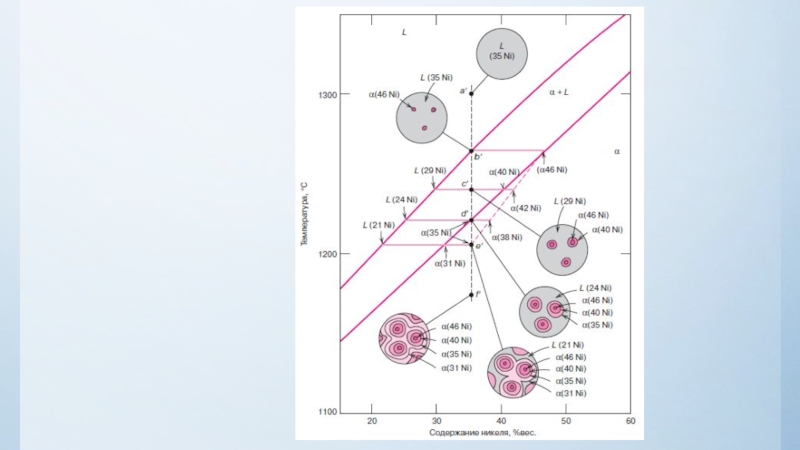
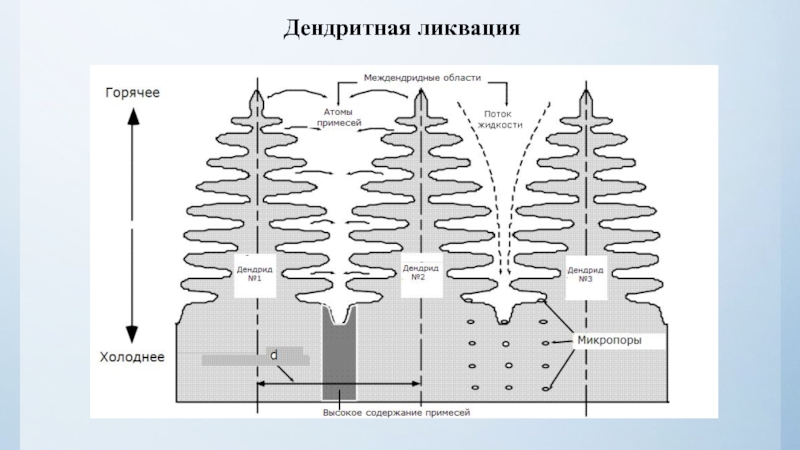
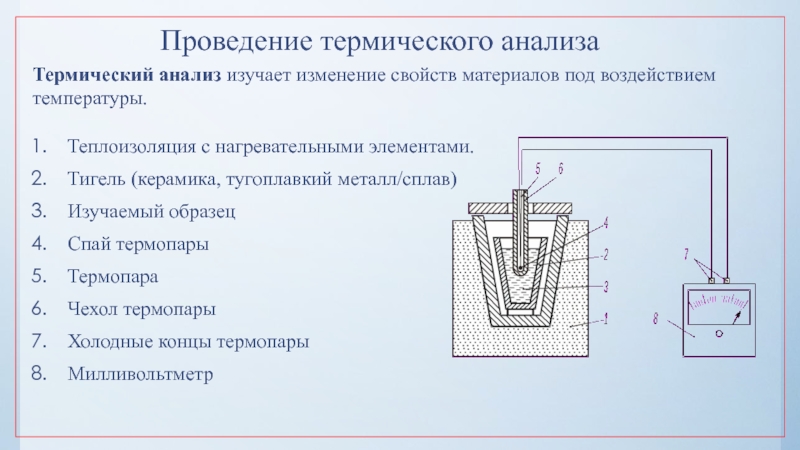
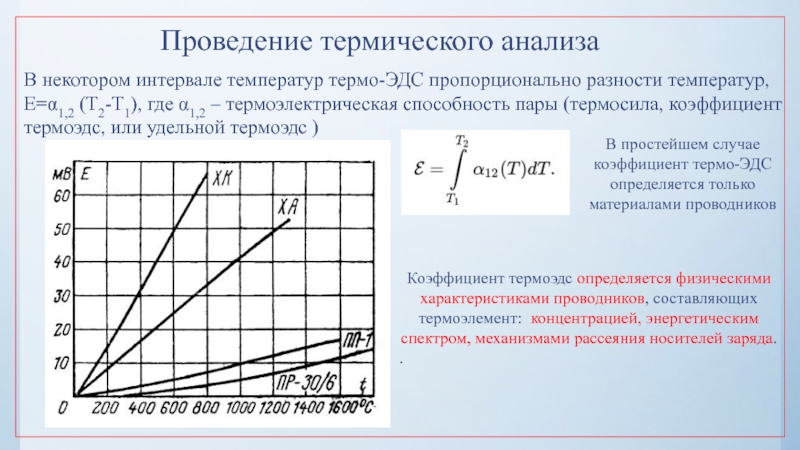
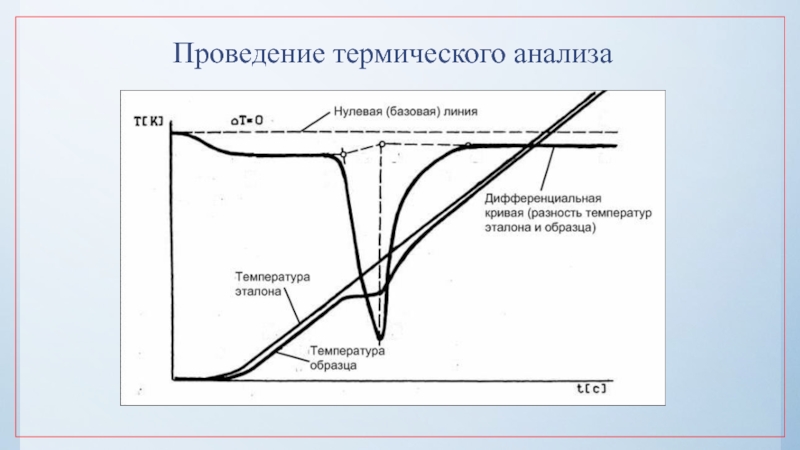
нулю и процесс кристаллизации идти не может.
Увеличение с.к. и ч.ц.
при малых степенях переохлаждения обусловлено тем, что подвижность атомов велика и увеличивается разность свободных энергий жидкого и твердого состояний.Снижение с.к. и ч.ц. при больших степенях переохлаждения вызвано уменьшением подвижности атомов
При очень больших степенях переохлаждения подвижность атомов недостаточна для перестройки и с.к. и ч.ц. равны нулю.
Размер образовавшихся кристаллов зависит от соотношения величин с.к. и ч.ц. при температуре кристаллизации, при данной степени переохлаждения.
Центры кристаллизации в области максимума скорости роста еще не образуются, а в области максимума скорости образования центров кристаллизации линейная скорость роста мала. Это тормозит суммарную скорость кристаллизации, и полное время этого процесса растет.
Vt – количество закристаллизовавшегося за время t вещества
dV/dt – объемная скорость кристаллизации
В предыдущей серии…